在全球范围内,酸性土壤(pH<5.5)约占陆地总面积的30%。据估计,中国超过40%的耕地和潜在可耕土地属于酸性土壤,并且酸性土壤以占全国27%的耕地养活了全国43%的人口[1]。近年来,随着人口的不断增长,以及由于盲目和过量施肥等不合理的农业措施所引起的土壤酸化问题,我国现代农业面临巨大挑战。因此,提高酸性土壤上作物的生产潜力,对保障粮食安全具有重要意义。然而,酸性土壤pH低、黏重贫瘠、土壤理化性质差、养分有效性低,以及土壤酸化对微生物多样性和群落结构的改变,严重限制了作物的生长和产量[2]。根系是植物吸收土壤养分以及与微生物互作的主要器官,挖掘和利用作物根系养分高效特性及对酸性土壤的不同适应机制,是提高酸性土壤中作物生产力的重要策略。
豆科植物能够与根瘤菌共生,形成特化器官——根瘤而进行生物固氮反应(Biological nitrogen fixation,BNF),为农业生态系统提供了不可替代的清洁氮源[3-4]。在农业生产中,豆科作物具有减肥增产、培肥土壤、提高pH、改良酸性土壤结构、改变根际微生物组及增加复种指数等效益,是一种优良的轮作换茬和间套作作物[5]。因此,充分发挥豆科作物的生物固氮作用,对农业减肥增效和保护生态环境均具有重要的现实意义。本文以大豆为代表,对豆科作物适应酸性土壤的根系养分高效遗传改良机制,包括根构型、根系分泌物和根际微生物等提高养分效率的生理与遗传机制,根际微生物组与土壤健康,豆科作物在农业生产中的生态效益等方面进行了归纳与总结,以期为豆科作物养分高效的遗传改良和应用提供理论依据和应用案例。
1 豆科作物适应酸性土壤提高养分效率的生理机制酸性土壤地区一般高温多雨,其良好的光热资源有利于植物快速生长。在全球范围内,虽然酸性土壤占总耕地和潜在可耕地面积的50%以上,但种植农作物的酸性土壤仅占世界农作物总面积的12%,蕴藏着巨大的农业发展潜力[6]。然而,酸性土壤中养分有效性低,尤其是缺磷(P),及铝(Al)、锰(Mn)等离子毒害,严重抑制了作物的生长和产量。在长期进化过程中,豆科植物形成了一系列适应酸性土壤的生理机制,如图1所示:

|
图 1 豆科作物提高养分效率的生理机制及根际微生物菌群的调控 Fig. 1 Physiological mechanism of improving nutrient efficiency, and regulation of rhizobacterial community in leguminous crops 豆科作物提高养分效率的生理机制主要包括:①豆科作物通过调控根构型提高对土壤养分的吸收;②通过根系分泌物活化土壤难溶态磷;③通过磷−铝(P-Al)交互,提高对酸性土壤的适应性;④和⑤通过与丛枝菌根真菌(AMF)及根瘤菌生物固氮(BNF)的共生互作提高养分利用效率;APase:酸性磷酸酶;R-COO−:有机酸 The physiological mechanisms of improving nutrient efficiency in legumes mainly include: ①Improving the absorption of soil nutrients forleguminous crops through regulating the root architecture modifications; ②Activating the insoluble complexes of phosphate (Pi) in soils through increasing the root exudation;③Improving the adaptation of legumes to acidic soils through phosphorus (P)-aluminum (Al) interactions; ④ and ⑤ Improving nutrient efficiency via arbuscular mycorrhizal fungi (AMF) and rhizobium biological nitrogen fixation(BNF). APase: acid phosphatase; R-COO−: organic acid |
①通过调控根构型提高对土壤养分的吸收和利用。根系是吸收土壤养分的主要器官。由于养分(如:磷)在酸性土壤中的分布极不均匀,植物对土壤养分的吸收很大程度上取决于根系在土层中的空间造型和分布,即根构型[7-8]。研究发现,菜豆Phaseolus vulgaris在缺磷条件下,通过调节根系向地性,改变根构型来提高其对酸性低磷土壤的适应性。Zhao等[9]利用大豆Glycine max磷效率“应用核心种质”,发现大豆根构型与磷效率密切相关。浅根型大豆具有合理的三维空间分布,利于对耕层土壤磷的吸收,进而提高磷效率和产量。
②利用根系分泌物活化土壤难溶性养分。合理根构型的建立为植物对土壤养分,尤其是土壤磷的高效吸收奠定了基础。然而,磷在土壤中主要以难溶态的形式存在。酸性土壤中 60%~80% 的磷为难溶性无机磷,主要由土壤黏粒和阳离子(如Fe3+、Ca2+和Al3+等)吸附、固定,沉淀形成Fe-P、Al-P和Ca-P等难溶态化合物;其余为难溶性有机磷,包括植酸磷、磷脂和核酸磷等[10-11]。由于植物无法直接吸收这部分磷源,养分效率的提高需要合理根构型结合根系或根际微生物直接/间接的活化养分的作用,而植物根系促进质子、有机酸和酸性磷酸酶的分泌是其活化利用土壤难溶磷的重要途径。一般而言,植物通过根系分泌有机酸活化土壤难溶性无机磷[12];分泌酸性磷酸酶(Acid phosphatase,APase)活化有机磷源,从而提高养分效率[13]。
③协同磷−铝交互作用,提高对酸性土壤的综合适应性。磷、铝元素之间存在显著的互作关系[14]。首先,磷与铝结合形成难溶性磷酸铝络合物,使根际或植物体内的铝活性下降,进而减轻铝毒危害;其次,有机酸与磷酸根竞争吸附金属阳离子,络合土壤或生长介质中的铝生成沉淀并促进磷的释放;此外,磷、铝交互调控植物有机酸的分泌,同时达到降低铝毒和增强磷效率的作用[15]。从大豆磷高效基因型HN89中克隆的苹果酸转运子GmALMT1受pH、铝和磷三者协同调控。在拟南芥Arabidopsis thaliana及大豆离体毛根中过表达该基因,均能增加根系苹果酸的分泌,进而增强转基因材料对低pH和铝毒的耐性[14],暗示GmALMT1参与的苹果酸分泌是大豆养分高效且适应酸性土壤的重要机制。
④与菌根真菌(Arbuscular mycorrhiza fungi,AMF)共生,提高对土壤氮、磷养分的获取。AMF形成大量的根外菌丝,不仅扩大了养分吸收面积,还具有较强吸收和运转养分的能力。利用同位素标记法发现,外生菌丝可延伸至距离根系8~27 cm根围处吸收土壤氮、磷等养分[16-18];同时根外菌丝能够进入根毛无法触及的土壤间隙,提高了土壤养分的空间利用率。AMF还能通过促进共生植物根系分泌有机酸和磷酸酶,提高共生体对土壤难溶性磷的活化能力[19]。研究表明,AMF的侵染显著增加了玉米Zea mays根际磷酸酶活性,促进了蚕豆Vicia faba根系柠檬酸、苹果酸和酸性磷酸酶的分泌,进而促进了植物对土壤有机磷的活化和利用,提高了植物磷效率和生物量[20-21]。此外,AMF能够促进根系生长发育,增加侧根数目和长度,进一步提高植物本身对土壤养分的吸收利用能力[22]。
⑤与根瘤菌共生形成根瘤,进行生物固氮,达到减肥增效的作用。对于酸性土壤,由于环境高温多雨,土著根瘤菌较少,接种根瘤菌等农业措施对豆科作物的生长尤为重要。然而,筛选获得适应酸性土壤且具有较强竞争结瘤能力和高效固氮能力的根瘤菌株系,是实现酸性土壤中豆科作物高产的基础[23]。在巴西,大豆增产主要依赖根瘤菌接种措施[24]。本实验室(福建农林大学根系生物学研究中心)在研究前期,从酸性土壤上分离获得了高效固氮且具有广适性的根瘤菌株系。田间试验发现,在中、低氮水平下,大豆接种高效根瘤菌菌剂比常规施肥增产90%以上[25]。生物固氮作用不仅显著增加大豆氮含量,而且还能显著提高植株磷含量。说明大豆接种高效根瘤菌具有同时提高植株氮效率和磷效率的潜力。生物固氮显著提高磷效率的机制主要包括:首先,根瘤菌具有活化难溶态磷和有机磷的能力。根瘤菌能活化Ca-P,在以Ca3(PO4)2为磷源的培养基上生长,会形成明显的溶磷圈[26];当根瘤菌在难溶态磷或有机磷为磷源的液体培养基中生长时,pH显著降低而培养液中磷的有效性明显增加[27]。其次,根瘤菌本身能分泌生长素IAA和胞外多糖等物质[26, 28-31],暗示了根瘤菌对宿主根系生长及根际微生物环境具有一定的调控作用。再次,大量田间试验发现,接种根瘤菌显著刺激了大豆根系生长,根构型明显变浅,促进了宿主植物本身对土壤磷的吸收[32]。最后,接种根瘤菌能促使大豆根际及根瘤际释放大量质子和有机酸,进一步促进宿主对难溶态磷的活化和利用[26]。同时,由于大豆生物固氮作用,使其具有更强招募有益土壤微生物的能力,进而增强对酸性土壤的适应性[33]。
2 豆科作物根系养分高效的遗传分子机制根构型的改变与结瘤固氮是豆科作物适应酸性土壤和提高氮、磷养分效率的重要生理机制。然而,根构型对低磷胁迫的适应性反应与磷效率的关系以及结瘤固氮均是由多基因控制的数量性状,表现为数量性状的遗传特点。同时,数量性状座位(Quantitative trait loci,QTL)的定位分析为氮、磷效率的数量性状遗传学研究和养分高效品种的选育提供了有效的手段和途径。
研究表明[34],在大豆中,利用根构型存在显著差异的亲本构建106个F9群体,发现31个根系性状与磷效率相关的QTLs位点,分布在5个连锁群上,可解释的变异率为9.1%~31.1%。其中,位于B1连锁群的Satt519和Satt519-Sat-128位置,以及D2连锁群的Satt458位置,分布多个根系性状与磷效率相关的QTLs。根系是豆科作物共生根瘤形成和发挥固氮功能的主要部位。研究发现,接种高效根瘤菌,改变了大豆根构型,使其明显变浅,而浅根型大豆具有更强的磷效率和结瘤能力[32],说明根构型−磷效率−生物固氮之间存在必然的遗传调控关系。利用根构型与结瘤固氮具有明显差异的大豆亲本JD12与NF58构建175个F9:11重组自交系,通过分析根构型、结瘤固氮和生物量等21个相关指标,一共定位到70个QTLs位点。其中,qBNFRA-C2,qBNF-RA-O和qBNF-RA-B1是大豆中新发现的控制生物固氮和根构型的位点[32]。这些研究结果为根构型与生物固氮调控的机理研究以及为培育氮、磷高效的大豆新材料提供了遗传基础。
进一步利用SoyBase(https://soybase.org/)数据库结合最近的研究结果,发现根构型、磷效率和生物固氮等相关性状的QTLs存在共定位现象(图2)。GmINS1是控制大豆生物固氮相关QTL,即qBNF-11的主要候选基因,GmINS1也位于共定位区间。Li等[35]通过对该候选基因的克隆及功能解析,发现GmINS1通过转录调控,促进了根瘤膨大发育而提高了大豆的生物固氮能力,为豆科作物氮效率的遗传改良提供候选基因或遗传材料。此外,在大豆10号染色体上,发现多个控制根构型、磷效率和生物固氮相关的调控基因。例如,控制根构型的β−扩张蛋白基因GmEXPB2位于10号染色体,过表达该基因能显著促进根系伸长、增加根尖分生区和伸长区细胞数目及长度,进而显著提高大豆磷效率。同时,GmEXPB2的表达,一方面通过松弛细胞壁直接调控根瘤菌侵染线形成数量、加快根瘤原基和根瘤早期维管束的发育,提高生物固氮效率;另一方面,通过调控根构型、增加根毛区长度及根毛密度扩大根瘤菌与大豆根系的接触面积,进一步促进大豆结瘤,最终显著提高大豆氮、磷利用效率[36-37]。此外,介导根瘤获取磷的关键转运子GmPT5和GmPT7也位于10号染色体。其中,GmPT5能促进根瘤在磷缺乏条件下从宿主根系抢夺磷,增强生物固氮能力[25],是“以磷增氮”的关键分子调控机制;GmPT7介导根瘤对外界磷的吸收及磷向根瘤类菌体中的运转[38]。由此可见,挖掘控制根构型−磷效率−生物固氮相关性状的主效基因及其功能解析,对遗传分子机理的研究,对大豆根系遗传改良及氮、磷效率的提高等均具有重要意义。
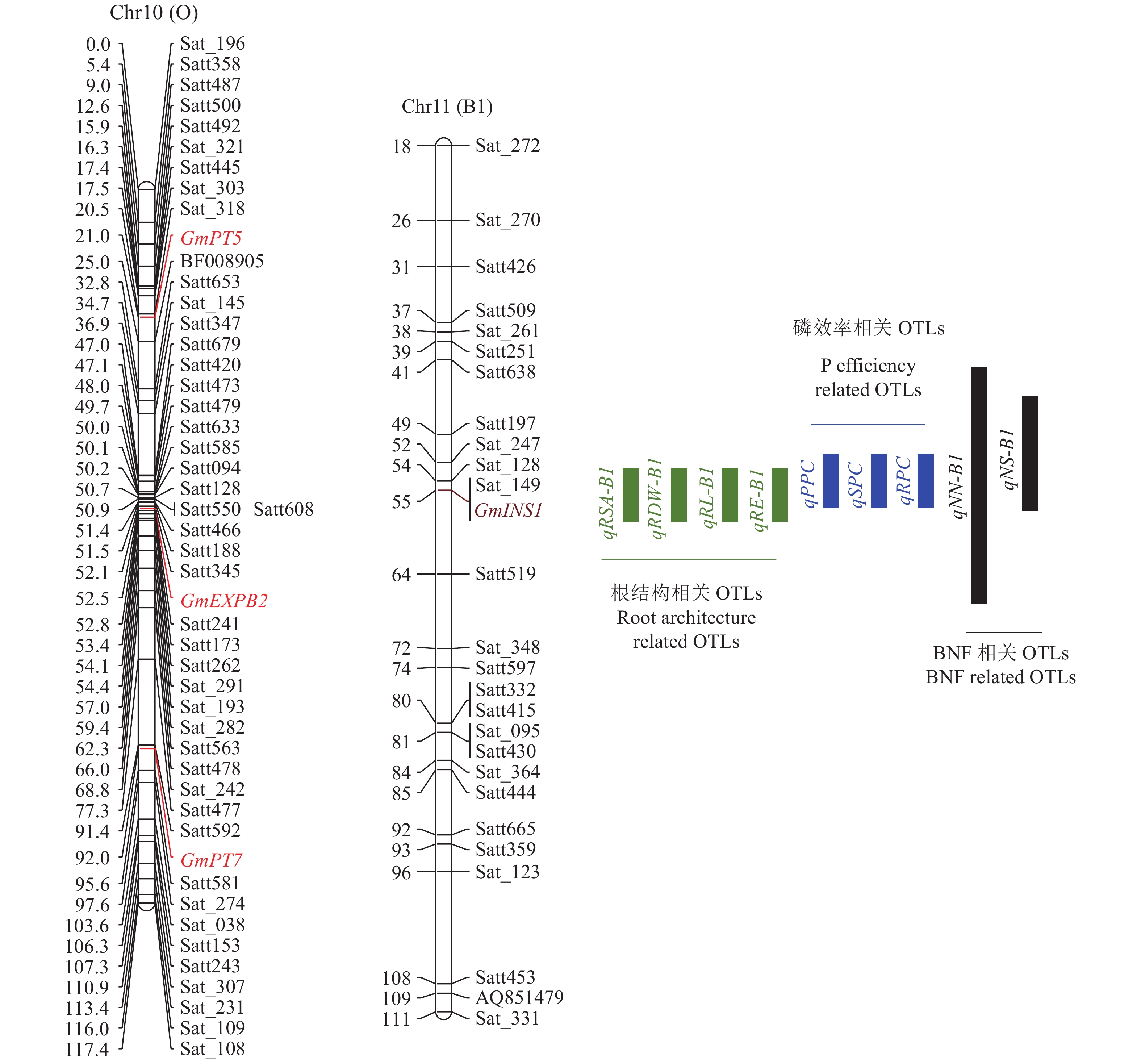
|
图 2 大豆根构型、磷效率和生物固氮等性状的QTLs克隆及相关重要基因的定位 Fig. 2 Cloning of QTLs for root architecture, P efficiency and BNF traits and localization of some related genes in soybean 根构型相关QTLs,如控制根表面积(RSA)、根干质量(RDW)、根长(RL)和根宽(RE)的QTLs与磷效率相关QTLs,如控制植株磷含量(PPC)、地上部磷含量(SPC)和根系磷含量(RPC)的QTLs,以及与生物固氮(BNF)相关QTLs,如控制根瘤数目(NN)和根瘤大小(NS)等性状的QTLs在11号染色体(B1)共定位 Root architecture related QTLs, such as QTLs for root surface area (RSA), root dry weight (RDW), root length (RL) and root extent (RE) and phosphorus efficiency related QTLs, such as QTLs for plant P content (PPC), shoot P content (SPC) and root P content (RPC) as well as biological nitrogen fixation (BNF) related QTLs, such as QTLs for nodule number (NN) and nodule size (NS) were co-localized on chromosome 11 (B1) |
根际受植物根系活动影响,不同于土体的部分微域环境,是植株物质交换、信号转导、养分吸收的重要场所,同时也是植物与微生物互作的重要界面[39-40]。土壤微生物数量庞大,在生态系统中功能活跃,是最丰富的生物资源库[41]。微生物的种类和数量取决于植物根系活动、根系分泌物组成和土层深度等,是一个动态且有生命的自然体。据估计,植物20%~50%的光合产物被运送到根部,其中17%左右的碳以根际沉积的形式,分泌到根际作为微生物活动的碳源,导致土壤微生物在根际富集,进行固氮、氧化、硝化、氨化和硫化等,在提高土壤养分有效性、促生、抑制病原微生物活性和维持宿主植物健康等方面具有重要作用[42-46]。因此,植物对根际微生物的吸引及其在土壤中的分布活动,能够反映出微生物对植物生长发育的影响以及在土壤肥力、物质循环、能量转化中的调控作用。
众所周知,根系与根瘤菌间的分子对话是豆科植物共生根瘤形成的先决条件。植物首先分泌黄酮类物质,诱导根瘤菌合成一些脂壳寡糖类结瘤因子,两者进行特异性识别后,进一步促使结瘤过程的发生[47-49]。豆科植物与固氮微生物共生关系的建立,暗示了在微生物互作方面的特异性,是有别于非豆科植物的。研究发现,大豆根际倾向吸引大量具有固氮功能的微生物菌群,可能由于大豆根系分泌物的筛选作用,致使大豆根际微生物的菌群密度显著高于土壤中微生物菌群密度,然而其多样性显著低于土壤微生物的多样性[33, 50]。在门分类水平上,大豆根际的优势微生物菌群主要为变形菌门、放线菌门、拟杆菌门和厚壁菌门;而在属分类水平上,大豆根际显著富集了大量固氮微生物,包括根瘤菌属Rhizobium、固氮菌属Azotobacter、慢生根瘤菌属Bradyrhizobium和中华根瘤菌属Sinorhizobium等[33]。在这些固氮微生物群落里,只有根瘤菌能与大豆互利共生,形成根瘤,行使生物固氮的功能。
植物根际促生菌是附生于植物根系的一类可促进植物生长、提高对土壤矿质营养吸收和利用、并能抑制有害微生物的有益菌类[51-53]。研究表明,大豆根际富集了大量促生菌种,包括自身固氮菌、解磷菌/溶磷菌和硅酸盐细菌Silicate bacteria等,这些根际促生细菌共同促进了大豆生长,使植株生物量增加[54]。此外,微生物组之间存在协同调控作用,固氮菌和解磷细菌共同存在时,能够相互促进、相互依存,并增强植物根系生理活性,提高植物养分效率和抗逆能力[55-56]。虽然放线菌的解磷能力相对于细菌和真菌较弱,但有些具有解磷能力的放线菌,例如链霉菌属Streptomyces,具有更好的生防功能[57-60],因此,将根际微生物组重新组装,对提高作物养分效率、维护土壤健康、减轻和预防作物病害等方面均具有重要作用[61-62]。然而,根际微生物组随着豆科作物品种与根系分泌物的不同而发生变化。研究发现,高结瘤能力的大豆品种,更具有吸引有益根际微生物的能力,同时接种高效根瘤菌对大豆的根际微生物组也产生明显影响,说明豆科作物–根瘤菌共生作用与根际微生物存在协同交互作用[33]。
综上可知,大豆对根际微生物群落的调控,继而提高养分效率的机制主要包括:一方面,大豆根系通过分泌物或者根际沉积的形式从土壤中吸引特定的微生物在根际富集;另一方面,大豆不同基因型,对根际微生物的菌群结构具有一定的调控和影响;其次,外源的微生物,例如接种的高效根瘤菌会直接调控大豆根际微生物菌群的组成,促进植物生长,进而维护土壤健康(图1)。然而,关于豆科作物根际富集微生物的种类偏好性、不同种群微生物组与养分活化的关系及其相应的生理与分子调控机制等还需进一步挖掘探索。
4 大豆在农业生产中的应用及生态效益豆科植物不仅能够与根瘤菌共生进行生物固氮反应,而且还能被菌根真菌侵染,进而形成AMF−豆科植物−根瘤菌共生体系。在农业生产中,充分利用豆科植物这种天然的共生系统对提高植株氮、磷养分效率、修复土壤、丰富根际微生物群落、肥地养地和发展可持续生态农业等均具有重要意义。
豆科作物在农业生态系统中发挥着不可替代的作用,尤其体现在豆科作物(如大豆)与非豆科作物(玉米–茶)间作/套作栽培方式所带来的经济及生态效益方面。首先,在传统农业种植模式上,大豆−玉米间作形式最为普遍且具有明显的产量优势。大量研究表明,间作系统的经济产量明显高于单作大豆或玉米,并且玉米具有更强的间作优势,大豆具有促进玉米产量增加的作用[63]。由于大豆的生物固氮作用,在两种作物生长期间,大豆固定的氮可以向禾本科作物转移,这种转移的氮素成为禾本科作物生长所需的一种重要的氮源[64-66]。大田试验发现,间作玉米的吸氮量和生物量比单作时分别增加了55.7%和27.9%,进而显著提高了玉米产量[64]。其次,豆科作物生物固氮可显著降低温室气体的释放。玉米与豆科植物间作,土壤N2O的含量显著低于玉米单作。与其他豆科作物相比,玉米–大豆间作的土壤N2O排放量降低最为显著,大豆是间作系统中效果最明显的豆科作物[67]。此外,由于植物根构型的差异,间作系统还显著提高了作物对不同土层养分的吸收,阻止了氮淋失到深层土壤,减少了其对水体的污染[68]。第三,大豆–玉米间作可通过根系互作改变土壤生态环境,继而影响根际微生物组,使有益微生物增多,从而增强其对土传植物病原菌的拮抗而降低土传病害发生[33, 61, 69]。
豆科作物与茶树间/套作的种植模式,对我国生态茶园建设意义重大[70]。中国是茶的发源地,同时也是世界第一产茶大国。然而,我国茶园普遍存在土壤酸化、养分效率低、水土流失严重等问题。首先,通过筛选适应酸性土壤的养分高效大豆品种与茶树进行间/套作,能显著促进茶叶生长,增加茶叶产量的同时提高茶叶品质。其次,作为绿肥,大豆秸秆还田后,显著改善了茶园土壤的理化性质,提高了土壤pH,增加了土壤有机质及有效氮和全氮含量,平衡了土壤养分,结合其他绿肥(如油菜等),可大幅度减少或者不用额外使用化学肥料。再次,与大豆间作,改良了茶园生态环境和小气候,显著减少了病虫害和杂草发生,降低了茶园管理成本,进而提高了茶园的经济效益。最后,与大豆间作,不仅提高土壤肥力,而且改善了土壤健康,茶−豆间/套作显著提高了土壤微生物多样性,改变了茶园微生物组,更有利于茶园生态发展。
5 展望酸性土壤养分有效性低限制了作物的生长和产量,通过挖掘作物自身潜力,培育养分高效的新品系对减肥增效的可持续农业建设至关重要。目前,现有的数据和理论未能完全解析豆科作物适应酸性土壤养分高效的调控机制。今后,应进一步加强豆科作物遗传机制的研究,尤其在揭示根构型、根系分泌物与根际微生物互作相关的遗传机制方面,包括根构型与养分效率/微生物互作相关的QTL定位及主效基因功能解析、根系分泌物–土壤养分活化和离子毒害–微生物碳源三者之间的平衡及可能的遗传调控,豆科作物根际微生物组参与的养分高效遗传控制等,以寻找相应的分子标记或关键目标基因,为应用分子标记辅助选择和转基因等现代生物技术改良适应酸性土壤营养高效的新材料奠定基础;基于豆科作物生物固氮的特殊性,需要进一步加强豆科作物适应酸性土壤根际微生物种质资源的筛选与鉴定等基础性研究,揭示根际微生物互作机制及效果评价,从分子水平上解析微生物参与的豆科作物养分高效的机理;进一步推动豆科作物在生态农业建设中的应用,结合绿肥产业技术,使其在肥地养地、促进土壤健康、减肥增效的可持续农业生产中发挥实质性的作用。
| [1] |
HE Z, YANG X, BALIGAR V C. Increasing nutrient utilization and crop production in the red soil regions of China[J]. Commun Soil Sci Plan, 2001, 32(7/8): 1251-1263. (  0) 0) |
| [2] |
KOCHIAN L V, HOEKENGA O A, PIÑEROS M A. How do crop plants tolerance acid soils? Mechanisms of aluminum tolerance and phosphorous efficiency[J]. Annu Rev Plant Biol, 2004, 55: 459-493. DOI:10.1146/annurev.arplant.55.031903.141655 (  0) 0) |
| [3] |
HERRIDGE D F, PEOPLES M B, BODDEY R M. Global inputs of biological nitrogen fixation in agricultural systems[J]. Plant Soil, 2008, 311(1/2): 1-18. (  0) 0) |
| [4] |
OLDROYD G E, DOWNIE J A. Coordinating nodule morphogenesis with rhizobial infection in legumes[J]. Annu Rev Plant Biol, 2008, 59(1): 519-546. DOI:10.1146/annurev.arplant.59.032607.092839 (  0) 0) |
| [5] |
李欣欣, 许锐能, 廖红. 大豆生物固氮在农业减肥增效中的贡献及应用潜力[J]. 大豆科学, 2016, 35(4): 531-535. (  0) 0) |
| [6] |
VON UEXKÜLL H R, MUTERT E. Global extent, development and economic impact of acid soils[J]. Plant Soil, 1995, 171(1): 1-15. DOI:10.1007/BF00009558 (  0) 0) |
| [7] |
LYNCH J P. Root architecture and plant productivity[J]. Plant Physiol, 1995, 109: 7-13. DOI:10.1104/pp.109.1.7 (  0) 0) |
| [8] |
LIAO H, RUBIO G, YAN X, et al. Effect of phosphorus availability on basal root shallowness in common bean[J]. Plant Soil, 2001, 232: 69-79. DOI:10.1023/A:1010381919003 (  0) 0) |
| [9] |
ZHAO J, FU J B, LIAO H, et al. Characterization of root architecture in an applied core collection for phosphorus efficiency of soybean germplasm[J]. Chin Sci Bull, 2004, 49(15): 1611-1620. DOI:10.1007/BF03184131 (  0) 0) |
| [10] |
SAMPLE E C, SOPER R J, RACZ G J. Reactions of phosphate fertilizers in soils[M]//KHASAWNEH F E, SAMPLE E C, KAMPRATH E J . The role of phosphorus in agriculture. Wisconsin: Am Soc Agronomy, Crop Sci Soc Am, Soil Sci Soc Am, 1980: 263-312.
(  0) 0) |
| [11] |
SANYAL S K, D E DATTA S K. Chemistry of phosphorus transformations in soil[J]. Adv Soil Sci, 1991, 16: 1-120. (  0) 0) |
| [12] |
DUBEY K K, RENU P, SINGH Y K, et al. Organic acid exudation and its relationship with phosphorus uptake efficiency in mungbean [Vignaradiata (L.) Wilczek] genotypes
[J]. Ann Biol, 2014, 30(4): 579-588. (  0) 0) |
| [13] |
WANG X R, WANG Y X, TIAN J, et al. Overexpressing AtPAP15 enhances phosphorus efficiency in soybean
[J]. Plant Physiol, 2009, 151(1): 233-240. DOI:10.1104/pp.109.138891 (  0) 0) |
| [14] |
LIAO H, WAN H, SHAFF J, et al. Phosphorus and aluminum interactions in soybean in relation to aluminum tolerance: Exudation of specific organic acids from different regions of the intact root system[J]. Plant Physiol, 2006, 141: 674-684. DOI:10.1104/pp.105.076497 (  0) 0) |
| [15] |
YANG L T, JIANG H X, TANG N, et al. Mechanisms of aluminum-tolerance in two species of citrus: Secretion of organic acid anions and immobilization of aluminum by phosphorus in roots[J]. Plant Sci, 2011, 180(3): 521-530. DOI:10.1016/j.plantsci.2010.11.011 (  0) 0) |
| [16] |
HATTINGH M J, GRAY L E, GERDEMANN J W. Uptake and translocation of 32P labeled phosphate to onion roots by endomycorrhizal fungi
[J]. Soil Sci, 1973, 116(5): 383-387. DOI:10.1097/00010694-197311000-00007 (  0) 0) |
| [17] |
RHODES L H, GERDEMANN J W. Phosphate uptake zones of mycorrhizal and non-mycorrhizal onions[J]. New Phytol, 1975, 75(3): 555-561. DOI:10.1111/nph.1975.75.issue-3 (  0) 0) |
| [18] |
AMES R N, REID C P P, PORTER L K, et al. Hyphal uptake and transport of nitrogen from two 15N-labelled sources by Glomus mosseae, a vesicular-arbuscularmycorrhizal fungus
[J]. New Phytol, 1983, 95(3): 381-396. DOI:10.1111/nph.1983.95.issue-3 (  0) 0) |
| [19] |
苏友波, 林春, 张福锁, 等. 不同AM菌根菌分泌的磷酸酶对根际土壤有机磷的影响[J]. 土壤, 2003, 35(4): 334-338. DOI:10.3321/j.issn:0253-9829.2003.04.013 (  0) 0) |
| [20] |
宋勇春, 李晓林, 冯固. 泡囊丛枝(VA)菌根对玉米根际磷酸酶活性的影响[J]. 应用生态学报, 2001, 12(4): 593-596. DOI:10.3321/j.issn:1001-9332.2001.04.027 (  0) 0) |
| [21] |
QIAO X, BEI S, LI C, et al. Enhancement of faba bean competitive ability by arbuscularmycorrhizal fungi is highly correlated with dynamic nutrient acquisition by competing wheat[J]. Sci Rep, 2015, 5: 8122. DOI:10.1038/srep08122 (  0) 0) |
| [22] |
LI X X, ZENG R S, LIAO H. Improving crop nutrient efficiency through root architecture modifications[J]. J Integr Plant Biol, 2016, 58(3): 193-202. DOI:10.1111/jipb.12434 (  0) 0) |
| [23] |
程凤娴, 曹桂琴, 王秀荣, 等. 华南酸性低磷土壤中大豆根瘤菌高效株系的发现及应用[J]. 科学通报, 2008, 53(23): 2903-2910. DOI:10.3321/j.issn:0023-074X.2008.23.011 (  0) 0) |
| [24] |
ALVES B J R, BODDEY R M, URQUIAGA S. The success of BNF in soybean in Brazil[J]. Plant Soil, 2003, 252(1): 1-9. DOI:10.1023/A:1024191913296 (  0) 0) |
| [25] |
QIN L, ZHAO J, TIAN J, et al. The high-affinity phosphate transporter GmPT5 regulates phosphate transport to nodules and nodulation in soybean[J]. Plant Physiol, 2012, 159(4): 1634-1643. DOI:10.1104/pp.112.199786 (  0) 0) |
| [26] |
QIN L, JIANG H, TIAN J, et al. Rhizobia enhance acquisition of phosphorus from different sources by soybean plants[J]. Plant Soil, 2011, 349(1/2): 25-36. (  0) 0) |
| [27] |
ALIKHANI H A, SALEH-RASTIN N, ANTOUN H. Phosphate solubilization activity of rhizobia native to Iranian soils[J]. Plant Soil, 2006, 287(1/2): 35-41. (  0) 0) |
| [28] |
DEFEZ R, ANDREOZZI A, DICKINSON M, et al. Improved drought stress response in alfalfa plants nodulated by an IAA over-producing Rhizobium strain
[J]. Front Microbiol, 2017, 8: 2466. DOI:10.3389/fmicb.2017.02466 (  0) 0) |
| [29] |
JIAN L, BAI X, ZHANG H, et al. Promotion of growth and metal accumulation of alfalfa by coinoculation with Sinorhizobium and Agrobacterium under copper and zinc stress
[J]. Peer J, 2019, 7: e6875. DOI:10.7717/peerj.6875 (  0) 0) |
| [30] |
IMADA E L, ROLLA DOS SANTOS A A P, OLIVEIRA A L M, et al. Indole-3-acetic acid production via the indole-3-pyruvate pathway by plant growth promoter Rhizobium tropici CIAT 899 is strongly inhibited by ammonium
[J]. Res Microbiol, 2017, 168(3): 283-292. DOI:10.1016/j.resmic.2016.10.010 (  0) 0) |
| [31] |
KOPYCIŃSKA M, LIPA P, CIEŚLA J, et al. Extracellular polysaccharide protects Rhizobium leguminosarum cells against zinc stress in vitro and during symbiosis with clover
[J]. Environ Microbiol Rep, 2018, 10(3): 355-368. DOI:10.1111/emi4.2018.10.issue-3 (  0) 0) |
| [32] |
YANG Y Q, ZHAO Q S, LI X X, et al. Characterization of genetic basis on synergistic interactions between root architecture and biological nitrogen fixation in soybean[J]. Front Plant Sci, 2017, 8: 1466. DOI:10.3389/fpls.2017.01466 (  0) 0) |
| [33] |
ZHONG Y J, YANG Y Q, LIU P, et al. Genotype and rhizobium inoculation modulate the assembly of soybean rhizobacterial communities[J]. Plant Cell Environ, 2019, 42(6): 2028-2044. DOI:10.1111/pce.v42.6 (  0) 0) |
| [34] |
LIANG Q, CHENG X, MEI M, et al. QTL analysis of root traits as related to phosphorus efficiency in soybean[J]. Ann Bot, 2010, 106(1): 223-234. DOI:10.1093/aob/mcq097 (  0) 0) |
| [35] |
LI X X, ZHENG J K, YANG Y Q, et al. INCREASING NODULE SIZE1 expression is required for normal rhizobial symbiosis and nodule development
[J]. Plant Physisol, 2018, 178: 1233-1248. DOI:10.1104/pp.18.01018 (  0) 0) |
| [36] |
GUO W B, ZHAO J, LI X X, et al. A soybean β-expansin gene GmEXPB2 intrinsically involved in root system architecture responses to abiotic stresses
[J]. Plant J, 2011, 66: 541-552. DOI:10.1111/j.1365-313X.2011.04511.x (  0) 0) |
| [37] |
LI X X, ZHAO J, TAN Z Y, et al. GmEXPB2, a cell wall β-expansin, affects soybean nodulation through modifying root architecture and promoting nodule formation and development
[J]. Plant Physiol, 2015, 169: 2640-2653. (  0) 0) |
| [38] |
CHEN L Y, QIN L, ZHOU L L, et al. A nodule-localized phosphate transporter GmPT7 plays an important role in enhancing symbiotic N2 fixation and yield in soybean
[J]. New Phytol, 2018, 221(4): 2013-2025. (  0) 0) |
| [39] |
NIHORIMBERE V, CAWOY H, SEYER A, et al. Impact of rhizosphere factors on cyclic lipopeptide signature from the plant beneficial strain Bacillus amyloliquefaciens S499
[J]. FEMS Microbiol Ecol, 2012, 79(1): 176-191. DOI:10.1111/j.1574-6941.2011.01208.x (  0) 0) |
| [40] |
HIRSCH A M, ALVARADO J, BRUCE D, et al. Complete genome sequence of Micromonospora strain L5, a potential plant-growth-regulating actinomycete, originally isolated from Casuarina equisetifolia root nodules[J/OL]. Genome Announc, 2013, 1(5). doi: 10.1128/genomeA.00759-13.[2019-05-20]. https://mra.asm.org/content/1/5/e00759-13.short.
(  0) 0) |
| [41] |
VANNIER N, MONY C, BITTEBIERE A K, et al. A microorganisms’s journey between plant generations[J]. Microbiome, 2018, 6(1): 79. DOI:10.1186/s40168-018-0459-7 (  0) 0) |
| [42] |
JONES D L, NGUYEN C, FINLAY D. Carbon flow in the rhizosphere: Carbon trading at the soil-root interface[J]. Plant Soil, 2009, 321(1/2): 5-33. (  0) 0) |
| [43] |
KUZYAKOV Y, DOMANSKI G. Carbon input by plants into the soil[J]. J Plant Nutr Soil Sci, 2000, 163(4): 421-431. DOI:10.1002/(ISSN)1522-2624 (  0) 0) |
| [44] |
HENNION N, DURAND M, VRIET C, et al. Sugars en route to the roots: Transport, metabolism and storage within plant roots and towards microorganisms of the rhizosphere[J]. Physiol Plant, 2019, 165(1): 44-57. DOI:10.1111/ppl.12751 (  0) 0) |
| [45] |
JACOBY R, PEUKERT M, SUCCURRO A, et al. The role of soil microorganisms in plant mineral nutrition-current knowledge and future directions[J]. Front Plant Sci, 2017, 8: 1617. DOI:10.3389/fpls.2017.01617 (  0) 0) |
| [46] |
OHKAMA-OHTSU N, WASAKI J. Recent progress in plant nutrition research: Cross-talk between nutrients, plant physiology and soil microorganisms[J]. Plant Cell Physiol, 2010, 51(8): 1255-1264. DOI:10.1093/pcp/pcq095 (  0) 0) |
| [47] |
OLDROYD G E D, DOWNIE J A. Calcium, kinases and nodulation signaling in legumes[J]. Nat Rev Mol Cell Biol, 2004, 5: 566-576. DOI:10.1038/nrm1424 (  0) 0) |
| [48] |
RADUTOIU S, MADSEN L H, MADSEN E B, et al. LysM domains mediate lipochitin-oligosaccharide recognition and Nfr genes extend the symbiotic host range
[J]. EMBO J, 2007, 26(17): 3923-3935. DOI:10.1038/sj.emboj.7601826 (  0) 0) |
| [49] |
MURRAY J D. Invasion by invitation: Rhizobial infection in legumes[J]. MPMI, 2011, 24(6): 631-639. DOI:10.1094/MPMI-08-10-0181 (  0) 0) |
| [50] |
XU Y, WANG G, JIN J, et al. Bacterial communities in soybean rhizosphere in response to soil type, soybean genotype, and their growth stage[J]. Soil Biol Biochem, 2009, 41(5): 919-925. DOI:10.1016/j.soilbio.2008.10.027 (  0) 0) |
| [51] |
LIU Z, BESKROVNAYA P, MELNYK R A, et al. A genome-wide screen identifies genes in rhizosphere-associated Pseudomonas required to evade plant defenses[J/OL]. M Biol, 2018, 9(6). doi: 10.1128/mBio.00433-18.[2019-05-20]. https://www.researchgate.net/publication/328771150_.
(  0) 0) |
| [52] |
BERG M, KOSKELLA B. Nutrient- and dose-dependent microbiome-mediated protection against a plant pathogen[J]. Curr Biol, 2018, 28(15): 2487-2492. DOI:10.1016/j.cub.2018.05.085 (  0) 0) |
| [53] |
LIU J, TANG L, GAO H, et al. Enhancement of alfalfa yield and quality by plant growth-promoting rhizobacteria under saline-alkali conditions[J]. J Sci Food Agric, 2019, 99(1): 281-289. DOI:10.1002/jsfa.2019.99.issue-1 (  0) 0) |
| [54] |
王志刚, 钟鹏, 王建丽, 等. 东北黑土区大豆根际促生菌生长条件及促生效应[J]. 大豆科学, 2012, 31(2): 270-273. DOI:10.3969/j.issn.1000-9841.2012.02.022 (  0) 0) |
| [55] |
AFZAL A, BANO A. Rhizobium and phosphate solubilizing bacteria improve the yield and phosphorus uptake in wheat (Triticum aestivum)
[J]. Int J Agric Biol, 2008, 10(1): 1560-8530. (  0) 0) |
| [56] |
ABID K, SULTAN T, KIANI M Z, et al. Effect of Rhizobium and phosphate solubilizing bacteria at different levels of phosphorus applied on nodulation, growth and yield of peas (Pisum sativum)
[J]. Int J Biosci, 2016, 8(5): 112-121. (  0) 0) |
| [57] |
EVANGELISTA-MARTÍNEZ Z. Isolation and characterization of soil Streptomyces species as potential biological control agents against fungal plant pathogens
[J]. World J Microbiol Biotechnol, 2014, 30(5): 1639-1647. DOI:10.1007/s11274-013-1568-x (  0) 0) |
| [58] |
JOG R, PANDYA M, NARESHKUMAR G, et al. Mechanism of phosphate solubilization and antifungal activity of Streptomyces spp. isolated from wheat roots and rhizosphere and their application in improving plant growth
[J]. Microbiology, 2014, 160: 778-788. DOI:10.1099/mic.0.074146-0 (  0) 0) |
| [59] |
DIAS M P, BASTOS M S, XAVIER V B, et al. Plant growth and resistance promoted by Streptomyces spp. in tomato
[J]. Plant Physiol Biochem, 2017, 118: 479-493. DOI:10.1016/j.plaphy.2017.07.017 (  0) 0) |
| [60] |
王世强, 魏赛金, 杨陶陶, 等. 链霉菌JD211对水稻幼苗促生作用及土壤细菌多样性的响应[J]. 土壤学报, 2015, 52(3): 673-681. (  0) 0) |
| [61] |
GAO X, WU M, WANG X R, et al. Root interactions in a maize/soybean intercropping system control soybean soil-borne disease, red crown rot[J/OL]. PLoS One, 2014, 9(5): e95031.[2019-05-20]. https://doi.org/10.1371/journal.pone.0095031.
(  0) 0) |
| [62] |
LOBO C B, JUÁREZ TOMÁS M S, VIRUEL E, et al. Development of low-cost formulations of plant growth-promoting bacteria to be used as inoculants in beneficial agricultural technologies[J]. Microbiol Res, 2019, 219: 12-25. DOI:10.1016/j.micres.2018.10.012 (  0) 0) |
| [63] |
李志贤, 王建武, 杨文亭, 等. 广东省甜玉米/大豆间作模式的效益分析[J]. 中国生态农业学报, 2010, 18(3): 627-631. (  0) 0) |
| [64] |
WANG G, SHENG L, ZHAO D. Allocation of nitrogen and carbon is regulated by nodulation and mycorrhizal networks in soybean/maize intercropping system[J/OL]. Front Plant Sci, 2016, 7.[2019-05-20]. https://doi.org/10.3389/fpls.2016.01901.
(  0) 0) |
| [65] |
MENG L, ZHANG A, WANG F, et al. Arbuscularmycorrhizal fungi and rhizobium facilitate nitrogen uptake and transfer in soybean/maize intercropping system[J/OL]. Front Plant Sci, 2015, 6.[2019-05-20]. https://doi.org/10.3389/fpls.2015.00339.
(  0) 0) |
| [66] |
INGRAFFIA R, AMATO G, FRENDA A S, et al. Impacts of arbuscularmycorrhizal fungi on nutrient uptake, N2 fixation, N transfer, and growth in a wheat/faba bean intercropping system[J]. PLoS One, 2019, 14(3): e0213672.[2019-05-20]. https://doi.org/10.1371/journal.pone.0213672.
(  0) 0) |
| [67] |
HUANG J X, CHEN Y Q, SUI P, et al. Soil nitrous oxide emissions under maize-legume intercropping system in the north China plain[J]. J Integr Agric, 2014, 13(6): 1363-1372. DOI:10.1016/S2095-3119(13)60509-2 (  0) 0) |
| [68] |
HUANG J X, SUI P, NIE S W, et al. Effect of maize-legume intercropping on soil nitrate and ammonium accumulation[J]. J Food Agric Environ, 2011, 9(3/4): 416-419. (  0) 0) |
| [69] |
LIAN T, MU Y, MA Q, et al. Use of sugarcane-soybean intercropping in acid soil impacts the structure of the soil fungal community[J]. Sci Rep, 2018, 8(1): 14488. DOI:10.1038/s41598-018-32920-2 (  0) 0) |
| [70] |
黎健龙, 涂攀峰, 陈娜, 等. 茶树与大豆间作效应分析[J]. 中国农业科学, 2008, 41(7): 2040-2047. DOI:10.3864/j.issn.0578-1752.2008.07.022 (  0) 0) |
 2019, Vol. 40
2019, Vol. 40


