禽大肠埃希菌病是由禽致病性大肠埃希菌(Avian pathogenic Escherichia coli,APEC)引起的,禽大肠埃希菌病的发病率和死亡率随着家禽养殖业的迅速发展也随之增加,对养禽业的发展造成严重的经济损失。大肠埃希菌外膜的主要组成成分有脂多糖(Lipopolysaccharides, LPS),其亲水性糖链可以对疏水性物质进入细胞时产生屏障作用,对维持细胞稳定性具有重要作用,为细胞生存提供保护[1]。细菌外膜通透性、外膜表面疏水性都与LPS的结构有关联,LPS还在细胞黏附性和生物被膜形成过程中起到重要作用[2]。经过加工修饰后的LPS会改变细菌的部分生物学功能。例如,细菌对某些抗生素和阳离子抗菌肽的敏感性会因为细菌LPS次级脂肪酸链的缺失而增强[3-5]。细菌LPS的类脂A通过棕榈酰转移酶的作用使其脂肪酸链的数目增加[6],Lau等[7]研究发现细胞外膜的流动性变化与LPS脂肪酸链数目的改变有关系,细胞外膜的流动性变化可以对大肠埃希菌细胞外膜通透性产生影响,Carty等[8]发现细菌外膜通透性增加会使细菌外排大分子的数量增加,进而提高细菌生物被膜的形成量。
细菌在遭受到各种环境胁迫,如抗生素、低pH、高渗透压时,为了抵抗不利的生存环境而形成生物被膜[4]。细胞表面与疏水性化学分子的结合能力称为细胞表面疏水性,不同的菌株在不同的生长条件下细菌外膜表面疏水性对生物被膜形成能力的影响是不同的[9]。PhoP/PhoQ 二元调控系统是这种特定机制中细菌调控基因转录表达的关键途径之一,可通过调控毒力基因的表达来适应外界环境的变化,有研究表明,与LPS合成有关的脂质A的表达受PhoP/PhoQ的调控[10]。细菌外膜LPS的类脂A结构可以通过pagP基因编码的棕榈酰转移酶进行棕榈酰化[11]。pagP是在沙门菌中发现的,与类脂A脂肪酸链修饰有关的蛋白酶, 它是一种外膜棕榈酰转移酶[11-13]。而在大肠埃希菌和相关的革兰阴性致病菌中,pagP可以通过抵抗抗菌肽[14-16]的作用帮助致病菌逃避宿主免疫防御,并通过TLR4 / MD2途径调节触发的炎症反应[17-19]。pagP基因的转录受PhoP/PhoQ调节子控制,其控制在感染宿主过程中诱导的细菌脂质A修饰酶的表达[20-21]。Hittle等[22]报道称副百日咳博德特氏菌Bordetella parapertussis pagP基因通过参与介导对脂质A的修饰来调控细菌外膜功能,这是细菌在感染宿主期间与其相互作用的一种修饰方式。本研究以APEC的pagP基因缺失株为研究对象,研究pagP基因缺失对细菌外膜特性的影响,为进一步研究pagP基因在禽致病性大肠埃希菌中的致病作用提供理论依据。
1 材料与方法 1.1 供试材料禽致病性大肠埃希菌AE17野生株、pagP基因缺失株(ΔpagP)与回复株(CpagP)由安徽农业大学兽医病理生物学与疫病防控安徽省重点实验室保存[23-24];LB 液体培养基、琼脂粉、葡萄糖均购自上海生工;二甲苯、MH培养基、戊二醛、丙酮、结晶紫、红霉素、氨苄西林、乙酸、M9基本培养基购自源叶生物。
1.2 细菌外膜通透性检测采用微量肉汤稀释法[25-26]测定禽致病性大肠埃希菌ΔpagP、AE17以及CpagP对红霉素、氨苄西林的最小抑菌浓度(Minimal inhibitory concentration, MIC)。配制1.28 mg/mL的红霉素、氨苄西林贮存液,收集生长至对数期的细菌菌体,在使用分光光度计测D600 nm时利用LB液体培养基稀释菌液,调整细菌数为108 CFU/mL,经无菌MH肉汤按1∶100 的体积比稀释为106 CFU/mL,以无菌培养基作为对照组,37 ℃条件下过夜培养后观察结果。
1.3 菌株自聚合特性研究 1.3.1 菌株自聚合能力测定禽致病性大肠埃希菌AE17、ΔpagP以及CpagP菌液接种至灭菌的LB液体培养基中,于37 ℃、200 r/min条件下培养至细菌对数生长期,收集菌液,6 000 r/min离心5 min获得菌体后,用无菌PBS缓冲液洗涤重悬,用分光光度计测定600 nm下的初始吸光度(D600 nm)。然后快速取重悬液5 mL置于试管中,在 37 ℃静置,12 h后取各菌株上层液体1 mL,再次在600 nm下测定吸光度(D′600 nm)。每个样品设3个平行样。自聚合能力计算公式:
| $ \text{自聚合能力}=\left( {1 - D'{ _{600\;{\rm{nm}}}}/{D_{600\;{\rm{nm}}}}} \right) \times 100\% \text{。} $ |
用“1.3.1”的方法处理生长至对数期的AE17、ΔpagP以及CpagP菌液,调整初始D600 nm=1.2并分装于试管中,分别置于4、22和37 ℃条件下,静置培养12 h后用分光光度计测D600 nm,分别计算菌株在4、22和37 ℃环境温度时的自聚合能力,分析温度对菌株自聚合的影响。
相同方法处理生长至对数期的AE17、ΔpagP以及CpagP菌液,并分别调整每株菌的初始D600 nm为 1、2和3,分装于试管中,37 ℃静置培养,测不同时间段D600 nm的值,计算自聚合能力,分析不同初始菌液浓度对菌株自聚合能力的影响。
1.4 外膜疏水性研究禽致病性大肠埃希菌AE17、ΔpagP以及CpagP菌液接种至灭菌的LB液体培养基中,置于恒温震荡培养箱,37 ℃、200 r/min条件下培养至细菌的对数生长期,收集菌液,6 000 r/min离心5 min,获得菌体后,用无菌PBS缓冲液洗涤3次,无菌PBS缓冲液重悬浮,用分光光度计在600 nm下测定吸光度(D600 nm)。然后,吸取重悬液5 mL置于试管中,加入2 mL二甲苯溶液漩涡震荡2 min, 混匀后室温静置30 min,重新形成为水相和有机相两相体系。轻轻吸取水相,避免吸取到有机相,再次在600 nm下测定吸光度(D′600 nm)。每个样品设3个平行样。外膜表面疏水性计算公式:
| $ \text{疏水性}=\left( {1 - D'{ _{600\;{\rm{nm}}}}/{D_{600\;{\rm{nm}}}}} \right) \times 100\% \text{。} $ |
取培养至对数中期的AE17菌液按初始D600 nm=0.03分别接种至含2 mL LB、M9和M9+20 g/L葡萄糖培养基的试管中。37 ℃静置培养24 h,吸出培养液,用纯水清洗3次,以1 g/L结晶紫溶液2.5 mL对管壁上的生物被膜进行染色,室温静置15 min,用纯水清洗直至无紫色液体流出,取2 mL体积分数为30%的乙酸溶液加入试管中,超声处理30 min后,以体积分数为30%的乙酸溶液作为对照,用分光光度计测定D597 nm,记为生物被膜形成率。以上试验重复3次。
1.5.2 溶氧与培养时间对生物被膜形成的影响取培养至对数中期的AE17菌液按初始D600 nm=0.03接种至含2 mL LB液体培养基的试管中,分别在转速为0、100和200 r/min(以摇床转速来控制溶氧条件)条件下培养24 h,并于37 ℃静置培养12、24、36和48 h,测定溶氧与培养时间不同情况下的生物被膜形成率。
1.6 pagP缺失对生物被膜形成的影响 1.6.1 生物被膜形成能力观察取培养至对数期的AE17、ΔpagP以及CpagP菌液,收集菌体。用LB液体培养基调整D600 nm =0.03,按每孔200 μL加入96孔试验板中,37 ℃静置培养48 h。用PBS缓冲液洗3次,加1 g/L结晶紫溶液200 μL,室温静置15 min进行染色,用纯水洗净96孔板,观察生物被膜形成情况。
1.6.2 扫描电镜观察细菌生物被膜在6孔细胞板中放入细胞爬片,加入2 mL浓度为108 CFU/mL的菌液,在37 ℃培养箱中静置培养36 h后,通过扫描电镜观察细菌被膜聚合状况。扫描电镜(SEM)观察前处理步骤:
1)样本制备:将培养的细胞爬片取出,PBS缓冲液清洗3次,晾干。
2)固定:用体积分数为2.5%的戊二醛溶液固定2 h, 用无菌PBS缓冲液清洗3次,尽快将样本放入体积分数为3.0%的戊二醛溶液中,4 ℃条件下固定6 h,用无菌PBS缓冲液漂洗3次,每次20 min。
3)梯度脱水:4 ℃条件下,使用体积分数分别为30%、50%、70%、80%、95%和100%的乙醇溶液,依次处理20 min,吸取溶液弃去,再于4 ℃条件下使用丙酮处理20 min,重复2次。
4)干燥:将处理好的样本浸泡在丙酮中送至安徽农业大学生物科技楼公共平台中心进行真空冷冻干燥。
5)黏台:用导电胶将干燥后的样品固定于样品台上。
6)喷金:在不导电的样品表面喷镀一层10 nm左右的贵金属。
7)进样观察。
1.6.3 数据分析应用SPSS 20.0、GraphPad Prism 5和Excel 2007进行数据分析和作图,采用Duncan’s法进行处理组间的多重比较分析。
2 结果与分析 2.1 MIC试验本试验选取了红霉素和氨苄西林进行MIC测定,研究pagP缺失对菌株外膜通透性的影响。结果显示,对于红霉素,AE17、CpagP和ΔpagP的MIC分别为40、20和7 μg/mL,ΔpagP对红霉素的敏感性显著增加(P=0.044)。对于氨苄西林,AE17、CpagP和ΔpagP的MIC分别为40、28和20 μg/mL,ΔpagP与AE17相比对氨苄西林的敏感性有所增加,但是差异不显著(P=0.052)。
2.2 菌株自聚合特性菌株自身凝集性反映了菌体之间的相互作用,其对生物被膜的形成可能具有一定的影响。本试验结果显示,AE17、ΔpagP和CpagP的自聚合能力分别为27.39%、87.89%和28.08%,与AE17相比ΔpagP的自聚合能力显著增强(P=0.016),与CpagP相比ΔpagP的自聚合能力也显著增强(P=0.011),说明pagP基因缺失会增加细菌的自聚合能力。
2.3 温度对菌株自聚合特性的影响如图1所示,在不同培养温度条件下,ΔpagP的自聚合能力显著高于AE17和CpagP,ΔpagP的自聚合能力达到80%左右,而AE17和CpagP的自聚合能力只有15%左右;但在不同培养温度条件下的同一种菌株的自聚合能力没有明显的差异,说明环境温度与菌株的自聚合特性之间没有直接的相关性。
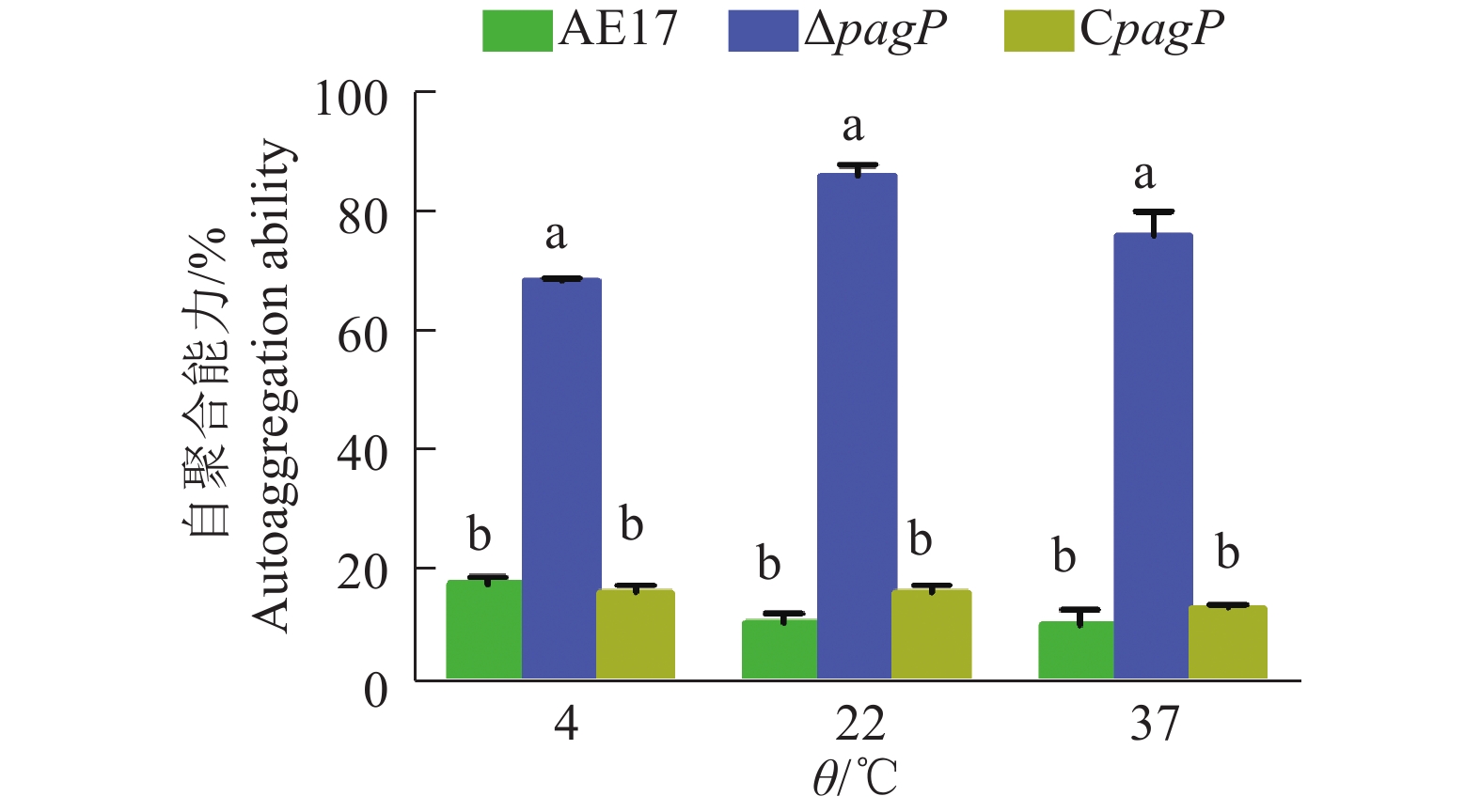
|
图 1 不同培养温度下菌株自聚合能力 Fig. 1 Autoaggregation abilities of bacteria strains at different culture temperatures 相同温度柱子上的不同小写字母表示差异显著(P<0.05,Duncan’ s法) Different lowercase letters on the bars of the same temperature indicate significant difference(P<0.05,Duncan’ s test) |
菌株自聚合与细胞间的互作有一定的关系。如图2所示,在同一初始浓度条件下,AE17和CpagP的菌株自聚合能力低于ΔpagP,且AE17与CpagP的自聚合能力几乎一致;同一菌株在不同初始浓度条件下的自聚合能力不同,调节初始菌液浓度的D600 nm为2和3时,同一菌株的自聚合能力没有明显差异,而且在0~1 h的自聚合能力降低较快,但是当把菌液初始浓度的D600 nm调至为1时,菌株的自聚合能力明显降低。
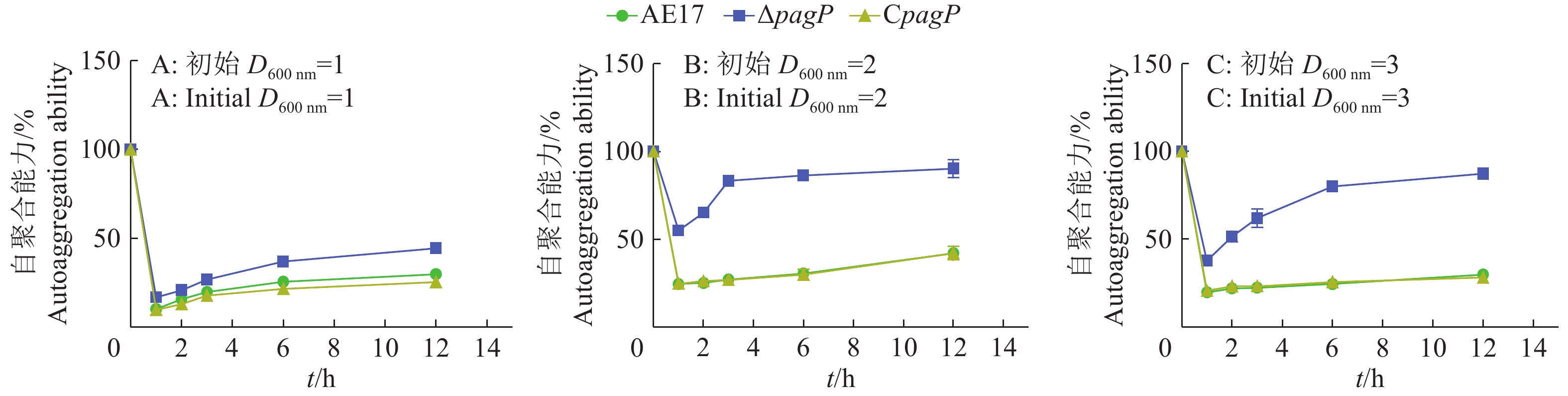
|
图 2 不同初始浓度对菌株自聚合能力的影响 Fig. 2 Effects of different initial concentrations on autoaggregation abilities of bacteria strains |
细胞表面疏水性大小会影响菌体自凝合能力和生物被膜形成能力等,因此本试验测定了ΔpagP、AE17和CpagP的外膜疏水性。结果显示,AE17的疏水性为5.923%,ΔpagP的疏水性为5.337%,CpagP的疏水性为5.030%,AE17与ΔpagP相比外膜疏水性无显著差异(P=0.705),ΔpagP和CpagP相比外膜疏水性无显著差异(P=0.842),说明pagP基因的缺失与细菌的外膜疏水性无特定的关系。
2.6 培养条件对生物被膜形成的影响细菌生物被膜是细菌抵御外界环境胁迫而形成的,细菌生物被膜的形成能力与外界环境条件的差异有关系,因此我们研究了细菌培养时间、培养基中含氧量和培养基种类不同对细菌生物被膜形成的影响。
以AE17为分析对象,分析在不同培养条件下的生物被膜形成能力。在LB培养基中D597 nm=0.542,M9基本培养基中D597 nm=0.485,M9+w为0.2%的葡萄糖培养基中D597 nm=0.535。结果显示,细菌在3种培养基中生物被膜形成能力差异不显著(P=0.155)。以摇床不同转速来调节细菌培养时环境的含氧情况,结果显示在静置状态(摇床转速为0)时D597 nm=0.508,摇床转速为100 r/min时D597 nm=0.215,摇床转速为200 r/min时D597 nm=0.125。静置状态与转速100 r/min相比差异显著(P=0.029),与转速200 r/min相比差异也显著(P=0.009),说明静置状态明显更利于生物被膜形成。AE17的生物被膜形成量随着时间的延长逐渐增加,0 h时D597 nm=0.369,24 h后D597 nm=0.432,36 h后D597 nm=0.706,48 h后D597 nm=0.820。结合以上结果,选取LB培养基在静置状态下培养48 h来检测pagP缺失对细菌生物被膜形成的影响。
2.7 生物被膜形成能力观察AE17、ΔpagP以及CpagP菌株在96孔板,LB培养基中培养48 h,结晶紫染色观察细菌生物被膜,结果如图3所示,培养48 h的ΔpagP的生物被膜脱落,AE17和CpagP回复株的生物被膜完好。

|
图 3 结晶紫染色观察细菌生物被膜 Fig. 3 Crystal violet staining for bacterial biofilm observation |
在六孔板中放入爬片,细菌在六孔板中培养,经过处理进行扫描电镜观察,结果如图4所示,pagP基因缺失株连接紧密,而AE17和CpagP的分布相对松散。说明pagP缺失株的聚合能力强。

|
图 4 扫描电镜观察不同菌株生物被膜 Fig. 4 Scanning electron microscope observation of biofilms of different strains |
研究表明,敲除LPS合成过程中的某些重要基因,会使得对应的突变株对抗生素的敏感性增强[27]。Vuorio等[28-29]对大肠埃希菌影响LPS结构的一些基因缺失的研究发现,基因缺失后LPS含量显著降低,使得细胞外膜这个天然屏障对抗生素的抵抗能力严重减弱,从而细菌对抗生素的敏感性升高。细菌对某些抗生素和阳离子抗菌肽的敏感性会因为细菌LPS次级脂肪酸链的缺失而增强[3, 9]。这一结论与本试验结果一致,说明可能是由于pagP缺失,使pagP介导的LPS中类脂A的脂肪酸链修饰功能不能发生,脂肪酸链的数目发生变化,从而影响大肠埃希菌的外膜通透性。
3.2 pagP基因缺失对细菌疏水与自聚合能力的影响不同的菌株在不同的生长条件下细菌外膜表面疏水性对于生物被膜形成能力的影响是不同的[9]。细菌的生理状态易受到外界环境温度的影响,温度的高低会影响细胞代谢活动的强弱。因此,为了研究细菌生理状态是否对菌株自聚合能力产生影响,试验对不同培养温度条件下的菌株自聚合能力进行测定。试验结果表明pagP基因缺失对菌株的外膜疏水性无显著影响,但却明显增强了其自聚合能力,可能pagP基因缺失后菌株通过另外的途径来增强细菌之间的相互作用,加速细菌的凝集。
3.3 pagP基因缺失对细菌生物被膜形成的影响细菌生物被膜是细菌的自我保护机制,是细菌抵御外界环境胁迫而形成的,细菌生物被膜的形成能力与外界环境条件的差异有关系。LPS的结构与细菌生物被膜形成能力的强弱密切相关[2, 7]。LPS在细菌生物被膜形成过程中的作用在大肠埃希菌中已有报道[30-31]。马鹏[32]的研究发现,在LPS上不同位点的磷酸基团的改变和脂肪酸链多糖链的改变会不同程度地影响大肠埃希菌的生物被膜形成能力,因此LPS结构与生物被膜的形成具有紧密的联系。宋祥军等[24]通过结晶紫法检测发现pagP基因缺失APEC导致生物被膜形成能力增强,与本试验结果一致。生物被膜形成能力测定以及扫描电镜观察显示,pagP缺失后的APEC生物被膜形成能力显著高于AE17,与MIC试验以及菌株自聚合试验相联系,pagP缺失细菌外膜通透性增加,自聚合能力增强,生物被膜形成能力增加,这与Carty等[8]的研究类似,即细菌外膜通透性的增加会提高生物被膜的形成量。本试验对pagP缺失后细菌其他性能所受的影响还有待进一步研究。
细菌的鞭毛、菌毛和LPS等结构与细菌生物被膜的形成有关,包括LPS在内的多种细胞大分子影响了细胞外膜的疏水性和菌株自身凝集特性,细胞外膜的疏水性和菌株自身凝集特性与细菌生物被膜形成能力的强弱有关联。本研究发现pagP缺失使APEC的细菌外膜通透性增加,自聚合能力增强,生物被膜形成能力增加,从而使细菌的自我保护能力增强。我们研究了pagP基因缺失对细菌外膜特性的影响,为进一步研究pagP基因在禽致病性大肠埃希菌中的致病作用提供了理论依据。
| [1] |
NIKAIDO H. Molecular basis of bacterial outer membrane permeability revisited[J]. Microbiol Mol Biol Rev, 2003, 67(4): 593-656. DOI:10.1128/MMBR.67.4.593-656.2003 (  0) 0) |
| [2] |
HUANG T P, SOMERS E B, WONG A C. Differential biofilm formation and motility associated with lipopoly saccharide/exopolysaccharide-coupled biosynthetic genes in Stenotrophomonas maltophilia
[J]. J Bacteriol, 2006, 188(8): 3116-3120. DOI:10.1128/JB.188.8.3116-3120.2006 (  0) 0) |
| [3] |
洪水根, 汪德耀. 膜分子生物学[M]. 基隆: 水产出版社, 1997: 60-73.
(  0) 0) |
| [4] |
COSTERTON J W, LEWANDOWSKI Z, CALDWELL D E, et al. Microbial biofilms[J]. Ann Rev Microbiol, 1995, 49: 711-745. DOI:10.1146/annurev.mi.49.100195.003431 (  0) 0) |
| [5] |
BRABETZ W, MULLER-LOENNIES S, HOLST O, et al. Deletion of the heptosyltransferase genes rfaC and rfaF in Escherichia coli K-12 results in an Re-type lipopolysaccharide with a high degree of 2-aminoethanol phosphate substitution
[J]. Eur J Biochem, 1997, 247(2): 716-724. DOI:10.1111/ejb.1997.247.issue-2 (  0) 0) |
| [6] |
KAROW M, GEORGOPOULOS C. Isolation and characterization of the Escherichia coli msbB gene, a multicopy suppressor of null mutations in the high-temperature requirement gene htrB
[J]. J Bacteriol, 1992, 174(3): 702-710. DOI:10.1128/jb.174.3.702-710.1992 (  0) 0) |
| [7] |
LAU P C Y, LINDHOUT T, BEVERIDGE T J, et al. Differential lipopolysaccharide core capping leads to quantitative and correlated modifications of mechanical and structural properties in Pseudomonas aeruginosa biofilms
[J]. J Bacteriol, 2009, 191(21): 6618-6631. DOI:10.1128/JB.00698-09 (  0) 0) |
| [8] |
CARTY S M, SREEKUMAR K R, RAETZ C R H. Effect of cold shock on lipid A biosynthesis in Escherichia coli. Induction at 12℃ of an acyltransferase specific for palmitoleoyl-acyl carrier protein
[J]. J Biol Chem, 1999, 274(14): 9677-9685. DOI:10.1074/jbc.274.14.9677 (  0) 0) |
| [9] |
BROOKE J S, ALBERT V, WATTS P, et al. Mutation of a lipopolysaccharide synthesis gene results in increased biofilm of Stenotrophomonas maltophilia, on plastic and glass surfaces
[J]. Ann Microbiol, 2008, 58(1): 35-40. DOI:10.1007/BF03179442 (  0) 0) |
| [10] |
BERTRAND N, HOULE S, LEBIHAN G, et al. Increased Pho regulon activation correlates with decreased virulence of an avian pathogenic Escherichia coli O78 strain
[J]. Infec Immun, 2010, 78(12): 5324-5331. DOI:10.1128/IAI.00452-10 (  0) 0) |
| [11] |
BISHOP R E. The lipid A palmitoyltransferase pagP: Molecular mechanisms and role in bacterial pathogenesis
[J]. Mol Microbiol, 2005, 57(4): 900-912. DOI:10.1111/j.1365-2958.2005.04711.x (  0) 0) |
| [12] |
BISHOP R E, GIBBONS H S, GUINA T, et al. Transfer of palmitate from phospholipids to lipid A in outer membranes of gram-negative bacteria[J]. Embo Journal, 2000, 19: 5071-5080. DOI:10.1093/emboj/19.19.5071 (  0) 0) |
| [13] |
RAETZ C R H, REYNOLDS C M, TRENT M S, et al. Lipid A modification systems in gram-negative bacteria[J]. Annu Rev Biochem, 2007, 76: 295-329. DOI:10.1146/annurev.biochem.76.010307.145803 (  0) 0) |
| [14] |
PRESTON A, MAXIM E, TOLAND E, et al. Bordetella bronchiseptica pagP is a Bvg-regulated lipid A palmitoyl transferase that is required for persistent colonization of the mouse respiratory tract
[J]. Mol Microbiol, 2003, 48(3): 725-736. DOI:10.1046/j.1365-2958.2003.03484.x (  0) 0) |
| [15] |
GUO L, LIM K B, PODUJE C M, et al. Lipid A acylation and bacterial resistance against vertebrate antimicrobial peptides[J]. Cell, 1998, 95: 189-198. DOI:10.1016/S0092-8674(00)81750-X (  0) 0) |
| [16] |
PILIONE M R, PISHKO E J, PRESTON A, et al. pagP is required for resistance to antibody-mediated complement lysis during Bordetella bronchiseptica respiratory infection
[J]. Infec Immun, 2004, 72: 2837-2842. DOI:10.1128/IAI.72.5.2837-2842.2004 (  0) 0) |
| [17] |
MUROI M, OHNISHI T, TANAMOTO K. MD-2, a novel accessory molecule is involved in species-specific actions of Salmonella lipid A
[J]. Infec Immun, 2002, 70: 3546-3550. DOI:10.1128/IAI.70.7.3546-3550.2002 (  0) 0) |
| [18] |
TANAMOTO K, AZUMI S. Salmonella-type heptaacylated lipid A is inactive and acts as an antagonist of lipopolysaccharide action on human line cells
[J]. J Immunol, 2000, 164: 3149-3156. DOI:10.4049/jimmunol.164.6.3149 (  0) 0) |
| [19] |
KAWASAKI K, ERNST R K, MILLER S I. 3-O-Deacylation of lipid A by PagL, a PhoP/PhoQ-regulated deacylase of Salmonella typhimurium, modulates signaling through toll-like receptor 4
[J]. J Biol Chem, 2004, 279: 20044-20048. DOI:10.1074/jbc.M401275200 (  0) 0) |
| [20] |
BADER M W, SANOWAR S, DALEY M E, et al. Recognition of antimicrobial peptides by a bacterial sensor kinase[J]. Cell, 2005, 122: 461-472. DOI:10.1016/j.cell.2005.05.030 (  0) 0) |
| [21] |
MURATA T, TSENG W, GUINA T, et al. PhoP/Q-mediated regulation produces a more robust permeability barrier in the outer membrane of Salmonella enterica serovar typhimurium
[J]. J Bacteriol, 2007, 189: 7213-7222. DOI:10.1128/JB.00973-07 (  0) 0) |
| [22] |
HITTLE L E, JONES J W, HAJJAR A M, et al. Bordetella parapertussis pagP mediates the addition of two palmitates to the lipopolysaccharide lipid A
[J]. J Bacteriol, 2015, 197(3): 572-580. DOI:10.1128/JB.02236-14 (  0) 0) |
| [23] |
邵颖, 涂健, 汪雪雁, 等. APEC强毒力岛核心基因irp2、fyu A敲除对其致病性影响的研究
[J]. 中国兽医学报, 2014, 34(4): 564-570. (  0) 0) |
| [24] |
宋祥军, 李春晓, 祁克宗, 等. pagP基因对禽致病性大肠杆菌抗菌肽抗性和致病性的影响
[J]. 微生物学通报, 2017, 44(12): 2888-2895. (  0) 0) |
| [25] |
刘玉庆, 李璐璐, 骆延波, 等. EUCAST欧盟药敏试验标准[M]. 北京: 中国标准出版社, 2016.
(  0) 0) |
| [26] |
张筝, 赵俊杰, 李运喜, 等. 微量肉汤稀释法药敏试验的误差分析[J]. 中国抗生素杂志, 2016, 41(11): 858-864. DOI:10.3969/j.issn.1001-8689.2016.11.009 (  0) 0) |
| [27] |
VAARA M. Antibiotic-supersusceptible mutants of Escherichia coli and Salmonella typhimurium
[J]. Antimicrob Agents Chemother, 1993, 37(11): 2255-2260. DOI:10.1128/AAC.37.11.2255 (  0) 0) |
| [28] |
VUORIO R, VAARA M. The lipid A biosynthesis mutation lpx A2 of Escherichia coli results in drastic antibiotic supersusceptibility
[J]. Antimicrob Agents Chemother, 1992, 36(4): 826-829. DOI:10.1128/AAC.36.4.826 (  0) 0) |
| [29] |
VUORIO R, VAARA M. Mutants carrying conditionally lethal mutations in outer membrane genes omsA and firA (ssc) are phenotypically similar, and omsA is allelic to firA
[J]. J Bacteriol, 1992, 174(22): 7090-7097. DOI:10.1128/jb.174.22.7090-7097.1992 (  0) 0) |
| [30] |
AMINI S, GOODARZI H, TAVAZOIE S. Genetic dissection of an exogenously induced biofilm in laboratory and clinical isolates of E. coli
[J]. PLoS Pathog, 2009, 5(5): e1000432. DOI:10.1371/journal.ppat.1000432 (  0) 0) |
| [31] |
GENEVAUX P, BAUDA P, DUBOW M S, et al. Identification of Tn10 insertions in the rfaG, rfaP, and galU genes involved in lipopolysaccharide core biosynthesis that affect Escherichia coli adhesion
[J]. Arch Microbiol, 1999, 172(1): 1-8. DOI:10.1007/s002030050732 (  0) 0) |
| [32] |
马鹏. 埃希氏大肠杆菌脂多糖与其细胞外膜特性关系的研究[D]. 无锡: 江南大学, 2011.
(  0) 0) |
 2019, Vol. 40
2019, Vol. 40


