2. 广西畜禽品种改良站,广西 南宁 530001;
3. 广西科达畜禽改良有限责任公司,广西 南宁 530001
2. Guangxi Work Station of Livestock & Poultry Breed Improvement, Nanning 530001, China;
3. Guangxi Keda Livestock & Poultry Breed Improvement Co., LTD, Nanning 530001, China
作为精子到达输精管的通道,附睾是哺乳动物精子成熟,获得受精能力,储存和保护精子的重要器官。附睾液中的蛋白质由附睾上皮分泌,与精子相互作用或被吸收到精子表面,为精子的成熟和储存提供特殊的微环境[1]。附睾液微环境的组成随精子通过的区段不同发生复杂和连续的变化[2]。附睾头部、体部和尾部基因表达相差较大[3],头部是蛋白合成、分泌非常活跃的区域,体部和尾部较少[4]。分泌到附睾管腔液的蛋白呈现高度区域化,附睾管腔中极少有蛋白存在连续分泌现象[5]。目前附睾液中蛋白种类和作用的研究[1]较多,对附睾微环境中精子释放的蛋白的探究较少。精子经附睾转运后,精子质膜组成和精子表面蛋白加工及修饰会发生巨大变化,本研究通过体外培养对附睾头部曲细精管内精子释放的蛋白的种类进行鉴定和差异性分析,确定精子释放蛋白影响受精过程的分子机制,为阐明繁殖机理奠定一定的理论基础。
蛋白质组学是一门新兴学科,以大规模、高通量的方式研究某种类型的细胞、组织或体液含有的所有蛋白质的功能[6]。同位素标记相对和绝对定量(Isobaric tag for relative and absolute quantitation,iTRAQ)技术是一种新的体外同位素标记方法,由美国应用生物系统(Applied biosystems)公司推出[7],具有高通量、高灵敏度、高精确度的特点[8-9]。同时使用液相色谱–串联质谱的iTRAQ可以同时分离和鉴定数百种蛋白质,获得最大程度的全套信息[10-11]。Transwell小室由美国康宁(Corning)公司开发生产,该材料中间有一层聚碳酸酯膜组成的微孔滤膜将孔板内的培养空间分为上、下室2部分[12],根据不同细胞体积不同,孔径0.1~12.0 μm不等,主要用于共培养、趋化、迁移、侵袭等细胞试验[13-14]。本研究充分利用Transwell小室独特的滤膜装置将精子细胞与释放蛋白分离为2部分,消除了因上、下室培养液成分和作用条件不同等造成的干扰,探究分离猪附睾头部精子释放蛋白的新方法。
1 材料与方法 1.1 样品采集选取同一种猪场相同批次相同生长环境的6月龄性成熟长白猪6头,无菌操作摘取附睾组织。样品采集于广西科达畜禽改良有限责任公司。
1.2 试剂与仪器Q ExactiveTM HF-X 质谱仪、低温离心机、C18除盐柱(Thermo)、Bradford蛋白定量试剂盒(Bio-Rad)、多肽标记的iTRAQ®试剂盒、二硫苏糖醇(Sigma)、碘乙酸(Sigma)、胰酶(Promega)、Transwell小室和精子细胞培养液(南宁阳光实验器材经营部)。
1.3 附睾头部精子的采集摘取长白猪附睾,剔除脂肪组织和结缔组织,用PBS缓冲液冲洗3次洗去血迹,浸润在预热的37 ℃生理盐水中,用无菌手术剪在附睾头部、尾部各切1个小孔,以便空气流通,保持管腔内大气压恒定。将5 mL注射器针头缓慢刺入附睾头部曲细精管内,轻轻挤压曲细精管并抽取精液,用1.5 mL EP管收集,室温3 000 r·min−1离心10 min,弃上清,保留沉淀,重新悬浮于1 mL NC-BWW培养液中。采用台盼蓝染色测定精子浓度,用NC-BWW培养液作为稀释液将精子浓度调整为2×105~5×105 mL−1,观察并统计精子活力、成活率和畸形率,弃去其中任一参数低于60%的样品。在37 ℃、体积分数为5% CO2、95%空气的环境中孵育30 min以便精子恢复正常生命状态。整个孵育过程中定期将精子悬浮液轻轻混合以防止细胞沉降,并在孵育结束时再次评估精子活力。
1.4 释放蛋白的分离取稀释后的精子细胞溶液2 mL在单个Transwell小室内培养,精子释放的蛋白及培养液通过微孔滤膜进入下室,整个精子细胞被滤膜阻挡保留在上室。Transwell小室收集释放蛋白的示意图如图1。将Transwell小室在37 ℃、体积分数为5% CO2、95%空气的环境中孵育30 min,以便精子正常分泌蛋白,将上、下室的组分用2 mL EP管分别收集,上室组分标记为DCU,下室组分标记为DCL,置于−80 ℃保存。
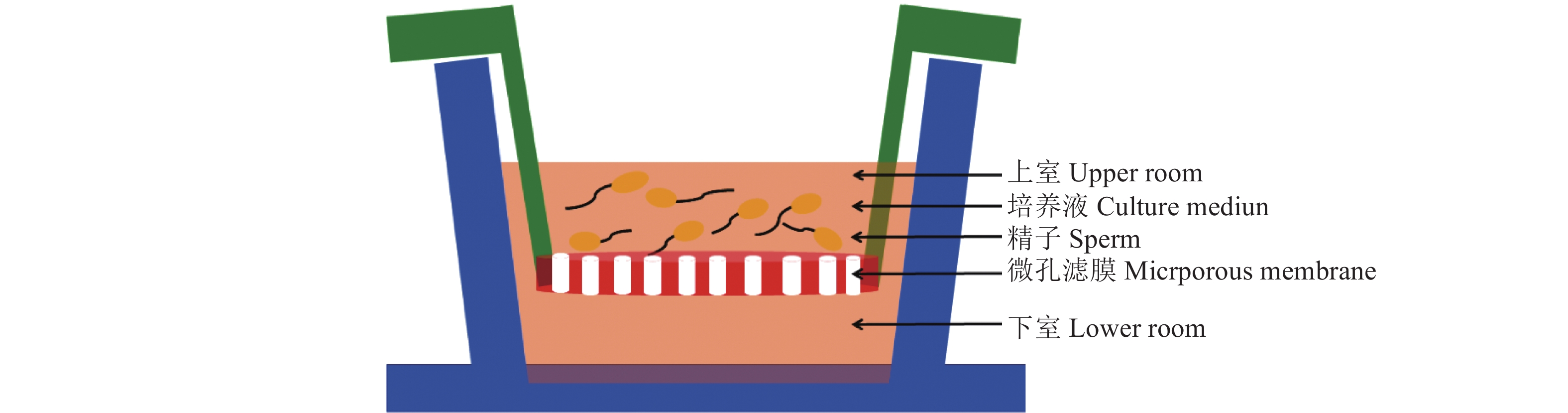
|
图 1 利用Transwell小室收集释放蛋白示意图 Fig. 1 Schematic diagram of released protein collection using Transwell chamber |
从−80 ℃冰箱取出样品,低温研磨成粉,迅速转移至液氮预冷的离心管,加入适量蛋白裂解液振荡混匀,冰水浴超声使充分裂解;离心后取上清加入二硫苏糖醇于56 ℃反应1 h,然后加入足量碘乙酸,于室温避光反应1 h;加入−20 ℃预冷丙酮沉淀2 h,于4 ℃、12 000 r·min−1离心15 min,收集沉淀;加入1 mL −20 ℃预冷丙酮重新悬浮,并清洗沉淀,加入适量蛋白溶解液溶解沉淀。
1.6 蛋白质检使用Bradford蛋白质定量试剂盒,按照说明书配制BSA标准蛋白溶液,对上、下室收集到的样品进行蛋白浓度测量。每组样品重复3次。取30 µg蛋白待测样品进行34.55 g·L−1 SDS-PAGE凝胶电泳,其中浓缩胶电泳条件为80 V、20 min,分离胶电泳条件为120 V、60 min。电泳结束后进行考马斯亮蓝R-250染色,脱色至条带清晰。
1.7 iTRAQ标记上下室各取100 µg蛋白样品,加入蛋白溶解液补足体积至100 μL,加入胰酶和TEAB缓冲液,混匀后于37 ℃酶切过夜;加入等体积1%(φ)甲酸,混匀后离心,取上清液缓慢通过C18除盐柱,然后用清洗液连续清洗,再加入洗脱液洗脱2次,洗脱样合并后冻干;加入TEAB缓冲液复溶,并加入足量iTRAQ标记试剂,室温颠倒混匀;取等体积标记后的样品混合,除盐后冻干。将保存好的样品送至北京诺禾致源生物信息科技有限公司进行馏分分离和液质检测。
1.8 质谱数据分析质谱原始数据格式为*raw,存放质谱数据完整的扫描信息,下机后的raw文件直接导入到Proteome Discoverer 2.2软件进行数据库检索,谱肽和蛋白定量的具体分析参数为:使用赛默飞超高分辨质谱仪(Thermo Q ExactiveTM HFX),标记量化,胰蛋白酶酶切,前体离子搜库时质量偏差容忍范围为10−5,碎片离子搜库时质量偏差容忍范围位0.02。本次使用的数据库为P101SC18101236-01-sus_scrofa-uniprot-2018.10.29.fasta(48969 sequences)。
1.9 生物信息学分析蛋白功能注释采用GO数据库(http://amigo.geneontology.org/amigo)进行分析,从细胞组分、分子功能和生物过程3个方面对蛋白功能进行描述。通过KEGG数据库(http://www.genome.jp/kegg" target=_blank title="点击浏览原文">http://www.genome.jp/kegg/">http://www.genome.jp/kegg/)路径分析,确定蛋白质参与的最主要的生化代谢途径和信号转导途径。使用Interproscan(http://www.ebi.ac.uk/interpro/)对蛋白质家族、结构域和功能位点进行非冗余分析。
2 结果与分析 2.1 蛋白SDS-PAGE电泳利用Transwell小室的上、下室收集蛋白,收集后的蛋白进行SDS-PAGE电泳,结果表明,上、下室含有的总蛋白种类多、数量丰富,蛋白条带大小有明显差异(图2)。
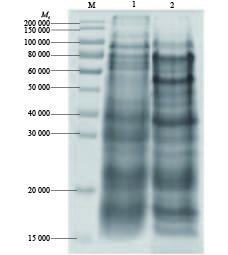
|
图 2 待测蛋白的SDS-PAGE结果 Fig. 2 SDS-PAGE results s of tested proteins M:标准分子质量蛋白Marker;1:Transwell上室收集到的蛋白;2:Transwell下室收集到的蛋白 M: Protein with standard relative molecular mass; 1: Protein collected by Transwell upper room; 2: Protein collected by Transwell lower room |
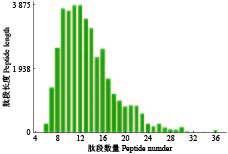
经质谱定量分析,共鉴定到542种蛋白,离子峰均一集中,杂质干扰较少(图3)。分离出的蛋白相对分子质量主要集中在2×104~4×104(图4)。肽段长度主要集中在9~13肽,仅有少部分蛋白质肽段长度大于22肽(图5)。综上所述,蛋白的质谱定量分析显示,样品成分均一、杂质少、保真性强、可信度高。
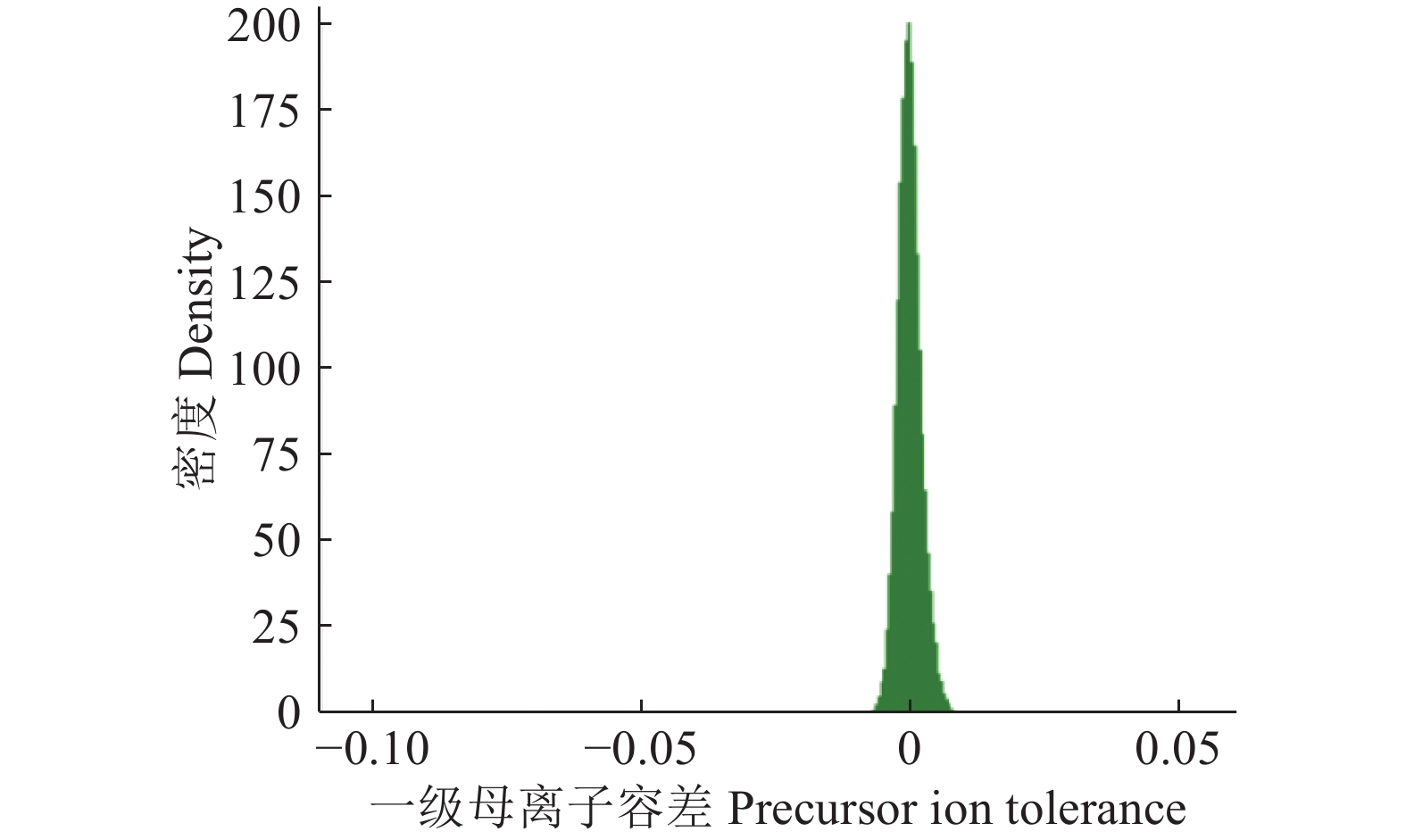
|
图 3 一级质谱母离子容差分布图 Fig. 3 The tolerance diagram of first-stage mass spectrometer precursor ion |
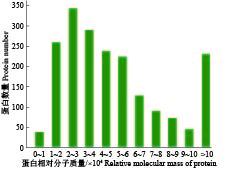
|
图 4 蛋白相对分子质量分布图 Fig. 4 Distribution diagram of relative molecular mass of protein |
|
图 5 肽段长度分布图 Fig. 5 Peptide length distribution diagram |
对Transwell小室上、下室收集到且均有表达的蛋白进行蛋白含量差异性分析,当蛋白含量的差异倍数(Fold change,FC)≥1.5,P≤0.05时,蛋白表达量上调;当FC≤0.67,P≤0.05时,蛋白表达量下调。在鉴定到的所有蛋白中,464种蛋白表达量显著上调,78种蛋白表达量显著下调。53.87%(292/542)的蛋白未匹配到详细的描述,仅得到相关的基因名称。上室表达量最高的蛋白为精子酵素(Acrosin),达90 082.5 ng·μL−1,下室表达量最高的是由WFDC10AL基因编码的未命名蛋白(Uncharacterized protein),达162 351.4 ng·μL−1。上、下室蛋白表达量不同表明精子内部蛋白与释放蛋白有所差异,同时也说明利用Transwell小室分离精子释放蛋白的方法切实有效。在表达量上调、下调的所有蛋白中,蛋白含量差异倍数排在前10位的蛋白汇总如表1和表2。
|
|
表 1 前 10 位表达量上调蛋白信息1) Table 1 Top 10 up-regulated protein information |
|
|
表 2 前10位表达量下调蛋白信息1) Table 2 Top 10 down-regulated protein information |
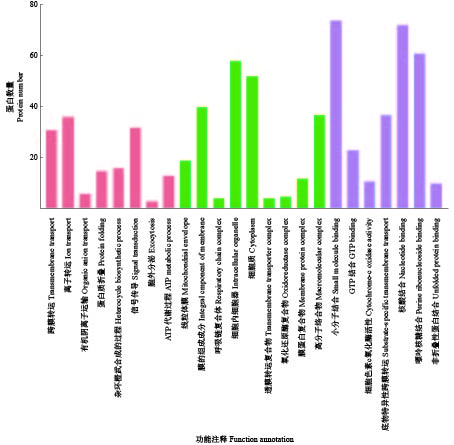
将差异蛋白数据在GO数据库进行搜库,功能注释共得到543个条目,其中分子功能(Molecular function)占52.30%(284/543),细胞组分(Cellular component)占11.79%(64/543),生物过程(Biological process)占11.42%(62/543),另外133个蛋白未得到功能注释(图6)。差异蛋白主要参与跨膜转运(Transmembrane transport)、离子转运(Ion transport)、含嘌呤的化合物生物合成(Purine-containing compound biosynthesis)、ATP合成(ATP synthesis)等生物过程,是构成细胞膜(Cell membrane)、细胞器(Organelle)、细胞质(Cytoplasm)等细胞组分的主要成分,使小分子结合(Small molecule binding)、底物特异性跨膜转运(Substrate-specific transmembrane transport)、核酸结合(Nucleotide binding)、嘌呤核糖结合(Purine ribonucleoside binding)、非折叠性蛋白质结合(Unfolded protein binding)等功能正常进行。精子经过附睾微环境时,被赋予运动和受精能力,此次验证的差异性蛋白主要在信号转导和呈递运输方面发挥作用,佐证了精子释放蛋白的生物功能。细胞组分的验证表明差异蛋白能够维持机体生命活动的正常进行,共同构成精子完整的细胞形态。核酸结合、嘌呤核糖结合等分子功能充分说明精子释放蛋白能够携带相关的遗传信息进入雌性生殖道,为遗传信息的稳定提供分子基础。
|
图 6 差异蛋白GO功能注释分析 Fig. 6 GO function annotation analysis of differential protein |
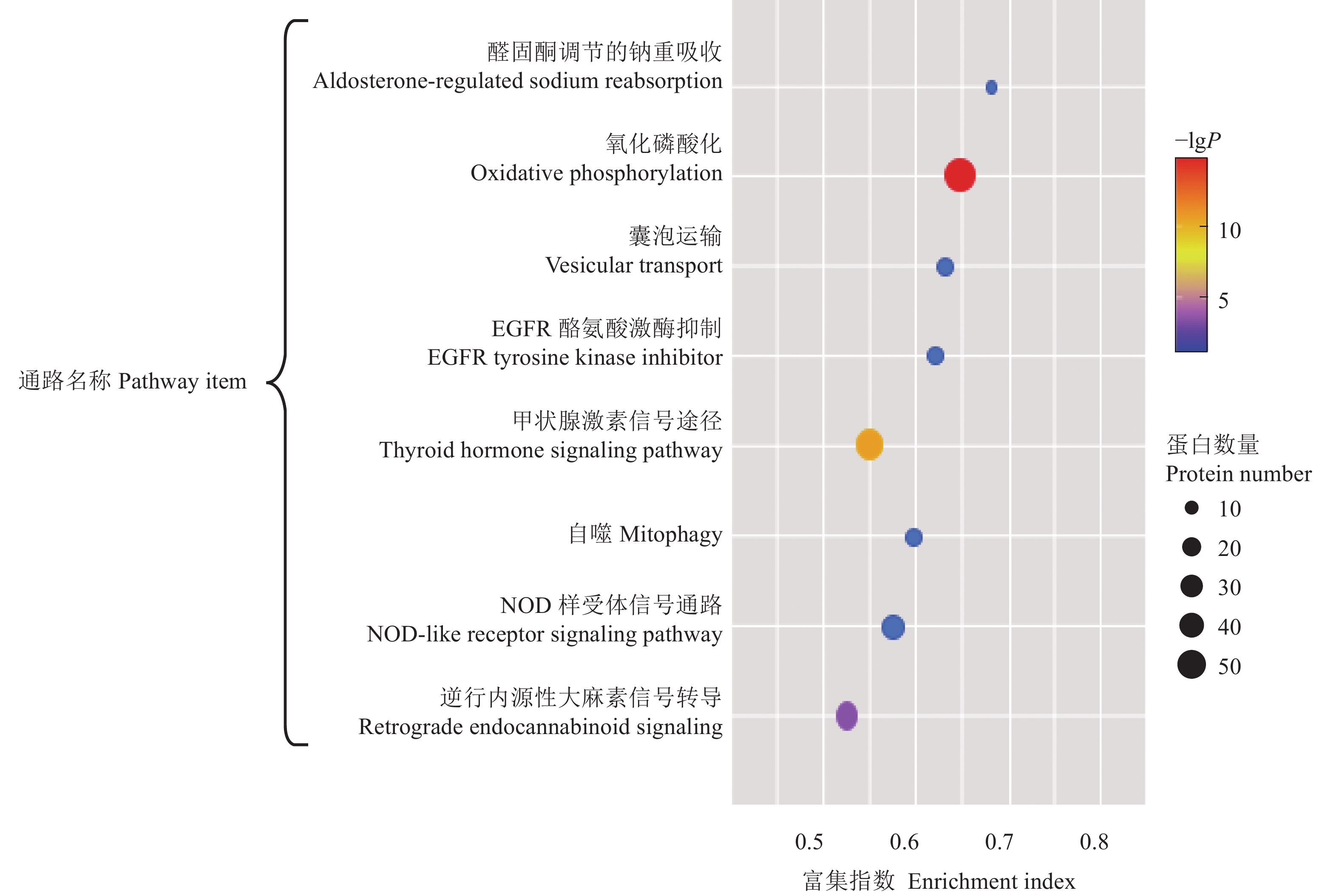
应用与GO富集相同的差异基因进行KEGG路径富集分析,结果如图7所示,前5位的功能条目分别为:醛固酮调节的钠重吸收(Aldosterone-regulated sodium reabsorption)、囊泡运输(Vesicular transport)、EGFR酪氨酸激酶抑制(EGFR tyrosine kinase inhibitor)、自噬(Mitophagy)、NOD样受体信号通路(NOD-like receptor signaling pathway)。醛固酮是肾素−血管紧张素系统的重要活性成份之一,可激活糖皮质激素诱导蛋白激酶1以及氧化应激等引起的细胞凋亡和损伤。此外,自噬信号通路预测表明差异性蛋白可能参与精子的抗氧化和凋亡过程,影响精子的繁殖力。精子分泌蛋白KEGG通路富集分析缩小了精子发生机制所涉及的信号转导途径,为进一步深入研究奠定基础。
|
图 7 差异蛋白KEGG富集散点图 Fig. 7 KEGG enrichment scatter plot of differential protein |
对差异蛋白进行结构域分析,结果表明,硫氧还蛋白样折叠(Thioredoxin-like fold)、半乳糖结合域(Galactose-binding domain-like)、糖苷水解酶(Glycoside hydrolase)、组蛋白折叠(Histone-fold)、琥珀酸脱氢酶(Succinate dehydrogenase)等为差异蛋白的主要结构域,为蛋白发挥生理功能提供稳定的结构基础。半乳糖、糖苷水解酶和琥珀酸脱氢酶等结构域表明差异蛋白可能参与精子的糖代谢途径,为精子发生和精卵结合提供动力来源。
3 讨论与结论栗瑞兰等[15]选取成年公羊的附睾分段分割研究GPX5在附睾中的表达与蛋白定位,齐晓伟等[16]采用分段处理鉴定大鼠附睾管腔液中可能参与精子成熟和精子表面修饰的附睾特异蛋白。与以上研究不同,本研究旨在探究在附睾微环境作用下,精子通过附睾后释放出的蛋白如何参与后续生理活动,故创新使用Transwell小室分离猪附睾头部精子释放蛋白,有效避免了机械压力破坏精子完整的内部结构,并维持其正常生命活动,保证其在生理状态下分泌蛋白。Transwell上、下小室独特的分离装置最大程度上确保检测的蛋白为分泌成分,排除精子体内结构性物质的干扰。该试验对猪附睾头部精子释放蛋白分离方法的优化,为后续成分的功能研究奠定了基础。
精子在附睾运行过程中与附睾液微环境相互作用不断成熟,表现为获得运动能力和受精能力,精子获得这些新性状可能与其质膜的变化有关,即精子膜结构发生有序改变,包括膜脂、膜蛋白、膜上糖基成分、膜电荷以及膜流动性与通透性的改变[17]。当精子离开附睾腔后,精子表面会释放大量的蛋白质,参与精子的发生、成熟、获能、精卵粘附与识别、顶体反应等环节。本研究中,差异性蛋白ADAM3、CCT3、CCT8与精卵结合和顶体反应有关,PRKACA与精子获能有关[18],同理类推,ADAM29、CCT2、CCT4、CCT5和CCT6A这些未被描述功能的蛋白,可能同属一个家族具有同样的功能。本研究有很多蛋白未被富集到详细的功能描述,我们可通过对基因的研究推测蛋白特征。例如,SYCP2基因被证实小鼠纯合SYCP2突变体减数分裂受到阻滞,雄性不育,雌性生育力降低,产仔数大幅减少[19]。CRISP1、ADAM7、GPX5、SPAM1、SPINK2、PSME4、TXNDC8被证明为附睾转运期间添加的蛋白质,非分泌蛋白[20-23]。
本研究表达量显著下调的磷酸果糖激酶,在人类最常见的不育遗传病Klinefelter综合征中,患者睾丸组织中该基因的表达量严重下降[24]。此外,附睾特异性α−甘露糖苷酶(Epididymis-specific alpha-mannosidase,MAN2B2)可以影响猪排卵率进而影响产仔数[25]。因此推测精子表面释放的蛋白通过调控糖酵解相关酶影响机体的繁殖能力。富集通路的分析表明囊泡运输作为精子细胞参与精卵结合的重要途径[26],钙感受器可触发突触囊泡融合,Ca2+在精子的活动能力、获能、定向运动、顶体反应及受精卵发育中都起重要作用[27]。酪氨酸激酶家族成员EGFR定位于细胞膜上,EGFR酪氨酸激酶抑制剂(EGFR-TKI)能够选择性地竞争胞内酶结构域Mg-ATP结合位点,催化ATP磷酸基转移至下游蛋白酪氨酸残基上,使其发生磷酸化,阻止下游信号转录[28]。磷酸基团的添加或去除可以诱导变构修饰,引起蛋白质构象变化,导致其激活或失活[29],因此,酪氨酸磷酸化对促进精子获能至关重要。
本研究中精子表面释放蛋白主要参与跨膜转运、离子运输、化合物生物合成、ATP合成等生物过程,这些蛋白对维持精子形态结构完整性、新陈代谢、生理功能、超极化运动、膜流动性改变、完成受精过程等可能起关键作用[30]。综上所述,本研究创新使用Transwell小室分离猪附睾头部精子释放蛋白,并采用高灵敏度、高准确性的iTRAQ技术检测释放蛋白,对鉴定得到的差异蛋白进行生物信息学分析,从GO功能注释、KEGG富集、结构域预测等方面进行研究,为今后从蛋白水平和基因水平阐明受精过程和生殖机理提供试验依据。
| [1] |
刘芙君, 李建远, 王海燕. 附睾分泌蛋白与精子成熟的研究进展[J]. 国际病理科学与临床杂志, 2006, 26(5): 457-460. (  0) 0) |
| [2] |
TURNER T T. Spermatozoa are exposed to a complex microenvironment as they traverse the epididymis[J]. Ann N Y Acad Sci, 1991, 637: 364-383. DOI:10.1111/j.1749-6632.1991.tb27323.x (  0) 0) |
| [3] |
JOHNSTON D S, JELINSKY S A, BANG H J, et al. The mouse epididymal transcriptome: Transcriptional profiling of segmental gene expression in the epididymis[J]. Biol Reprod, 2005, 73(3): 404-413. DOI:10.1095/biolreprod.105.039719 (  0) 0) |
| [4] |
HERMO L, ROBAIRE B. Epididymal cell types and their functions[M]//ROBAIRE B, HINTON B T. The epididymis: From molecules to clinical practice. New York: Kluwer Academic/Plenum Publishers, 2001: 81-102.
(  0) 0) |
| [5] |
SYNTIN P, DACHEUX F, DRUART X, et al. Characterization and identification of proteins secreted in the various regions of the adult boare pididymis[J]. Biol Reprod, 1996, 55(5): 956-974. DOI:10.1095/biolreprod55.5.956 (  0) 0) |
| [6] |
LAU A T Y, HE Q Y, CHIU J F. Proteomic technology and its biomedical applications[J]. Acta Biochim Biophys Sin, 2003, 35(11): 965-975. (  0) 0) |
| [7] |
ROSS P L, HUANG Y L N, MARCHESE J N, et al. Multiplexed protein quantitation in Saccharomyces cerevisiae using amine-reactive isobaric tagging reagents
[J]. Mol Cell Proteomics, 2004, 3(12): 1154-1169. DOI:10.1074/mcp.M400129-MCP200 (  0) 0) |
| [8] |
SU L, CAO L, ZHOU R, et al. Identification of novel biomarkers for sepsis prognosis via urinary proteomic analysis using iTRAQ labeling and 2D-LC-MS/MS[J]. PLoS One, 2013, 8(1). doi: 10.1371/journal.pone.0054237.
(  0) 0) |
| [9] |
HUANG C, WANG Y, LIU S, et al. Quantitative proteomic analysis identified paraoxonase 1 as a novel serum biomarker for microvascular invasion in Hepatocellular Carcinoma[J]. J Proteome Res, 2013, 12(4): 1838-1846. DOI:10.1021/pr3011815 (  0) 0) |
| [10] |
GLEN A, EVANS C A, GAN C S, et al. Eight-plex iTRAQ analysis of variant metastatic human prostate cancer cells identifies candidate biomarkers of progression: An exploratory study[J]. Prostate, 2010, 70(12): 1313-1332. (  0) 0) |
| [11] |
KESHAMOUNI V G, MICHAILIDIS G, GRASSO C S, et al. Differential protein expression profiling by iTRAQ-2DLC-MS/MS of lung cancer cells undergoing epithelial-mesenchymal transition reveals a migratory/invasive phenotype[J]. J Proteome Res, 2006, 5(5): 1143-1154. DOI:10.1021/pr050455t (  0) 0) |
| [12] |
唐秋琳, 毕锋. Transwell法检测细胞侵袭迁移能力实验中的影响因素[J]. 实验科学与技术, 2018, 16(4): 18-21. DOI:10.3969/j.issn.1672-4550.2018.04.005 (  0) 0) |
| [13] |
SHAW L M. Tumor cell invasion assays[J]. Methods Mol Biol, 2005, 294: 97-105. (  0) 0) |
| [14] |
MARSHALL J. Transwell® invasion assays
[J]. Methods Mol Biol, 2011, 769(2): 97-110. (  0) 0) |
| [15] |
栗瑞兰, 张通, 范晓梅, 等. GPX5在成年绵羊附睾中的表达与蛋白定位[J]. 中国农业科学, 2015, 48(24): 4989-4995. DOI:10.3864/j.issn.0578-1752.2015.24.013 (  0) 0) |
| [16] |
齐晓伟, 常勇杰, 于和鸣. 大鼠附睾管腔液Mr22000蛋白的鉴定研究[J]. 中华男科学杂志, 2009, 15(1): 20-25. (  0) 0) |
| [17] |
GADELLA B M. The assembly of a zona pellucida binding protein complex in sperm[J]. Reprod Domest Anim, 2008, 43(5): 12-19. (  0) 0) |
| [18] |
SKERGET S, ROSENOW M A, PETRITIS K, et al. Sperm proteome maturation in the mouse epididymis[J]. PLoS One, 2015, 10(11). doi: 10.1371/journal.pone.0140650.
(  0) 0) |
| [19] |
YANG F. Mouse SYCP2 is required for synaptonemal complex assembly and chromosomal synapsis during male meiosis[J]. J Cell Biol, 2006, 173(4): 497-507. DOI:10.1083/jcb.200603063 (  0) 0) |
| [20] |
CAO W, GERTON G L, MOSS S B. Proteomic profiling of accessory structures from the mouse sperm flagellum[J]. Mol Cell Proteomics, 2006, 5(5): 801-810. DOI:10.1074/mcp.M500322-MCP200 (  0) 0) |
| [21] |
STEIN K K, GO J C, LANE W S, et al. Proteomic analysis of sperm regions that mediate sperm-egg interactions[J]. Proteomics, 2010, 6(12): 3533-3543. (  0) 0) |
| [22] |
GUO X, SHEN J, XIA Z, et al. Proteomic analysis of proteins involved in spermiogenesis in mouse[J]. J Proteome Res, 2010, 9(3): 1246-1256. DOI:10.1021/pr900735k (  0) 0) |
| [23] |
CHAUVIN T, XIE F, LIU T, et al. A systematic analysis of a deep mouse epididymal sperm proteome[J]. Biol Reprod, 2012, 87(6): 141. DOI:10.1095/biolreprod.112.104208 (  0) 0) |
| [24] |
ALVES M G, MARTINS A D, JARAK I, et al. Testicular lactate content is compromised in men with Klinefelter syndrome[J]. Mol Reprod Dev, 2016, 83(3): 208-216. DOI:10.1002/mrd.22608 (  0) 0) |
| [25] |
CAMPBELL E M, NONNEMAN D J, KUEHN L A, et al. Genetic variation in the mannosidase 2B2 gene and its association with ovulation rate in pigs
[J]. Anim Genet, 2010, 39(5): 515-519. (  0) 0) |
| [26] |
陈元颖, 郝振华, 李巍. 囊泡运输的分子细胞机制[J]. 中国细胞生物学学报, 2019, 41(1): 3-12. DOI:10.11844/cjcb.2019.01.0001 (  0) 0) |
| [27] |
黄品秀, 韦继红. 受精调控机制的研究进展[J]. 中华妇幼临床医学杂志(电子版), 2014, 10(1): 116-119. DOI:10.3877/cma.j.issn.1673-5250.2014.01.029 (  0) 0) |
| [28] |
YARDEN Y. The EGFR family and its ligands in human cancer: Signalling mechanisms and therapeutic opportunities[J]. Eur J Cancer, 2001, 37(4): 3-8. (  0) 0) |
| [29] |
TILLO S E, XIONG W H, TAKAHASHI M, et al. Liberated PKA catalytic subunits associate with the membrane via myristoylation to preferentially phosphorylate membrane substrates[J]. Cell Rep, 2017, 19(3): 617-629. DOI:10.1016/j.celrep.2017.03.070 (  0) 0) |
| [30] |
HE L, JIANG H, CAO D, et al. Comparative transcriptome analysis of the accessory sex gland and testis from the Chinese mitten crab (Eriocheir sinensis)[J]. PLoS One, 2013, 8(1). doi: 10.1371/journal.pone.0053915.
(  0) 0) |
 2019, Vol. 40
2019, Vol. 40


