2. 湛江市农业科学研究院,广东 湛江 510935
2. Zhanjiang Academy of Agricultural Sciences, Zhanjiang 510935, China
甘蔗Saccharum hybrids spp. 是世界上最重要的糖料作物及较有发展前景的可再生绿色能源作物。在我国,蔗糖产量占国民食糖需求总量的90%以上[1]。但随着经济的发展,甘蔗与果蔬争地矛盾日趋突出,甘蔗生产逐渐向干旱缺水的坡地和偏远山区转移,而甘蔗的种植对自然资源有一定的要求,特别是对水分和温度的要求较严格[2]。干旱己成为制约我国蔗糖产量及品质的关键因素之一,选育和推广抗旱性强的高产、高糖品种对提高甘蔗产量、降低生产成本具有重要意义。
在干旱胁迫条件下,作物能通过产生保护性物质降低对干旱的敏感性,或产生一系列生理生化变化,减轻干旱的伤害,表现出抗逆性[3]。研究表明甘蔗根系活力,叶片可溶性蛋白含量、可溶性糖含量、脯氨酸含量变化可作为甘蔗抗旱性鉴定和评价的重要指标[4-6]。在干旱胁迫条件下,植物叶片中的超氧化物歧化酶(Superoxide dismutase,SOD)、过氧化物酶(Peroxidase,POD)和过氧化氢酶(Catalase,CAT)这3种酶活性快速降低,使植物的膜系统受外界不良因素的影响而损坏,这种反应与生物氧自由基有一定关联性[7-8]。边芯等[3]通过研究干旱胁迫对持绿性甘蔗细茎野生种叶片生理及甘蔗生物量的影响,表明在干旱胁迫条件下持绿性甘蔗细茎野生种能通过产生保护性物质降低对干旱的敏感性,通过SOD、CAT、POD活性变化,减轻干旱对植株的伤害,从而表现出更好的抗旱性,SOD、CAT、POD活性可作为衡量甘蔗抗旱能力的指标。
甘蔗受到干旱胁迫后,产生的各种生理变化错综复杂,受多种因素影响,仅根据某单一指标评定甘蔗品种的抗旱性会造成评定结果的片面性。综合运用主成分分析法和模糊隶属函数法评价作物的抗旱性可综合评定作物主要抗旱性生理生化指标,对参试作物品种的抗旱性强弱进行排序及聚类,得到较单一指标更为客观可靠的抗旱性评定结果[9-10]。这种方法在大豆[9]、玉米[10]等主要农作物的抗旱性评价中已得到较好应用,在甘蔗品种抗旱性评价中尚未广泛应用,甘蔗品种抗旱性评价以单一指标或少数指标为主。本研究以华南农业大学和湛江市农业科学研究院联合培育的甘蔗10个优良新品系和甘蔗主栽品种ROC22为材料,测定甘蔗伸长初期人工干旱胁迫和正常供水2种处理甘蔗叶片及根系的8项生理参数,运用主成分分析结合聚类分析综合评价参试甘蔗材料的抗旱性,为甘蔗优良抗旱新品种选育提供科学依据。
1 材料与方法 1.1 试验材料参试材料为华南农业大学甘蔗研究室和湛江市农业科学研究院联合培育的10个甘蔗优良新品系:A6−13115、A3−1320、A6−13111、A13−1396、A1−1305、A11−1390、A7−13120、A6−13122、A7−13104、A4−1316,以及目前我国甘蔗主栽耐旱品种ROC22(对照)。
1.2 材料种植与处理试验于2017年2—5月在华南农业大学甘蔗育种基地温室进行。采用盆栽种植的方法,用高、上径、下径分别为32.0、33.5、28.0 cm的塑料桶,每个桶的桶底钻3~5个直径为0.4 cm的圆孔,排去土壤中多余水分。所用栽培土壤为大田土,每桶装2/3高的土壤。蔗种砍成单芽段,每桶种4~5个单芽,每份材料种6桶,下种后覆土3~5 cm,待甘蔗成苗后每桶保留3株长势相近的蔗苗。
待甘蔗生长到伸长初期时,每个材料分成2组(每组3桶),充分淋水至桶里土壤水分饱和。一组正常供水(对照组),另一组不供水进行干旱胁迫处理(处理组)。干旱胁迫开始后,每天定时观察2组蔗株的生长情况,当处理组大多数蔗株正3叶以下全部枯黄,且正3叶全部萎蔫时(约干旱胁迫15 d),甘蔗达到干旱胁迫处理要求,此时分别取对照组和处理组心叶下面第1片叶片和根系进行超低温保存,次日进行生理指标测定。
1.3 测定项目及方法甘蔗根系活力测定采用TTC法[11],叶片可溶性蛋白含量测定采用考马斯亮蓝G−250比色法[12],叶片可溶性糖含量测定采用蒽酮比色法[13],叶片SOD活性测定采用氮蓝四唑光化还原法[14],叶片CAT活性测定采用过氧化氢还原法[14],叶片POD活性测定用愈创木酚法[15],叶片脯氨酸含量测定采用酸性茚三酮显色法[16],叶片丙二醛(Malondialdehyde,MDA)含量测定采用硫代巴比妥酸法[17]。除根系活力外,其余指标的试验结果都用叶片的鲜质量表示。
1.4 数据处理抗旱系数(DC)[18]:
| $ {\rm{DC}} \!=\! {\text{干旱胁迫处理测定值}}/{\text{对照测定值}}\! \times \! 100 \;{\text{%}}{\text{ ,}} $ | (1) |
综合指标的隶属函数值(UXj)[19]:
| $ {U_{{X_j}}} = \left( {{X_j} - {X_{\min }}} \right)/\left( {{X_{\max }} - {X_{\min }}} \right)\;\;\;\;\;\;j = 1,2, \ldots ,{{n}}, $ | (2) |
式中,Xj表示第j个综合指标的值,Xmin表示第j个综合指标的最小值,Xmax表示第j个综合指标的最大值。
综合指标的权重(Wj)[20]:
| $ {W_j} = {P_j}/\sum\limits_{j = 1}^{{n}} {{P_{{j}}}} \;\;\;\;\;j = 1,2, \ldots ,{{n}}, $ | (3) |
式中,Wj表示第j个综合指标在所在综合指标中的重要程度,即权重;Pj为各品系第j个综合指标的贡献率。
甘蔗品种在干旱胁迫条件下抗旱性的综合评价值用D表示[21]:
| $ D = \sum\limits_{j = 1}^{{n}} {\left( {{U_{{X_j}}} \times {{{\rm{W}}_{{j}}}} } \right)} \;\;\;\;\;j = 1,2, \ldots ,{{n}}, $ | (4) |
采用Microsoft Excel 2013进行数据处理和作图,使用IBM SPSS 22.0软件进行方差分析和聚类分析,聚类用欧式距离作为相似性尺度。
2 结果与分析 2.1 干旱胁迫对甘蔗根系活力的影响由图1可知,与正常供水相比,伸长初期受到干旱胁迫后,甘蔗新品系及对照种ROC22的根系活力都呈现不同程度的降低,且降幅均达显著差异水平。降幅最小的品系是A6−13122,为34.13%;降幅最大的是A4−1316,为51.47%;对照种ROC22的降幅为35.47%。
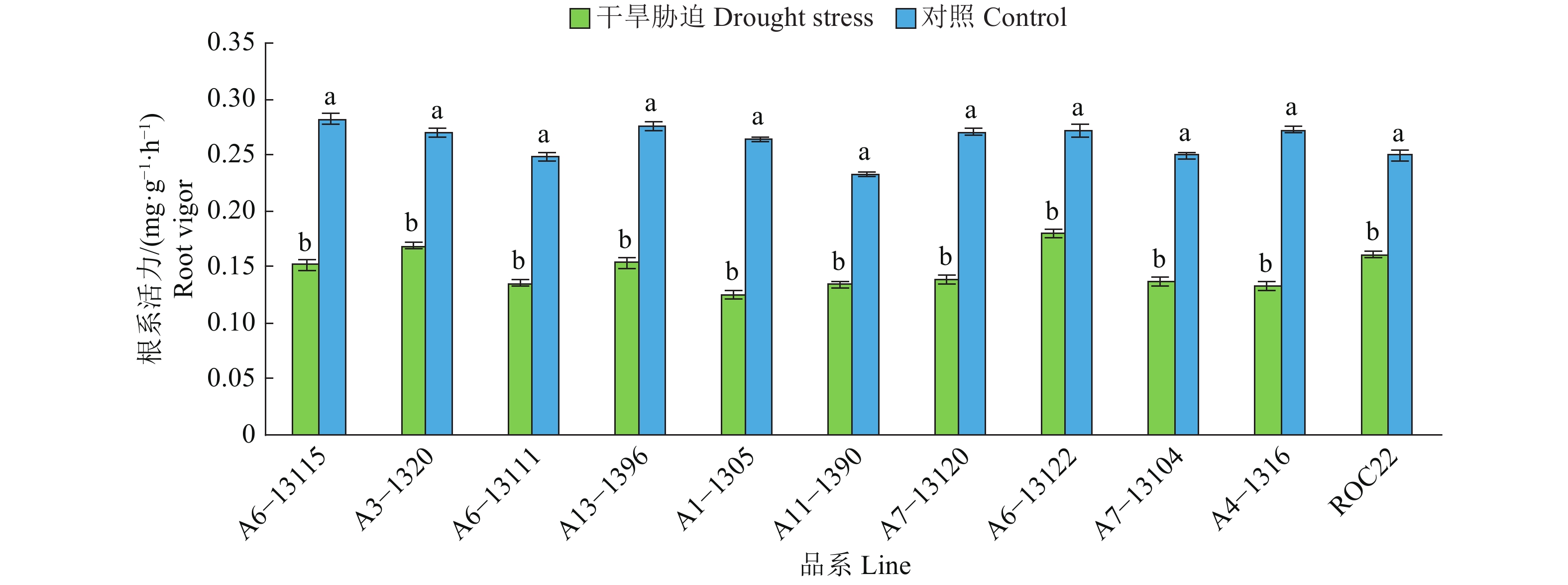
|
图 1 干旱胁迫对甘蔗根系活力的影响 Fig. 1 Effect of drought stress on root vitality of sugarcane 相同品系(品种)柱形图上的不同小写字母,表示差异显著(P<0.05,Duncan’ s法) Different lowercase letters on bars of the same sugarcane line (cultivar) indicate significant differences (P<0.05, Duncan’ s method) |
与正常供水相比,伸长初期受到干旱胁迫后,甘蔗新品系及对照种ROC22叶片脯氨酸含量、可溶性蛋白含量和可溶性糖含量都呈现不同程度的增加趋势,且增幅均达差异显著水平(图2)。脯氨酸含量增幅最小的品系是A7−13104,为52.50%;增幅最大的品系是A6−13111,为69.48%;对照种ROC22增幅为57.34%(图2A)。可溶性蛋白含量增幅最小的品系是A4−1316,为22.83%;增幅最大的是对照种ROC22,为36.12%(图2B)。可溶性糖含量增幅最小的品系是A4−1316,为51.13%;增幅最大的品系是A3−13104,为77.93%;对照种ROC22的增幅为75.67%(图2C)。

|
图 2 干旱胁迫对甘蔗叶片渗透调节物质含量和抗氧化酶活性的影响 Fig. 2 Effects of drought stress on osmotic regulating substance content and antioxidant enzyme activity in sugarcane leaves 各图中相同性状相同品系(品种)柱形图上的不同小写字母,表示差异显著(P<0.05,Duncan’ s法) Different lowercase letters on bars of the same trait and line (cultivar) in each figure indicate significant differences (P<0.05, Duncan’ s method) |
与正常供水相比,伸长初期受到干旱胁迫后,甘蔗新品系及对照种ROC22叶片SOD、POD和CAT活性都呈现不同程度的增加趋势,且增幅均达差异显著水平。SOD活性增幅最小的品系是A1−1305,为34.17%;增幅最大的品系是A7−13120,为59.55%;对照种ROC22增幅为49.67%(图2D)。POD活性增幅最小的品系是A7−13120,为36.36%;增幅最大的是对照种ROC22,为64.75%(图2E)。CAT活性增幅最小的品系是A7−13120,增幅为41.82%;增幅最大的品系是A6−13115,为84.21%;对照种ROC22的增幅为71.59%(图2F)。
2.4 干旱胁迫对甘蔗叶片丙二醛含量的影响与正常供水相比,伸长初期受到干旱胁迫后,甘蔗新品系及对照种ROC22叶片MDA含量都呈现不同程度的增加趋势,且增幅均达显著差异水平。增幅最小的品系是A7−13120,为29.46%;增幅最大的品系是A6−13115,为86.53%;对照种ROC22的增幅为70.87%(图3)。

|
图 3 干旱胁迫对甘蔗叶片MDA含量的影响 Fig. 3 Effect of drought stress on MDA content in sugarcane leaves 相同品系(品种)柱形图上的不同小写字母,表示差异显著(P<0.05,Duncan’ s法) Different lowercase letters on bars of the same line (cultivar) indicate significant differences (P<0.05, Duncan’ s method) |
对根系活力、脯氨酸含量、可溶性蛋白含量、可溶性糖含量、MDA含量、SOD活性、POD活性、CAT活性8个生理指标的抗旱系数(表1)进行主成分分析后,将8个指标转化成为相互独立的综合新指标CI1~CI8,前2个综合指标的贡献率分别为68.62%、12.64%,累积贡献率达到81.26%(表2),因此忽略CI3~CI8这6个综合指标。由表2可以看出,在第一主成分CI1中,根系活力、脯氨酸含量、可溶性蛋白含量、可溶性糖含量、SOD活性、POD活性、CAT活性的系数较大,占了全部信息的68.62%,因此该成分代表了根系活力、脯氨酸含量、可溶性蛋白含量、可溶性糖含量、SOD活性、POD活性、CAT活性;在第二主成分CI2中,MDA含量的系数较大,反映了全部信息的12.64%,因此该成分代表了MDA含量。
|
|
表 1 甘蔗品系各单项指标的抗旱系数 Table 1 Drought resistance coefficient for each individual indicator of sugarcane lines |
|
|
表 2 各综合指标的系数及贡献率 Table 2 Coefficient and contribution rate of each comprehensive indicator |
通过公式(2)可得出2个主成分综合指标相应的隶属函数值(UXj),根据2个指标的贡献率通过公式(3)求出权重(Wj),最后通过公式(4)得到不同品系抗旱性的综合评价值(D),并对D值进行排序(表3)。D值越大,说明甘蔗的综合抗旱能力越强。A3−1320的D值最大,为0.886,评价为最抗旱;A4−1316的D值最小,为0.115,评价为最不抗旱;其他品系介于二者之间;对照种ROC22的D值为0.603,综合抗旱能力排在第5位。
|
|
表 3 甘蔗品系的综合指标值、Wj值、UXj值、D值及排序 Table 3 The comprehensive index values, Wj values, UXj values, D values and ranking of tested sugarcane lines |
通过对参试甘蔗材料抗旱性综合评价值(D)进行聚类分析,将10个甘蔗新品系及对照种ROC22分成抗旱性强、中度抗旱和抗旱性弱3个类型(图4)。抗旱性强的品系有2个:A6−13115、A3−1320,所占比例为18.18%;中度抗旱的品系(品种)有3个:ROC22、A13−1396、A6−13122,所占比例为27.27%;抗旱性弱的品系有6个:A6−13111、A1−1305、A11−1390、A7−13120、A7−13104、A4−1316,所占比例为54.55%。

|
图 4 基于D值的不同甘蔗品系抗旱性聚类分析 Fig. 4 Drought resistance clustering analyses of different sugarcane lines based on D values H:抗旱性强;M:中度抗旱;L:抗旱性弱 H:High drought resistance;M:Medium drought resistance;L:Low drought resistance |
抗旱性是作物在干旱胁迫下正常生长、繁殖或生存,胁迫解除后能够迅速恢复生长的能力[22]。抗旱性鉴定是通过筛选、评价和归类,提供优异抗旱种质资源的过程[23]。植物遭受干旱胁迫时会造成细胞膜系统的破坏和代谢紊乱,从而导致大量活性氧积累,SOD、POD、CAT是植物活性氧的清除剂,这3种酶的活性与植物抗旱性密切相关[24-25]。本研究中,甘蔗受干旱胁迫后,与对照组(正常供水)相比,甘蔗叶片SOD、POD和CAT活性均显著增加,上述3种酶的活性增幅最小的品系依次为A1−1305、A7−13120和A7−13120,抗旱性聚类均为抗旱性弱类型,CAT活性增幅最大的品系为A6−13115,抗旱性聚类属于抗旱性强类型,验证了Devi等[24]和Huseynova等[25]的研究结果。作物根系生理活性与根系主动吸水有关,根系越发达,作物吸水效率越高,可缓解干旱对植株的影响[26-27]。本研究中,甘蔗受干旱胁迫后,与正常供水相比,甘蔗根系活力均显著降低。根系活力降幅最小的品系为A6−13122,降幅最大的品系为A4−1316,抗旱性聚类表明前者属于中度抗旱类型,后者为抗旱性弱类型,这也验证了上述观点[26-27]。王川等[28]研究发现小麦植株受干旱胁迫后,抗旱性强的小麦品种总能保持较高的可溶性糖含量,因此认为可溶性糖含量可以作为小麦抗旱性评价的指标,本研究也得到类似结论。张明生等[29]发现甘薯处于逆境时,与抗逆性相关的基因被激活,诱导合成新的蛋白,导致植株可溶性蛋白含量增加,增强细胞的吸水能力从而提高植株抗旱性,因此认为可溶性蛋白含量可作为甘薯抗旱性评价指标。本研究中,甘蔗受干旱胁迫后,叶片可溶性蛋白质含量均显著增加,增幅最小的品系为A4−1316,最大的为对照种ROC22,抗旱性评价聚类表明前者为抗旱性弱类型,后者为中度抗旱类型,这也表明可溶性蛋白含量与甘蔗的抗旱性相关。
参试甘蔗品系抗旱性综合评价结果表明,A6−13115抗旱性强,A7−13104、A4−1316、A1−1305和A7−13120抗旱性弱。作物抗旱性是各生理生化代谢途径对干旱胁迫响应综合作用的结果,对不同指标作物的抗旱反应不一定相同,单一指标评价作物抗旱性往往具有片面性,评价结果可靠性差,采用多个指标综合分析能使评价结果更加可靠和科学。本研究采用抗旱系数对各指标进行数据处理,使其具有可比性,结合主成分分析法可以在不损失或很少损失原有信息的前提下,将原来个数较多而且彼此相关的指标转换成少数几个新的彼此独立的综合指标,并结合其隶属函数值及权重,得到甘蔗抗旱性综合评价值D值。D值是一个无量纲的数,且位于[0, 1],从而使得甘蔗品种的抗旱性差异具有可比性[30]。主成分分析法在大豆、水稻、小麦的抗旱性鉴定中已得到较好的应用[9, 21, 23],因此采用主成分分析结合聚类分析的综合评价方法可提高甘蔗抗旱性鉴定结果的可靠性。本研究中,A3−1320鉴定为抗旱性强品系,A13−1396鉴定为中度抗旱品系,与田间抗旱表现一致。对照品种ROC22鉴定为中度抗旱的甘蔗品种,这与ROC22多年田间种植表现一致,但与檀小辉等[31]对54个广西区试甘蔗品种进行抗旱性评价的结果不一致,可能是抗旱评价标准不同导致。
采用主成分和聚类方法对多个指标综合评价,能提高甘蔗抗旱评价的可靠性和准确性。本研究对参试的甘蔗新品系和对照品种ROC22作抗旱性评价,将其分为抗旱性强、中度抗旱和抗旱性弱3个类型。抗旱性强的品系有A6−13115、A3−1320;中度抗旱的品系有A13−1396、A6−13122及ROC22;抗旱性弱的品系有A6−13111、A1−1305、A11−1390、A7−13120、A7−13104、A4−1316。
| [1] |
王继华, 张木清, 曹干. 甘蔗抗旱育种研究进展[J]. 广东农业科学, 2010, 37(12): 34-51. DOI:10.3969/j.issn.1004-874X.2010.12.012 (  0) 0) |
| [2] |
毕黎明, 刘伟丽, 李杨瑞. 甘蔗抗旱性研究进展与展望[J]. 南方农业学报, 2006, 37(5): 522-527. DOI:10.3969/j.issn.2095-1191.2006.05.015 (  0) 0) |
| [3] |
边芯, 郎荣斌, 桃联安, 等. 干旱胁迫对持绿性甘蔗细茎野生种叶片生理和生物量的影响[J]. 中国糖料, 2017, 39(3): 5-8. (  0) 0) |
| [4] |
谢金兰, 吴建明, 黄杏, 等. 我国甘蔗新品种(系)的抗旱性研究[J]. 江苏农业科学, 2015, 43(3): 108-112. (  0) 0) |
| [5] |
SANCHEZ F J, MANZANARES M, DE ANDRES E F, et al. Turgor maintenance, osmotic adjustment and soluble sugar and proline accumulation in 49 pea cultivars in response to water stress[J]. Field Crops Res, 1998, 59(3): 225-235. DOI:10.1016/S0378-4290(98)00125-7 (  0) 0) |
| [6] |
刘艳, 陈贵林, 蔡贵芳, 等. 干旱胁迫对甘草幼苗生长和渗透调节物质含量的影响[J]. 西北植物学报, 2011, 31(11): 2259-2264. (  0) 0) |
| [7] |
刘瑞显, 王友华, 陈兵林, 等. 花铃期干旱胁迫下氮素水平对棉花光合作用与叶绿素荧光特性的影响[J]. 作物学报, 2008, 34(4): 675-683. DOI:10.3321/j.issn:0496-3490.2008.04.020 (  0) 0) |
| [8] |
张绪成, 上官周平. 不同抗旱性小麦叶片膜脂过氧化的氮素调控机制[J]. 植物营养与肥料学报, 2007, 13(1): 106-112. DOI:10.3321/j.issn:1008-505X.2007.01.018 (  0) 0) |
| [9] |
潘相文, 李文滨, 李艳华, 等. 主成分分析在大豆抗旱性评价上的应用[J]. 大豆科学, 2006, 25(4): 379-382. DOI:10.3969/j.issn.1000-9841.2006.04.009 (  0) 0) |
| [10] |
胡树平, 苏治军, 于晓芳, 等. 玉米自交系抗旱相关性状的主成分分析与模糊聚类[J]. 干旱地区农业研究, 2016, 34(6): 81-88. DOI:10.7606/j.issn.1000-7601.2016.06.13 (  0) 0) |
| [11] |
陈云风. 不同水稻杂交组合根系活力及其产量相关性[J]. 江苏农业科学, 2015, 43(12): 93-94. (  0) 0) |
| [12] |
高俊凤. 植物生理学实验指导[M]. 西安: 世界图书出版社, 2006: 142-143.
(  0) 0) |
| [13] |
刘海英, 王华华, 崔长海, 等. 可溶性糖含量测定(蒽酮法)实验的改进[J]. 实验室科学, 2013, 16(2): 19-20. DOI:10.3969/j.issn.1672-4305.2013.02.007 (  0) 0) |
| [14] |
张志良, 瞿伟菁. 植物生理学实验指导 [M]. (3版). 北京: 高等教育出版社, 2003: 123-124.
(  0) 0) |
| [15] |
HAMMERSCHMIDT R, NUCKLES E M, KUĆ J. Association of enhanced peroxidase activity with induced systemic resistance of cucumber to Colletotrichum lagenarium
[J]. Physiol Plant Pathol, 1982, 20(1): 73-76. DOI:10.1016/0048-4059(82)90025-X (  0) 0) |
| [16] |
职明星, 李秀菊. 脯氨酸测定方法的改进[J]. 河南科技学院学报(自然科学版), 2005, 33(4): 10-12. DOI:10.3969/j.issn.1673-6060-B.2005.04.003 (  0) 0) |
| [17] |
张志良, 瞿伟菁, 李小方. 植物生理学实验指导 [M]. (4版). 北京: 高等教育出版社, 2009: 212-213.
(  0) 0) |
| [18] |
胡标林, 余守武, 万勇, 等. 东乡普通野生稻全生育期抗旱性鉴定[J]. 作物学报, 2007, 33(3): 425-432. DOI:10.3321/j.issn:0496-3490.2007.03.012 (  0) 0) |
| [19] |
周广生, 梅方竹, 周竹青, 等. 小麦不同品种耐湿性生理指标综合评价及其预测[J]. 中国农业科学, 2003, 36(11): 1378-1382. DOI:10.3321/j.issn:0578-1752.2003.11.026 (  0) 0) |
| [20] |
刘莹, 盖钧镒, 吕慧能,等. 大豆耐旱种质鉴定和相关根系性状的遗传与QTL定位[J]. 遗传学报, 2005, 32(8): 855-863. (  0) 0) |
| [21] |
杨瑰丽, 杨美娜, 黄翠红, 等. 水稻幼穗分化期的抗旱性研究与综合评价[J]. 华北农学报, 2015, 30(6): 140-145. DOI:10.7668/hbnxb.2015.06.021 (  0) 0) |
| [22] |
徐建欣, 杨洁, 徐志军. 海南山栏稻品种全生育期抗旱性鉴定与评价[J]. 热带作物学报, 2018, 39(1): 55-60. DOI:10.3969/j.issn.1000-2561.2018.01.009 (  0) 0) |
| [23] |
白志英, 李存东, 孙红春, 等. 小麦代换系抗旱生理指标的主成分分析及综合评价[J]. 中国农业科学, 2008, 41(12): 4264-4272. DOI:10.3864/j.issn.0578-1752.2008.12.043 (  0) 0) |
| [24] |
DEVI M A, GIRIDHAR P. Variations in physiological response, lipid peroxidation, antioxidant enzyme activities, proline and isoflavones content in soybean varieties subjected to drought stress[J]. Proc Natl Acad Sci, India, Sect B Biol Sci, 2015, 85(1): 35-44. DOI:10.1007/s40011-013-0244-0 (  0) 0) |
| [25] |
HUSEYNOVA I M, ALIYEVA D R, MAMMADOV A C, et al. Hydrogen peroxide generation and antioxidant enzyme activities in the leaves and roots of wheat cultivars subjected to long-term soil drought stress[J]. Photosynth Res, 2015, 125(1/2): 279-289. (  0) 0) |
| [26] |
王一, 曹敏建, 李春红, 等. 模拟干旱对不同耐性玉米自交系幼苗根系和水分利用效率的影响[J]. 作物杂志, 2011(6): 50-52. DOI:10.3969/j.issn.1001-7283.2011.06.012 (  0) 0) |
| [27] |
丁红, 张智猛, 戴良香, 等. 干旱胁迫对花生生育中后期根系生长特征的影响[J]. 中国生态农业学报, 2013, 21(12): 1477-1483. (  0) 0) |
| [28] |
王川, 谢惠民, 王娜, 等. 小麦品种可溶性糖和保护性酶与抗旱性关系研究[J]. 干旱地区农业研究, 2011, 29(5): 94-99. (  0) 0) |
| [29] |
张明生, 谢波, 谈锋, 等. 甘薯可溶性蛋白、叶绿素及ATP含量变化与品种抗旱性关系的研究[J]. 中国农业科学, 2003, 36(1): 13-16. DOI:10.3321/j.issn:0578-1752.2003.01.003 (  0) 0) |
| [30] |
王军, 周美学, 许如根, 等. 大麦耐湿性鉴定指标和评价方法研究[J]. 中国农业科学, 2007, 40(10): 2145-2152. DOI:10.3321/j.issn:0578-1752.2007.10.004 (  0) 0) |
| [31] |
檀小辉, 廖洁, 刘铭, 等. 广西28个区试甘蔗品种抗旱性分析[J]. 安徽农业科学, 2011, 39(21): 12687-12690. DOI:10.3969/j.issn.0517-6611.2011.21.020 (  0) 0) |
 2019, Vol. 40
2019, Vol. 40


