2. 北京桑德环境工程有限公司,北京 101102;
3. 山东省环境保护科学研究设计院有限公司,山东 济南 250013
2. Beijing Sounds Environmental Engineering Co., Ltd., Beijing 101102,China;
3. Shandong academy of Environmental Sciences Co., Ltd., Ji’ nan 250013, China
抗生素是指由微生物或者动植物在生命过程中产生的、可以对其他细胞正常生命活动产生干扰的化学物质[1]。抗生素不仅可以应用于人和动植物体疾病的防治,也可以作为动物饲养中的生长促进剂。被机体吸收的抗生素只有小部分存在于机体组织中;大部分以初始母体或代谢产物的形式随粪尿排出体外,并最终直接或间接进入环境[2-3]。兽用抗生素排入环境,对水质和食品安全具有极大的风险,若不及时处理,会对人类的生存环境产生很大的影响。据统计,我国近年抗生素产量和使用量逐年增加,如2010年我国抗生素生产总量为18.5万t,国内消耗11.8万t;而2013年的抗生素生产总量达到了24.8万t,国内消耗16.2万t。大环内酯类、β−内酰胺类、氟喹诺酮类、四环素类和磺胺类分别占总量的26%、21%、17%、7%和5%。由于抗生素的滥用,在多种介质中可以检测到抗生素的存在,如鸡蛋、作物、土壤和生活用水等,对人体健康、土壤肥效、植物生长、微生物多样性和生态安全等方面造成潜在的威胁[4-5]。抗生素进入到环境后,首先会直接对水环境造成影响,长期饮用含有抗生素的水源会影响人体的免疫系统,降低机体免疫力,对人类健康产生危害。
目前,去除或降低污水中抗生素的方法主要有微生物降解[6]、非生物降解及吸附(ICPB及吸附材料)[7-8]、植物修复[9-10]、人工湿地[11-13]等方法。其中,植物修复和人工湿地技术早已被广泛应用于污染物去除,如用东南景天Sedum alfredii与甜玉米套种轮作可以显著降低土壤中重金属镉和铅含量[14];陈静雅等[15]研究表明,垂直潜流人工湿地对抗生素污染严重的河水中氮、磷去除效果最佳,对总氮(TN)、氨氮(NH4+−N)、总磷(TP)和磷酸盐(PO43−−P)的平均去除率分别为37.6%、51.6%、54.1%和41.4%。由于不同植物对不同污染物具有不同的去除效果,因此在人工湿地的应用与研究中,择优选取植物对去除污水中的有毒有害污染物至关重要。研究表明在人工湿地系统中,有植物种植的人工湿地对抗生素的去除能力显著高于无植物种植的人工湿地,主要原因是植物根系能吸附、吸收水体中抗生素,并且根系分泌物也可以降解抗生素[16];杨登等[17]研究表明,生物塘−人工湿地工艺可以利用系统的植物和基质降低污水中Cd含量,去除率最高可达35.8%;陈小洁等[18]在水培试验中用水生植物大漂Pistia stratiotes和凤眼莲Eichhornia crassipes去除水样中多种抗生素,结果表明大漂和凤眼莲对抗生素污染的水体表现出了不同程度的修复功能,其中,凤眼莲对盐酸四环素的去除效率高于90%;Liang等[19]研究发现,水生植物芦苇Phragmites australis、香蒲Typha orientalis、香根草Vetiveria zizanioides和美人蕉Canna indica对人工湿地中的磺胺甲恶唑去除率无显著差异,约为73%。
本研究根据某规模化养猪场兽药的实际使用情况,选取常用的兽药抗生素阿莫西林、盐酸多西环素和氟苯尼考作为污染物,选取4种常用人工湿地植物在不同浓度抗生素条件下进行水培试验,以寻找具有较优抗生素去除效率的水生植物,为人工湿地等工程应用提供理论参考。
1 材料与方法 1.1 材料供试抗生素:盐酸多西环素、氟苯尼考和阿莫西林,均在我国养殖业和医疗事业中应用较为广泛。其中,盐酸多环素属于四环素类抗生素,分子式C22H25N2O8Cl,相对分子质量512.93;氟苯尼考属于氯霉素类抗生素,分子式C12H14Cl2FNO4S,相对分子质量358.20;阿莫西林属于β−内酰胺类类抗生素,分子式C16H25N3O8S,相对分子质量419.46。
供试植物:皇竹草Pennisetum hydridum、风车草Pontderia cordata、美人蕉和梭鱼草Cyperus alternifolius,采自华南农业大学校园内,均为生长状态良好的植株,同种类型植株的株高、叶片数和叶片大小基本一致。
1.2 试验装置水培试验采用高60.0 cm、上部直径34.5 cm、底部直径26.0 cm的开口塑料桶,用穿孔聚氯乙烯泡沫塑料做盖板,外围用铝箔纸包裹,以防光解。每桶植株3棵,用海绵把供试植物固定于塑料盖板,根系自然悬垂在溶液中,保持24 h连续通气。先用1/2 Hogland营养液培养植物3 d,之后改为完全Hogland营养液,并加入不同质量浓度的盐酸多西环素、氟苯尼考和阿莫西林,每种抗生素质量浓度分别为0(对照)、0.1、1.0、10.0、100.0、500.0和1 000.0 μg/L,每个质量浓度设置3个重复。水培试验在华南农业大学温室进行,光照16 h、黑暗8 h,30 ℃水培7和14 d。
1.3 测定项目与方法 1.3.1 株高测量水培试验14 d后,观察并利用直尺测量供试植物株高。
1.3.2 叶绿素含量测定参考王磊等[20]的方法。取供试植物中部幼嫩叶片,用剪刀去除叶脉后剪成0.2 cm左右宽的细丝混合均匀,称取0.10~0.20 g细丝放入25 mL比色管中。在比色管中加入浸提混合液(丙酮与无水乙醇以体积比2∶1混合)10 mL,并将黏附在管壁的碎叶片冲洗到浸提液中,盖上瓶塞黑暗浸提24 h,其间摇动4~5次;次日待叶片细丝组织已全部变白(表明叶绿素已浸提干净)后用浸提液定容至25 mL,25 ℃、1 2 000 r/min离心5 min,收集上清液后在波长645和663 nm下测定光密度(D),以浸提混合液为空白对照。按下式计算植物叶片叶绿素含量(wT):
| $ \begin{array}{l} \;\;\;\;\;\;\;\;\;\;\;\;\;{w_{\rm{a}}} = 12.72{D_{{\rm{663}}\;{\rm{nm}}}} - 2.59{D_{{\rm{645}}\;{\rm{nm}}}}\text{,}\\ \;\;\;\;\;\;\;\;\;\;\;\;\;{w_{\rm{b}}} = 22.88{D_{{\rm{645}}\;{\rm{nm}}}} - 4.67{D_{{\rm{663}}\;{\rm{nm}}}}\text{,}\\ {w_{\rm{T}}} = {w_{\rm{a}}} + {w_{\rm{b}}} = 20.29{D_{{\rm{645}}\;{\rm{nm}}}} + 8.05{D_{{\rm{663}}\;{\rm{nm}}}}\text{,} \end{array} $ |
式中,wa和wb分别为叶绿素a和叶绿素b含量。
1.3.3 水体抗生素浓度测定在试验进行0、7和14 d后收集各处理水样,于4 ℃条件下储存。将收集的水样,与0.1 mol/L的EDTA−Mcllvaine缓冲液按体积比1∶1混合并振荡5 min后,避光超声萃取30 min,4 ℃、10 000 r/min离心10 min,收集上清液。上清液过HLB固相萃取小柱(Waters Oasis,3 mL,60 mg;过柱前预先用5.0 mL分析纯甲醇活化HLB小柱),滤液以5 mL/min的速度过柱,待其完全流出后,用6 mL超纯水冲洗固相萃取小柱,室温干燥15 min,待水分蒸发完全后,用1/5样品体积的分析纯甲醇进行洗脱,洗脱液过0.22 μm的滤膜,并置−20 ℃冰箱待测。高效液相色谱-串联质谱(HPLC-MS)分析水体中抗生素浓度。按下式计算抗生素去除率:
| $ {\text{去除率}}= \left( {{\rho _{_0}} - \rho } \right)/{\rho _{_0}} \times 100{\text{%}} \text{,} $ |
式中,ρ0为抗生素起始质量浓度,ρ为水培试验后抗生素残留的质量浓度。
1.4 数据处理采用Microsoft Excel进行统计分析,作图软件为Sigma Plot 12.0,方差分析软件为SPSS Statistics2.1,应用Duncan’s多重比较对不同处理进行显著性检测。
2 结果与分析 2.1 抗生素对植物株高的影响由表1可知,随着水培液中抗生素质量浓度的增加,供试植物都呈现出类似的生长趋势:低质量浓度(0~0.1 μg/L)胁迫时,植株生长没有明显变化;中等质量浓度(1.0~100.0 μg/L)胁迫时,促进植物生长;高质量浓度(>100.0 μg/L)胁迫时,抑制植株生长。风车草在1.0~100.0 μg/L阿莫西林和氟苯尼考胁迫下促进植株生长,其中,10.0 μg/L阿莫西林对风车草的促生作用最为明显,比对照高6.4%;而氟苯尼考则是在10.0和100.0 μg/L时对植株的促生作用最为明显,均比对照高约7.5%;抗生素质量浓度高于100.0 μg/L时,质量浓度与株高呈负相关。风车草在10.0 μg/L盐酸多西环素胁迫下促进植株生长,株高比对照高5.2%。其他3种水培植物也呈现类似结果,美人蕉在10.0 μg/L的阿莫西林和盐酸多西环素及100.0 μg/L氟苯尼考胁迫下生长最佳,梭鱼草则在100.0 μg/L的阿莫西林、盐酸多西环素和10 μg/L氟苯尼考胁迫下株高最高,优于其他处理。皇竹草株高在1.0 μg/L的阿莫西林胁迫下最高,以及在100.0 μg/L氟苯尼考或盐酸多西环素胁迫下最高。
|
|
表 1 水培14 d后不同抗生素种类及浓度对水培植物株高的影响1) Table 1 Effects of different antibiotics and concentrations on plant height at 14 days after hydroponic |
从图1可以得出,不同浓度抗生素胁迫下供试植物叶绿素含量与株高呈现类似的相关性,中低浓度胁迫会增加植株叶绿素含量,而高浓度胁迫则会降低植株叶绿素含量,抑制植物生长。在10.0 μg/L阿莫西林胁迫下,供试植株叶绿素含量达到最高,显著高于空白对照;而在1 000.0 μg/L阿莫西林胁迫时,叶绿素含量显著降低,对植株的危害作用达到最大。在氟苯尼考和盐酸多西环素胁迫下,植株叶绿素含量与阿莫西林胁迫结果类似,但是皇竹草在100.0 μg/L抗生素胁迫条件下叶绿素含量最高。
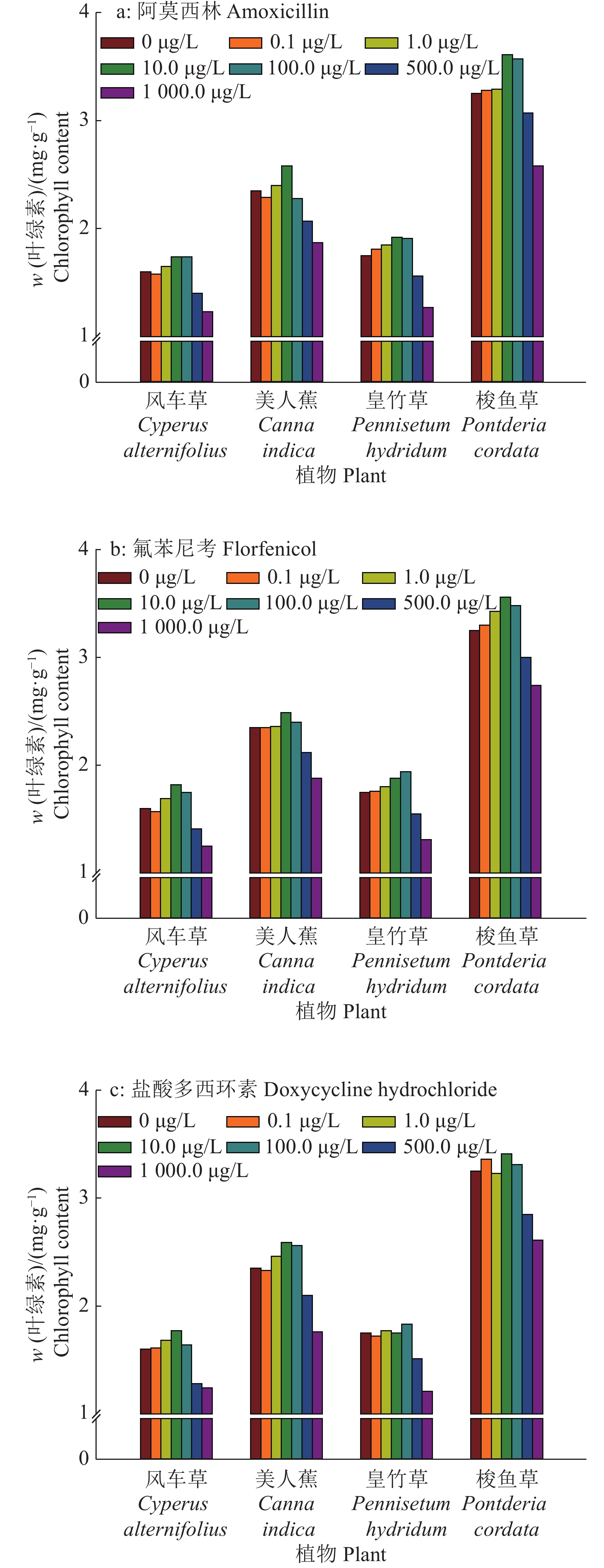
|
图 1 不同浓度抗生素胁迫14 d后植物叶绿素含量变化 Fig. 1 Changes of chlorophyll contents in plants at 14 days after treated with different contents of antibiotics |
由表2可以看出,3种抗生素在7和14 d无植株处理会有轻微水解,浓度越高,水解效率越低。不同植物对水培液中的抗生素具有一定的去除能力,且随着培养时间的推移,去除率也逐渐增大。处理后7 d,皇竹草和美人蕉对100.0 μg/L阿莫西林的去除效果很接近,分别为44.0%和41.0%;对于氟苯尼考的去除效果而言,皇竹草是最佳供选植物,去除率为49.4%;美人蕉对盐酸多西环素的去除效果最好,去除率达到48.3%。处理后14 d,皇竹草和美人蕉对100.0 μg/L阿莫西林和氟苯尼考的去除率接近,分别为55.0%、54.0%和56.2%、54.7%。对100.0 μg/L的盐酸多西环素去除率最佳的植物是美人蕉,去除率是48.3%。上述结果表明,对100.0 μg/L抗生素去除率最好的供试植株是皇竹草和美人蕉;对10.0 μg/L的阿莫西林、氟苯尼考和盐酸多西环素去除率最高的供试植物分别是美人蕉、皇竹草和美人蕉。
|
|
表 2 不同处理水培7和14 d后水培液中抗生素残留量1) Table 2 Antibiotic residues in hydroponic solution of different plants at 7 and 14 days after different treatments |
近年来由于兽药抗生素的广泛应用和滥用,其排入环境后对水质、食品安全和生态安全都具有很大的风险,兽药抗生素的暴露与儿童超重或肥胖也有明显的联系[21]。为了去除畜禽养殖废水中兽药抗生素,寻求降低地表水环境中兽药抗生素的方法,本研究选取常用的人工湿地植物皇竹草、风车草、美人蕉和梭鱼草在不同浓度抗生素条件下进行水培试验。
3.1 抗生素在水体中可自然轻微降解不同浓度抗生素无植物处理的水样,抗生素浓度都会有轻微的降低,无植物处理1 000 μg/L阿莫西林,7和14 d后分别降低至968和944 μg/L,这表明在无光照处理下抗生素会自然轻微水解。抗生素的自然水解中含有部分微生物降解,如冷一非[22]用四环素驯化土壤后,分离得到的嗜麦芽窄食假单胞菌Stenotrophomonas maltophilia DT1具有降解四环素能力,降解能力高达50%以上;此外,环境中也存在具有降解抗生素能力的真菌,如Huang等[8]发现酵母菌Trichosporon mycotoxinivorans XPY-10具有降解四环素类抗生素能力。但在自然水体环境中,靠抗生素的轻微自然水解显然不足以达到消除抗生素污染的目的。
3.2 水体中抗生素对植物生长的影响本研究水培试验中,4种植物在不同浓度抗生素胁迫下表现出不同的生长趋势和抗生素去除率:风车草在盐酸多西环素胁迫下,低浓度胁迫对植株生长无影响;在氟苯尼考和阿莫西林胁迫下,低浓度均促进植株生长作用,在高浓度处理条件下对植株具有抑制生长作用;美人蕉、梭鱼草和皇竹草在低浓度的盐酸多西环素、氟苯尼考和阿莫西林处理条件下均可以促进植株生长,而高浓度则抑制植株生长。Boxall等[23]研究表明,胡萝卜Daucus carota和莴笋Lactuca sativa L. var. angustanaIrish在苯丁唑啉、土霉素和恩诺沙星抗生素胁迫下生长受到抑制,而同等浓度的阿莫西林和氟苯尼考对胡萝卜和莴笋生长没有明显影响。Luo等[24]研究表明,低浓度的抗生素处理植物可以提高植株的根系活力,为正常生长的根部细胞提供更好的生理基础,从而提高代谢速率、缓解低浓度抗生素胁迫危害。这是因为高浓度抗生素胁迫后,根系活力受抑制而影响植物固氮能力,干扰植物根系固氮结构;并且原生质形成和叶酸合成受到抑制,从而影响谷胱甘肽转移酶和一系列抗氧化系统酶的合成表达,致使大量的氧自由基无法清除而氧化损伤植物体细胞,导致植物生长受到抑制,表现出毒害效应[25]。
3.3 植物对水体抗生素去除的效果和机理皇竹草对阿莫西林的去除效果最佳,美人蕉的去除效果弱于皇竹草,但是优于其他2种植物。4种水生植物对氟苯尼考的去除效果中,100.0和1 000.0 μg/L处理7 d后,美人蕉的去除效果最佳,显著优于其他3种植物,500.0 μg/L处理梭鱼草的去除效果优于其他植物。4种植物在盐酸多西环素胁迫下,美人蕉的去除效果相对最佳;比较不同植物对抗生素的去除率发现,在盐酸多西环素胁迫下,美人蕉在100.0 μg/L胁迫下去除率最高,达到55.0%;在氟苯尼考胁迫下,皇竹草在100.0 μg/L胁迫下去除效率最高,达到56.2%,;在阿莫西林胁迫下,皇竹草和美人蕉在100.0 μg/L胁迫下去除效率相近且最高,分别达到53.5%和54.0%。这可能是因为相比于其他2种植物,美人蕉和皇竹草的植物组织器官较为发达,根系较为粗壮且具有许多发达的不定根,从而能够更好地适应和耐受严峻的抗生素环境,生物代谢活性也更高,所以去除抗生素的效果也更明显。
研究表明,美人蕉在去除大环内酯类抗生素物质时,其主要的去除机制是美人蕉的根系活动,如根系吸收和根系微生物去除[26]。此外,梭鱼草在多种抗生素(氨甲酰氮草、氧氟沙星和罗红霉素)胁迫条件下,通过提高自身的抗氧化酶系统的解毒能力以抵抗抗生素的胁迫,从而维持自身的光合作用达到缓解胁迫作用[16]。抗生素进入环境后,首先带来的影响是环境微生物多样性受到抑制,抗生素耐受菌和降解菌丰度增加。Liao等[27]研究表明,金霉素驯化土壤后微生物结构发生变化,多样性降低,而芽孢杆菌属Bacillus Cohn和假单胞菌属Pseudomonas丰度增加,抗生素浓度也随之降低。当植物受到抗生素胁迫后,植物可以直接或者间接缓解环境中的胁迫,其中抗生素的去除有可能是部分抗生素被植物吸收,在植株体内代谢分解或者贮存于植物组织中。Chung等[28]利用萝卜Raphanus sativus吸收土壤中兽药残留(金霉素、氟诺沙星和大环内酯),从而降低环境中抗生素浓度,缓解抗生素带来的危害。本研究水培液中抗生素浓度降低后,微生物受到的胁迫程度随之降低,对毒性的耐受能力和解毒能力随之增强,对抗生素的去除效果也明显提高。而湿地植物对抗生素环境的耐受性很可能取决于其根系发达程度,根系越发达,分泌的根系分泌物就越多,从而更好地缓解抗生素的胁迫和改善周围的根际环境,降低外界环境毒性。
3.4 结论Leng等[6]发现在自然水体中抗生素污染水平都小于15 μg/L,而四环素类抗生素污染水平相对较高,达到44~255 μg/L。本研究考虑现实中的污染程度,在10.0 μg/L阿莫西林胁迫下,皇竹草的去除率最高,均接近50.0%;10.0 μg/L阿莫西林胁迫下,风车草的去除率是48.7%,接近皇竹草的去除效果。在实际应用中,应根据水体中不同浓度抗生素残留量,选择不同的水生植物以达到最佳的去除效果;普通污染水体中(如普通江河)选择皇竹草作为优选植物去除污染水体中抗生素;在养殖场附近的池塘或者人工湿地由于受污染较为严重,建议选用美人蕉或者皇竹草;对于四环素类使用较多的饲养场附近水体,优选美人蕉作为第一修复植物。
| [1] |
李新慧, 郑权, 李静, 等. 氟喹诺酮对垂直流人工湿地性能及微生物群落的影响[J]. 环境科学, 2018, 39(10): 4809-4816. (  0) 0) |
| [2] |
吴凡, 屠荫奇, 宋歌. 浅谈畜禽养殖过程中抗生素污染情况[J]. 科技致富向导, 2013(29): 67. (  0) 0) |
| [3] |
EZZARIAI A, HAFIDI M, KHADRA A, et al. Human and veterinary antibiotics during composting of sludge or manure: Global perspectives on persistence, degradation, and resistance genes[J]. J Hazard Mater, 2018, 359: 465-481. DOI:10.1016/j.jhazmat.2018.07.092 (  0) 0) |
| [4] |
YANG G, WANG C L, CHIU Y H. Occurrence and distribution of phthalate esters and pharmaceuticals in Taiwan river sediments[J]. J Soil Sediment, 2015, 15(1): 198-210. DOI:10.1007/s11368-014-1003-4 (  0) 0) |
| [5] |
CHARUAUD L, JARDE E, JAFFREZIC A, et al. Veterinary pharmaceutical residues from natural water to tap water: Sales, occurrence and fate[J]. J Hazard Mater, 2019, 361: 169-186. DOI:10.1016/j.jhazmat.2018.08.075 (  0) 0) |
| [6] |
LENG Y, BAO J, SONG D, et al. Background nutrients affect the biotransformation of tetracycline by Stenotrophomonas maltophilia as revealed by genomics and proteomics
[J]. Environ Sci Technol, 2017, 51(18): 10476-10484. DOI:10.1021/acs.est.7b02579 (  0) 0) |
| [7] |
XIONG H, ZOU D, ZHOU D, et al. Enhancing degradation and mineralization of tetracycline using intimately coupled photocatalysis and biodegradation (ICPB)[J]. Chem Eng J, 2017, 316: 7-14. DOI:10.1016/j.cej.2017.01.083 (  0) 0) |
| [8] |
HUANG X, ZHANG X, FENG F, et al. Biodegradation of tetracycline by the yeast strain Trichosporon mycotoxinivorans XPY-10
[J]. Prep Biochem Biotech, 2016, 46(1): 15-22. DOI:10.1080/10826068.2014.970692 (  0) 0) |
| [9] |
WANG J, ZHI D, ZHOU H, et al. Evaluating tetracycline degradation pathway and intermediate toxicity during the electrochemical oxidation over a Ti/Ti4O7 anode
[J]. Water Res, 2018, 137: 324-334. DOI:10.1016/j.watres.2018.03.030 (  0) 0) |
| [10] |
XIONG H, DONG S, ZHANG J, et al. Roles of an easily biodegradable co-substrate in enhancing tetracycline treatment in an intimately coupled photocatalytic-biological reactor[J]. Water Res, 2018, 136: 75-83. DOI:10.1016/j.watres.2018.02.061 (  0) 0) |
| [11] |
SENGUPTA A, SARKAR D, DAS P, et al. Tetracycline uptake and metabolism by vetiver grass (Chrysopogon zizanioides L. Nash)
[J]. Environ Sci Pollut R, 2016, 23(24): 24880-24889. DOI:10.1007/s11356-016-7688-8 (  0) 0) |
| [12] |
BERGLUND B, KHAN G A, WEISNER S E B, et al. Efficient removal of antibiotics in surface-flow constructed wetlands, with no observed impact on antibiotic resistance genes[J]. Sci Total Environ, 2014, 476/477: 29-37. DOI:10.1016/j.scitotenv.2013.12.128 (  0) 0) |
| [13] |
CHOI Y, KIM L, ZOH K. Removal characteristics and mechanism of antibiotics using constructed wetlands[J]. Ecol Eng, 2016, 91: 85-92. DOI:10.1016/j.ecoleng.2016.01.058 (  0) 0) |
| [14] |
陈铭孙, 李择桂, 林贤柯, 等. 低镉铅甜玉米品种筛选及在间套种修复污染土壤中的应用[J]. 江苏农业科学, 2018(17): 285-289. (  0) 0) |
| [15] |
陈静雅, 王晓昌, 郑于聪, 等. 潮汐流人工湿地对高污染河水氮磷的去除特性[J]. 环境科学与技术, 2017, 40(12): 32-37. (  0) 0) |
| [16] |
YAN Q, FENG G, GAO X, et al. Removal of pharmaceutically active compounds (PhACs) and toxicological response of Cyperus alternifolius exposed to PhACs in microcosm constructed wetlands
[J]. J Hazard Mater, 2016, 301: 566-575. DOI:10.1016/j.jhazmat.2015.08.057 (  0) 0) |
| [17] |
杨登, 尹晓辉, 邹慧玲, 等. 生物塘−人工湿地工艺去除农田灌溉水中镉污染的效果[J]. 环境工程技术学报, 2018, 8(2): 155-160. DOI:10.3969/j.issn.1674-991X.2018.02.021 (  0) 0) |
| [18] |
陈小洁, 李凤玉, 郝雅宾. 两种水生植物对抗生素污染水体的修复作用[J]. 亚热带植物科学, 2012, 41(4): 1-7. (  0) 0) |
| [19] |
LIANG Y, ZHU H, BAÑUELOS G, et al. Removal of sulfamethoxazole from salt-laden wastewater in constructed wetlands affected by plant species, salinity levels and co-existing contaminants[J]. Chem Eng J, 2018, 341: 462-470. DOI:10.1016/j.cej.2018.02.059 (  0) 0) |
| [20] |
王磊, 汤家鑫, 高兴国, 等. PEG模拟干旱胁迫条件下光叶珙桐幼苗叶片叶绿素含量变化[J]. 安徽农业科学, 2018(32): 91-92. DOI:10.3969/j.issn.0517-6611.2018.32.026 (  0) 0) |
| [21] |
WANG H, WANG N, WANG B, et al. Antibiotics detected in urines and adipogenesis in school children[J]. Environ Int, 2016, 89/90: 204-211. DOI:10.1016/j.envint.2016.02.005 (  0) 0) |
| [22] |
冷一非. 微生物降解四环素特性及降解机理研究[D]. 武汉: 中国地质大学, 2017.
(  0) 0) |
| [23] |
BOXALL A B, JOHNSON P, SMITH E J, et al. Uptake of veterinary medicines from soils into plants[J]. J Agr Food Chem, 2006, 54(6): 2288-2297. DOI:10.1021/jf053041t (  0) 0) |
| [24] |
LUO Y, XU L, RYSZ M, et al. Occurrence and transport of tetracycline, sulfonamide, quinolone, and macrolide antibiotics in the Haihe River Basin, China[J]. Environ Sci Technol, 2011, 45(5): 1827-1833. DOI:10.1021/es104009s (  0) 0) |
| [25] |
WEBER K P, MITZEL M R, SLAWSON R M, et al. Effect of ciprofloxacin on microbiological development in wetland mesocosms[J]. Water Res, 2011, 45(10): 3185-3196. DOI:10.1016/j.watres.2011.03.042 (  0) 0) |
| [26] |
TAI Y, TAM N F, DAI Y, et al. Assessment of rhizosphere processes for removing water-borne macrolide antibiotics in constructed wetlands[J]. Plant Soil, 2017, 419(1/2): 489-502. DOI:10.1007/s11104-017-3359-x (  0) 0) |
| [27] |
LIAO X, ZOU R, LI B, et al. Biodegradation of chlortetracycline by acclimated microbiota[J]. Process Saf Environ, 2017, 109: 11-17. DOI:10.1016/j.psep.2017.03.015 (  0) 0) |
| [28] |
CHUNG H S, LEE Y, RAHMAN M M, et al. Uptake of the veterinary antibiotics chlortetracycline, enrofloxacin, and sulphathiazole from soil by radish[J]. Sci Total Environ, 2017, 605/606: 322-331. DOI:10.1016/j.scitotenv.2017.06.231 (  0) 0) |
 2019, Vol. 40
2019, Vol. 40


