2. 桂林医学院 药学院,广西 桂林 541001;
3. 桂林医学院 生物技术学院,广西 桂林 541001;
4. 中国医学科学院 药用植物研究所,北京 100193
2. College of Pharmacy, Guilin Medical University, Guilin 541001, China;
3. College of Biotechnology, Guilin Medical University, Guilin 541001, China;
4. Institute of Medicinal Plant Development, Chinese Academy of Medical Sciences, Beijing 100193, China
荧光原位杂交技术(Fluorescence in situ hybridization,FISH)是20世纪80年代发展起来的非放射性原位杂交技术,其原理是将DNA序列用digoxigenin-11-dUTP等非放射性标记物制备成探针,与染色体标本杂交,将探针直接定位到染色体上[1-2]。多色荧光原位杂交技术在FISH的基础上发展,建立于1996年,可通过一次杂交同时鉴定多个探针位点,具有安全、简便、灵敏度高等优点。
rDNA是成簇分布于1个或数个位点、拷贝数为500~40 000的重复序列,是植物基因组中研究最多的遗传单位,它在染色体上的物理定位可为核型分析提供稳定有效的染色体标记,是构建染色体分子核型以及研究基因组结构、功能和进化的重要手段[3]。rDNA已经在许多重要的模式作物和经济作物的基因组中进行了广泛的物理定位,为物种染色体识别、基因组结构分析、物理图谱构建及物种亲缘关系研究提供了重要的信息[4-8]。
葫芦科Cucurbitaceae植物具有重要的经济价值,包括许多重要的蔬菜瓜果、药用植物和观赏植物。该科植物染色体多数为中小染色体,且不易染色,依靠传统的核型分析手段,从外形和长度难以区分染色体。荧光原位杂交等技术可在小染色体上标记可识别的信号,更好地区分染色体,是研究中小染色体的良好手段[9]。国内有关葫芦科植物分子细胞遗传学研究工作开展得较少,只有少量报道[10-12]。大部分葫芦科植物在分子细胞遗传学领域的研究,至今仍是空白。
研究采用改进的rDNA双色荧光原位杂交法,在拟南芥Arabidopsis thaliana 45S rDNA和5S rDNA的5′端进行荧光修饰,对20种葫芦科植物中期染色体进行45S、5S rDNA的物理定位,了解rDNA序列在这些植物上的信号位点的数目和分布模式,积累该类群植物分化过程中染色体形态变化的分子遗传学资料,为研究葫芦科植物核型、遗传育种、进化分类等分析提供更为准确的理论数据。
1 材料与方法 1.1 试验材料以20种葫芦科植物为试验材料,这些植物包括冬瓜Benincasa hispida、西瓜Citrullus lanatus、甜瓜Cucumis melo、金瓜Gymnopetalum chinense、波棱瓜Herpetospermum pedunculosum、葫芦Lagenaria siceraria、丝瓜Luffa cylindrica、苦瓜Momordica charantia、木鳖子Momordica cochinchinensis、云南木鳖Momordica dioica、西葫芦Cucurbita pepo、南瓜Cucurbita moschata、蛇瓜Trichosanthes anguina、瓜叶栝楼Trichosanthes cucumerina、糙点栝楼Trichosanthes dunniana、全缘栝楼Trichosanthes ovigera、罗汉果Siraitia grosvenorii、钮子瓜Zehneria maysorensis、红瓜Coccinia grandis和佛手瓜Sechium edule。植物材料经中国科学院药用植物研究所云南分所李海涛副研究员鉴定。植物分类名称参照《中国植物志》[13]。凭证标本和染色体标本保存于南开大学生命科学学院染色体实验室。
1.2 荧光原位杂交(FISH) 1.2.1 染色体标本制备和预处理采用陈瑞阳等[14]的去壁低渗法制备染色体标本。标本预处理包括以下步骤:1)标记,在荧光显微镜下标记分裂相的坐标,在载玻片背面用玻璃刀标记出分裂相的位置;2)褪色,将染色体片子浸泡到体积分数为45%的冰乙酸溶液中5 min,空气干燥;3)固定,滴加质量分数为4%的多聚甲醛溶液,静置10 min,空气干燥;4)变性,滴加10 μL体积分数为70%的去离子甲酰胺溶液,70 ℃处理2 min;5)干燥,甩掉盖片,依次用−20 ℃的体积分数为70%、85%和100%的乙醇溶液梯度脱水,每次4 min,空气干燥。
1.2.2 探针合成和制备从拟南芥5S rDNA和45S rDNA序列中选取一段重复序列,由上海生工生物公司合成探针,在5′端标记荧光信号,5S rDNA标记TAMRA红色荧光,45S rDNA标记FAM绿色荧光。
1.2.3 染色体荧光原位杂交过程1)杂交:取2×SSC溶液、5S和45S探针配制成5 ng/ μL的混合探针,在标本滴加7 μL的5S和45S混合探针,盖上18 mm×18 mm的盖玻片,放入湿盒,在37 ℃杂交箱中黑暗杂交1 h以上。
2)洗脱:在Tween-20体积分数为0.2%的4×SSC溶液中黑暗洗涤10 min;清水冲洗,黑暗中空气干燥。
3)信号检测:每处滴加含有DAPI的防荧光淬灭剂5 μL,盖上盖玻片,在荧光显微镜下观察并拍照。在荧光显微镜下,蓝色的分裂相在紫外光激发下观察,红色的5S杂交信号在绿色光激发下观察,绿色的45S荧光信号在蓝色光激发下观察。
4)图像采集和处理:在Nikon 80i荧光显微镜下观察,冷CCD拍照。用Spot 4.1软件进行图像合成,用Adobe Photoshop CS6软件调整图像,将染色体分割,再将图片导入Karyotype核型分析软件,对染色体进行配对,测量染色体相对长度、着丝点位置、长短臂比值,根据相对长度对染色体进行排序编号后输出核型图。
1.2.4 ITS2序列扩增、回收、测序提取瓜叶栝楼基因组DNA为模板,扩增ITS2序列,引物为通用引物,正向引物:5′-GCGATACTTGGTGTGAAT-3′,反向引物:5′-GACGCTTCTCCAGACTACAAT-3′。反应体系(50 μL):10×PCR buffer 5 μL,DNA模板2 μL,引物-F和引物-R各2 μL,dNTPs 1 μL,Taq酶0.4 μL,超纯水37.6 μL。反应程序:94 ℃预变性5 min;94 ℃ 30 s,94 ℃ 30 s,56 ℃ 30 s,72 ℃ 45 s,循环40次;72 ℃延伸7 min,4 ℃保温。反应在Eppendorf 50−60 HZ PCR扩增仪(德国Eppendorf公司)上进行,在Syngene DYV6-EE凝胶成像分析系统(英国Syngene公司)下观察、拍照。将扩增到的PCR产物用TaKaRa MiniBEST Agarose Gel DNA Extraction Kit Ver.4.0试剂盒回收,回收的ITS2片段与全式金克隆载体Peasy Blunt Zero连接,转化大肠埃希菌Escherichia coli感受态,挑取单克隆,送上海生工生物公司测序。
2 结果与分析 2.1 葫芦科植物45S和5S rDNA荧光原位杂交信号的位点数目除瓜叶栝楼外,45S rDNA杂交信号数目为1~7对不等,钮子瓜45S rDNA杂交信号1对,冬瓜、西瓜、甜瓜、葫芦、丝瓜、苦瓜、云南木鳖子、红瓜、佛手瓜45S rDNA杂交信号2对,金瓜、蛇瓜、糙点栝楼、罗汉果为3对,木鳖子、南瓜为4对,西葫芦、全缘栝楼为5对,波棱瓜为7对。与45S rDNA杂交位信号相比,5S rDNA杂交信号位点数目较少,为1~2对,除金瓜、西葫芦、南瓜为2对杂交信号外,其余17种植物均为1对杂交信号。
金瓜、波棱瓜、葫芦、木鳖子、云南木鳖、西葫芦、蛇瓜、糙点栝楼、全缘栝楼、钮子瓜、红瓜、佛手瓜等12种植物的45S rDNA和 5S rDNA荧光原位杂交结果为新记录。瓜叶栝楼未检测到45S rDNA杂交信号,需进一步试验检测。
2.2 瓜叶栝楼ITS2序列扩增结果瓜叶栝楼仅探测到1对5S rDNA荧光位点,未检测到45S rDNA杂交位点,为进一步验证,用瓜叶栝楼基因组DNA为模板扩增ITS2序列,测序结果如下:CGCATCGCTGCCCCCCACGCAACCCCCCTTCGGGTTGGTTGCGCAGGTGCGGGCACACGCTGGCCTCCCGTGCGCACCGTCGTGCGGATGGCTTAAATTCGAGTCCTCGGCGCCTGTCGTCGCGACACTACGGTGGTTGATCCAACCTCGGTACCGCGTCGCGACCTCAGTCCGCGCAACTCCTCCCCGCGAGCGAGCGAGGACTTCTATGTCGACCCTCTGAACGTCGTCCCCAAAGACGATGCTCTCGACG。此序列此前未曾在GenBank登记,为新记录。ITS2序列是45S rDNA的内转录间隔区,其成功扩增说明45S rDNA在瓜叶栝楼中是存在的。
2.3 葫芦科植物45S和5S rDNA荧光杂交信号在染色体上的分布情况葫芦科植物多为中小染色体,荧光杂交信号的位置难以精确测量,故将荧光杂交信号分布的位置大致分为短臂顶端、短臂/长臂、着丝点等部位来区分。20种植物中,45S和5S rDNA在染色体短臂、短臂顶端、着丝点等位置均有分布,分布在臂上的荧光杂交信号都位于短臂上。为叙述方便,将20种植物按染色体基数分组进行荧光杂交结果的分析。
2.3.1 染色体基数为10的葫芦科植物由图1可知,波棱瓜、糙点栝楼、南瓜和西葫芦的染色体数分别为20、20、40和40条,染色体基数为10。

|
图 1 染色体基数为10的4种葫芦科植物45S和5S rDNA荧光原位杂交结果 Fig. 1 45S and 5S rDNA FISH results of four Cucurbitaceae plants with the basic chromosome number of 10 a1、b1、c1和d1分别为波棱瓜、糙点栝楼、南瓜和西葫芦的荧光原位杂交结果;a2、b2、c2和d2分别为波棱瓜、糙点栝楼、南瓜和西葫芦的染色体核型图 a1, b1, c1 and d1 are the FISH results of Herpetospermum pedunculosum, Trichosanthes dunniana, Cucurbita moschata and Cucurbita pepo, respectively; a2, b2, c2 and d2 are chromosomal nucleotypes of Herpetospermum pedunculosum, Trichosanthes dunniana, Cucurbita moschata and Cucurbita pepo, respectively |
波棱瓜(图1a)检出45S rDNA杂交信号7对,分别位于2、3、5、7、8、9、10号染色体,其中2号染色体的荧光信号位于短臂顶端,3、7、10号染色体杂交信号在短臂上,5、8、9号染色体的杂交信号在着丝点上;检出5S rDNA荧光信号1对,位于2号染色体短臂顶端。2号染色体兼有45S rDNA和5S rDNA荧光信号,且都分布在染色体短臂顶端。
糙点栝楼(图1b)检出45S rDNA杂交信号3对,分别位于7、8、10号染色体上,均分布在短臂顶端;检出5S rDNA荧光信号1对,位于7号染色体短臂顶端。7号染色体同时具有45S rDNA和5S rDNA荧光杂交信号,且都分布在短臂顶端。
南瓜(图1c)检出45S rDNA荧光信号4对,分别位于2、5、8、9号染色体短臂;检出5S rDNA 2对,分别位于1、3号染色体短臂。
西葫芦(图1d)检出5对45S rDNA荧光信号,分布位于2、3、4、7、16号染色体,其中,2、3、7、16号染色体的荧光位点位于短臂上,4号染色体的荧光位点在着丝点;检出5S rDNA杂交信号2对,分别位于1号染色体短臂和11号染色体短臂顶端。
2.3.2 染色体基数为11的葫芦科植物由图2可知,西瓜、金瓜、葫芦、苦瓜、蛇瓜、瓜叶栝楼和全缘栝楼的染色体数目均为22条,染色体基数为11。

|
图 2 染色体基数为11的7种葫芦科植物45S和5S rDNA荧光原位杂交结果 Fig. 2 45S and 5S rDNA FISH results of seven Cucurbitaceae plants with the basic chromosome number of 11 a1、b1、c1、d1、e1、f1和g1分别为西瓜、金瓜、葫芦、苦瓜、蛇瓜、瓜叶栝楼和全缘栝楼的荧光原位杂交结果;a2、b2、c2、d2、e2、f2和g2分别为西瓜、金瓜、葫芦、苦瓜、蛇瓜、瓜叶栝楼和全缘栝楼的染色体核型图 a1, b1, c1, d1, e1, f1 and g1 are the FISH results of Citrullus lanatus, Gymnopetalum chinense, Lagenaria siceraria, Momordica charantia, Trichosanthes anguina, Trichosanthes cucumerina and Trichosanthes ovigera, respectively; a2, b2, c2, d2, e2, f2 and g2 are chromosomal nucleotypes of Citrullus lanatus, Gymnopetalum chinense, Lagenaria siceraria, Momordica charantia, Trichosanthes anguina, Trichosanthes cucumerina and Trichosanthes ovigera, respectively |
西瓜(图2a)检出2对45S rDNA信号,分别位于3、10号染色体短臂顶端;检出1对5S rDNA,位于10号染色体短臂顶端。10号染色体同时具有45S rDNA、5S rDNA荧光位点,均位于染色体短臂顶端。
金瓜(图2b)检出3对45S rDNA杂交信号,分别位于5、9、10号染色体上,且都分布在染色体短臂顶端;检出2对5S rDNA杂交信号,分别位于8、9号染色体,荧光位点分布在8号染色体的短臂和9号染色体短臂顶端。9号染色体短臂顶端同时具有45S rDNA、5S rDNA杂交信号。
葫芦(图2c)检出45S rDNA杂交信号2对,位于1、10号染色体短臂顶端;检出1对5S rDNA杂交信号,位于1号染色体短臂顶端。1号染色体短臂顶端同时具有45S rDNA、5S rDNA杂交信号。
苦瓜(图2d)检出45S rDNA杂交信号2对,位于8、9号染色体短臂顶端;检出5S rDNA杂交信号1对,位于11号染色体短臂。
蛇瓜(图2e)检出45S rDNA杂交信号3对,分别位于7、9、10号染色体短臂顶端;检出1对5S rDNA杂交信号,位于10号染色体短臂顶端。10号染色体短臂顶端同时具有45S rDNA、5S rDNA杂交信号。
瓜叶栝楼(图2f)检出5S rDNA信号1对,信号特别强烈,位于6号染色体短臂靠近着丝点处;未检出45S rDNA杂交信号,有待进一步试验检测。
全缘栝楼(图2g)检出45S rDNA杂交信号5对,分别位于6、8、9、10、11号染色体短臂顶端;检出5S rDNA杂交信号1对,位于10号染色体短臂顶端。10号染色体短臂顶端同时具有45S rDNA、5S rDNA杂交信号。
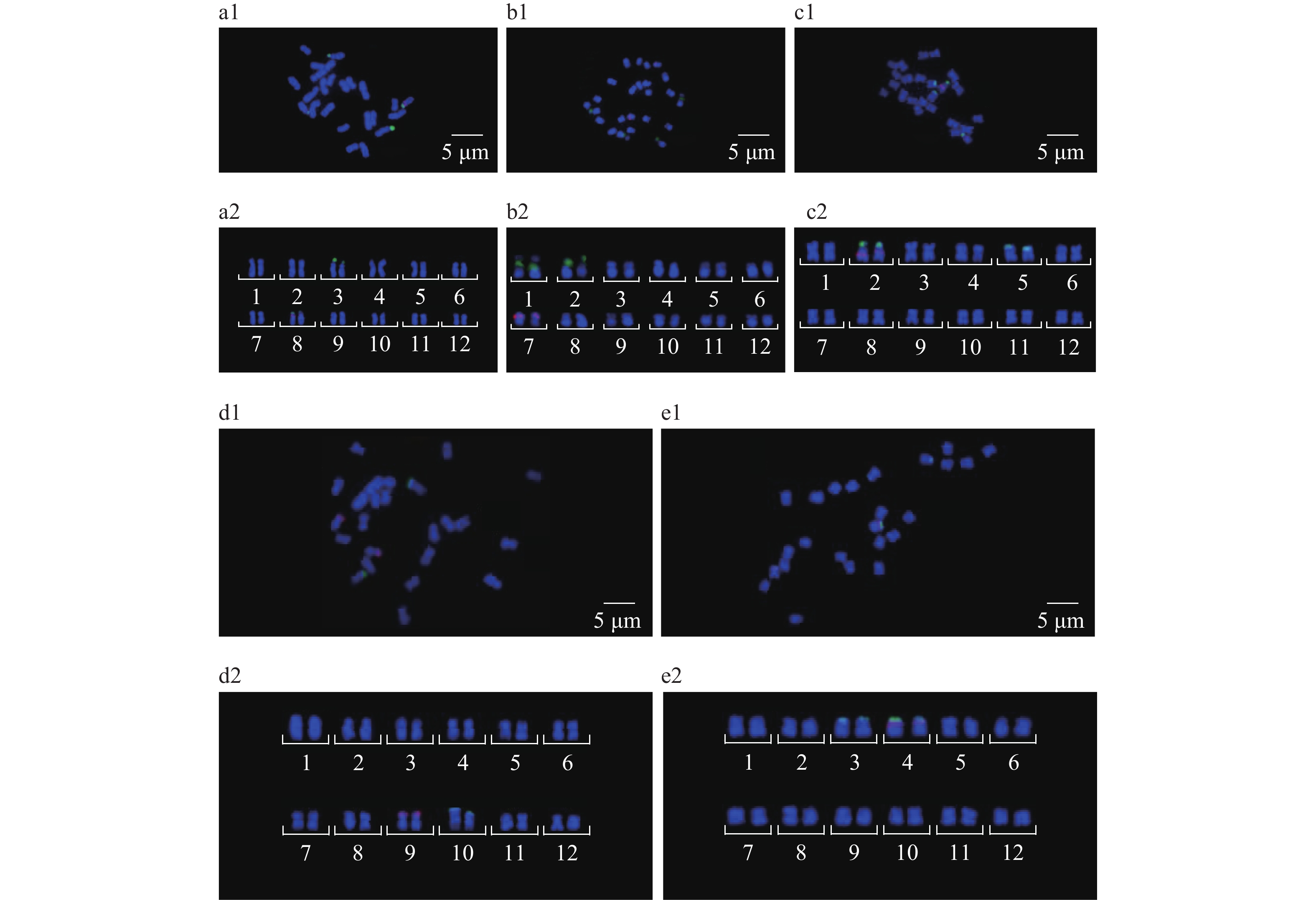
2.3.3 染色体基数为12的葫芦科植物由图3可知,冬瓜、甜瓜、云南木鳖、钮子瓜和红瓜的染色体数目均为24条,染色体基数为12。
|
图 3 染色体基数为12的4种葫芦科植物45S和5S rDNA荧光原位杂交结果 Fig. 3 45S and 5S rDNA FISH results of four Cucurbitaceae plants with the basic chromosome number of 12 a1、b1、c1、d1和e1分别为冬瓜、甜瓜、云南木鳖、钮子瓜和红瓜的荧光原位杂交结果;a2、b2、c2、d2和e2分别为冬瓜、甜瓜、云南木鳖、钮子瓜和红瓜的染色体核型图 a1, b1, c1, d1 and e1 are the FISH results of Benincasa hispida, Cucumis melo, Momordica dioica, Zehneria maysorensis and Coccinia grandis, respectively; a2, b2, c2, d2 and e2 are chromosomal nucleotypes of Benincasa hispida, Cucumis melo, Momordica dioica, Zehneria maysorensis and Coccinia grandis, respectively |
冬瓜(图3a)检出2对45S rDNA杂交信号,分别位于3号、8号染色体短臂顶端;检出1对5S rDNA信号,位于8号染色体短臂顶端。8号染色体短臂顶端同时具有45S rDNA、5S rDNA杂交信号。
甜瓜(图3b)检出45S rDNA杂交信号2对,位于1、2号染色体短臂顶端;检出1对5S rDNA信号,位于7号染色体短臂顶端。
云南木鳖(图3c)检出45S rDNA杂交信号2对,位于2、5号染色体短臂顶端;检出5S rDNA信号1对,位于2号染色体着丝点处。2号染色体同时具有45S rDNA和5S rDNA杂交信号。
钮子瓜(图3d)检出45SrDNA信号1对,位于10号染色体短臂顶端;检出5SrDNA信号1对,位于9号染色体短臂顶端。
红瓜(图3e)检出45S rDNA杂交信号2对,位于3、4号染色体短臂顶端;检出5S rDNA信号1对,位于4号染色体短臂顶端。4号染色体短臂顶端同时具有45S rDNA、5S rDNA杂交信号。
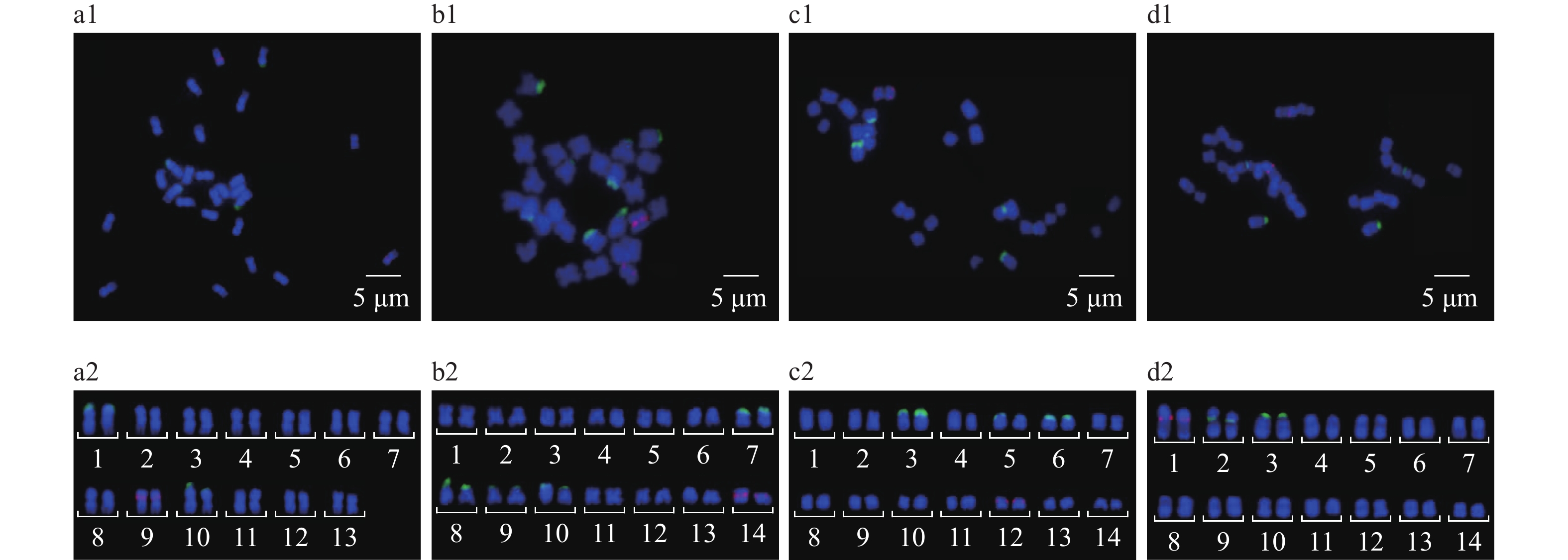
2.3.4 染色体基数为13或14的葫芦科植物由图4可知,丝瓜的染色体数目为26条,染色体基数为13。木鳖子、罗汉果和佛手瓜的染色体数目为28条,染色体基数为14。
|
图 4 染色体基数为13或14的4种葫芦科植物45S和5S rDNA荧光原位杂交结果 Fig. 4 45S and 5S rDNA FISH results of four Cucurbitaceae plants with the basic chromosome number of 13 or14 a1、b1、c1和d1丝瓜、木鳖子、罗汉果和佛手瓜的荧光原位杂交结果;a2、b2、c2和d2分别为丝瓜、木鳖子、罗汉果和佛手瓜的染色体核型图 a1, b1, c1 and d1 are the FISH results of Luffa cylindrica, Momordica cochinchinensis, Siraitia grosvenorii and Sechium edule, respectively; a2, b2, c2 and d2 are chromosomal nucleotypes of Luffa cylindrica, Momordica cochinchinensis, Siraitia grosvenorii and Sechium edule, respectively |
丝瓜(图4a)检出45S rDNA杂交信号2对,位于1、10号染色体短臂顶端;检出5S rDNA杂交信号1对,位于9号染色体短臂。
木鳖子(图4b)检出45S rDNA信号4对,分别位于7、8、9、10号染色体短臂顶端;检出5S rDNA染色体1对,位于14号染色体着丝点处。
罗汉果(图4c)检出45SrDNA信号3对,分别位于3、5、6号染色体短臂顶端;检出5S rDNA信号1对,位于12号染色体短臂。
佛手瓜(图4d)检出45S rDNA信号2对,分别位于2号染色体短臂和3号染色体短臂顶端;检出5S rDNA信号1对,位于1号染色体短臂。
3 讨论与结论冬瓜、西瓜、甜瓜、南瓜、丝瓜、苦瓜、罗汉果等7种植物45S rDNA和5S rDNA荧光原位杂交国内已有报道 [10-11]。试验结果表明,苦瓜检出2对45S rDNA信号2对,1对5S rDNA、罗汉果检出45S rDNA信号3对,5S rDNA信号1对,试验结果和李琦等 [10]报道的一致。冬瓜检出45S rDNA荧光信号2对,5S rDNA信号1对,与徐延浩等 [11]的研究结果一致。西瓜检出2对45S rDNA位点信号,1对5S rDNA位点信号,其中1对45S rDNA和1对5S rDNA位点位于同一对染色体上,试验结果与李琦等 [10]的报道不一致。李琦等[10]用45S rDNA和5S rDNA探针杂交西瓜,观察到2对45S rDNA信号,1对5S rDNA信号,但45S rDNA信号和5S rDNA信号不在同一对染色体上。甜瓜检出45S rDNA信号2对,5S rDNA信号1对;丝瓜检出45S rDNA信号2对,5S rDNA信号1对;南瓜检出45S rDNA信号4对,检出5S rDNA信号2对。试验结果和徐延浩等[11]报道的甜瓜有1对45S rDNA杂交信号、没有5S rDNA杂交信号;丝瓜有5对45S rDNA信号、1对5S rDNA信号;南瓜有5对45S rDNA信号、2对5S rDNA信号的结果不一致。试验结果的差异和试验材料的品种有关系,也与杂交过程的操作、rDNA在基因组中的大小有关系,有待于进一步试验验证。
瓜叶栝楼原位杂交试验检测到1对5S rDNA杂交信号,没有检测到45S rDNA杂交信号。由于瓜叶栝楼的种子很难再获得,尚未能再进行荧光原位杂交的重复试验。为进一步检验,作者以瓜叶栝楼基因组DNA为模板,通用引物为引物扩增瓜叶栝楼的ITS2序列并测序成功。ITS2是45SrDNA的内转录间隔区,是rDNA序列的一部分,ITS2的扩增成功说明45S rDNA是存在的。荧光原位杂交试验未能检测到45S rDNA杂交信号是因为试验操作导致试验结果的偏差。
在核型分析中,次缢痕、核仁组成区(Nucleolar organizer region,NOR)和随体的数目、位置、形态和大小常常是区分种的重要特征,但相对着丝点,次缢痕和随体的识别和判断更为困难。目前,大部分文献描述植物核型特征时,仍沿用随体一词表述端部NOR [15]。葫芦科植物多为中小染色体,染色体难以染色和识别。Chen等 [16]首先将45S rDNA定位在黄瓜染色体上,检测到4对信号,位于着丝粒处。徐延浩等[11]通过把45S rDNA和5S rDNA定位在染色体上,鉴定了南瓜、丝瓜、冬瓜的同源染色体,对这3种植物和黄瓜的亲缘关系也做了简单的推测,这是传统核型分析难以做到的。李琦等 [10]对西瓜、苦瓜和罗汉果做了类似的研究。本文研究20种葫芦科植物,其中冬瓜、西瓜、金瓜、葫芦、木鳖子、蛇瓜等6种植物在核型分析中观察到了随体(未发表)。而在本文中,除瓜叶栝楼外,19种植物观察到了45S rDNA荧光信号,准确地显示了NOR的位置,其中冬瓜、西瓜、甜瓜、金瓜、波棱瓜、葫芦、丝瓜、苦瓜、木鳖子、云南木鳖、蛇瓜、糙点栝楼、全缘栝楼、罗汉果、钮子瓜、佛手瓜等17种植物的染色体顶端有45S rDNA荧光信号,为随体染色体。可见,荧光原位杂交技术是研究中小染色体的有力工具,可为染色体的识别和分析提供稳定、特定的标记。染色体标记结合传统的核型分析技术,是细胞遗传学发展的新阶段,是构建分子核型的必要手段。
除瓜叶栝楼外,供试的19种葫芦科植物,45S rDNA在各基因组中数目的变化从1对到7对,荧光位点在染色体上的分布位置相对固定,大多数分布在染色体特别是短臂的端部。45S rDNA数目的变化已经在多种植物中被发现和证实,这种多态性的起因是多样的,包括染色体重排、不等交换、转座子引起的隐蔽rDNA拷贝数扩增等原因。45S rDNA参与构成NOR,NOR通常被认为是随体染色体的次缢痕。李懋学等[15]认为,绝大部分的植物随体,其实是端部的NOR,在植物中,次缢痕区即NOR,两者几乎可作为同义词,在核型分析时,使用次缢痕,讨论功能时,使用NOR。植物的随体,有着广泛的变异,这样的差异不仅存在于种间,也存在于种内,其大小、长短不一,有些难以辨认。因此光学显微镜观察并不能完全鉴别染色体有没有随体。45S rDNA杂交的结果,对于随体的判断、染色体的鉴别、同源染色体的鉴定,是有力的证据。FISH技术能识别核型分析观察不到的随体,明确标记出NOR,是构建植物精细核型的关键。
与45S rDNA相比,5S rDNA在基因组中的数目则相对稳定,20种葫芦科植物有1~2对5S rDNA,但其分布模式变化很大,从端部到近着丝点都有。Mantovani等[17]发现大部分已进行5S rDNA定位的植物中,数目以1对或2对为主,但在染色体上没有固定的分布模式。我们的研究结果与前人对5S rDNA的描述相符合。
随体染色体是植物分类进化的一个重要依据。染色体经过了漫长的进化,在内外压力下不断变化,随体数目越多,就意味着rDNA基因在基因组中经历了广泛的进化,从而发生了变化,其数目、大小、位置都有很高的多样性。45S rDNA和5S rDNA进化模式不一样,前者是数目大小的变化,后者更主要的是分布模式的变化。我们的试验进一步验证了这个观点。
rDNA在葫芦科植物上的定位可为构建葫芦科作物物理图谱、在细胞和分子水平对葫芦科进行系统研究提供依据。此外,研究结果为这20种植物的核型分析提供了稳定有效的标记,为构建精细核型以及进一步的遗传、基因组结构分析研究奠定了基础。
| [1] |
LALEV A I, NAZAR R N. Conserved core structure in the internal transcribed spacer 1 of the Schizosaccharomyces pombe precursor ribosomal RNA[J]. J Mol Bio, 1998, 284: 1341-1351. DOI:10.1006/jmbi.1998.2222 (  0) 0) |
| [2] |
PILLAY M, HILU K W. Chloroplast DNA restriction site analysis in the genus Bromus (Poaceae)
[J]. Amer J Bot, 1995, 83: 239-250. (  0) 0) |
| [3] |
FRELLO S, HESLOP-HARRISON J S. Chromosomal variation in Crocus vernus hill (Iridaceae) investigated by in situ hybridization of rDNA and a tandemly repeated sequence
[J]. Ann Bot, 2000, 86(2): 317-322. DOI:10.1006/anbo.2000.1189 (  0) 0) |
| [4] |
SANG Y, LIANG G H. Comparative physical mapping of the 18S-5. 8S-26S rDNA in three Sorghum species
[J]. Genome, 2000, 43(5): 22-28. (  0) 0) |
| [5] |
HAN Y H, LI L J, SONG Y C, et al. Physical mapping of the 5S and 45S rDNA in teosintes[J]. Hereditas, 2002, 137(1): 16-19. DOI:10.1034/j.1601-5223.2002.1370103.x (  0) 0) |
| [6] |
TAKETA S, ANDO H, TAKEDA K, et al. Ancestry of American polyploid Hordeum species with the I genome inferred from SS and 18S-25S rDNA
[J]. Ann Bot, 2005, 96(1): 23-33. DOI:10.1093/aob/mci147 (  0) 0) |
| [7] |
HASTEROK R, WOLNY E, HOSIAWA M, et al. Comparative analysis of rDNA distribution in chromosomes of various species of Brassicaceae[J]. Ann Bot, 2006, 97(4): 205-216. (  0) 0) |
| [8] |
龚志云, 吴信淦, 程祝宽, 等. 水稻45S rDNA和5S rDNA的染色体定位研究[J]. 遗传学报, 2002, 29(3): 241-244. (  0) 0) |
| [9] |
利容千. 中国蔬菜植物核型研究[M]. 武汉: 武汉大学出版社. 1989: 8-9, 97-100.
(  0) 0) |
| [10] |
李琦, 马璐, 黄婧, 等. 西瓜、苦瓜与罗汉果染色体的rDNA定位及其核型分析[J]. 武汉大学学报(理学版), 2007, 53(4): 449-456. DOI:10.3321/j.issn:1671-8836.2007.04.014 (  0) 0) |
| [11] |
徐延浩, 杨飞, 程有林, 等. 45S rDNA和5S rDNA在南瓜、丝瓜和冬瓜染色体上的比较定位[J]. 遗传, 2007, 29(5): 614-620. DOI:10.3760/j.issn:1003-9406.2007.05.054 (  0) 0) |
| [12] |
牛凯, 陈成彬, 刘慧静. rDNA序列在多种蔬果类植物染色体上的定位[J]. 南开大学学报(自然科学版), 2017, 50(5): 67-75. (  0) 0) |
| [13] |
中国科学院中国植物志编辑委员会. 中国植物志[M]. 北京: 科学出版社, 2004.
(  0) 0) |
| [14] |
陈瑞阳, 宋文芹, 李秀兰, 等. 植物有丝分裂染色体标木制作的新方法[J]. 植物学报, 1979, 21: 297-298. (  0) 0) |
| [15] |
李懋学, 张赞平. 作物染色体及其研究技术[M]. 北京: 中国农业出版社, 1996.
(  0) 0) |
| [16] |
CHEN J F, STAUB J E, ADELBERG J W, et al. Physical mapping of 45S rRNA genes in Cucumis species by fluorescence in situ hybridization
[J]. Canadian Journal of Botany, 1999, 77(3): 389-393. DOI:10.1139/b98-226 (  0) 0) |
| [17] |
MANTOVANI M, DOS L D, ABEL S, et al. Conserved 5S and variable 45S rDNA chromosomal localisation revealed by FISH in Astyanax scabripinnis (Pisces, Characidae)
[J]. Genetica, 2005, 123(3): 211-216. DOI:10.1007/s10709-004-2281-3 (  0) 0) |
 2019, Vol. 40
2019, Vol. 40


