2. 华南农业大学 农学院/广东省微生物信号与作物病害防控重点实验室,广东 广州 510642
2. College of Agriculture, South China Agricultural University/ Guangdong Province Key Laboratory of Microbial Signals & Disease Control, Guangzhou 510642, China
由荔枝霜疫霉Peronophythora litchii引起的霜疫病是荔枝的一种重要病害,可严重影响荔枝的生产和采后保鲜。在田间自然环境中,该病原菌主要以孢子囊和游动孢子的形式经流水和液滴飞溅传播,以卵孢子的形式在土壤和落果上越冬[1]。防治霜疫病以使用化学药剂为主[2-3]。但化学药剂的大量使用不仅污染环境,还会导致病原菌产生抗药性,因此急需开发环境友好型杀菌剂。
荔枝多酚作为荔枝体内重要的次生代谢产物,广泛存在于荔枝叶片、果皮和果核中,其不但具有降糖、抗癌、抗氧化等活性[4-5],还具有抗细菌和抗病毒活性,例如木犀草素(Luteolin,荔枝叶片多酚类物质)对金黄色葡萄球菌Staphylococcus aureus、大肠埃希菌Escherichia coli、痢疾志贺氏菌Shigella dysenteriae等具有很强的抑制作用[6];原花青素A(A-type proanthocyanidins,荔枝种子多酚类物质)在体外具有抗单纯疱疹病毒(Herpes simplex virus-1)和柯萨奇病毒(Coxsackie virus B3)的活性[7]。荔枝多酚抗植物病原菌活性鲜有报道。植物多酚具有很强的抗真菌活性,Wang等[8]报道甜樱桃多酚类物质可以抑制链格孢Alternaria alternata生长和交链孢菌酮酸的积累;Xu等[9]研究了18种合成或天然酚类物质对货架期葡萄灰霉病的控制作用,表明紫檀芪和白皮杉醇能显著减轻灰霉病害发生的严重程度。关于荔枝多酚对荔枝霜疫霉及霜疫病的作用效果鲜见报道。本文通过纯培养条件研究荔枝多酚对霜疫霉生长、产孢、孢子萌发、卵孢子产生等方面的影响,以期为荔枝霜疫病的发生流行和开发荔枝多酚类生物源杀菌剂研究奠定理论基础。
1 材料和方法 1.1 供试菌株荔枝霜疫霉菌株(编号SHS3)为华南农业大学农学院植物病理学系真菌研究室分离、鉴定和保存。
1.2 荔枝果皮多酚的抽提及含量测定 1.2.1 多酚物质的抽提参考王敏等[10]的方法并略加改进,取黑叶荔枝的果皮,用粉碎机研磨粉碎后置于干燥器中保存。称取荔枝果皮粉末0.2 g,加入70%(φ)的乙醇溶液15 mL及少许CaCO3,浸提24 h,在45 ℃下超声波(700 W)提取15 min,5 000 r·min−1离心10 min,再加入5 mL 70%(φ)乙醇溶液提取2次,合并浸提液,将浸提液真空浓缩,除去乙醇备用。
1.2.2 多酚含量的测定多酚含量的测定采用福林−酚比色法[11]。精密称取没食子酸标准品(美国sigma公司)0.1 g,用去离子水定容至100 mL。将此溶液稀释成质量浓度为500.000、250.000、125.000、62.500、31.250、15.625 μg·mL−1的溶液,各质量浓度梯度的溶液分别取20 μL于5 mL试管中,加入1.8 mL 2 mol·L−1的福林−酚试剂(购自Fluka公司),放置5 min后加入1.2 mL 15%(w) Na2CO3溶液,在40 ℃烘箱中保温30 min后,测定D760 nm,绘制标准曲线,并进行线性回归分析。
取果皮浸提液20 μL按上述同样的步骤和方法测定浸提液的D760 nm,进而求出抽提得到的多酚总含量。
1.3 荔枝多酚对荔枝霜疫霉的影响 1.3.1 对菌落生长形态的影响方法参考文献[12],荔枝霜疫霉于25 ℃条件下PDA培养基培养7 d后,用打孔器获取直径为5 mm的菌饼置于含有不同质量浓度荔枝多酚(0、10、50、100、150、200、250、300 μg·mL−1)的PDA平板上,于25 ℃条件下培养7 d后,拍照记录霜疫霉菌落生长状态。试验重复3次。
1.3.2 对生长量的影响方法参考文献[13],荔枝霜疫霉于25 ℃条件下PDA培养基培养7 d后,用打孔器获取直径一致的菌饼(d = 5 mm),接种于含有100 mL PD培养基的250 mL三角瓶中,PD培养基中荔枝多酚的终质量浓度分别为0、10、50、100、150、200、250和300 μg·mL−1。每个锥形瓶中接入3个菌饼,置于28 ℃条件下,200 r·min−1培养5 d后,使用真空抽滤的方法收集菌丝和孢子,80 ℃烘箱中烘干至恒质量,以只接相同大小的空白PDA培养基作为对照,将每个处理的质量减去对照的质量即可计算菌丝的生长量。每个处理设置3次重复。
1.3.3 对孢子囊产量的影响方法参考文献[14],将荔枝霜疫霉在PDA培养基上培养7 d后,切取生长直径一致的菌落,用无菌水冲洗孢子囊并配制成5×104 mL−1的悬浮液。吸取100 μL的孢子囊悬浮液分别涂布在含有多酚质量浓度为10、50、100、150、200、250、300 μg·mL−1的PDA平板上,以空白PDA为对照,每个处理设置3次重复。将所有的处理置于25 ℃条件下分别培养2、4、6 d后,于每个培养皿的5个不同点各取菌碟5块,无菌水冲洗后测定单位面积孢子囊的数量。
1.3.4 对孢子囊形态和萌发方式的影响将“1.3.3”不同处理培养得到的霜疫霉配制成浓度为104 mL−1的孢子囊悬浮液,分别吸取30 μL不同处理的孢子囊悬浮液于凹玻片上,25 ℃条件下黑暗培养2 h后,在显微镜下观察孢子囊的形态和萌发,每个处理设置3次重复,每次重复选取50个孢子囊测定大小,计数100个孢子囊测定萌发率。
1.3.5 对孢子囊萌发的影响将荔枝霜疫霉在胡萝卜培养基上培养7 d后,切取生长直径一致的菌落,用无菌水冲洗后配制成5×104 mL−1的孢子囊悬浮液。分别在水琼脂平板上加入荔枝多酚化合物使其终质量浓度分别达到10、50、100、150、200、250、300 μg·mL−1,然后取200 μL孢子囊悬浮液分别涂布在含不同浓度多酚的平板上,以不加多酚为对照。参照Kao等[15]和Neufeld等[16]方法,将处理后的平板在16 ℃条件下放置30 min,然后在25 ℃条件下放置2 h后加入2 μL 12%(w) CuSO4溶液固定,观察孢子囊的萌发,统计萌发率。每个处理设置3次重复,每次重复计数100个孢子囊。
1.3.6 对游动孢子萌发的影响参考Pauline等[17]方法,将荔枝霜疫霉在胡萝卜培养基中于25 ℃条件下培养7 d后,用无菌水迅速配成浓度为104 mL−1的孢子囊悬浮液,置于16 ℃黑暗培养2 h后用孔径为20 μm的滤膜过滤混合液,即可除去孢子囊,配制得到游动孢子悬浮液,将得到的悬浮液在振荡器震荡30 s。
分别在水琼脂平板上加入荔枝多酚化合物使其终质量浓度分别达到10、50、100、150、200、250、300 μg·mL−1,取200 μL配制得到的游动孢子悬浮液分别涂布在含不同浓度多酚的平板上,以不加多酚为对照。将处理的平板在25 ℃下放置2 h后统计游动孢子的萌发,每个处理设置3次重复,每次重复计数100个游动孢子。
1.3.7 对卵孢子产量的影响参照Flier等[18]方法,将荔枝霜疫霉菌饼接种在含有多酚质量浓度分别为10、50、100、150、200、250、300 μg·mL−1的PDA平板中央,25 ℃条件下黑暗培养25 d后,在离接种点10 mm的区域内随机切取2块10 mm×10 mm的菌丝块,置于10 mL离心管中,加入3 mL去离子水,用高速匀浆机(6 000 r·min−1)匀浆2 min,吸取50 μL匀浆液,在显微镜下记录其中的卵孢子数量,从而求得每平方毫米卵孢子数量。每个处理设置3次重复。
2 结果与分析 2.1 没食子酸标准曲线的绘制及荔枝多酚质量浓度的确定通过测定不同质量浓度没食子酸的D760 nm,得到没食子酸标准曲线图,其线性方程为y = 0.000 8 x + 0.143 4,R2 = 0.999 2>0.95,D760 nm与对应的质量浓度呈线性关系。根据测得的标准曲线和荔枝多酚的D760 nm求出分离得到的荔枝多酚质量浓度,并在此基础上配制不同质量浓度的荔枝多酚溶液。
2.2 荔枝多酚对荔枝霜疫霉菌落形态的影响多酚的不同质量浓度影响荔枝霜疫霉的菌落形态。多酚质量浓度较低时,霜疫霉菌落的气生菌丝为绒状;多酚质量浓度为300 μg·mL−1时,气生菌丝为毡状,菌落致密,平铺在平板表面(图1)。
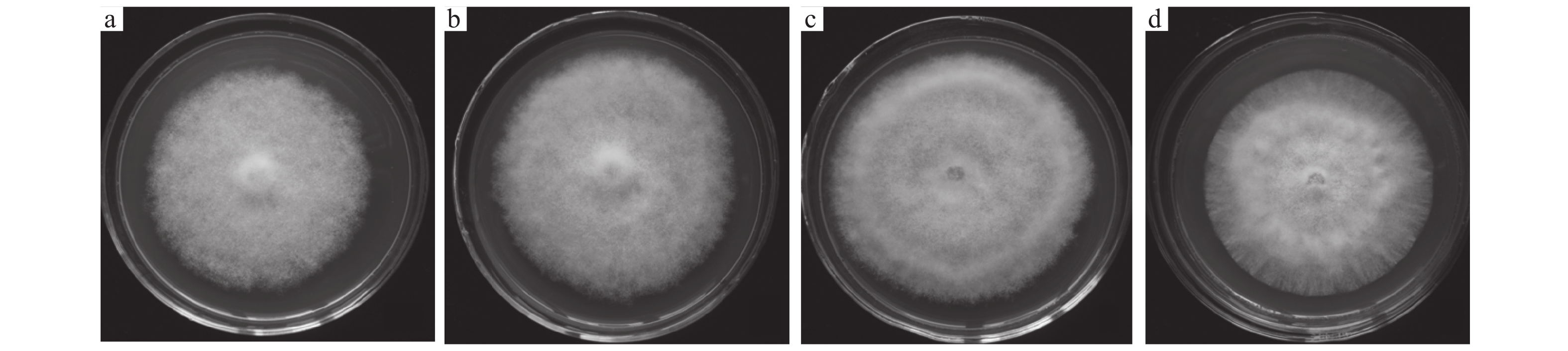
|
图 1 荔枝霜疫霉在不同质量浓度荔枝多酚的PDA平板上的菌落形态 Fig. 1 Colony morphologies of Peronophythora litchii cultured on PDA plates at different concentrations of litchi polyphenols a:0(CK);b:50 μg·mL−1;c:200 μg·mL−1;d:300 μg·mL−1 |
不同质量浓度的荔枝多酚能够显著影响霜疫霉的生长量。如图2所示,低质量浓度的多酚对荔枝霜疫霉的生长量有显著促进作用,多酚质量浓度为50 μg·mL−1时,霜疫霉的生长量最大,菌丝干质量达到0.53 g;荔枝多酚质量浓度为150~300 μg·mL−1时,霜疫霉的生长量无显著差异,但显著低于对照。
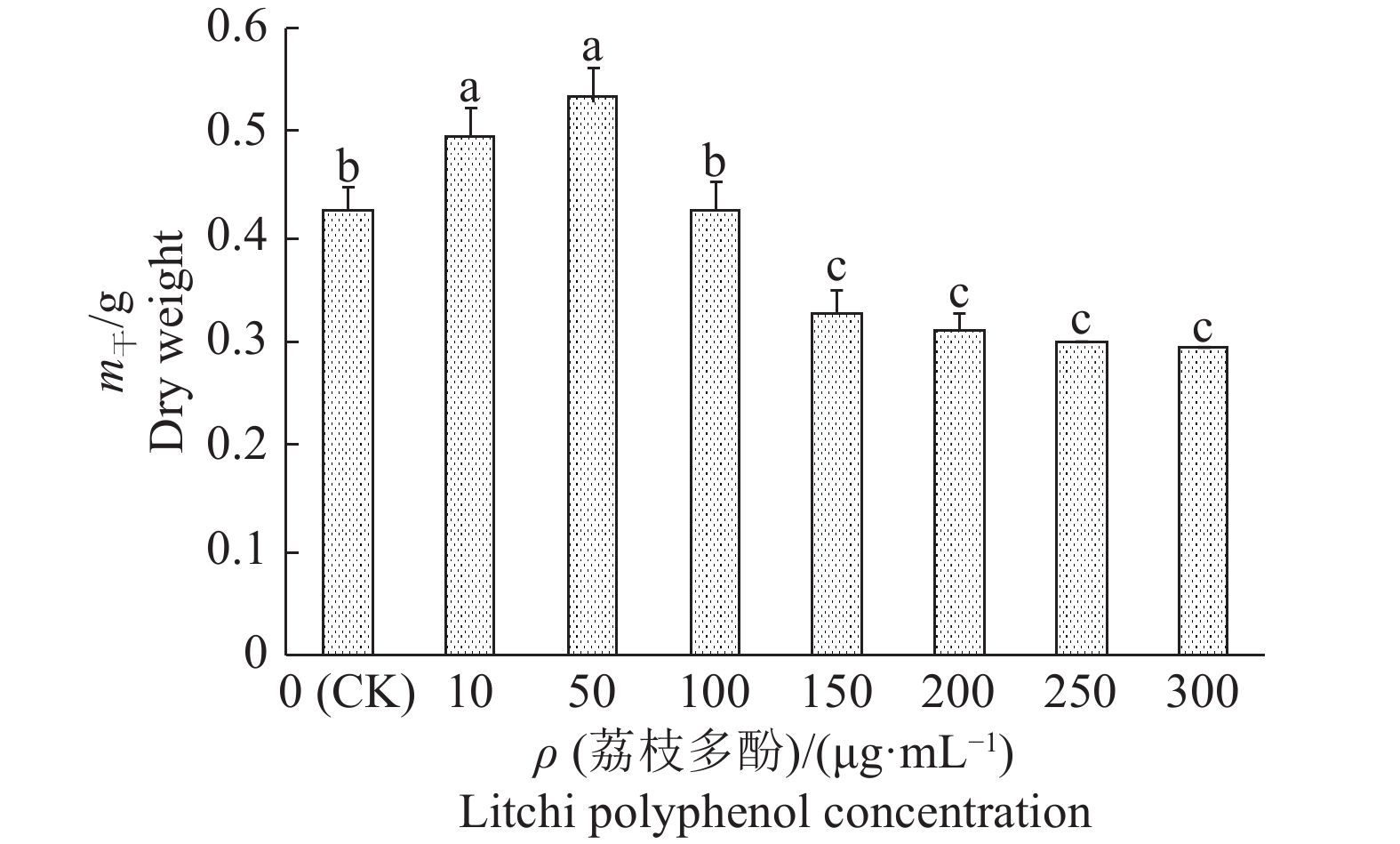
|
图 2 不同质量浓度的荔枝多酚对荔枝霜疫霉菌丝干质量的影响 Fig. 2 Effects of different litchi polyphenol concentrations on dry weight of Peronophythora litchii 图中柱子上方不同小写字母者,表示差异显著(P<0.05,Duncan’ s法) Columns with different lowercase letters indicate significantly different (P<0.05,Duncan’ s method) |
荔枝多酚抑制霜疫霉孢子囊的产量,由表1可知,随着荔枝多酚质量浓度的提高,霜疫霉孢子囊的产量呈下降趋势。培养6 d时,对照的孢子囊产量最多,当荔枝多酚质量浓度增大为250 μg·mL−1时,孢子囊产量下降了89.6%,仅为28.0 mm−2。
|
|
表 1 荔枝多酚对霜疫霉孢子囊产量的影响1) Table 1 Effects of litchi polyphenols on sporangia production of Peronophythora litchii |
荔枝多酚影响霜疫霉孢子囊的萌发方式和大小。当荔枝多酚的质量浓度不大于100 μg·mL−1时,孢子囊只以产生芽管的方式萌发,当多酚质量浓度为150 μg·mL−1时,有1.9%的孢子囊以释放游动孢子的方式萌发,且随着多酚质量浓度的增加,孢子囊释放游动孢子的萌发方式所占的比例逐渐加大(表2)。随着多酚质量浓度的增加,孢子囊变长,多酚为300 μg·mL−1时,孢子囊为38.6 μm ×21.6 μm,明显长于对照孢子囊。
|
|
表 2 荔枝多酚对霜疫霉孢子囊萌发方式及大小的影响1) Table 2 Effects of litchi polyphenols on sporangia germination mode and size of Peronophythora litchi |
荔枝多酚质量浓度为10~50 μg·mL−1时促进孢子囊萌发,之后多酚质量浓度的增加抑制霜疫霉孢子囊萌发,当多酚质量浓度为300 μg·mL−1时,孢子囊萌发率降低了19.2%(图3A)。荔枝多酚质量浓度为0~300 μg·mL−1时,显著促进游动孢子萌发(图3B)。

|
图 3 荔枝多酚对霜疫霉孢子囊和游动孢子萌发的影响 Fig. 3 Effects of litchi polyphenols on germination of sporangia and zoospores of Peronophythora litchii 图中柱子上方不同小写字母者,表示差异显著(P<0.05,Duncan’ s法) Columns with different lowercase letters are significantly different (P<0.05,Duncan’ s method) |
在PDA培养基中加入荔枝多酚后,可显著提高荔枝霜疫霉卵孢子产量。在无荔枝多酚的PDA培养基上,培养荔枝霜疫霉2~4周未见卵孢子产生,而在培养基中加入100 μg·mL−1的荔枝多酚,培养1周后可见大量卵孢子产生,最多可达10.8 mm−2,继而随着多酚质量浓度的提高,卵孢子的产量逐渐降低至稳定水平(图4)。
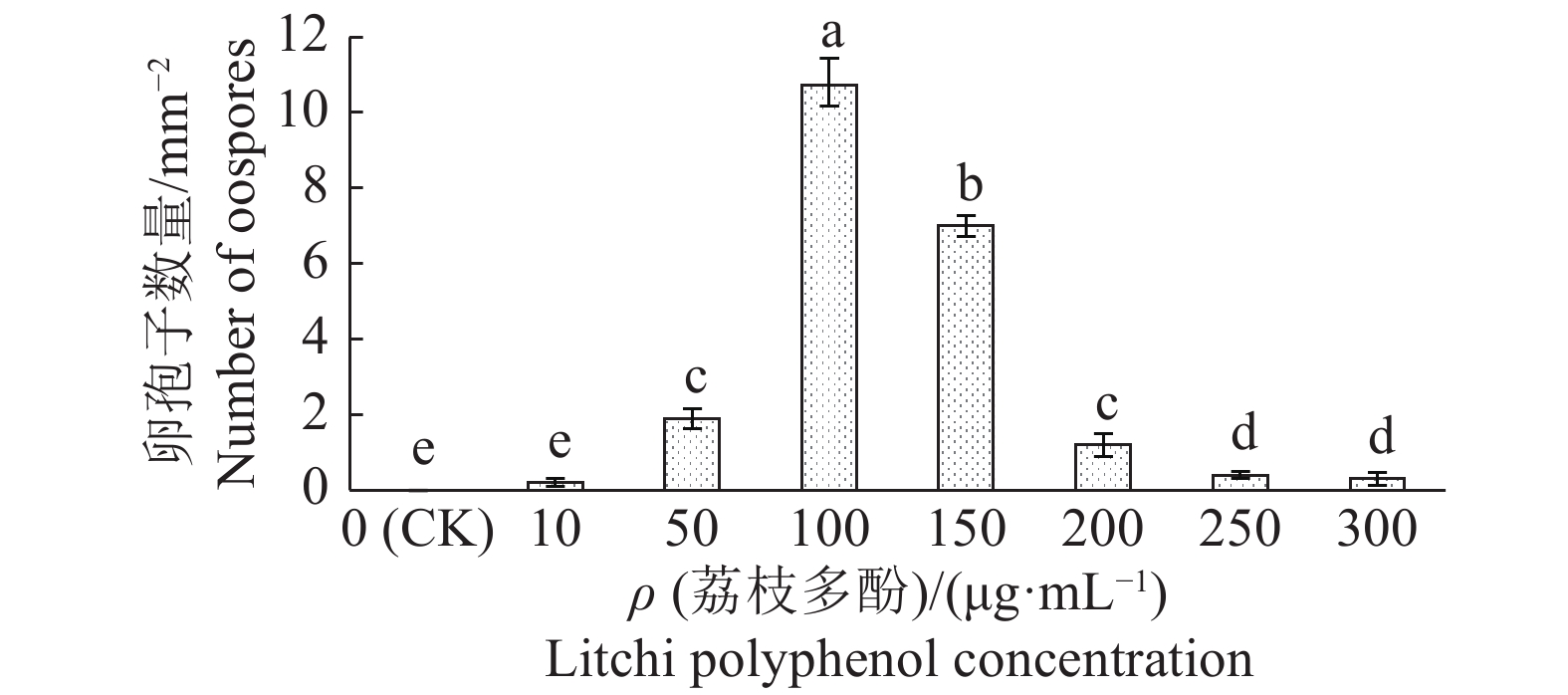
|
图 4 荔枝多酚对荔枝霜疫霉卵孢子产量的影响 Fig. 4 Effect of litchi polyphenols on oospore number of Peronophythora litchii 图中柱子上方不同小写字母者,表示差异显著(P<0.05,Duncan’ s法) Columns with different lowercase letters are significantly different (P<0.05,Duncan’ s method) |
多酚作为植保素的重要组成成分,广泛存在于各种植物体内,对多种病原微生物的活性均有显著的影响[19-20]。本文利用溶剂浸提法,从果皮中提取荔枝多酚类物质,当其质量浓度大于150 μg·mL−1时可明显抑制霜疫霉的生长、孢子囊萌发;孢子囊的产量随着荔枝多酚质量浓度的升高明显减少。此结果说明荔枝多酚类物质具有抑制霜疫霉生长和产生孢子囊的活性,表明其具有开发新型安全性生物源杀菌剂的潜力,但具体是哪一种酚起主要作用有待于进一步研究。
荔枝多酚类物质可参与荔枝霜疫霉生长发育的调控。研究表明当荔枝多酚质量浓度大于150 μg·mL−1时,孢子囊开始以释放游动孢子的形式萌发,而且随着多酚质量浓度增加,游动孢子的萌发率亦增加;荔枝霜疫霉在含有荔枝多酚的PDA培养基上产生大量卵孢子,而在PDA培养基上不易产生卵孢子。据此推测荔枝霜疫霉在长期的进化中,因为不断适应环境和寄主,一方面荔枝多酚类物质可导致孢子囊数量的减少并抑制其萌发,但可通过促进游动孢子的产生和萌发来弥补孢子囊作为侵染源数量上的损失;另一方面霜疫霉利用荔枝多酚类物质产生卵孢子,并以此度过不良环境条件而使之成为次年的初侵染源。由此可见,荔枝多酚类物质对霜疫病的发生和流行起到一定的抑制作用。
| [1] |
张荣. 荔枝霜疫霉侵染过程研究及农业措施控制作用初探[D]. 广州: 华南农业大学, 2012: 25.
(  0) 0) |
| [2] |
李堃娟, 黄远峰, 叶建春, 等. 五种杀菌剂防治荔枝霜疫病的田间药效试验[J]. 广西农学报, 2013, 28(2): 12-13. DOI:10.3969/j.issn.1003-4374.2013.02.004 (  0) 0) |
| [3] |
易赛, 潘汝谦, 徐大高, 等. 荔枝霜疫霉菌对烯酰吗啉的敏感性测定[J]. 广东农业科学, 2014, 41(2): 87-91. DOI:10.3969/j.issn.1004-874X.2014.02.022 (  0) 0) |
| [4] |
MA Q, XIE H, JIANG Y, et al. Phenolics and sesquiterpenes from litchi pericarp[J]. J Funct Foods, 2014, 9: 156-161. DOI:10.1016/j.jff.2014.04.020 (  0) 0) |
| [5] |
IARAHIM S R M, MOHAMED G A. Litchi chinensis: Medicinal uses, phytochemistry, and pharmacology
[J]. J Ethnopharmacol, 2015, 174: 492-513. DOI:10.1016/j.jep.2015.08.054 (  0) 0) |
| [6] |
WEN L, WU D, JIANG Y, et al. Identification of flavonoids in litchi (Litchi chinensis Sonn.) leaf and evaluation of anticancer activities
[J]. J Funct Foods, 2014, 6: 555-563. DOI:10.1016/j.jff.2013.11.022 (  0) 0) |
| [7] |
XU X, XIE H, WANG Y, et al. A-type proanthocyanidins from lychee seeds and their antioxidant and antiviral activities[J]. J Agric Food Chem, 2010, 58: 11667-11672. DOI:10.1021/jf1033202 (  0) 0) |
| [8] |
WANG M, JIANG N, WANG Y, et al. Characterization of phenolic compounds from early and late ripening sweet cherries and their antioxidant and antifungal activities[J]. J Agric Food Chem, 2017, 65: 5413-5420. DOI:10.1021/acs.jafc.7b01409 (  0) 0) |
| [9] |
XU D, DENG Y, HAN T, et al. In vitro and in vivo effectiveness of phenolic compounds for the control of postharvest gray mold of table grapes[J]. Postharvest Biol Tec, 2018, 139: 106-114. DOI:10.1016/j.postharvbio.2017.08.019 (  0) 0) |
| [10] |
王敏, 陈磊, 黄雪松. 荔枝中多酚含量的测定[J]. 食品与发酵工业, 2010, 36(2): 172-175. (  0) 0) |
| [11] |
SINGLETON V L, ROSSI J A. Colorimetry of total phenolics with phosphomolybdic phosphotungstic acid reagents[J]. Am J Enol Viticult, 1965, 16: 144-158. (  0) 0) |
| [12] |
曾勇, 罗建军, 丘麒, 等. 23种植物提取物对荔枝霜疫霉病菌的抑菌活性[J]. 华中农业大学学报, 2007, 26(6): 780-784. DOI:10.3321/j.issn:1000-2421.2007.06.006 (  0) 0) |
| [13] |
方中达. 植病研究方法[M]. 北京: 中国农业出版社, 1998: 40-41.
(  0) 0) |
| [14] |
KO W H, CHASE L L, KUNIMOTO R K. A microsyringe method for determining concentration of fungal propagules[J]. Phytopathol, 1973, 63: 1206-1207. DOI:10.1094/Phyto-63-1206 (  0) 0) |
| [15] |
KAO W H, LEU L S. Sporangium germination of Peronophythora litchii, the causal organism of litchi downy blight
[J]. Mycologia, 1980, 72(4): 737-748. DOI:10.1080/00275514.1980.12021242 (  0) 0) |
| [16] |
NEUFELD K N, OJIAMBO P S. Interactive effects of temperature and leaf wetness duration on sporangia germination and infection of cucurbit hosts by Pseudoperonospora cubensis
[J]. Plant Dis, 2012, 96(3): 345-353. DOI:10.1094/PDIS-07-11-0560 (  0) 0) |
| [17] |
PAULINE B, GRANT B R. Some conditions governing zoospore production in axenic cultures of Phytophthora cinnamomi Rands
[J]. Aust J Bot, 1979, 27(2): 103-115. DOI:10.1071/BT9790103 (  0) 0) |
| [18] |
FLIER W G, GRÜNWALD N J, FRY W E, et al. Formation, production and viability of oospores of Phytophthora infestans from potato and Solanum demissum in the Toluca Valley, central Mexico
[J]. Mycol Res, 2001, 105(8): 998-1006. DOI:10.1016/S0953-7562(08)61958-9 (  0) 0) |
| [19] |
黄谦. 蓝药睡莲(Nymphaea stellata Willd)多酚活性研究及遗传毒性评价[D]. 成都: 四川师范大学, 2009.
(  0) 0) |
| [20] |
LAMBERT C, BISSO J, WAFFO-TEGUO P, et al. Phenolics and their antifungal role in grapevine wood decay: Focus on the Botryosphaeriaceae family[J]. J Agric Food Chem, 2012, 60: 11859-11868. DOI:10.1021/jf303290g (  0) 0) |
 2019, Vol. 40
2019, Vol. 40


