2. 中南林业科技大学 林学院,湖南 长沙 410000;
3. 广东省林业调查规划院,广东 广州 510520
2. College of Forestry, Central South University of Forestry and Technology, Changsha 410000, China;
3. Guangdong Forestry Survey and Planning Institute, Guangzhou 510520, China
无瓣海桑Sonneratia apetala群落具有显著的高生物量与能量积累和归还量特性,其生产力水平处于我国红树林群落中的较高位置,利用太阳能形成生物量的水平较高。我国华南沿海滩涂大多数为淹浸较深、风浪较大的恶劣前沿海滩,对裸滩宜林地选择无瓣海桑进行红树林生态恢复造林较为适宜,该物种成林快,具有景观和防护等生态效益明显的特点[1]。1985年中国红树林考察团把无瓣海桑从孟加拉国引入海南省东寨港种植,1996年引入粤西沿海的廉江市和广东深圳湾,1998年开始引入粤东及其他地方[2]。根据调查发现,从广东最北的潮汕地区到中部的深圳、珠海,再到南部的湛江地区,外来种无瓣海桑均能正常生长,而且比较速生,已成为广东省红树林主要造林树种之一。无瓣海桑在10个调查区域均有分布,是广东沿岸最常见红树林树种 [3]。
近年来,对无瓣海桑的研究主要在小区域内进行,且研究重点各不相同,包括人工林下土壤微生物群落研究[4]、底栖动物群落演替[5]、群落特征研究[6-7]、吸附重金属能力的比较[8-9]、根际微生物特征[10]、幼苗种群更新特征[11]、消波效应的研究[12],以及对湛江、深圳、广州南沙无瓣海桑生物量的局部调查[13-15],尚缺乏对广东全省范围内无瓣海桑总体生物量的研究。无瓣海桑作为外来树种在广东已有较大面积的造林推广,从固碳角度该树种发挥了哪些作用尚不明确,效果如何仍值得探讨。本文通过对广东省不同地区无瓣海桑生物量及其分配规律的研究,构建适用于广东省范围内无瓣海桑人工林的生物量估算模型,通过生物量信息得到各地区生物碳储量,结合各地区土壤碳储量,估算各地区无瓣海桑林碳储量,为开展广东省红树林生物量为基础的碳汇调查与监测提供基础数据,也为开展全国红树林碳汇监测提供经验和方法。
1 材料与方法 1.1 研究地概况广东是我国海岸线最长的省份,大陆海岸线长4 114 km,岛屿海岸线长1 649 km,其中适宜红树林生长的滩涂岸线约494 km;全省现有湿地面积175.34万hm2,约占全省国土面积的9.8%,其中近海与海岸湿地面积共81.51万hm2,占全国湿地总面积的46.5%,分布于沿海14个地级市[16]。广东省红树林在我国分布最广、面积最大,红树林分布西至廉江市高桥镇、南至徐闻县五里(20°15′N)、北至饶平县海山(23°40′N),湛江的廉江市、遂溪、徐闻、雷州、湛江市区,茂名电白县,阳江市阳西,江门恩平、台山、新会,珠海市淇澳岛,东莞市太平、长安,深圳市福田、宝安区,惠州惠东县,汕尾海丰,汕头市区、饶平、南澳县等地均有红树林成片分布[17]。
1.2 研究方法 1.2.1 样地设置与群落调查于2014—2015年,对广东省10个地区(潮州、广州、惠州、江门、茂名、汕头、深圳、湛江、中山、珠海)的无瓣海桑人工林固定样地(14个大样地包含共计44个10 m×10 m小样地)进行群落结构调查,调查方法严格按照文献[18]进行。用每木检尺法测定每个样方中所有植株的胸径、树高,包括枯立木和倒木,并在备注中标明枯死程度(叶和枝剩余程度);测定所有活木和死木、倒木的胸径(D)(或地径)和树高(H),用于估算不同地区无瓣海桑人工林的生物量,计算林分密度,并向相关人员咨询年龄信息。标准木信息见表1。
|
|
表 1 无瓣海桑标准木信息表 Table 1 Information table of Sonneratia apetala standard trees |
于2014—2015年,对广东省8个地区(潮州、广州、惠州、茂名、汕头、湛江、中山、珠海)的典型无瓣海桑人工林的立木进行每木检尺,求出平均胸径和平均树高。根据每木调查结果,按径阶(2 cm)选取25株标准木伐倒,地上部生物量参照“分层切割法”测定。以2 m为区分段进行分层切割,群落地上部生物量从标准木各组分的生物量比例和样方林木测定数据进行推算,分别以树干材、树干皮、枝、叶等各组分计量。地下部生物量分大根(d≥2.0 cm,包括根蔸)、中根(0.2 cm≤d<2.0 cm)和细根(d<0.2 cm)计量,每个样地内测定2个1 m× 1 m小样方内地上呼吸根量。各样品于60 ℃条件下烘干,将分析样研磨、装瓶、待测,另抽小样于85 ℃条件下烘至恒质量,求算干质量和含水量,以换算生物量,构建无瓣海桑生物量异速生长方程。
自从Kittredge用胸径估计树木的叶量以来,相关生长关系在定量生态学中得到了普遍应用。式(1)的相关干系生物量与生长中的树高和胸径或整个树体生物量与其他部分之间,一般是吻合的。用这种关系,对各种大小林木能间接换算为单位土地面积上的生物量。因此,测定无瓣海桑纯林时,可采用相关生长关系建立起无瓣海桑各器官之间的回归方程。
| $ W = a{\left( {{D^2}H} \right)^b}, $ | (1) |
式中,W为生物量,D为1.3 m处植株胸径,H为树高,a、b为模型参数。
为了检验模型的精确度,本研究采用以下5个统计指标对模型进行精度评价:平均误差(Mean error, ME)、平均绝对误差(Mean absolute error, MAE)、总相对误差(Total relative error, TRE)、平均系统误差(Mean systematic error, MSE)和平均百分标准误差(Mean percent standard error, MPSE) [19-22]。
1.2.3 土壤取样与分析土壤中的碳主要集中在1 m 深土层,1 m 以下土层含碳量低且随土层加深而不断下降[23],因此土壤样品取 1 m 深土层。各样地内,随机选择2 个地点,用土钻钻取2 个深达1 m 的土柱,按 0~30、30~60、60~100 cm 高度分为 3层,分别测量各层鲜质量,然后将2个土柱相同土层的土壤混匀,每层取 2 组土壤样品(每组 2 份),分别用于土壤容重、有机碳含量测定。土壤容重采用环刀法测定,土壤有机碳含量利用 EA3000 CHNS/O 元素分析仪测定。
1.2.4 无瓣海桑林总碳储量计算单木生物量采用异速生长方程估算,样地生物量为样地单木生物量之和。分别计算样方内每棵树木的地上和地下生物量,累加样方内所有树木的地上和地下生物量得到植物生物量,再乘上不同树种的植物碳含量,计算得到植物碳储量,植物碳含量用元素分析仪测得。由于强烈的潮汐作用,无瓣海桑林下的枯枝落叶残留量极少,对总碳储量的研究影响极小,故不计算入总碳储量内。无瓣海桑林下自然更新困难,天然更新的灌草本植物较少,生物量极小,可视为树种单一林分。土壤碳密度计算方法为有机碳含量、容重和土壤厚度之积,土壤碳储量即土壤碳密度与面积之积。红树林总碳储量即为植物总碳储量与土壤碳储量之和,其中植物总碳储量包括地上、地下生物量碳储量。
1.3 数据处理运用Excel软件进行数据处理和作图,应用SPSS 20.0软件进行数据分析,其中,不同地区不同土层有机碳含量、土壤容重差异性采用单因素方差分析(One-way ANOVA)和Duncan’ s多重比较分析。
2 结果与分析 2.1 无瓣海桑分布情况及群落调查结果研究采用遥感区划(图1)与现场样地调查相结合的方式,即在室内根据遥感影像进行判读区划的基础上,进一步通过外业调查确定每一红树林地块的范围。根据调查,广东省现有红树林面积为12 039.80 hm2,其中无瓣海桑林的面积为1 724.12 hm2,占广东省红树林总面积的14.32%,主要分布在珠江口地区,粤东地区较少,具体分布位置为潮州、广州、惠州、江门、茂名、汕头、深圳、湛江、中山、珠海共10个地区。
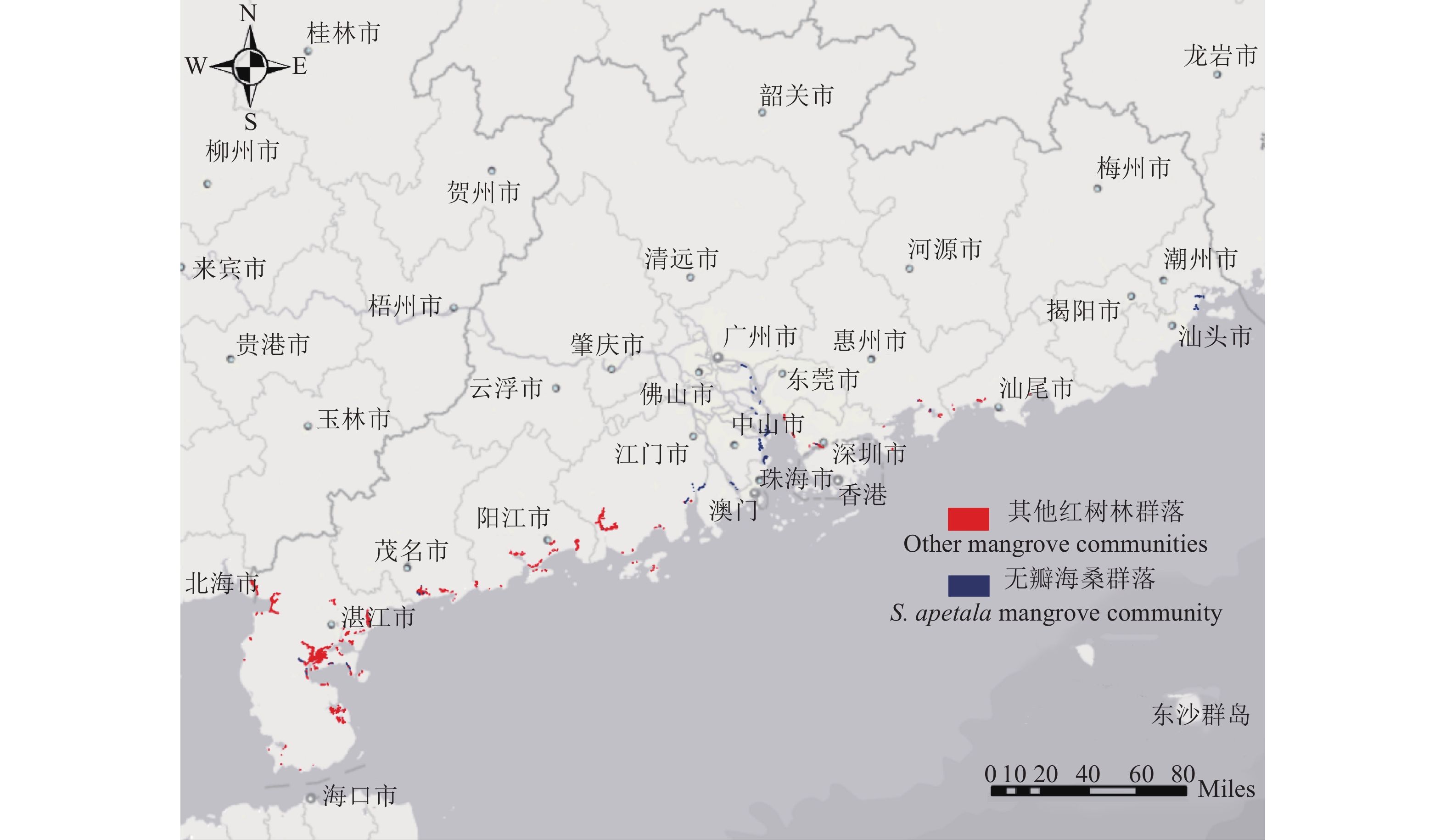
|
图 1 广东省无瓣海桑分布图 Fig. 1 Distribution of Sonneratia apetala in Guangdong Province |
对各地的无瓣海桑群落进行调查,结果见表2。广东省无瓣海桑的林龄为8~20年,潮州、惠州地区造林较晚,其林龄为8年,广州、汕头、湛江、中山和珠海地区造林较早,其林龄为15年,深圳的林龄最大,为20年。无瓣海桑的林分密度随着林龄的增加而对应减小,植株密度最大的地区为潮州(0.68株·m−2),植株密度最小的地区为湛江(0.14株·m−2)。广州和珠海2个地区的林分面积最大,分别占广东省无瓣海桑林总面积的28.61%和28.65%。
|
|
表 2 各地区无瓣海桑群落结构信息1) Table 2 Community structure of Sonneratia apetala in each region |
根据25株标准木的生物量干质量信息,选取式(1)的生物量模型,用SPSS20.0软件进行模型模拟,得到不同部位生物量模型的相关参数a、b,具体见表3。
|
|
表 3 无瓣海桑生物量模型参数和统计结果1) Table 3 Model parameters and statistical results of Sonneratia apetala |
通过对指标决定系数(R2)的观察发现,除枝、叶外,其他各部分的决定系数都大于0.8,地上、地下部分的决定系数达到了0.9,植株总生物量的决定系数更是达到了0.952,说明D、H这2项因子已经解释了立木生物量变动的95%以上,其检验统计量的T值达到了2.633和21.475,均大于临界值2,说明模型的拟合效果较好。通过对P值的观察,发现各部分模型的P均小于0.001,说明模型对各部分生物量的解释程度达到极显著水平。
2.3 模型精度检验应用检验数据,对本文所建立的单木各生物量模型进行验证和评价,计算各统计指标,结果见表4。ME和MAE反映了样本间的离散程度,TRE和MSE是反映拟合效果的重要指标,地上部分、地下部分和总生物量模型的TRE和MSE基本在±5%左右,表明模型拟合效果良好,MPSE达到 20%左右,该指标反映的是单株生物量估计误差的平均水平,其结果也较好。
|
|
表 4 无瓣海桑生物量模型统计指标1) Table 4 Model statistical indexes of Sonneratia apetala biomass |
元素分析仪测得无瓣海桑各部位有机碳含量(表5),木材部分有机碳含量最高,其有机碳质量分数为45.10%,根的有机碳含量最低,其有机碳质量分数为39.80%。
|
|
表 5 无瓣海桑各部位有机碳含量1) Table 5 Organic carbon contents in different parts of Sonneratia apetala |
由表6可知,广东省无瓣海桑林植被碳密度为25.70~ 84.11 t·hm−2,10个地区无瓣海桑林植被碳密度从小到大的顺序为:茂名25.70 t·hm−2<江门29.28 t·hm−2<惠州34.25 t·hm−2<湛江34.89 t·hm−2<广州36.01 t·hm−2<珠海63.46 t·hm−2<汕头65.10 t·hm−2<潮州76.16 t·hm−2<中山80.18 t·hm−2<深圳84.11 t·hm−2。由表6可知,各地区无瓣海桑林植被碳储量从小到大的顺序为:惠州589.48 t<深圳694.77 t<潮州1 070.87 t<江门1 781.69 t<茂名2 102.75 t<湛江7 425.64 t<汕头11 207.69 t<中山13 610.40 t<广州17 763.33 t<珠海31 347.76 t。
|
|
表 6 广东省各地区无瓣海桑林碳密度与碳储量1) Table 6 Carbon density and carbon storage ofSonneratia apetalain different region of Guangdong Province |
对10个地区的土壤土样进行有机碳含量及容重的测定,结果见表7。大部分地区的土壤有机碳含量在0~30 cm土层表现出最高水平,在60~100 cm土层表现出最低水平。除广州外的其他地区的土壤容重则随着土层深度的增加而相应减小。其中,惠州地区与其他地区相比,其土壤有机碳含量明显较高。各地区各土层土壤有机碳含量差异显著,土壤容重的差异显著。
|
|
表 7 广东省各地区无瓣海桑林土壤有机碳含量及容重1) Table 7 Soil organic carbon content and soil bulk density ofSonneratia apetalain different region of Guangdong province |
表6显示10个地区的土壤碳密度,其顺序从小到大为:潮州143.49 t·hm−2 <茂名183.47 t·hm −2<江门197.55 t·hm−2<湛江226.41 t·hm−2 <广州237.56 t·hm −2 <深圳253.74 t·hm −2 <中山264.83 t·hm −2<珠海288.62 t·hm−2 <汕头321.18 t·hm −2<惠州574.66 t·hm−2。表6显示,各地区土壤碳储量大小顺序为:潮州2 017.47 t<深圳2 095.89 t <惠州9 889.82 t<江门12 018.89 t<茂名15 013.69 t<中山44 952.50 t<湛江48 184.51 t<汕头55 290.93 t<广州117 174.84 t<珠海142 568.17 t。
2.6 无瓣海桑林总碳密度与总碳储量由表6可知,10个地区无瓣海桑林总碳密度从小到大依次为:茂名209.17 t·hm−2<潮州219.65 t·hm−2<江门226.83 t·hm−2<湛江261.30 t·hm−2<广州273.57 t·hm−2<深圳337.85 t·hm−2<中山345.02 t·hm−2<珠海352.09 t·hm−2<汕头386.28 t·hm−2<惠州608.91 t·hm−2,无瓣海桑林植被碳密度较土壤碳密度低,占总碳密度比例较少,惠州地区植被碳密度仅为总碳密度的5.63%,而潮州地区的植被碳密度占到了总碳密度的34.67%,综合其他地区的情况可知,无瓣海桑林植被碳密度占总碳密度的16.32%,土壤碳密度占总碳密度的83.68%。
由表6可知,10个地区无瓣海桑林的总碳储量从小到大依次为:深圳2 790.65 t<潮州3 088.34 t<惠州10 479.30 t<江门13 800.58 t<茂名17 116.43 t<湛江55 610.15 t<中山58 562.90 t<汕头66 498.62 t<广州134 938.18 t<珠海173 915.93 t,广东省无瓣海桑林的总面积为1 724.12 hm2,总碳储量为536 801.09 t,植被碳密度为50.81 t·hm−2,土壤碳密度为260.54 t·hm−2,总碳密度为311.35 t·hm−2。广州和珠海无瓣海桑林面积占了广东省无瓣海桑林总面积的57.26%,这2个地区无瓣海桑林总碳储量占广东省无瓣海桑林总碳储量的57.54%。
3 讨论与结论 3.1 广东省无瓣海桑生物量模型本研究通过来自广东省8个不同地区的25株无瓣海桑标准解析木,构建适用于广东省各地区的无瓣海桑生物量模型,除枝、叶部分的模型外,其他各部分模型的精确度都达到了0.9以上。由于各地无瓣海桑生长的立地条件不同,且不同年龄无瓣海桑的树冠及分枝结构、利用生态空间的能力均存在差异[24],造成各地区无瓣海桑枝、叶生物量差异很大,模型模拟就不准确。先前有学者模拟了湛江[13]、深圳福田[25]、广州南沙[26]的无瓣海桑生物量模型,其模型精度高,但适用范围并不广,本文构建的无瓣海桑生物量模型,模型精度高,可适用于广东省范围内无瓣海桑林分生物量的估算。
3.2 不同地区无瓣海桑植被碳密度广东省各地区的无瓣海桑植被碳密度存在较大的差异,年龄相近的珠海和惠州无瓣海桑人工林,其密度大致相同,但单位面积上植被碳密度却差了近一倍,珠海无瓣海桑林植被碳密度比茂名的也高出许多,这与红树林生长的立地因子不无关系。种群和群落的植被碳密度主要受种植密度、成活率、人为干扰、郁闭度、年龄及入侵物种的影响。即使同一地点同一树种(红海榄),生物量调查结果差异也很大,这与调查群落的具体地点和方法有关。从海滩红树林群落的演替规律可知,同一树种,越是处在外滩,演替时间越短,群落的年龄也越小[27-29]。不同纬度太阳辐射能的差异是造成红树林植物生物量差异的重要原因[30-31]。低纬度地区的太阳辐射充足,红树林植物可以进行有效的光合作用,生长较少受到温度的影响[32]。因此,低纬度地区有利于红树林植物的生长,形成高大的乔木,高纬度地区易形成低矮的灌木。
事实上,即使处于同一纬度的红树林植物分布区,其气候条件(降水量和气温等)可能也有较大差异,进而对红树林植物生物量及其分配格局造成影响[33]。因此,未来在红树林植被碳密度及其分配格局的影响研究中,应进一步考虑不同的降水量和气温等因素。与植物地上生物量的研究相比,现有关于无瓣海桑地下生物量的研究相对较少,且缺乏统一标准的研究方法,导致无瓣海桑地下生物量研究结果具有较大的误差,也对红树林植物生物量分布格局的研究带来不确定性。在中小尺度上,无瓣海桑林生物量同时受到土壤、地形地貌和水文水利条件等综合影响,因此在今后研究中,应考虑中小尺度的环境条件的差异,进一步增强植物生物量分布研究的准确性。
总体而言,广东省的无瓣海桑植被碳密度随着年龄的增加而增加,林分密度逐渐变小,生物量增长量趋于稳定,不同地区的立地条件造成了各地区无瓣海桑径阶的不同,植被碳密度之间差异较大。
3.3 不同地区无瓣海桑林地土壤碳密度无瓣海桑群落土壤属于酸性硫酸盐类型的土壤,是红树植物发育条件下的一种特殊土壤。土壤中的有机碳来源于自身群落生产以及海洋、河流流入等。其中自身群落的枯枝烂叶以及果实等掉落物是主要有机碳来源。群落土壤的有机碳累积受生物因子和非生物因子的影响,其中生物因子主要包括植物的初级生产力、腐生生物的活动等;非生物因素主要是潮汐、气候等[34]。
从全国范围看,红树林群落有机碳质量分数不同地区差异性大,从不足0.12%到14.5%,平均为3.05%。广东省的无瓣海桑群落土壤的有机碳质量分数从1.55%到3.49%,平均为1.96%[34]。从总体来看,广东省无瓣海桑群落的有机碳含量相对不高,而更低纬度的海南省东寨港红树林群落土壤有机碳含量更高,其质量分数达3.22%。土壤有机碳含量还与当地的地形有关,海南省红树林大多生长在河口海岸和泄湖,而广东省的无瓣海桑林大多生长在开阔海岸,河口海岸处于低洼地带,通常具有丰富的淤泥,这无疑更适合红树林的生长和扩散。而且广东省人口密度大,经济发达,导致一些生活垃圾进入红树林,这些都是广东省无瓣海桑群落土壤有机碳含量低于海南省的原因。
广东省的无瓣海桑群落土壤有机碳密度远低于海南省的红树林群落土壤平均有机碳密度(1 m深为704 t·hm−2)[35]。当红树林达到成熟林分的时候,地上部的生物量年变化很小,而土壤有机碳密度随着时间逐年提高[36]。广东省的无瓣海桑林属人工林,林龄在10年左右,土壤中有机碳的累积还不是很多,这是造成广东省无瓣海桑群落土壤有机碳含量比海南省低的原因。而三江平原湿地地处我国东北,气候寒冷,有机物分解缓慢,人为干扰较少,这些都是广东省无瓣海桑林土壤有机碳含量低于三江平原湿地的原因。
3.4 广东省无瓣海桑林的碳储量广东省无瓣海桑林的总面积为1 724.12 hm2,总碳储量为536 801.09 t,植被碳密度为50.81 t·hm−2,土壤碳密度为260.54 t·hm−2,总碳密度为311.35 t·hm−2。与海南省东寨港红树林[37]、全国红树林碳储量平均水平[38]基本一致,但比印度[39]、印尼和帕劳群岛[40]更低纬度的红树林碳储量低。树种从两方面影响了碳储量:一方面为植物自身生长量不同,另一方面为不同树种对土壤影响明显不同,继而导致碳储量因树木组合不同而异。
| [1] |
韩维栋, 高秀梅. 无瓣海桑人工林的生物量与能量研究(英文)[J]. 广西科学, 2004(3): 243-248. DOI:10.3969/j.issn.1005-9164.2004.03.022 (  0) 0) |
| [2] |
吴天佑. 广东省湿地红树林的地位和作用的研究[J]. 粤东林业科技, 2005(1): 35-41. (  0) 0) |
| [3] |
何克军, 林寿明, 林中大. 广东红树林资源调查及其分析[J]. 广东林业科技, 2006(2): 89-93. DOI:10.3969/j.issn.1006-4427.2006.02.022 (  0) 0) |
| [4] |
杜欢, 杨琼, 黎双飞, 等. 无瓣海桑和秋茄人工林下土壤微生物群落研究[J]. 林业与环境科学, 2017, 33(3): 1-7. DOI:10.3969/j.issn.1006-4427.2017.03.001 (  0) 0) |
| [5] |
唐以杰, 安东, 方展强, 等. 珠海夹洲岛无瓣海桑与秋茄群落对重金属吸附能力的比较研究[J]. 生态科学, 2015, 34(3): 13-19. (  0) 0) |
| [6] |
刘莉娜, 胡长云, 李凤兰, 等. 无瓣海桑群落特征研究[J]. 沈阳农业大学学报, 2016, 47(1): 41-48. (  0) 0) |
| [7] |
CHEN L Z, ZENG X Q, TAM N F Y, et al. Comparing carbon sequestration and stand structure of monoculture and mixed mangrove plantations of Sonneratia caseolaris and S. apetala in Southern China
[J]. Forest Ecol Manage, 2012, 284: 222-229. DOI:10.1016/j.foreco.2012.06.058 (  0) 0) |
| [8] |
唐以杰, 方展强, 钟燕婷, 等. 不同生态恢复阶段无瓣海桑人工林湿地中大型底栖动物群落的演替[J]. 生态学报, 2012, 32(10): 3160-3169. (  0) 0) |
| [9] |
张弛, 王树功, 郑耀辉, 等. 生物扰动对红树林沉积物中AVS和重金属迁移转化的影响[J]. 生态学报, 2010, 30(11): 3037-3045. (  0) 0) |
| [10] |
杨琼, 谭凤仪, 吴苑玲, 等. 不同林龄海桑林和无瓣海桑林根际微生物特征[J]. 生态学杂志, 2014, 33(2): 296-302. (  0) 0) |
| [11] |
安东, 缪绅裕, 陈蔚, 等. 珠海淇澳岛无瓣海桑人工林更新幼苗种群特征[J]. 广州大学学报(自然科学版), 2015, 14(1): 50-55. (  0) 0) |
| [12] |
田野, 陈玉军, 侯琳, 等. 广东湛江无瓣海桑红树林消波效应初步研究[J]. 浙江农业科学, 2014(2): 210-213. DOI:10.3969/j.issn.0528-9017.2014.02.023 (  0) 0) |
| [13] |
黄月琼, 吴小凤, 韩维栋, 等. 无瓣海桑人工林林分生物量的研究[J]. 江西农业大学学报(自然科学版), 2002(4): 533-536. (  0) 0) |
| [14] |
彭聪姣, 钱家炜, 郭旭东, 等. 深圳福田红树林植被碳储量和净初级生产力[J]. 应用生态学报, 2016, 27(7): 2059-2065. (  0) 0) |
| [15] |
朱可峰, 廖宝文, 章家恩. 广州市南沙红树植物无瓣海桑、木榄人工林生物量的研究[J]. 林业科学研究, 2011, 24(4): 531-536. (  0) 0) |
| [16] |
国家林业局. 第2次全国湿地资源调查结果[J]. 国土绿化, 2014(2): 6-7. (  0) 0) |
| [17] |
陈远生, 甘先华, 吴中亨. 广东省沿海红树林现状和发展[J]. 广东林业科技, 2001, 17(1): 20-26. DOI:10.3969/j.issn.1006-4427.2001.01.005 (  0) 0) |
| [18] |
HOWARD J, HOYT S, ISENSEE K, et al. Coastal blue carbon: methods for assessing carbon stocks and emissions factors in mangroves, tidal salt marshes, and seagrasses[J]. J Am Hist, 2014, 14(4): 4-7. (  0) 0) |
| [19] |
曾伟生, 骆期邦, 贺东北. 兼容性立木生物量非线性模型研究[J]. 生态学杂志, 1999(4): 19-24. DOI:10.3321/j.issn:1000-4890.1999.04.005 (  0) 0) |
| [20] |
PARRESOL B R. Assessing tree and stand biomass: A review with examples and critical comparisons[J]. Forest Sci, 1999, 45(4): 573-593. (  0) 0) |
| [21] |
PARRESOL B R. Additivity of nonlinear biomass equations[J]. Canad J Forest Res, 2001, 31(5): 865-878. DOI:10.1139/x00-202 (  0) 0) |
| [22] |
ZABEK L M, PRESCOTT C E. Biomass equations and carbon content of aboveground leafless biomass of hybrid poplar in Coastal British Columbia[J]. Forest Ecol Manag, 2006, 223(1): 291-302. (  0) 0) |
| [23] |
DONATO D C, KAUFFMAN J B, MURDIYARSO D, et al. Mangroves among the most carbon-rich forests in the tropics[J]. Nat Geosci, 2011, 4(5): 293-297. DOI:10.1038/ngeo1123 (  0) 0) |
| [24] |
周元满, 王平, 刘素青, 等. 无瓣海桑人工林树冠结构的分形分析[J]. 福建林学院学报, 2012, 32(3): 252-256. DOI:10.3969/j.issn.1001-389X.2012.03.011 (  0) 0) |
| [25] |
ZAN Q, WANG Y, LIAO B, et al. Biomass and net productivity of Sonneratia apetala, S. caseolaris mangrove man-made forest
[J]. J Wuhan Bot Res, 2001, 19(5): 391-396. (  0) 0) |
| [26] |
ZHU K F, LIAO B W, ZHANG J E. Studies on the biomass of mangrove plantation of Sonneratia apetala and Bruguiera gymnorrhiza in the wetland of Nansha in Guangzhou City
[J]. Forest Res, 2011, 24(4): 531-536. (  0) 0) |
| [27] |
李云, 郑德璋, 陈焕雄, 等. 红树植物无瓣海桑引种的初步研究[J]. 林业科学研究, 1998(1): 42-47. (  0) 0) |
| [28] |
梁士楚, 王伯荪. 红树植物木榄种群植冠层结构的分形特征[J]. 海洋通报, 2002(5): 26-31. DOI:10.3969/j.issn.1001-6392.2002.05.004 (  0) 0) |
| [29] |
温远光. 广西英罗港5种红树植物群落的生物量和生产力[J]. 广西科学, 1999(2): 63-68. (  0) 0) |
| [30] |
SAENGER P, SNEDAKER S C. Pantropical trends in mangrove above-ground biomass and annual litterfall[J]. Oecologia, 1993, 96(3): 293. DOI:10.1007/BF00317496 (  0) 0) |
| [31] |
KOMIYAMA A, JIN E O, POUNGPARN S. Allometry biomass and productivity of mangrove forests: A review[J]. Aquat Bot, 2008, 89(2): 128-137. DOI:10.1016/j.aquabot.2007.12.006 (  0) 0) |
| [32] |
ALONGI D M. Patterns of Mangrove wood and litter production within a beach ridge-fringing reef embayment, northern great barrier reef coast[J]. Estuar Coasts, 2011, 34(1): 32-44. DOI:10.1007/s12237-010-9289-y (  0) 0) |
| [33] |
KHAN M N I, SUWA R, HAGIHARA A. Biomass and aboveground net primary production in a subtropical mangrove stand of Kandelia obovata, (S. L.) Yong at Manko Wetland, Okinawa, Japan
[J]. Wetlands Ecol Manag, 2009, 17(6): 585-599. DOI:10.1007/s11273-009-9136-8 (  0) 0) |
| [34] |
朱耀军, 赵峰, 郭菊兰, 等. 湛江高桥红树林湿地有机碳分布及埋藏特征[J]. 生态学报, 2016, 36(23): 7841-7849. (  0) 0) |
| [35] |
辛琨, 颜葵, 李真, 等. 海南岛红树林湿地土壤有机碳分布规律及影响因素研究[J]. 土壤学报, 2014, 51(5): 1078-1086. (  0) 0) |
| [36] |
谈思泳. 华南红树林湿地表层土壤有机碳分布特征及其影响因子[D]. 南宁: 广西师范学院, 2017.
(  0) 0) |
| [37] |
胡杰龙, 辛琨, 李真, 等. 海南东寨港红树林保护区碳储量及固碳功能价值评估[J]. 湿地科学, 2015, 13(3): 338-343. (  0) 0) |
| [38] |
LIU H, REN H, HUI D, et al. Carbon stocks and potential carbon storage in the mangrove forests of China[J]. J Environ Manag, 2014, 133: 86-93. DOI:10.1016/j.jenvman.2013.11.037 (  0) 0) |
| [39] |
RAY R, GANGULY D, CHOWDHURY C, et al. Carbon sequestration and annual increase of carbon stock in a mangrove forest[J]. Atmosphe Environ, 2011, 45(28): 5016-5024. DOI:10.1016/j.atmosenv.2011.04.074 (  0) 0) |
| [40] |
KAUFFMAN J B, HEIDER C, COLE T G, et al. Ecosystem carbon stocks of micronesian mangrove forests[J]. Wetlands, 2011, 31(2): 343-352. DOI:10.1007/s13157-011-0148-9 (  0) 0) |
 2019, Vol. 40
2019, Vol. 40


