2. 榄菊日化实业有限公司,广东 中山 528434
2. Zhongshan Lanju Daily Chemical Industry, Zhongshan 528434, China
草地贪夜蛾Spodopter frugiperda (Smith)属于鳞翅目Lepidoptera夜蛾科Noctuidae灰翅夜蛾属Spodoptera,原产于美洲热带和亚热带地区[1-3],是一种典型的远距离迁飞性害虫[4]。自2016年1月在非洲尼日利亚和加纳发现后,至今已扩散到亚洲多个国家[4]。2019年1月,我国云南省江城县首次发现草地贪夜蛾,随后迅速蔓延到25个省,见虫面积超过100万hm2[5]。
草地贪夜蛾作为联合国粮农组织全球预警的重大害虫,具有适生区域广、迁飞能力和繁殖能力强、寄主范围广和取食量大等特点[5],其防控技术主要包括物理诱杀、农业防治和化学防治。物理诱杀技术主要用于成虫发生期,集中连片采用杀虫灯诱杀[6],可搭配性诱剂和食诱剂提升防治效果。然而,物理诱杀仅能杀死部分成虫,对于造成主要为害的幼虫无法直接防控,存在见效慢、防治不及时的缺点。农业防治上,通过不同作物间作套种,发挥生物多样性的自然控制优势,形成生态阻截带[7]是一种可持续发展的控制措施,但针对这种迁飞性强、繁殖迅速、取食量大的爆发性害虫,农业防治的具体措施还需要很长一段时间的探索过程。目前,化学防治是防治草地贪夜蛾的主要手段,多种杀虫剂如氯虫苯甲酰胺、氟氯双酰胺和乙基多杀菌素等对草地贪夜蛾都有良好的防效[5-6], 但由于草地贪夜蛾的农药代谢相关基因存在显著扩张,且世代周期短,抗药性产生的风险大。因此,开发特异性强、对环境友好、对人畜无害的绿色防控措施对草地贪夜蛾的可持续治理具有重要意义。
昆虫的生殖受到多种因素调控,每一种因素在分子水平上的反映均为某些特定的基因参与调控。针对草地贪夜蛾存在不同品系间杂种不育和交配障碍等生殖隔离现象,探索基于种群遗传调控的生物技术手段防控草地贪夜蛾,不仅可显著降低害虫的种群密度,还可以减少化学农药的使用、保护生态环境。本文对性连锁平衡致死系统、杂交不育、性激素和生殖发育调控相关基因等方面的研究现状进行了综述,以期为草地贪夜蛾防治提供更多潜在手段。
1 种群遗传调控昆虫种群遗传调控技术经历了20世纪基于辐射不育的昆虫不育技术和21世纪基于遗传转化的遗传调控技术[8]。1969年,Serebrovskii [9]提出通过遗传手段控制害虫的理论,主要是将携带遗传畸变的害虫品系释放到自然群体中,在自然环境下交叉交配后降低子代繁殖力,从而减少害虫种群数量。种群遗传调控是利用昆虫自身生长发育的关键基因,采用性别控制开关,通过遗传转化使雄虫成为携带导致后代雌虫发育异常或不育的遗传控制复合体。昆虫遗传调控基于不育昆虫种群控制系统[10],能够对目标昆虫的性别进行遗传调控,对益虫利用和农林害虫防治具有重要的意义。目前,利用较多的种群遗传调控手段有性连锁平衡致死系统和杂交不育产生不育个体,该技术在鳞翅目昆虫成功运用的例子较多,在鳞翅目棉铃虫Helicoverpa armigera和玉米螟Pyrausta nubilalis中均得到了实现[11-12]。加拿大不列颠哥伦比亚省等地在1992年进行了苹果蠹蛾Cydia pomonella遗传控制项目,通过将不育的苹果蠹蛾雄虫进行多年的田间释放,大大减少了苹果蠹蛾的种群数量[13-14]。
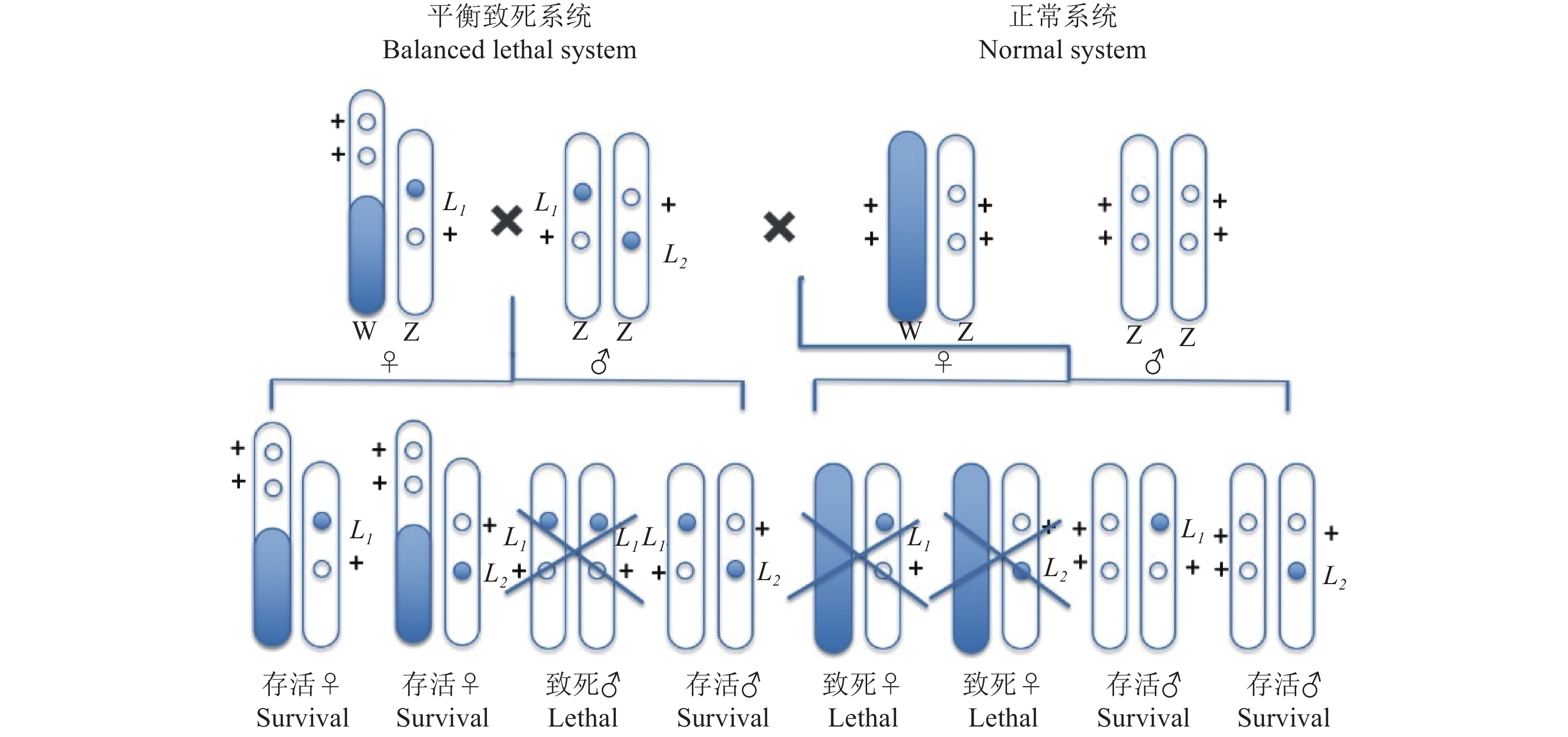
1.1 性连锁平衡致死系统平衡致死系统即一对同源染色体分别带有一个座位不同的隐性致死基因,这2个致死基因始终处在对应的染色体上,以杂合状态保存不发生分离[15]。1975年,Strunnikov[16]用经典遗传学建立了家蚕Bombyx mori的性连锁平衡致死系统。该系统利用雄性与雌性杂交,后代只有雄性正常孵化,而雌性在胚胎期死亡,实现只养雄蚕的目的。性连锁平衡致死系统中,雄蚕的2条Z染色体分别带有一个非等位突变致死基因L1和L2,当突变基因发生纯合时,雌蚕致死(图1)。
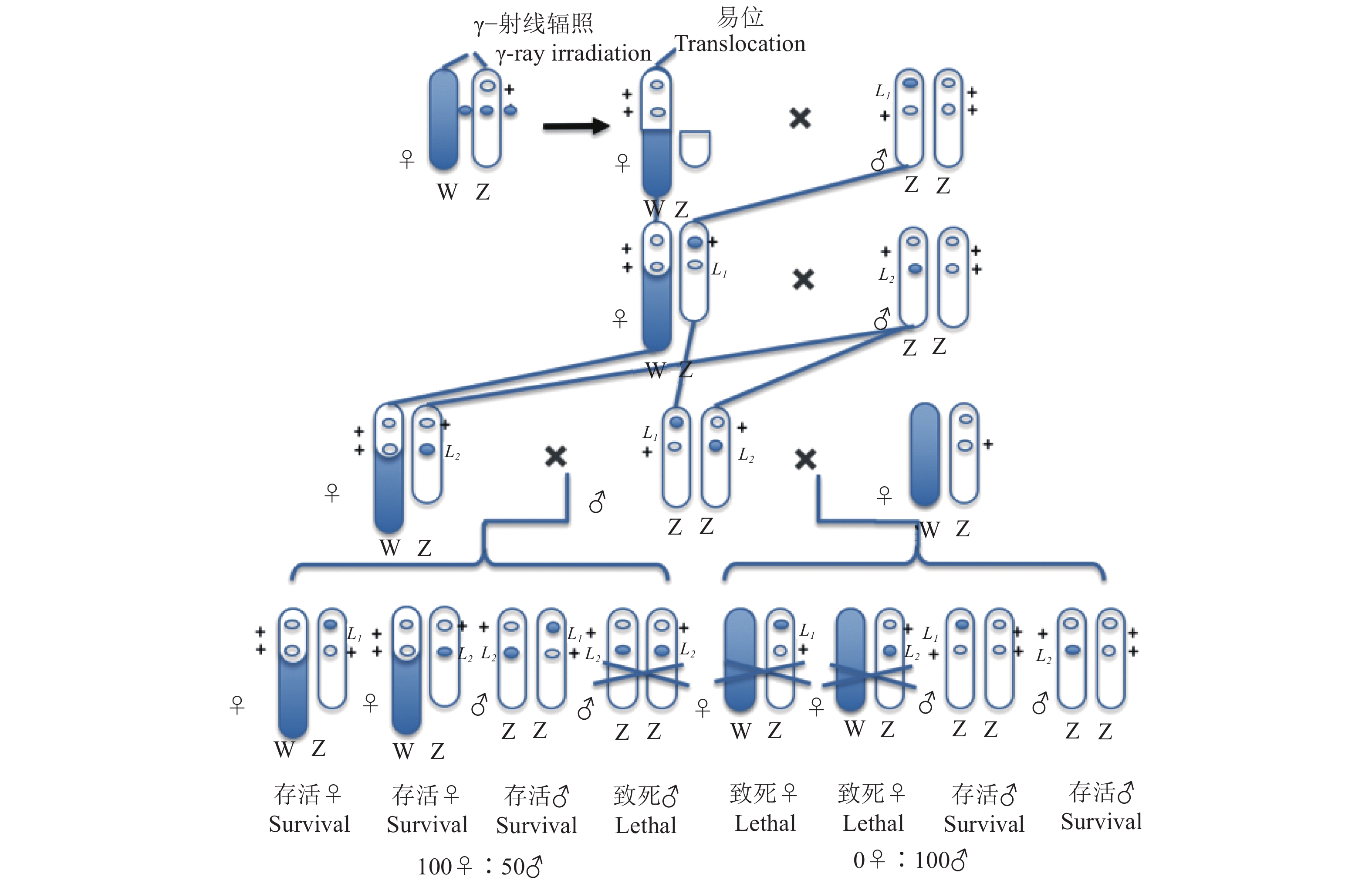
另一种是Z−W易位平衡致死系统[17](图2)。通过电离辐射把 Z 染色体左端的片段切下并使之易位到W染色体上,断裂的染色体剩余部分在以后的杂交中被正常的Z染色体所替代。染色体的改变产生了新的家蚕品系,其雌虫有一套Z−W染色体,雄虫跟正常的雄性一样, 存在2个Z染色体片段,被易位到W染色体上的Z染色体片段掩盖了相应的正常等位基因,该雌虫能够存活并且把致死基因传递给自己的雄性后代。依次杂交,易位处理雌虫先与一个带有致死基因的雄虫交配, 子代再与带有另一个异质结合致死基因的雄虫交配,成功育成了一个新的具有2个平衡致死基因的品系。由于2条Z染色体基因交换的影响, 所以性比通常是99.9♂∶0.1♀ ,在F1中任何一个雄性个体都带有来自父本的一个致死基因,这种雄性个体与正常雌性个体杂交所产生的后代, 性比为2♀ ∶1♂ [18-19]。何克荣等[20]已经把平衡致死系统的性别控制基因成功导入活体中,选育出实用的雄蚕品种。
|
图 2 不等位Z平衡致死基因培育的2个家蚕品系[17] Fig. 2 Two silkworm strains cultured with Z -linkaged balanced lethal [17] |
1923年,Ward[21]通过遗传杂交试验发现,黑腹果蝇Drosophila melanogaster 卷翅突变是平衡致死系统,即杂合子存活,纯合子致死。1969年,清久正夫细律子[22]对东方果蝇的蛹,使用2.4 KR的低剂量CY射线照射,在雌雄后代中,其雌性和雄性组合的4个世代都有明显的不育性遗传。通过拟果蝇D. simulans和毛果蝇D. mauritiana 2种果蝇之间进行杂交,对影响杂交不育基因进行定位,发现雄性杂交不育基因Odysseus(Ods) [23]。澳大利亚园艺产业为防止果蝇入侵,通过释放引入雄性不育果蝇,与野生雌性种群交配后产生不育后代,减少果蝇数量,应对果蝇入侵威胁[24]。2000 年,Heinirich 等 [25]在果蝇中建立了四环素控制的雌性特异的致死体系;Thomas 等 [26]也在果蝇中建立了类似系统, 但是使用的启动子是Yp3 和Hsp26, 致死基因是Ras64BV12和msl-2NOPU。2003年,Horn等 [11]利用转基因技术构建了一个果蝇胚胎期特异致死的遗传系统, 该系统运用了胚胎期特异表达启动子(nullo, serendipity α 启动子)调控表达tTA和hid基因, 从而引起果蝇胚胎期特异致死。
在农业上,昆虫种群调控不仅可以有效提高经济昆虫的生产效率,还可以保护经济作物不受害虫的损害。基于草地贪夜蛾品系间杂交的特殊性,构建携带2个致死的非等基因草地贪夜蛾致死品系,将性连锁致死系统应用于草地贪夜蛾具有较高的可行性(图1)。通过低剂量药品、食物或辐射获得2个品系草地贪夜蛾雌性绝育品系(图2),每个品系都具有不同的Z染色体易位性和Z染色体致死性,杂交后代雌性胚胎死亡率达100%,从而不需要进行繁琐的雌雄分离达到释放单一雄性个体的目的;另外,杂种雄性反复释放将导致自然种群中雌性死亡率每一代都逐步增加,产生累计效应获得更好的防治效果。
1.2 杂交不育不同生物种群的生殖隔离可以发生在合子前或者合子后。合子前障碍主要是由于2个品系之间交配时性行为或者雌性信息素导致的隔离[27-28],合子后隔离则主要是由于交配形成的合子不能发育至成体,或成体的生殖力低下 [15]。根据寄主趋向性,草地贪夜蛾被分为玉米品系(C)和水稻品系(R),2个品系在形态学上区分不出差异,但是在遗传上可以使用品系特异性分子标记区分开[29],且存在一定的生殖隔离。Groot等[30]发现2个品系在某种程度上也可以配对,但玉米品系和水稻品系存在一定生境隔离和行为隔离。
目前的研究表明,草地贪夜蛾C品系和R品系之间的生殖隔离在合子前后都有发生。1987年,Pashley等[27]用波多黎各和易斯安那州种群研究了合子后基因流动的障碍,发现雌性C品系和雄性R品系交配没有获得后代,也没有精原细胞转移;雌性R品系和雄性C品系之间可以交配受精,其后代被饲养到成虫阶段并与亲本回交,F1雌性的回交中没有产生后代,表明品系间的2个交叉方向的某个阶段存在繁殖障碍。2011年,Velásquez-Vélez 等[28]在哥伦比亚中部发现2种品系的生活史特征的合子后隔离,并确定了草地贪夜蛾中杂种雌性数量的减少和杂种不育性的增多,这与Haldane[31]关于杂种配子在杂种后代中生殖能力降低的研究结果相一致。Pashley等[27]比较了R×C、C×R、R × R、C× C等品系杂交组合发现,C×R品系杂交的F1代受精率显著降低。2016年,Kost等[32]发现当雌性R品系与雄性C品系交配时,所得RC品系杂种雌性的繁殖力显著降低,且不受其配偶伴侣的影响。RC品系生育能力降低是由于这些雌性不交配的行为不育所造成。遗传分析表明,Z染色体连锁的不育位点与常染色体(或细胞质)上的一个未知因子不相容,导致观察到性隔离。杂种不育在遗传上可能是由于染色体重排,例如基因转座或复制,染色体倒置或易位以及多倍性[33-34]。草地贪夜蛾R品系和C品系之间存在不相容性,具有明显的杂交障碍。
曾保胜等[10]基于草地贪夜蛾玉米型、水稻型杂交不育的现象,通过生物信息学对导致草地贪夜蛾杂合不相容性的因素进行基因定位,进而筛选导致杂种不育的基因,为利用分子手段防治草地贪夜蛾奠定基础。
2 生殖干扰在害虫防治中的应用昆虫的生殖受多种特定途径的基因调控。与昆虫生殖调控相关的基因在昆虫生殖过程中发挥重要作用,如影响昆虫保幼激素(Juvenile hormone, JH)、蜕皮激素(Molting hormone, MH)以及神经肽的生物合成及性信息素,并且直接参与昆虫的配子发生和交配行为。研究生殖调控相关基因,对于控制害虫繁殖、进行害虫防治具有重要的科学意义。
2.1 昆虫激素在害虫防治中的应用昆虫保幼激素和蜕皮激素是昆虫中最为重要的两大激素,在昆虫的发育和生殖过程中发挥着重要作用。保幼激素可以促进雌虫卵的成熟以及雄虫性腺,控制昆虫性发育,产生性信息素,促进卵子成熟等[35-36],Wigglesworth[35]通过对吸血蝽Rhodnius prolixus的研究发现,保幼激素可促进雌虫卵的成熟以及雄虫性腺的发育;叶恭银等[37]研究表明,高浓度的保幼激素对天蚕Antheraea yamamai卵巢发育有明显的抑制作用;保幼激素处理导致正常喂食的雌虫保幼激素降解减少,产卵受到抑制[38-39]。保幼激素浓度上升会导致果蝇卵母细胞的积聚以及产卵的延迟,蜕皮激素促进昆虫的蜕皮、变态发育等生理过程和行为,家蚕蜕皮激素调控卵黄蛋白的合成,其中,转录因子是家蚕卵黄蛋白基因表达趋势一致的基因,也受蜕皮激素的调节[40]。2010年,Parthasarathy等[41]研究蜕皮激素对赤拟谷盗Tribolium castaneum的卵巢发育和卵母细胞成熟的影响,通过从赤拟谷盗卵巢中提取的RNA的微阵列分析发现,赤拟谷盗雌虫羽化后第4天,与蜕皮激素生物合成相关的某些基因的表达量发生上调。
保幼激素及蜕皮激素的合成在昆虫生长发育及生殖过程中发挥着至关重要的作用,基于这2条通路中的关键酶被认为是用于昆虫防治的重要分子靶标。可以通过对草地贪夜蛾保幼激素及蜕皮激素相关基因的功能研究,从生殖的角度找到进行草地贪夜蛾防控的靶标基因,为其防治提供分子生物学依据。
2.2 雄性生殖相关基因在害虫防治中的作用在雄虫中,根据已有的报道,筛选出一系列雄虫生殖调控相关基因lola[42]、Gld2[43]、dic[44]、orb2[45]、aly[46]、Rab11[47]、cg5017[48]、nap1[48]、per[49]、topi[50]、odsH[51]、rac[52]、upd[52]、magu[52]等,这些基因在精子发生过程中维持减数分裂的有序进行、参与精子鞭毛丝的形成,并在细胞的减数分裂和精子发生末期调节细胞分化以及维持昆虫生物节律等方面发挥重要作用。
已发现在果蝇[51]、沙漠飞蝗Locusta migratoria [49]和赤拟谷盗[53]中,某些基因可参与雄虫的精子发生,并发挥重要作用。利用RNAi技术抑制,沙漠飞蝗的per基因不会对雄虫的性成熟及交配行为产生影响,但干扰后的雄虫与未处理的雌虫交配后会导致子代的孵化受影响。雄虫per基因被抑制,使昆虫的生物节律被打乱,导致交配时精子不能正常转运到雌虫的受精囊,致使与雌虫交配后的有效卵量下降。桔小实蝇Bactrocera dorsalis 通过RNAi技术抑制精子发生相关基因的表达,雄虫正常交配但受精卵的孵化率降低甚至不孵化,该结果在半野外试验中也得到了很好的验证,从而达到雄性不育技术的应用[54]。奚志勇团队让白纹伊蚊Aedes albopictus感染3种沃尔巴克氏体Wolbachia菌株,使受到细菌感染的蚊子在野外与正常雌蚊子交配时,有沃尔巴克氏体的精细胞遇到不含同种细菌的卵细胞,“胞质不融合”现象会让虫卵无法存活,可以达到蚊子绝育的效果[55];新型的CRISPR/Cas技术在害虫遗传调控方面也发挥了重要的作用,屠志坚团队找到了埃及伊蚊Aedes aegypti中的雄性因子Nix(Mfactor),并通过CRISPR/Cas技术对Nix基因进行功能研究[56]。通过敲除Nix基因,雄性的埃及伊蚊发生了性别分化的转换,并失去了生育能力,为害虫的生殖调控提供了新的思路。
通过筛选草地贪夜蛾雄性生殖调控基因,阐明相关基因对其雄虫精子发生的调控及生殖力的影响,通过RNAi或基因编辑技术导致雄性不育将为利用雄性不育技术防治草地贪夜蛾提供新的途径。
2.3 利用性信息素防治害虫性信息素调控昆虫的产卵、交配等行为,对协调生物体之间的相互作用以及维持整个种群的发展起到了重要的作用,夜蛾科性信息素通信可以确保雄性和雌性相互识别与交配,性信息素已用于多种害虫的检测,在蛾类配偶识别中性信息素起到关键作用。干扰性信息素使雄虫丧失寻找雌虫的定向能力,致使田间雌、雄虫交配几率大为减少,从而使下一代虫口密度急剧下降。
性信息素是蛾类物种求爱和交配的重要嗅觉信号,雌虫在腹部尖端的特殊腺体产生一种特定的性信息素,同种雄虫被其吸引[57-58]。应用性信息素防治害虫的控制效果与昆虫的生殖方式有关,如交配行为、生殖方式和飞行能力等[59]。昆虫延迟交配使昆虫当代的生殖力、卵孵化率、交配以及寿命受到抑制,控制了昆虫后代的危害,从而达到防治效果。延迟交配在小眼夜蛾 Panolis flammea和棉红铃虫Pectinophora gossypiella的防治中起到了一定的效果[60-61]。性信息素的合成和释放受信息素生物合成激活神经肽(PBAN)的调节[62],性信息素合成并应用于田间干扰昆虫交配已成为农业上重要的鳞翅目害虫管理(IPM)的可行策略。Kim等[62]确定了来自烟蚜夜蛾Heliothis virescens的PBAN受体(PBANR)促进飞蛾中性信息素的合成和释放,阐明了PBAN类似物的构效关系,为PBANR特异性激动剂和拮抗剂提供了框架,可破坏害虫生殖功能,达到防治害虫的目的。
Sekul和Sparks[63-64]初步确定Z9-14:Ac是草地贪夜蛾的主要性信息素的组分,随后Tumlinson 等[65]进一步确定草地贪夜蛾性信息素成分有7种化合物。来自北美的草地贪夜蛾性信息素成分有Z7-12:Ac、Z9-12:Ac、Z9-14:Ac和Z11-16:Ac[66-67];而瓜德罗普岛报道的主要成分有Z9-12:Ac、Z9-14:Ac和Z11-16:Ac[68]。在巴西,除了有Z9-14:Ac和Z11-16:Ac外,还报道了E7-12:Ac的存在[69]。地理种群不同,草地贪夜蛾信息素的组分和比例存在一定的差异[30, 70]。
草地贪夜蛾玉米品系和水稻品系的交配节律不同,雌性玉米品系释放性信息素和交配发生在深夜,水稻品系发生在后半夜[71-72]。以活体雌性作为信息素诱剂的诱饵,在诱捕器中发现雌性的玉米品系吸引了更多的雄性玉米品系,雌性水稻品系吸引了更多的雄性水稻品系[71]。对佛罗里达州收集的雌性信息素腺体提取物分析表明,雌性的玉米品系中Z7-12:OAc和Z9-12:OAc相对含量远低于水稻品系[70-71]。但是,在路易斯安那州和佛罗里达州进行不同雄性引诱试验结果表明,雄性对同一品系的雌性并没有持续的吸引作用[71],这表明雌性信息素的差异不足以引起雌性交配。草地贪夜蛾在雌性信息素混合物和雄性反应中存在地理差异[30, 71]。
草地贪夜蛾性信息素组成存在种内地理差异,来自不同地方的草地贪夜蛾性信息素的成分不同,玉米品系和水稻品系信息素变化也存在一定的差异[27]。通过改变草地贪夜蛾性信息素组分比例合成性引诱剂,并与雌虫释放的性信息素竞争,使雄虫产生错误信息,从而影响草地贪夜蛾的交配。探究草地贪夜蛾性信息素生物合成的关键因子,对于理解草地贪夜蛾利用性信息素交流产生种间隔离过程具有重要意义,可为害虫防治提供新思路。
3 小结与展望针对草地贪夜蛾在中国入侵爆发、防治需求迫切的形势,充分利用草地贪夜蛾生殖特性,通过损坏其遗传系统、诱发遗传紊乱或不育、干扰雌雄虫交配,进而降低种群数目等策略,结合并完善现有RNAi干扰或者基因编辑等遗传调控技术,构建特异性强、对环境友好、对人畜无害的绿色防控措施,对于减少农药使用量,有效控制草地贪夜蛾具有重要的理论和实践意义。
| [1] |
CRUZ I, TURPIN F T. Yield impact of larval infestations of the fall armyworm (Lepidoptera: Noctuidae) to midwhorl growth stage of corn[J]. J Econ Entomol, 1983, 76(5): 1052-1054. DOI:10.1093/jee/76.5.1052 (  0) 0) |
| [2] |
SPARKS A N. A review of the biology of the fall armyworm[J]. Fla Entomol, 1979, 2(62): 82-87. (  0) 0) |
| [3] |
CRUZI D D B. Using sex pheromone traps in the decision-making process for pesticide application against fall armyworm [Spodoptera frugiperda(Smith)(Lepidoptera: Noctuidae)] larvae in maize
[J]. Int J Pest Manage, 2012, 1(58): 83-90. (  0) 0) |
| [4] |
江幸福, 张蕾, 程云霞, 等. 草地贪夜蛾迁飞行为与监测技术研究进展[J]. 植物保护, 2019, 45(1): 12-18. (  0) 0) |
| [5] |
张蕊.多数地区“见虫未见灾”, 草地贪夜蛾对我国玉米主产区威胁全面解除, 下一步防治任务仍艰巨[R/OL]. (2019-09-17). https://m.nbd.com.cn/articles/2019-09-17/1372416.html.
(  0) 0) |
| [6] |
全国农业技术推广服务中心.植物病虫情报第26期2019年下半年玉米病虫害发生趋势预报[EB/OL].(2019-07-26).https://www.natesc.org.cn/Html/2019_07_26/28092_151760_2019_07_26_459392.html.
(  0) 0) |
| [7] |
PRASANNA B M, HUESING J E, EDDY R, et al. Fall armyworm in Africa: A guide for integrated pest management[M]. Tanzania: USAID, 2018.
(  0) 0) |
| [8] |
KNIPLING E F. Possibilities of insect control or eradication through the use of sexually sterile males[J]. J Econ Entomol, 1955, 48(4): 459-462. DOI:10.1093/jee/48.4.459 (  0) 0) |
| [9] |
SEREBROVSKII A S. On the possibility of a new method for the control of insect pests[J]. Zoologicheskill Zhurnal, 1969, 19: 618-680. (  0) 0) |
| [10] |
曾保胜, 许军, 陈树清, 等. 昆虫种群的遗传调控[J]. 中国科学: 生命科学, 2013, 43(12): 1098-1104. (  0) 0) |
| [11] |
HORN C, WIMMER E A. A transgene-based, embryo-specific lethality system for insect pest management[J]. Nat Biotechnol, 2003, 21(1): 64-70. DOI:10.1038/nbt769 (  0) 0) |
| [12] |
BLACKIV W C, ALPHEY L, JAMES A A. Why RIDL is not SIT[J]. Trends Parasitol, 2011, 27(8): 362-370. DOI:10.1016/j.pt.2011.04.004 (  0) 0) |
| [13] |
DYCK V A, GRAHAM S H, BLOEM K A. Implementation of the sterile insect release programme to eradicate the codling moth, Cydia pomonella (L.) (Lepidoptera: Olethreutidae), in British Columbia, Canada[C]// IAEA.Management of insect pests: Nuclear and related molecular and genetic techniques. Vienna: IUEA, 1992: 285-297.
(  0) 0) |
| [14] |
VREYSEN M J B, CARPENTER J E, MAREC F. Improvement of the sterile insect technique for codling moth Cydia pomonella (Linnaeus) (Lepidoptera Tortricidae) to facilitate expansion of field application
[J]. J Appl Entomol, 2010, 134(3): 165-181. DOI:10.1111/j.1439-0418.2009.01430.x (  0) 0) |
| [15] |
朱军. 遗传学[M]. 2版. 北京: 中国农业出版社, 2001.
(  0) 0) |
| [16] |
STRUNNIKOV V. Sex control in silkworms[J]. Nature, 1975, 5504(255): 111-113. (  0) 0) |
| [17] |
大沼昭夫. 蚕の食性突然変異に関する研究 (第 2 部) 第 12 報食性変異遺伝子 (Nps) の第 3 連関群における座位[J]. 蚕研彙報, 1989, 37: 15-22. (  0) 0) |
| [18] |
STRUNNIKOV V A. On the prospects of using balanced sex-linked lethals for insect pest control[J]. Theor Appl Genet, 1979, 55(1): 17-21. DOI:10.1007/BF00282971 (  0) 0) |
| [19] |
STRUNNIKOV V A. Artificial sex control in the silkworm (Bombyx mori): 1: The origination of sex labeled silkworm strain[M]. Genetika: Academia Nauk (USSR), 1969: 52-71.
(  0) 0) |
| [20] |
何克荣, 祝新荣, 黄健辉. 家蚕性连锁平衡致死系性别控制基因转移方法研究[J]. 中国农业科学, 2002, 35(2): 213-217. DOI:10.3321/j.issn:0578-1752.2002.02.019 (  0) 0) |
| [21] |
WARD L. The genetics of curly wing in Drosophila: Another case of balanced lethal factors
[J]. Genetics, 1923, 8(3): 276-300. (  0) 0) |
| [22] |
清久正夫佃律子. 人工不妊昆虫の生態に関する研究[J]. 日本応用動物昆虫学会誌, 1969, 2(13): 61-69. (  0) 0) |
| [23] |
PEREZ D E, WU C I. Further characterization of the Odysseus locus of hybrid sterility in Drosophila: One gene is not enough
[J]. Genetics, 1995, 140(1): 201-206. (  0) 0) |
| [24] |
禾本. 澳大利亚:引入昆虫不育技术对抗果蝇[J]. 中国果业信息, 2015, 32(10): 34. (  0) 0) |
| [25] |
HEINRICH J C, SCOTT M J. A repressible female-specific lethal genetic system for making transgenic insect strains suitable for a sterile-release program[J]. Proc Natl Acad Sci USA, 2000, 97(15): 8229-8232. DOI:10.1073/pnas.140142697 (  0) 0) |
| [26] |
THOMAS D D, DONNELLY C A, WOOD R J, et al. Insect population control using a dominant, repressible, lethal genetic system[J]. Science, 2000, 287(5462): 2474-2476. DOI:10.1126/science.287.5462.2474 (  0) 0) |
| [27] |
PASHLEY D P, MARTIN J A. Reproductive incompatibility between host strains of the fall armyworm (Lepidoptera: Noctuidae)[J]. Ann Entomol Soc Am, 1987, 80(6): 731-733. DOI:10.1093/aesa/80.6.731 (  0) 0) |
| [28] |
VELÁSQUEZ-VÉLEZ M I, SALDAMANDO-BENJUMEA C I, RIOS-DIEZ J D. Reproductive isolation between two populations of Spodoptera frugiperda (Lepidoptera: Noctuidae) collected in corn and rice fields from Central Colombia
[J]. Ann Entomol Soc Am, 2011, 104(4): 826-833. DOI:10.1603/AN10164 (  0) 0) |
| [29] |
NAGOSHI R N, MEAGHER R L. Tandem-repeat sequence in fall armyworm (Lepidoptera: Noctuidae) host strains[J]. Ann Entomol Soc Am, 2003, 96(3): 329-335. DOI:10.1603/0013-8746(2003)096[0329:FTSIFA]2.0.CO;2 (  0) 0) |
| [30] |
GROOT A T, MARR M, SCHÖFL G, et al. Host strain specific sex pheromone variation in Spodoptera frugiperda
[J]. Front Zool, 2008, 20(5): 1-13. (  0) 0) |
| [31] |
HALDANE M.A. Sex ratio and unisexual sterility in hybrid animals[J]. J Genet, 1922, 12(2): 101-109. DOI:10.1007/BF02983075 (  0) 0) |
| [32] |
KOST S, HECKEL D G, YOSHIDO A. AZ‐linked sterility locus causes sexual abstinence in hybrid females and facilitates speciation in Spodoptera frugiperda
[J]. Evolution, 2016, 70(6): 1418-1427. DOI:10.1111/evo.12940 (  0) 0) |
| [33] |
LYNCH M, FORCE A G. The origin of interspecific genomic incompatibility via gene duplication[J]. Am Nat, 2000, 156(6): 590-605. DOI:10.1086/316992 (  0) 0) |
| [34] |
MASLY J P, JONES C D, NOOR M A F. Gene transposition as a cause of hybrid sterility in Drosophila
[J]. Science, 2006, 5792(313): 1448-1450. (  0) 0) |
| [35] |
WIGGLESWORTH V B. The function of the corpus allatum in the growth and reproduction of Rhodnius prolixus
[J]. Quart J Micr Sci, 1936, 79: 91-119. (  0) 0) |
| [36] |
WYATT G R, DAVEY K G. Cellular and molecular actions of juvenile hormone: 2: Roles of juvenile hormone in adult insects[J]. Adv Insect Physiol, 1996, 26: 1-155. DOI:10.1016/S0065-2806(08)60030-2 (  0) 0) |
| [37] |
叶恭银, 龚和. 保幼激素和蜕皮激素对天蚕卵巢发育的影响[J]. 浙江农业大学学报, 1999, 25(3): 276-280. (  0) 0) |
| [38] |
RAMASWAMY S B, SHU S, PARK Y I, et al. Dynamics of juvenile hormone-mediated gonadotropism in the Lepidoptera[J]. Arch Insect Biochem Physiol, 1997, 35(4): 539. (  0) 0) |
| [39] |
RAMASWAMY S B, MBATABATA G N, COHEN N E. Necessity of juvenile hormone for choriogenesis in the moth, Heliothis virescens (Noctuidae)
[J]. Invertebr Reprod Dev, 1990, 17(1): 57-63. DOI:10.1080/07924259.1990.9672088 (  0) 0) |
| [40] |
REZA A M S, KANAMORI Y, SHINODA T, et al. Hormonal control of a metamorphosis specific transcriptional factor broad-complex in silkworm[J]. Comp Biochem Phys B, 2004, 139(4): 753-761. DOI:10.1016/j.cbpc.2004.09.009 (  0) 0) |
| [41] |
PARTHASARATHY R, SUN Z, BAI H, et al. Juvenile hormone regulation of vitellogenin synthesis in the red flour beetle, Tribolium castaneum
[J]. Insect Biochem Molec, 2010, 40(5): 405-414. DOI:10.1016/j.ibmb.2010.03.006 (  0) 0) |
| [42] |
DAVIES E L, LIM J G Y, JOO W J, et al. The transcriptional regulator lola is required for stem cell maintenance and germ cell differentiation in the Drosophila testis
[J]. Dev Biol, 2013, 373(2): 310-321. DOI:10.1016/j.ydbio.2012.11.004 (  0) 0) |
| [43] |
SARTAIN C V, CUI J, MEISEL R P, et al. The poly (A) polymerase GLD2 is required for spermatogenesis in Drosophila melanogaster
[J]. Development, 2011, 138(8): 1619-1629. DOI:10.1242/dev.059618 (  0) 0) |
| [44] |
FATIMA R. Drosophila Dynein intermediate chain gene, Dic61B, is required for spermatogenesis[J/OL]. PLoS One, 2011, 6(12): e27822. [2019-10-08]. https://doi.org/10.1371/journal.pone.0027822.
(  0) 0) |
| [45] |
XU S, HAFER N, AGUNWAMBA B, et al. The CPEB protein Orb2 has multiple functions during spermatogenesis in Drosophila melanogaster[J/OL]. PLoS Genetics, 2012, 8(11): e1003079. [2019-10-08]. https://doi.org/10.1371/journal.pgen.1003079.
(  0) 0) |
| [46] |
WHITE-COOPER H, LEROY D, MACQUEEN A, et al. Transcription of meiotic cell cycle and terminal differentiation genes depends on a conserved chromatin associated protein, whose nuclear localisation is regulated[J]. Development, 2000, 127(24): 5463-5473. (  0) 0) |
| [47] |
TIWARI A K, ROY J K. Rab11 is essential for fertility in Drosophila
[J]. Cell Biol Int, 2008, 32(9): 1158-1168. DOI:10.1016/j.cellbi.2008.04.002 (  0) 0) |
| [48] |
KIMURA S. The Nap family proteins, CG5017/Hanabi and Nap1, are essential for Drosophila spermiogenesis
[J]. FEBS Letters, 2013, 587(7): 922-929. DOI:10.1016/j.febslet.2013.02.019 (  0) 0) |
| [49] |
TOBBACK J, BOERJAN B, VANDERSMISSEN H P, et al. Male reproduction is affected by RNA interference of period and timeless in the desert locust Schistocerca gregaria
[J]. Insect Biochem Mol Biol, 2012, 42: 109-115. DOI:10.1016/j.ibmb.2011.11.003 (  0) 0) |
| [50] |
LIM C, TARAYRAH L, CHEN X. Transcriptional regulation during Drosophila spermatogenesis
[J]. Spermatogenesis, 2012, 2(3): 158-166. DOI:10.4161/spmg.21775 (  0) 0) |
| [51] |
CHENG Y J, FANG S, TSAUR S C, et al. Reduction of germ cells in the Odysseus null mutant causes male fertility defect in Drosophila melanogaster
[J]. Genes Genet Syst, 2012, 87(4): 273-276. DOI:10.1266/ggs.87.273 (  0) 0) |
| [52] |
WHITE-COOPER H. Molecular mechanisms of gene regulation during Drosophila spermatogenesis
[J]. Reproduction, 2010, 139(1): 11. DOI:10.1530/REP-09-0083 (  0) 0) |
| [53] |
XU J J, RAMAN C, ZHU F, et al. Identification of nuclear receptors involved in regulation of male reproduction in the red flour beetle, Tribolium castaneum
[J]. J Insect Physiol, 2012, 58: 710-717. DOI:10.1016/j.jinsphys.2012.02.006 (  0) 0) |
| [54] |
DONG Y C. Bactrocera dorsalis male sterilization by targeted RNA interference of spermatogenesis: Empowering sterile insect technique programs
[J]. Sci Rep, 2016, 6: 35750. DOI:10.1038/srep35750 (  0) 0) |
| [55] |
ZHENG X, ZHANG D, LI Y, et al. Incompatible and sterile insect techniques combined eliminate mosquitoes[J]. Nature, 2019, 7767(572): 56-61. (  0) 0) |
| [56] |
HALL A B, PAPATHANOS P A, SHARMA A, et al. Radical remodeling of the Y chromosome in a recent radiation of malaria mosquitoes[J]. Proc Natl Acad Sci USA, 2016, 113(15): 2114-2123. DOI:10.1073/pnas.1525164113 (  0) 0) |
| [57] |
PERCY-CUNNINGHAM J E, MACDONALD J A. Biology and ultrastructure of sex pheromone–producing glands[M]// Elsevier. Pheromone biochemistry. Academic Press, 1987: 27-75.
(  0) 0) |
| [58] |
RAINA A K, WERGIN W P, MURPHY C A, et al. Structural organization of the sex pheromone gland in Helicoverpa zea in relation to pheromone production and release
[J]. Arthropod Struct Dev, 2000, 29(4): 343-353. DOI:10.1016/S1467-8039(01)00014-7 (  0) 0) |
| [59] |
王香萍, 张钟宁. 延迟交配对昆虫生殖行为的影响以及与性信息素防治害虫的关系[J]. 昆虫知识, 2004, 41(4): 295-298. DOI:10.3969/j.issn.0452-8255.2004.04.003 (  0) 0) |
| [60] |
MARTINEZ V J, SAAR E. Statistics of the galaxy distribution[M]. Chapman and Hall/CRC, 2001:785-792..
(  0) 0) |
| [61] |
LEATHER S R, BURNAND A C. Factors affecting life-history parameters of the pine beauty moth, Panolis flammea (D&S): The hidden costs of reproduction
[J]. Funct Ecol, 1987(1): 331-338. DOI:10.2307/2389789 (  0) 0) |
| [62] |
KIM Y J, NACHMAN R J, AIMANOVA K, et al. The pheromone biosynthesis activating neuropeptide (PBAN) receptor of Heliothis virescens: Identification, functional expression, and structure–activity relationships of ligand analogs
[J]. Peptides, 2008, 29(2): 268-275. DOI:10.1016/j.peptides.2007.12.001 (  0) 0) |
| [63] |
SEKUL A A, SPARKS A N. Sex pheromone of the fall armyworm moth: Isolation, identification, and synthesis[J]. J Econ Entomol, 1967, 60(5): 1270-1272. DOI:10.1093/jee/60.5.1270 (  0) 0) |
| [64] |
SEKUL A A, SPARKS A N. Sex attractant of the fall armyworm moth[M]. Tifton: Southern Grain Research Laboratory, Agricultural Research Service, US Department of Agriculture, 1976.
(  0) 0) |
| [65] |
TUMLINSON J H, MITCHELL E R, TEAL P E A, et al. Sex pheromone of fall armyworm, Spodoptera frugiperda (J E Smith)
[J]. J Chem Ecol, 1986, 12(9): 1909-1926. DOI:10.1007/BF01041855 (  0) 0) |
| [66] |
MITCHELL E R, TUMLINSON J H, MCNEIL J N. Field evaluation of commercial pheromone formulations and traps using a more effective sex pheromone blend for the fall armyworm (Lepidoptera: Noctuidae)[J]. J Econ Entomol, 1985, 78(6): 1364-1369. DOI:10.1093/jee/78.6.1364 (  0) 0) |
| [67] |
DESCOINS C, SILVAIN J F, LALANNE-CASSOU B, et al. Monitoring of crop pests by sexual trapping of males in Guadeloupe and Guyana[J]. Agric Ecosys Environ, 1988, 21(1/2): 53-56. (  0) 0) |
| [68] |
ANDRADE R, RODRIGUEZ C, OEHLSCHLAGER A C. Optimization of a pheromone lure for Spodoptera frugiperda (Smith) in Central America
[J]. J Brazil Chem Soc, 2000, 11(6): 609-613. DOI:10.1590/S0103-50532000000600009 (  0) 0) |
| [69] |
BATISTA-PEREIRA L G, STEIN K, DE PAULA A F, et al. Isolation, identification, synthesis, and field evaluation of the sex pheromone of the Brazilian population of Spodoptera frugiperda
[J]. J Chemical Ecol, 2006, 32(5): 1085-1099. DOI:10.1007/s10886-006-9048-5 (  0) 0) |
| [70] |
UNBEHEND M, HÄNNIGER S, MEAGHER R L, et al. Pheromonal divergence between two strains of Spodoptera frugiperda
[J]. J Chem Ecol, 2013, 39(3): 364-376. DOI:10.1007/s10886-013-0263-6 (  0) 0) |
| [71] |
PASHLEY D P, HAMMOND A M, HARDY T N. Reproductive isolating mechanisms in fall armyworm host strains (Lepidoptera: Noctuidae)[J]. Ann Entomol Soc Am, 1992, 85(4): 400-405. DOI:10.1093/aesa/85.4.400 (  0) 0) |
| [72] |
SCHÖFL G, HECKEL D G, GROOT A T. Time‐shifted reproductive behaviours among fall armyworm (Noctuidae: Spodoptera frugiperda) host strains: Evidence for differing modes of inheritance
[J]. J Evolution Biol, 2009, 22(7): 1447-1459. DOI:10.1111/j.1420-9101.2009.01759.x (  0) 0) |
 2020, Vol. 41
2020, Vol. 41