草地贪夜蛾Spodoptera frugiperda是一种原产于美洲的热带和亚热带地区的杂食性害虫,严重威胁农业生产。其寄主范围广,能够为害玉米、水稻、棉花、大豆等80多种作物[1]。不同的草地贪夜蛾群体通常对特定作物具有取食趋性[2]。田间草地贪夜蛾主要分为玉米型(Corn strain)和水稻型(Rice strain)2个亚群[3]。玉米型主要取食玉米、高粱、棉花,而水稻型的取食性相对较为广谱,主要取食水稻、苜蓿、牧草、小米等作物[4]。除了取食偏好外,2个品系的草地贪夜蛾在生理特征、交配行为和性外激素的组成方面有很大的不同。但是,由于2种寄主型形态学和行为方面的相似性,在田间难以被区分开[5]。因此,对2种寄主型的草地贪夜蛾开展分子鉴定,将有助于了解该入侵物种的遗传结构,掌握害虫的入侵和扩散规律以及制定有效的防控策略[6-7]。
草地贪夜蛾亚群的分类主要根据田间采集的幼虫寄主范围,并结合分子标记的分化进行界定。基于线粒体细胞色素C氧化酶亚基I基因(COI)的分子标记不仅能够区分玉米型和水稻型2个亚群的,而且具备鉴别其亚型的能力,是目前最常用的有效分子条形码[7-10]。另外,有研究表明,根据Z染色体上编码磷酸丙糖异构酶基因(Tpi)开发的分子标记,能够更好地鉴定到草地贪夜蛾雌性“水稻型”和雄性“玉米型”的杂交型[7, 11]。2种标记有机结合能够提高鉴定的准确率[12-13]。
2018年底草地贪夜蛾通过中缅边境进入我国境内,目前已在云南、湖南、广西、广东等地发现其对玉米的为害[14]。广东省是水稻主要种植区,严密监测草地贪夜蛾是否存在为害水稻的风险显得格外重要[15]。另外,广东省为热带和亚热带季风气候区,草地贪夜蛾可在该省越冬,是可阻止其北迁的桥头堡[16]。本研究通过基于COI和Tpi 2个基因片段的分子标记,比较它们对入侵广州的草地贪夜蛾的鉴别能力,为监测虫源扩散规律以及预测预警虫情提供参考。
1 材料与方法 1.1 供试昆虫采集供试草地贪夜蛾于2019年5月12日在广州花都花山镇儒林村玉米地采集。寄主为喇叭口期的春玉米,所有样本均为4~6龄幼虫,6个样本分别标记为1#、2#、3#、4#、5#和6#。单头活体幼虫采集后放入含有新鲜玉米叶片的50 mL离心管,带回实验室进行形态学鉴定后,用液氮速冻储存于−80 ℃用于DNA提取。
1.2 DNA提取和扩增采用DNA/RNA共提取试剂盒(TIANGEN,中国)分别提取单头幼虫DNA和RNA。虫体放入含有1.5 mL DNA抽提液的2 mL离心管内,加入钢珠,放入样品研磨机(Bullet Blender®,美国)处理后,按照试剂盒说明书操作。DNA使用NanoDrop分光光度计(2000,赛默飞世尔)测定质量浓度,稀释到10 ng/μL后,用作PCR扩增模板。
用于PCR扩增COI和Tpi部分基因片段的引物如表1所示,选用的PCR引物在COI基因的相对位置如图1所示。采用PrimeSTAR® Max DNA Polymerase PCR(TaKaRa,日本)进行PCR扩增,反应体系包括PrimeSTAR® Max DNA Polymerase PCR(2×)10 μL,上游引物和下游引物各0.4 μL,模板1 μL,加ddH2O至20 μL;PCR反应为:98 ℃预变性2 min;98 ℃变性10 s,60 ℃退火15 s,72 ℃延伸30 s,35个循环;72 ℃延伸5 min。
|
|
表 1 扩增COI和Tpi基因片段所用引物 Table 1 Primers used for amplifying COI and Tpi gene fragments |
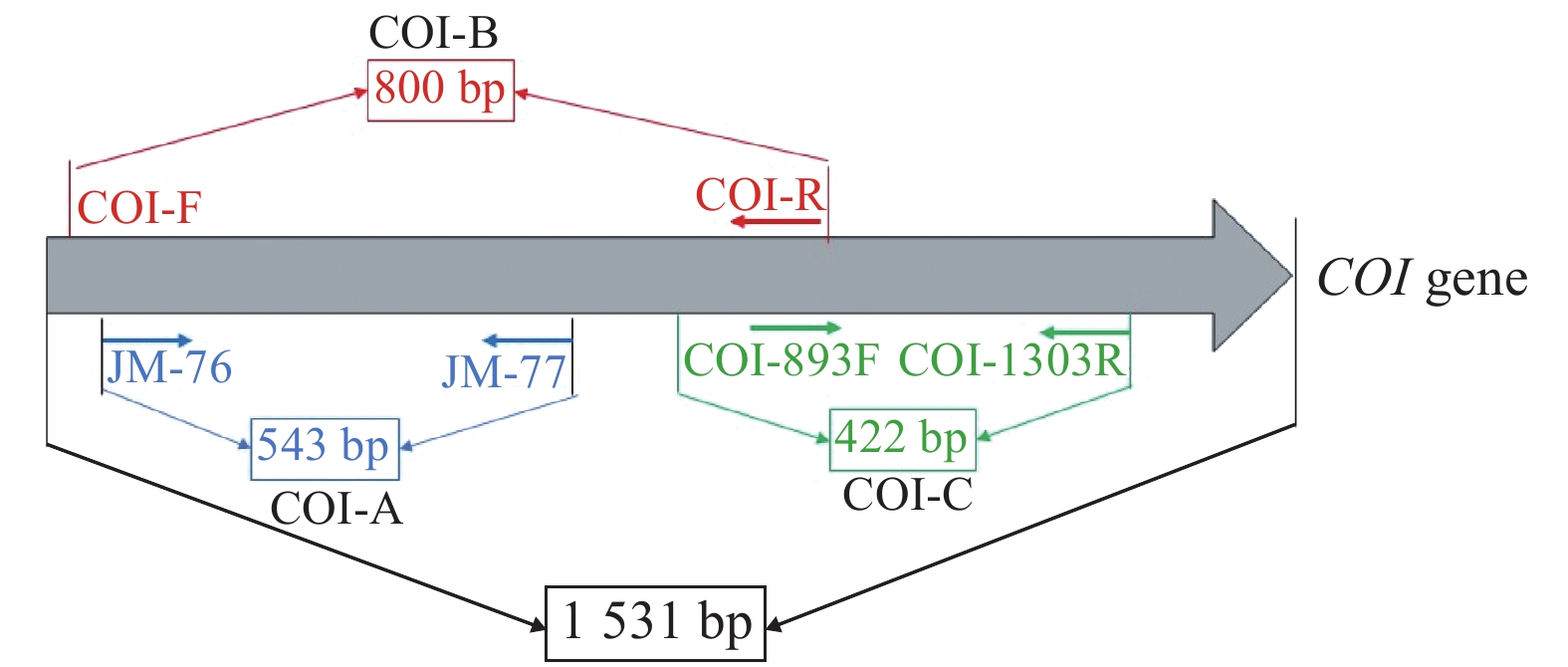
|
图 1 用于单倍型分析的COI基因3 个片段 Fig. 1 Three fragments of COI gene used for haplotype analysis |
使用15 g/L的琼脂糖凝胶电泳检测扩增片段特异性后,PCR产物由广州天一辉远基因科技有限公司进行切胶测序。对于测序结果为双峰或者低质量的样品,则将其PCR产物克隆到pEASY®-Blunt Cloning Vector后,每个样品各挑取10个克隆进行测序。
1.3 序列分析利用Lastergene软件包对正反向测序序列进行人工拼接、峰型校正和序列比对。从GenBank数据库下载已经发布的草地贪夜蛾COI和Tpi基因序列。针对已报道的基于COI和Tpi基因序列的“水稻型”和“玉米型”单倍型特点,分别进行差异位点分析,确定本研究中草地贪夜蛾的具体亚型。
2 结果与分析 2.1 COI标记鉴定草地贪夜蛾单倍型利用标记COI-A,COI-B和COI-C对所采集的6个样品进行了寄主型分析。结果(图2)显示,有5个样品扩增出了预期大小的单一特异性条带,将其PCR产物用于直接测序。
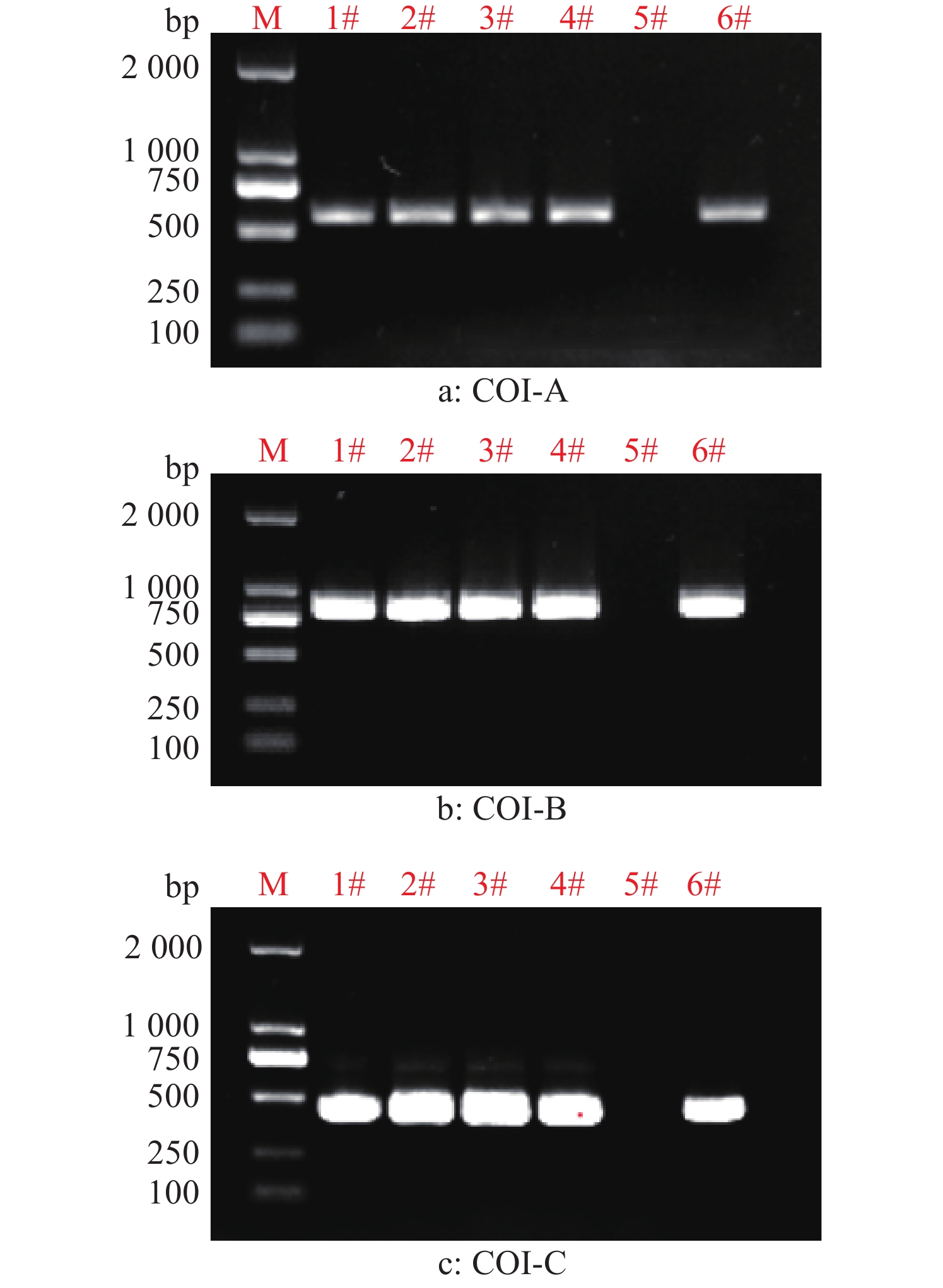
|
图 2 6头草地贪夜蛾COI-A、COI-B和COI-C标记的PCR扩增 Fig. 2 PCR amplification of COI-A, COI-B and COI-C markers from six Spodoptera frugiperda |
对COI-A的序列分析表明,来自4个样品(1#、2#、4#、6#)的序列与已报道的草地贪夜蛾水稻型(HM136593)仅存在一处碱基差异,与玉米型(HM136586)存在8处单碱基差异,说明根据COI-A标记鉴定的寄主型与实际样品来源寄主型并不一致(图3);对样品3#的COI-A产物测序分析发现其为双峰杂合,克隆重新测序后,分别获得了样品3#-1和3#-2两种单倍型。其中,3#-1与上述4个样品检测到的单倍型完全一致,3#-2则与Mythimna separate(KX863042) 对应的片段序列上存在1个碱基的差异,说明3#样品可能是草地贪夜蛾和M. separate的杂合(图3)。

|
图 3 基于COI-A标记的单倍型序列比对 Fig. 3 Haplotype sequence slignments based on COI-A markers HD majority:花都检测到的主要单倍体型;3#-1, 3#-2:样品3#的2种克隆类型 HD majority: Major haplotype in Huadu; 3#-1, 3#-2: Two types of clones from sample 3# |
进一步用COI-B和COI-C标记对样品进行寄主型鉴定,结果表明,除了样品5#无法扩增出条带之外,其余的5个样品均扩增出单一的预期条带。PCR产物测序结果显示所测样品序列完全一致且为水稻型(图2)。
将COI-A、COI-B和COI-C等3个标记的结果相比较,发现COI-A能够区分出草地贪夜蛾和M. separate的2种单倍型,而COI-B和COI-C仅能区分出草地贪夜蛾1种单倍型,说明虽然基于COI基因片段序列鉴定到的草地贪夜蛾寄主型与实际采集寄主种类不相符,但是,COI-A标记具有较好的物种鉴别能力,能够区分出杂合类型。
2.2 TPi标记鉴定草地贪夜蛾单倍型基于Tpi基因片段对所采集的6个样品进行了寄主型分析。除了样品5#无法扩增出条带之外,其余的5个样品均扩增出了预期大小的单一特异性条带(图4)。
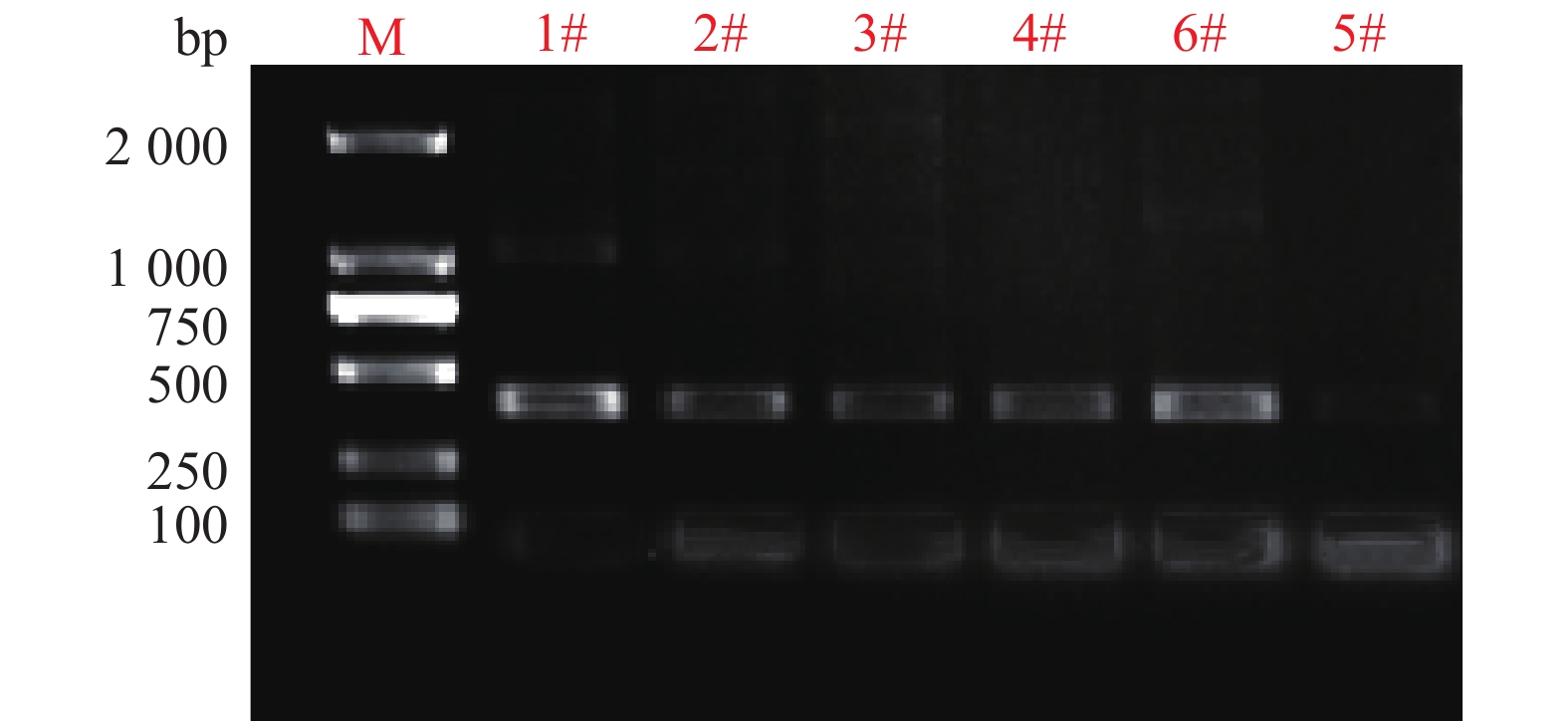
|
图 4 6头草地贪夜蛾Tpi基因片段的PCR扩增 Fig. 4 PCR amplification of Tpi gene fragment from six Spodoptera frugiperda |
对PCR产物进行双向测序并分析其序列差异,结果显示,所检测的序列与已报道玉米型一致,说明基于Tpi基因片段的鉴定结果与样品的寄主来源是一致的。样品2#和样品3#,在第126和127碱基处出现GA/AT的杂合双峰(图5),说明入侵广东的草地贪夜蛾种类并不单一。
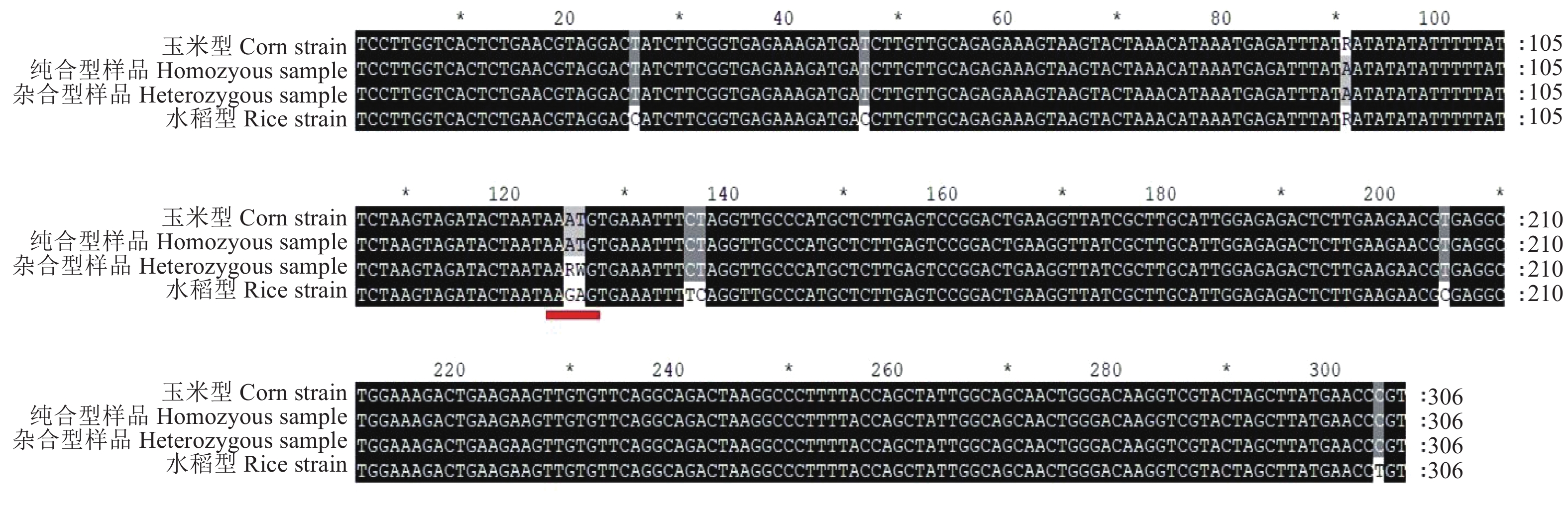
|
图 5 基于Tpi基因标记的单倍型序列比对 Fig. 5 Haplotype sequence alignments based on Tpi gene marker 红色标记为花都样品2#和3#出现杂合(RW)的位置 Red line indicates the heterozygous base pairs (RW) in sample 2# and 3# from Huadu |
本研究采集了入侵广州市的草地贪夜蛾样本,利用基于COI和Tpi基因片段的分子标记进行了寄主型的鉴定。基于COI-A、COI-B和COI-C标记的鉴定结果均显示入侵广州的草地贪夜蛾寄主单倍型为水稻型,与实际采集寄主不相符,可能原因是该标记不适合于检测入侵广州的草地贪夜蛾群体。但基于COI-A的标记能够区分草地贪夜蛾与其他近源种的基因型,为研究入侵草地贪夜蛾的田间行为和扩散提供丰富的信息。而COI-B和COI-C只鉴定到1种单倍型。COI-A和COI-B标记事实上扩增的是COI基因的同一片段,差别在于COI-A标记扩增的片段较小,且使用的是简并引物。因此,COI-A标记具有比COI-B标记和COI-C标记更强的鉴别能力。
Tpi基因标记的鉴定结果显示入侵广州的草地贪夜蛾寄主型为玉米型,与实际采集的寄主一致。基于Tpi基因标记,入侵广州的草地贪夜蛾群体被检测到具有2种单倍亚型,在该片段第126和第127位碱基具有RW杂合。先前报道的入侵云南的群体只有一种单倍型[12],说明草地贪夜蛾可能在扩散的过程中出现遗传杂交现象。
草地贪夜蛾是联合国粮农组织全球预警的跨国界迁飞性重大害虫。目前,入侵我国的草地贪夜蛾主要为害玉米,未见在水稻上定殖为害。华南地区是我国水稻主产区,应慎重评估草地贪夜蛾为害水稻的风险。对于“玉米型”和“水稻型”的区分,仅依靠个别基因的片段进行评估是不全面的[6]。基于微卫星标记的分子指纹分析可以较全面地了解草地贪夜蛾的遗传结构动态变化规律[17]。获得与寄主取食相关基因的信息进而开发基因功能性分子标记,是精准鉴定草地贪夜蛾寄主单倍型的前提[18]。
| [1] |
SPARKSAN. A review of the biology of the fall armyworm[J]. Fla Entomol, 1979, 62(2): 82-87. DOI:10.2307/3494083 (  0) 0) |
| [2] |
GOUIN A, BRETAUDEAU A, NAM K, et al. Two genomes of highly polyphagous lepidopteran pests (Spodoptera frugiperda, Noctuidae) with different host-plant ranges
[J]. Sci Rep-UK, 2017, 7(1): 11816. DOI:10.1038/s41598-017-10461-4 (  0) 0) |
| [3] |
DUMAS P, LEGEAI F, LEMAITRE C, et al. Spodoptera frugiperda (Lepidoptera: Noctuidae) host-plant variants: Two host strains or two distinct species?
[J]. Genetica, 2015, 143(3): 305-316. DOI:10.1007/s10709-015-9829-2 (  0) 0) |
| [4] |
MURÚA M G, NAGOSHI R N, DOS SANTOS D A, et al. Demonstration using field collections that Argentina fall armyworm populations exhibit strain-specific host plant preferences[J]. J Econ Entomol, 2015, 108(5): 203. (  0) 0) |
| [5] |
UNBEHEND M, HÄNNIGER S, MEAGHER R L, et al. Pheromonal divergence between two strains of Spodoptera frugiperda
[J]. J Chem Ecol, 2013, 39(3): 364-376. DOI:10.1007/s10886-013-0263-6 (  0) 0) |
| [6] |
FOTSO KUATE A, HANNA R, DOUMTSOP FOTIO A R P, et al. Spodoptera frugiperda Smith (Lepidoptera: Noctuidae) in Cameroon: Case study on its distribution, damage, pesticide use, genetic differentiation and host plants
[J]. PLoS One, 2019, 14(4): e0215749. DOI:10.1371/journal.pone.0215749 (  0) 0) |
| [7] |
HAJIBABAEI M, JANZEN D H, BURNS J M, et al. DNA barcodes distinguish species of tropical Lepidoptera[J]. P Natl Acad Sci USA, 2006, 103(4): 968-971. DOI:10.1073/pnas.0510466103 (  0) 0) |
| [8] |
NAGOSHI R N, MEAGHER R L, HAYROE M. Inferring the annual migration patterns of fall armyworm (Lepidoptera: Noctuidae) in the United States from mitochondrial haplotypes[J]. Ecol Evol, 2012, 2(7): 1458-1467. DOI:10.1002/ece3.268 (  0) 0) |
| [9] |
LEVY H C, GARCIA-MARUNIAK A, MARUNIAK J E. Strain identification of Spodoptera frugiperda (Lepidoptera: noctuidae) insects and cell line: PCR-RFLP of cytochrome oxidase c subunit i gene
[J]. Fla Entomol, 2002, 85(1): 186-190. DOI:10.1653/0015-4040(2002)085[0186:SIOSFL]2.0.CO;2 (  0) 0) |
| [10] |
NAGOSHI R N, MEAGHER R L, FLANDERS K, et al. Using haplotypes to monitor the migration of fall armyworm (Lepidoptera: Noctuidae) corn-strain populations from Texas and Florida[J]. J Econ Entomol, 2008, 101(3): 742-749. DOI:10.1093/jee/101.3.742 (  0) 0) |
| [11] |
NAGOSHI R N, MEAGHER R L. Using intron sequence comparisons in the triose-phosphate isomerase gene to study the divergence of the fall armyworm host strains[J]. Insect Mol Biol, 2016, 25(3): 324-337. DOI:10.1111/imb.2016.25.issue-3 (  0) 0) |
| [12] |
张磊, 靳明辉, 张丹丹, 等. 入侵云南草地贪夜蛾的分子鉴定[J]. 植物保护, 2019, 45(2): 19-24. (  0) 0) |
| [13] |
NAGOSHI R N, GOERGEN G, TOUNOU K A, et al. Analysis of strain distribution, migratory potential, and invasion history of fall armyworm populations in Northern Sub-Saharan Africa[J]. Sci Rep, 2018, 8(1): 3710. DOI:10.1038/s41598-018-21954-1 (  0) 0) |
| [14] |
吴秋琳, 姜玉英, 吴孔明. 草地贪夜蛾缅甸虫源迁入中国的路径分析[J]. 植物保护, 2019, 45(2): 1-6. (  0) 0) |
| [15] |
NAGOSHI R N. Evidence that a major subpopulation of fall armyworm found in the Western Hemisphere is rare or absent in Africa, which may limit the range of crops at risk of infestation[J]. PLoS One, 2019, 14(4): e0208966. DOI:10.1371/journal.pone.0208966 (  0) 0) |
| [16] |
吴秋琳, 姜玉英, 胡高, 等. 中国热带和南亚热带地区草地贪夜蛾春夏两季迁飞轨迹的分析[J]. 植物保护, 2019, 45(3): 1-9. (  0) 0) |
| [17] |
PAVINATO V A C, MARTINELLI S, DE LIMA P F, et al. Methodology microsatellite markers for genetic studies of the fall armyworm, Spodoptera frugiperda
[J]. Genet Mol Res, 2013, 12(1): 370-380. DOI:10.4238/2013.February.8.1 (  0) 0) |
| [18] |
do NASCIMENTO A R, FRESIA P, CÔNSOLI F L, et al. Comparative transcriptome analysis of lufenuron-resistant and susceptible strains of Spodoptera frugiperda (Lepidoptera: Noctuidae)
[J]. BMC Genomics, 2015, 16(1): 985. DOI:10.1186/s12864-015-2183-z (  0) 0) |
 2020, Vol. 41
2020, Vol. 41


