卵泡抑素相似蛋白1(Follistatin-like protein 1,FSTL1)基因,又名转化生长因子β1诱导蛋白36(TGF-β1-stimulated clone 36,TSC-36)基因,该基因编码的蛋白与卵泡抑素蛋白(一种BMP-4结合蛋白)相似,最初是从小鼠成骨细胞系MC3T3-E1克隆而来[1]。最近,FSTL1被鉴定为一种新型炎症蛋白[2],能促进免疫细胞合成促炎细胞因子和趋化因子[3-4]。FSTL1在炎性疾病的动物模型中介导促炎症事件[5-6],尤其在胶原诱导的小鼠关节炎中[7],血清FSTL1的水平与关节炎的严重程度相关。FSTL1在炎症条件下表达量升高并在治疗后表达量降低[4]。也有研究发现FSTL1蛋白对心脏具有保护作用,在心脏压力超负荷后能减轻心脏肥大症状[8],并可预防心脏缺血性损伤,其机理可能是通过AMP依赖的蛋白激酶(Adenosine 5′-monophosphate-activated protein kinase,AMPK)抑制血管平滑肌细胞(Vascular smooth muscle cell,VSMC)的增殖和迁移,而FSTL1能通过激活AMPK磷酸化,抑制促炎因子表达引起的细胞凋亡[8-9]。此外,在肥胖者的血清中,FSTL1的表达水平高于正常人血清中的水平[10],表明FSTL1可能是肥胖者炎症反应的潜在因子,参与调控肥胖相关性脂肪组织慢性炎症和胰岛素抵抗的发生。刘锐等[11]发现,FSTL1基因在猪中编码的蛋白是除苏门答腊猩猩和黑猩猩外,与人的FSTL1基因编码的蛋白相似性最高的蛋白序列,另外,FSTL1基因在1日龄长白猪的皮下脂肪组织中表达量较高,但其在脂肪发育中的作用机制尚不清楚。
前体脂肪细胞的分化受到一系列转录因子的精细调控,其成功分化为脂肪细胞的标志是脂滴的产生,而脂肪细胞中的脂滴是由甘油三酯和胆固醇酯组成的[12]。过氧化物酶体增殖物激活受体γ(Peroxisome proliferator-activated receptor gamma,PPARγ)和脂肪细胞蛋白2(Adipocyte protein 2,AP2)是前体脂肪细胞转化为脂肪细胞的重要标志蛋白[13];脂蛋白脂肪酶(Lipoprotein lipase,LPL)可以将甘油三酯分解成2种游离脂肪酸和1种单酰甘油分子[14];脂联素(Adiponectin)在糖脂代谢中有着重要的作用,主要参与脂肪酸分解[15];脂肪酸合酶(Fatty acid synthase,FASN)的表达也会促进细胞甘油三酯的降解[16-17]。
本研究以猪前体脂肪细胞为模型,在体外过表达和干扰FSTL1基因,利用甘油三酯测定试剂盒和RT-qPCR检测FSTL1基因对猪前体脂肪分化成脂的影响,为进一步研究FSTL1基因在猪机体脂肪组织生长发育中的功能奠定基础,为后续FSTL1基因对脂肪累积相关代谢疾病等研究提供理论依据。
1 材料与方法 1.1 材料1日龄长白小公猪购自广州市良种猪场;胎牛血清(FBS)、胰酶等细胞培养试剂均购于GIBCO公司;LipofectamineTM 3000在Invitrogen公司购买;氨苄青霉素(Amp)、胰岛素(INS)等小分子试剂均购于Sigma公司;大肠埃希菌Escherichia coli DH5α感受态细胞购于天根生化科技有限公司;T4 DNA连接酶、限制性内切酶购于Fermentas(MBI)公司;质粒相关试剂盒均购于Omega公司;反转录试剂和定量试剂购于TaKaRa公司;组织甘油三酯酶法测定试剂盒购于普利莱基因技术有限公司。
1.2 猪前体脂肪细胞体外培养和诱导分化将小猪处死后采集背部皮下脂肪组织。用含体积分数为1% 双抗的PBS缓冲液清洗,剪碎,经Ⅰ型胶原酶消化1 h,过40 μm筛,离心后用完全培养液吹打均匀,将细胞悬液接种于底面积为75 cm2的培养瓶,置于37 ℃、湿度为95%、CO2体积分数为5%的培养箱中培养,24 h后换液。
将猪前体脂肪细胞接板培养,每2 d换液1次。待细胞生长融合2 d后,用DMEM / F12培养基+10%(φ)FBS+0.5%(φ)双抗+5 μg/mL INS+0.5 mmol/L 3−异丁基−1−甲基黄嘌呤(IBMX)+1 μmol/L地塞米松(DEX)+0.1 μmol/L罗格列酮(RSG)诱导分化4 d,每2 d换液1次,随后用DMEM/ F12+10%(φ) FBS+0.5%(φ)双抗+5 μg/mL INS+0.1 μmol/L RSG继续培养到第8天,每2 d换液1次。
1.3 载体的构建 1.3.1 pcDNA3.1-FSTL1载体构建以1日龄长白公猪肺部组织cDNA为模板扩增过表达片段,片段长度1 342 bp,上游引物:5′-CCCACCTTCCCTTAGAGC-3′;下游引物:5′-TCACTGCCTGCACTCCCT-3′。继而在引物两端添加酶切位点:在上游引物的5′端添加酶切位点EcoRⅠ(识别位点为GAATTC)及在下游引物5′端添加酶切位点XhoⅠ(识别位点为CTCGAG),酶切引物序列如下:上游引物:5′-CCGGAATTCCCCACCTTCCCTTAGAGC-3′;下游引物:5′-CCGCTCGAGTCACTGCCTGCACTCCCT-3′。用限制性内切酶EcoRⅠ和 XhoⅠ将FSTL1基因回收片段及质粒pcDNA3.1 (+)双酶切后连接得到pcDNA3.1-FSTL1质粒。利用菌液PCR、双酶切及测序进行质粒鉴定。
1.3.2 pSilencer 4.1-491和pSilencer 4.1-530沉默子构建首先利用在线设计软件[
|
|
表 1 FSTL1基因shRNA Oligo序列 Table 1 shRNA Oligo sequence of FSTL1 gene |
Oligo序列退火后形成DNA双链,将DNA片段和pSilencer 4.1-CMV neo质粒用限制性内切酶BamHⅠ和HindⅢ进行酶切后,用T4连接酶连接得到pSilencer 4.1-491和pSilencer 4.1-530载体。测序鉴定。
1.4 RT-qPCR按Invitrogen的LipofectamineTM 3000转染试剂说明书分别将质粒pcDNA3.1、pcDNA3.1-FSTL1、pSilencer 4.1-NC、pSilencer 4.1-491和pSilencer 4.1-530转染到猪前体脂肪细胞中,24 h后提取RNA,RT-qPCR检测FSTL1基因的表达。
根据猪FSTL1基因及NCBI网站上猪的基因编码序列,应用Primer Premier 5.0软件,按照RT-qPCR引物设计要求设计相应的引物,由华大基因合成。各基因引物参数见表2。RT-qPCR结果采用2−△△Ct法进行基因相对表达量分析。
|
|
表 2 RT-qPCR引物序列和扩增产物长度 Table 2 RT-qPCR primer sequences and product length |
利用SPSS17.0进行单因素方差分析,结果取3个重复的平均值±标准误用于分析,并采用Duncan’ s法和t检验进行差异显著性分析。
2 结果与分析 2.1 猪前体脂肪细胞中成功过表达FSTL1将重组质粒pcDNA3.1-FSTL1载体进行菌液PCR验证,得到与预期大小相符合的PCR产物;将阳性菌的重组质粒pcDNA3.1-FSTL1进行双酶切验证,发现FSTL1基因片段已经成功插入到表达载体pcDNA3.1(+);将双酶切鉴定正确的pcDNA3.1-FSTL1质粒进行测序,测序结果同样表明猪FSTL1基因过表达载体pcDNA3.1-FSTL1构建成功,可应用于后续试验。将猪FSTL1基因序列提交到GenBank,登录号为KF021281。
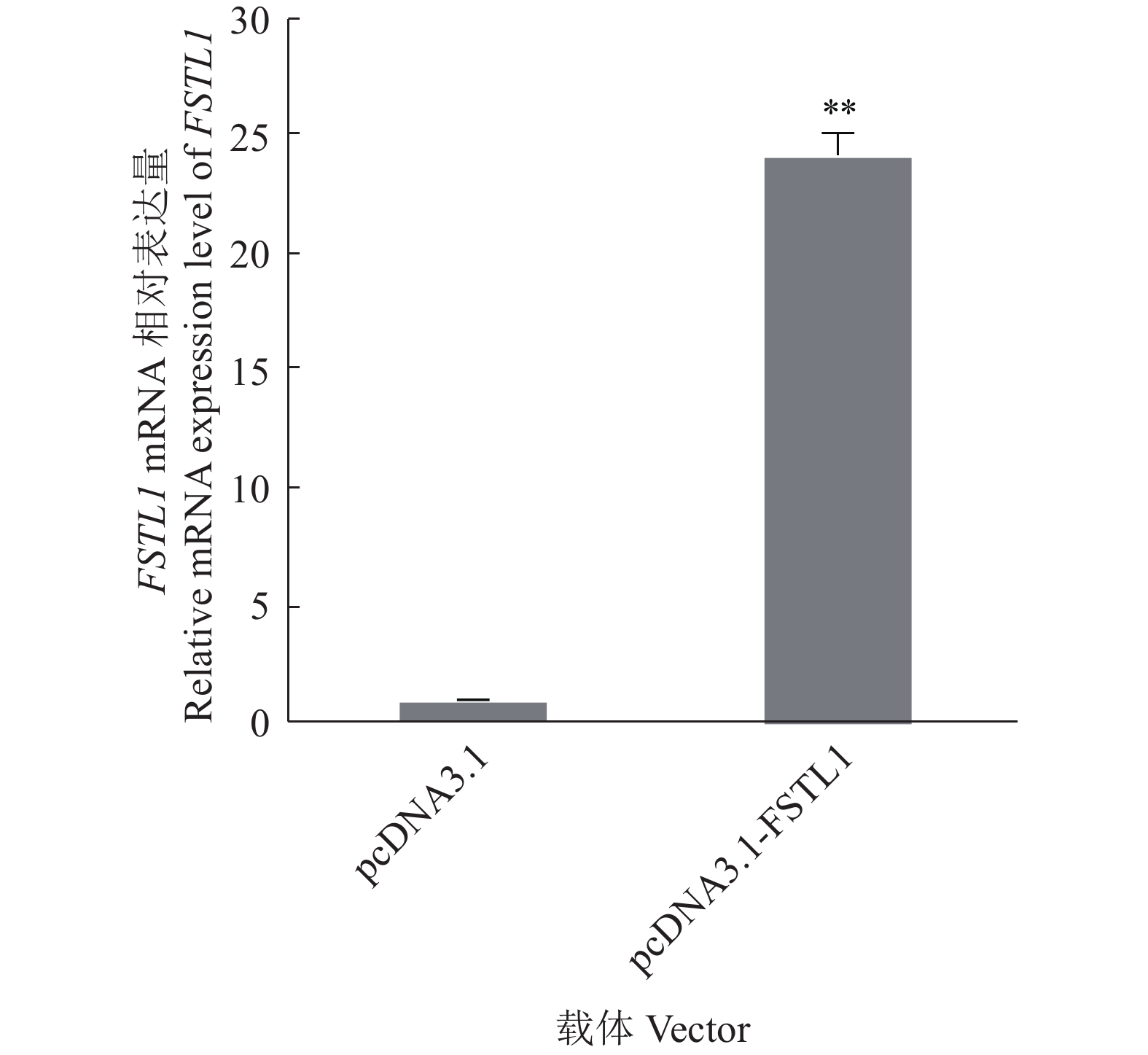
在体外培养猪前体脂肪细胞中转染过表达载体pcDNA3.1-FSTL1,RT-qPCR结果显示,过表达组FSTL1基因的mRNA表达量显著升高至对照组的24倍,说明在猪前体脂肪细胞中成功过表达FSTL1基因(图1)。
|
图 1 RT-qPCR检测FSTL1基因过表达 Fig. 1 Overexpression of FSTL1 gene detected by RT-qPCR “**”表示与对照相比差异显著(P<0.01,t检验) “**” indicates significant difference with the control (P<0.01, t test) |
重组质粒pSilencer 4.1-491和pSilencer 4.1-530经测序鉴定,其shRNA序列与设计的序列完全一致,表明猪FSTL1基因RNAi载体构建成功。
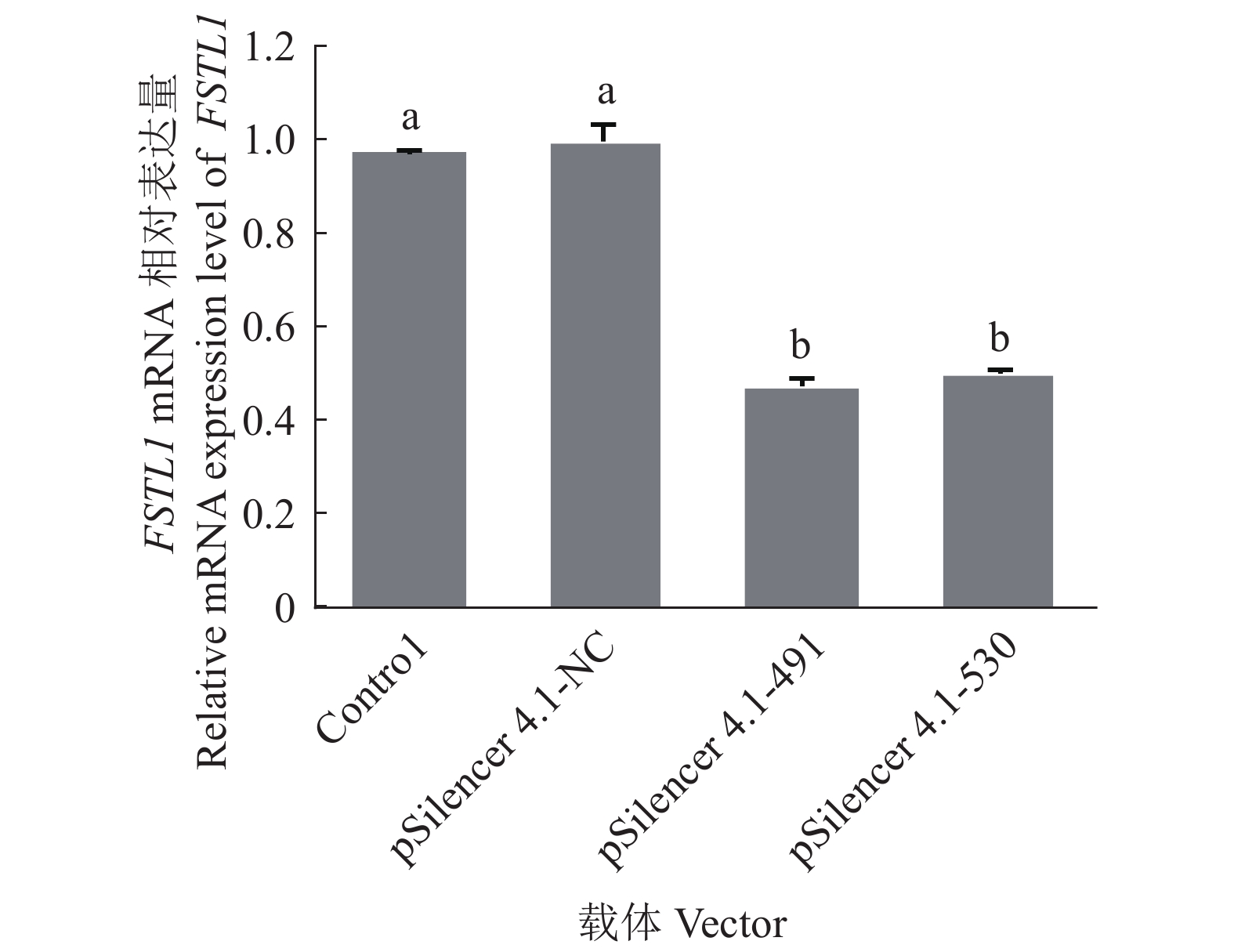
将阴性对照质粒pSilencer 4.1-NC及重组质粒pSilencer 4.1-491和pSilencer 4.1-530进行转染,以未处理的猪前体脂肪细胞作为空白对照组。RT-qPCR结果显示,与空白对照组相比,阴性对照质粒pSilencer 4.1-NC对FSTL1基因的相对表达量无影响;重组质粒pSilencer 4.1-491和pSilencer 4.1-530组的FSTL1基因相对表达量与阴性对照组相比分别降低了52%和49%,差异显著,表明重组质粒pSilencer 4.1-491和pSilencer 4.1-530成功干扰猪前体脂肪细胞中FSTL1基因的mRNA表达(图2),其中重组质粒pSilencer 4.1-491干扰组FSTL1基因的mRNA相对表达量更低。
|
图 2 RNAi载体干扰结果 Fig. 2 Results of RNAi vector interference 柱子上方不同小写字母表示差异显著(P<0.01,Duncan’ s法) Different lowercase letters on bars indicate significant difference (P < 0.01, Duncan’ s test) |
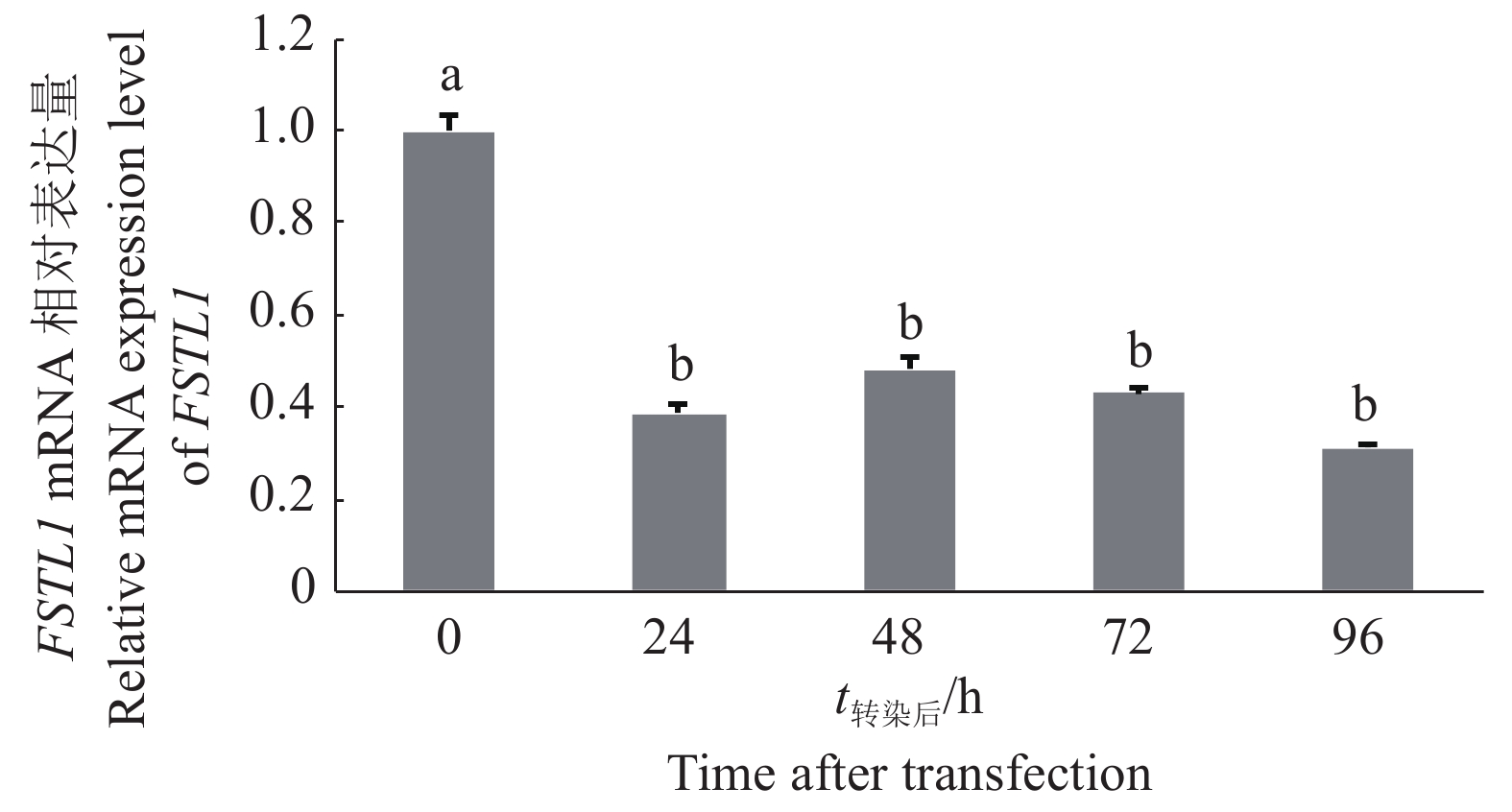
将干扰效率较高的重组质粒pSilencer 4.1-491转染猪前体脂肪细胞,RT-qPCR检测结果显示,与0 h(即未转染时)相比,转染后24、48、72和96 h时FSTL1基因mRNA的相对表达量分别降低了61%、52%、57%和69%,与未转染时相比差异极显著,表明重组质粒pSilencer 4.1-491能稳定干扰FSTL1基因的表达(图3)。
|
图 3 pSilencer 4.1-491干扰后不同时间FSTL1基因的mRNA相对表达量 Fig. 3 Relative mRNA expression of FSTL1 gene after pSilencer 4.1-491 interference 柱子上方不同小写字母表示差异显著(P<0.01,Duncan’ s法) Different lowercase letters on bars indicate significant difference (P < 0.01, Duncan’ s test) |
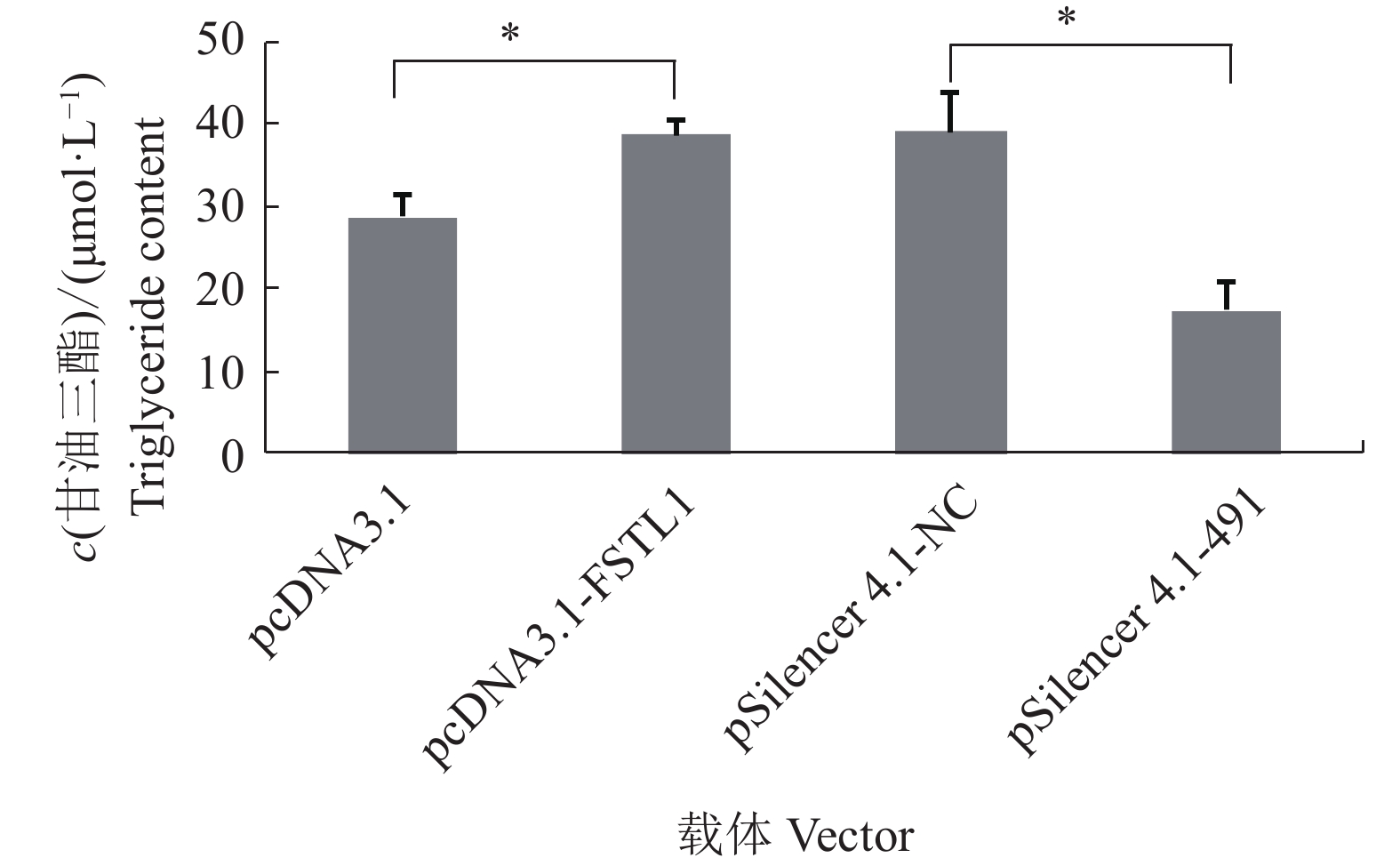
在猪前体脂肪细胞中过表达和干扰FSTL1基因2 d,诱导分化,测定第8天细胞内甘油三酯含量。结果(图4)显示,过表达FSTL1基因显著提高细胞中甘油三酯的含量;干扰后则显著降低细胞内甘油三酯的含量。表明,FSTL1基因促进猪前体脂肪细胞内甘油三酯的蓄积。
|
图 4 脂肪细胞甘油三酯含量 Fig. 4 Porcine adipocytes triglyceride content “*”表示差异显著(P<0.05,t检验) “*” indicates significant difference (P < 0.05, t test) |
在猪前体脂肪细胞中转染过表达和干扰FSTL1载体2 d,诱导分化,收集分化2 d后的样品,RT-qPCR检测脂肪细胞分化相关调节基因PPARγ1、PPARγ2、AP2、LPL、Adiponectin及FASN的mRNA相对表达量。结果表明,过表达FSTL1基因后,PPARγ2和AP2基因的mRNA表达量和对照组相比分别上调了73%和113%,差异极显著;LPL与FASN基因的mRNA表达量和对照组相比下调了44%和16%,差异显著;Adiponectin基因的mRNA表达量和对照组相比下调了79%,差异极显著(图5)。干扰FSTL1基因后,PPARγ1、LPL、FASN基因的mRNA表达量和对照组相比分别上调了32%、88%、103%,差异极显著;Adiponectin基因的mRNA表达量上调了49%,差异显著;而PPARγ2和AP2基因的mRNA表达量和对照组相比下调了18%和39%,差异极显著(图6)。
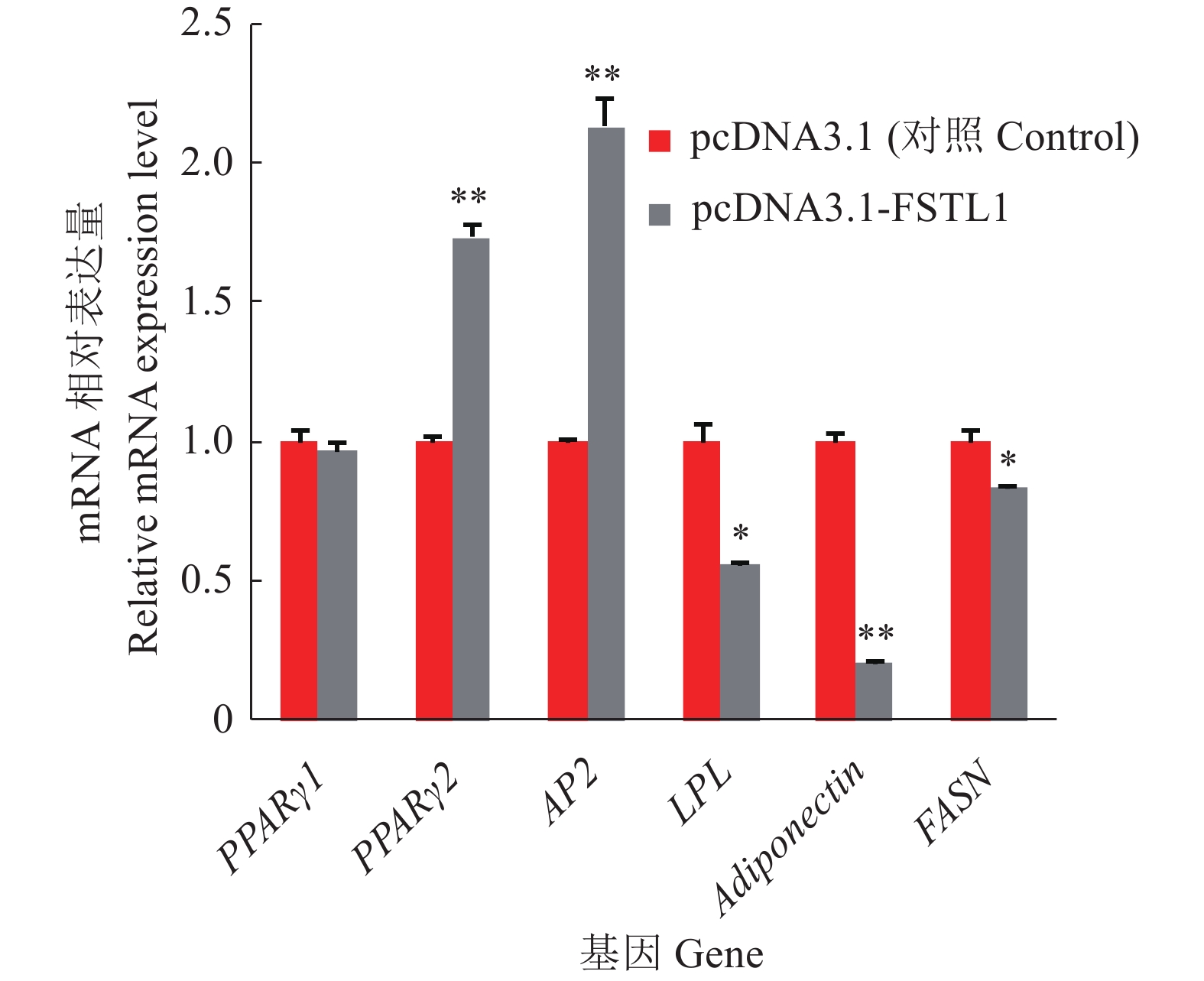
|
图 5 过表达FSTL1基因后脂肪细胞分化相关基因的mRNA相对表达量 Fig. 5 Relative mRNA expression of adipocyte differentiation related genes after overexpression of FSTL1 gene “*”和“**”分别表示与对照相比差异达到0.05和0.01的显著水平 (t检验) “*” and “**” indicate significant difference with the control at 0.05 and 0.01 significance levels, respectively (t test) |
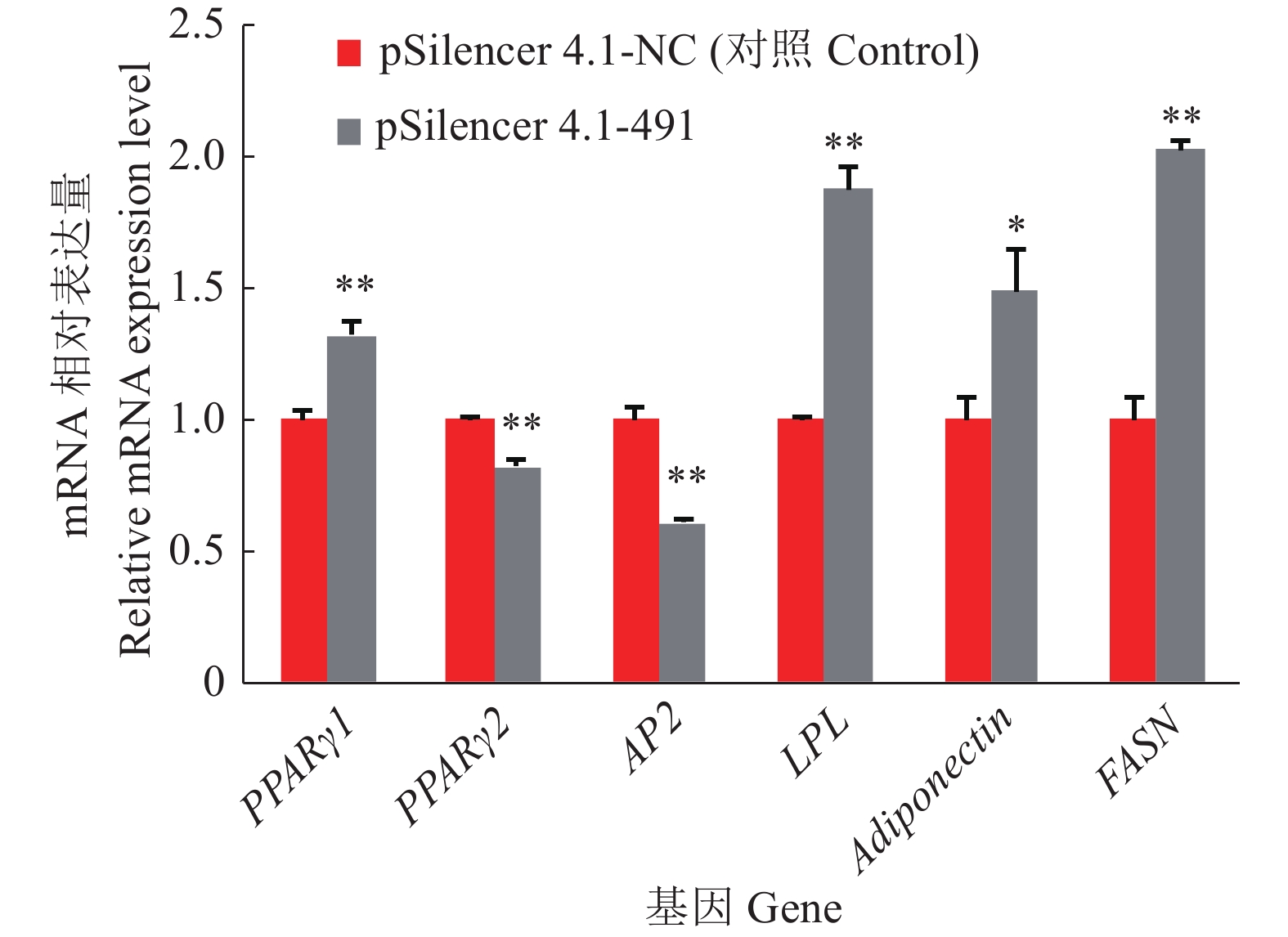
|
图 6 干扰FSTL1基因后脂肪细胞分化相关基因的mRNA相对表达量 Fig. 6 Relative mRNA expression of adipocyte differentiation related genes after interference of FSTL1 gene “*”和“**”分别表示与对照相比差异达到0.05和0.01的显著水平 (t检验) “*” and “**” indicate significant difference with the control at 0.05 and 0.01 significance levels, respectively (t test) |
2013年Fan等[10]发现,相较于野生型的正常小鼠来说,肥胖小鼠中FSTL1的mRNA和蛋白表达量都显著上调,说明FSTL1促进小鼠肥胖。但2018年Horak等[18]根据对肥胖与非肥胖中欧人群的调查研究,发现肥胖受试者的血浆中FSTL1糖蛋白水平显著低于非肥胖受试者,FSTL1蛋白的表达量与肥胖明显呈负相关,这与之前Fan等[10]的研究结果相反。Horak等[18]推断,因为他们采用的肥胖受试者是超级肥胖者(Super obese),与Fan等[10]的研究相比,被检测机体的肥胖程度不同,过度肥胖导致脂肪形成减少,因此无需持续表达FSTL1来促进甘油三酯的合成。本试验发现,过表达FSTL1基因能够促进猪前体脂肪细胞中甘油三酯合成,该结果与前期Fan等[10]的研究结果类似,说明FSTL1能够促进机体脂肪的合成。
2010年Wu等[19]将3T3-L1小鼠前体脂肪细胞诱导分化后,2 d内FSTL1基因的mRNA表达量显著上调,第3天FSTL1基因表达量开始下调,PPARγ和AP2基因的表达显著上调,故提出糖蛋白FSTL1的下调是前脂肪细胞向脂肪细胞成功转化的强有力标志。我们研究发现过表达FSTL1基因后,猪前体脂肪细胞诱导分化2 d后PPARγ2和AP2基因的表达上调,与Wu等[19]研究结果类似;同时在2017年有报道发现敲除3T3-L1前脂肪细胞中的FSTL1基因会损害分化[20],本研究中干扰FSTL1基因后,PPARγ2和AP2基因表达下调,抑制分化,与该报道结果一致,说明FSTL1有利于前体脂肪细胞分化成脂。
小鼠缺乏LPL会导致血液中甘油三酯含量的升高[21];过表达Adiponectin基因会导致脂肪细胞分化受损,敲除Adiponectin基因则会促进脂肪细胞脂滴蓄积[22];2009年又有研究发现LPL和Adiponectin基因表达下调增强脂肪3T3-L1细胞分化[23]。本研究过表达FSTL1基因和干扰FSTL1基因后,发现FSTL1基因使LPL和Adiponectin基因表达下调,该结果与前期Bauche等[22]研究结果类似,说明FSTL1基因通过下调LPL和Adiponectin基因表达促进脂肪细胞分化。
较低的FASN mRNA表达水平有利于肥胖个体甘油三酯的转移、脂肪细胞脂质的积累和脂肪的存储[24]。本研究通过过表达FSTL1基因和干扰FSTL1基因发现,FSTL1基因能抑制FASN表达,与上述研究结果类似,说明FSTL1基因通过抑制FASN的表达促进脂肪的蓄积。
综上所述,本研究发现FSTL1基因可通过上调PPARγ2和AP2基因,下调LPL、Adiponectin、FASN基因的表达,促进猪前体脂肪细胞的分化成脂,抑制细胞甘油三酯的降解,从而提高脂肪细胞中甘油三酯含量。
| [1] |
SHIBANUMA M, MASHIMO J, MITA A, et al. Cloning from a mouse osteoblastic cell line of a set of transforming-growth-factor-beta 1-regulated genes, one of which seems to encode a follistatin-related polypeptide[J]. Eur J Biochem, 1993, 217(1): 13-19. DOI:10.1111/j.1432-1033.1993.tb18212.x (  0) 0) |
| [2] |
陈超群, 蒋涛. 卵泡抑素样蛋白1的研究进展[J]. 医学综述, 2018, 24(1): 40-45. DOI:10.3969/j.issn.1006-2084.2018.01.008 (  0) 0) |
| [3] |
LEE S, KIM D, KYUNG K, et al. High circulating follistatin-like protein 1 as a biomarker of a metabolically unhealthy state[J/OL]. Endoc J, 2019. https://doi.org/10.1507/endocrj.EJ18-0352.
(  0) 0) |
| [4] |
CHALY Y, HOSTAGER B, SMITH S, et al. Follistatin-like protein 1 and its role in inflammation and inflammatory diseases[J]. Immunol Res, 2014, 59(1/2/3): 266-272. DOI:10.1007/s12026-014-8526-z (  0) 0) |
| [5] |
陈媛媛, 陈亚芬, 孙学然, 等. 糖基化终末产物调控糖尿病合并动脉粥样硬化中FSTL1表达的机制研究[J]. 国际心血管病杂志, 2019, 46(1): 31-35. DOI:10.3969/j.issn.1673-6583.2019.01.008 (  0) 0) |
| [6] |
GENG Y, DONG Y, YU M, et al. Follistatin-like 1 (Fstl1) is a bone morphogenetic protein (BMP) 4 signaling antagonist in controlling mouse lung development[J]. P Natl Acad Sci USA, 2011, 108(17): 7058-7063. DOI:10.1073/pnas.1007293108 (  0) 0) |
| [7] |
KAWABATA D, TANAKA M, FUJII T, et al. Ameliorative effects of follistatin-related protein/TSC-36/FSTL1 on joint inflammation in a mouse model of arthritis[J]. Arthritis Rheumat, 2004, 50(2): 660-668. DOI:10.1002/art.20023 (  0) 0) |
| [8] |
CHALY Y, FU Y, MARINOV A, et al. Follistatin-like protein 1 enhances NLRP3 inflammasome-mediated IL-1β secretion from monocytes and macrophages[J]. Eur J Immunol, 2014, 44(5): 1467-1479. DOI:10.1002/eji.201344063 (  0) 0) |
| [9] |
MIYABE M, OHASHI K, SHIBATA R, et al. Muscle-derived follistatin-like 1 functions to reduce neointimal formation after vascular injury[J]. Cardiovasc Res, 2014, 103(1): 111-120. DOI:10.1093/cvr/cvu105 (  0) 0) |
| [10] |
FAN N, SUN H, WANG Y, et al. Follistatin-like 1: A potential mediator of inflammation in obesity[J]. Mediat Inflamm, 2013, 2013: 752519. (  0) 0) |
| [11] |
刘锐, 黎镜聪, 侯连杰, 等. 猪FSTL1基因克隆、鉴定及组织mRNA表达水平分析
[J]. 黑龙江畜牧兽医, 2017(21): 9-12. (  0) 0) |
| [12] |
POOL R. Fat: Fighting the obesity epidemic[M]. Oxfordshire: Oxford University Press, 2001: 68.
(  0) 0) |
| [13] |
BAXA C, SHA R, BUELT M, et al. Human adipocyte lipid-binding protein: Purification of the protein and cloning[J]. Biochemistry, 1989, 28(22): 8683-8690. DOI:10.1021/bi00448a003 (  0) 0) |
| [14] |
MEAD J, IRVINE S, RAMJI, D. Lipoprotein lipase: Structure, function, regulation, and role in disease[J]. JMM, 2002, 80(12): 753-769. DOI:10.1007/s00109-002-0384-9 (  0) 0) |
| [15] |
GAO Y, LI F, ZHANG Y, et al. Silencing of ADIPOQ efficiently suppresses preadipocyte differentiation in porcine[J]. Cell Physiol Biochem, 2013, 31(2/3): 452-461. (  0) 0) |
| [16] |
RUAN H, HACOHEN N, GOLUB T, et al. Tumor necrosis factor-alpha suppresses adipocyte-specific genes and activates expression of preadipocyte genes in 3T3-L1 adipocytes: Nuclear factor-kappaB activation by TNF-alpha is obligatory[J]. Diabetes, 2002, 51(5): 1319-1336. DOI:10.2337/diabetes.51.5.1319 (  0) 0) |
| [17] |
RUAN H, MILES P, LADD C, et al. Profiling gene transcription in vivo reveals adipose tissue as an immediate target of tumor necrosis factor-alpha: Implications for insulin resistance
[J]. Diabetes, 2002, 51(11): 3176-3188. DOI:10.2337/diabetes.51.11.3176 (  0) 0) |
| [18] |
HORAK M, KURUCZOVA D, ZLAMAL F, et al. Follistatin-like 1 is downregulated in morbidly and super obese central-European population[J]. Dis Markers, 2018, 2018: 1-7. (  0) 0) |
| [19] |
WU Y, ZHOU S L, SMAS C M. Downregulated expression of the secreted glycoprotein follistatin-like 1 (Fstl1) is a robust hallmark of preadipocyte to adipocyte conversion[J]. Mech Develop, 2010, 127(3/4): 183-202. DOI:10.1016/j.mod.2009.12.003 (  0) 0) |
| [20] |
PRIETO-ECHAGUE V, LODH S, COLMAN L, et al. BBS4 regulates the expression and secretion of FSTL1, a protein that participates in ciliogenesis and the differentiation of 3T3-L1[J]. Sci Rep, 2017, 7(1): 9765. DOI:10.1038/s41598-017-10330-0 (  0) 0) |
| [21] |
OKUBO M, HORINISHI A, SAITO M, et al. A novel complex deletion-insertion mutation mediated by Alu repetitive elements leads to lipoprotein lipase deficiency[J]. Mol Genet Met, 2007, 92(3): 229-233. DOI:10.1016/j.ymgme.2007.06.018 (  0) 0) |
| [22] |
BAUCHE B, EI M, POTTIER A, et al. Overexpression of adiponectin targeted to adipose tissue in transgenic mice: Impaired adipocyte differentiation[J]. Endocrinology, 2007, 148(4): 1539-1549. DOI:10.1210/en.2006-0838 (  0) 0) |
| [23] |
CHOI S, CHA B, LEE Y, et al. Magnolol enhances adipocyte differentiation and glucose uptake in 3T3-L1 cells[J]. Life Sci, 2009, 84(25/26): 908-914. (  0) 0) |
| [24] |
HUDGINS L, BADAY A, HELLERSTEIN M, et al. The effect of dietary carbohydrate on genes for fatty acid synthase and inflammatory cytokines in adipose tissues from lean and obese subjects[J]. J Nutr Biochem, 2008, 19(4): 237-245. DOI:10.1016/j.jnutbio.2007.02.013 (  0) 0) |
 2020, Vol. 41
2020, Vol. 41


