家蚕Bombyx mori是一种经济昆虫,在我国有着5 000年的饲养历史,在生理学、遗传学、分子生物学和基因组学上取得了丰硕的研究成果。家蚕是典型的卵滞育昆虫,不同品种蚕卵滞育的程度有所不同:北方地区蚕卵多为滞育品种,每年只孵化1次(一化性)或2次(二化性);南方地区气候温暖潮湿,很多品种1年可孵化多次(多化性)[1]。其中,二化性品种可以通过调控母代的催青(解除滞育后的蚕卵在适当温度等条件下诱导孵化的过程)饲养条件,如温度、光照、湿度等来控制子代蚕卵的滞育性[2]。同时,人们在滞育卵产下后的适当时期,通过一些物理、化学方法阻止蚕卵进入滞育,如酸类浸渍、温水浸渍、有机溶剂处理、摩擦、高浓度氧(O2)处理(简称高氧法)等[3-7],使蚕卵进入活化状态,按照人们生产生活的需要生长发育。在蚕业生产上,传统采用HCl处理法(简称HCl法)阻断或者解除滞育。该方法对处理条件要求严格,导致蚕卵死亡的情况时有发生,并且HCl的大量使用对环境会造成一定的危害,找到更安全、环保、便捷的阻断滞育方法是保证蚕业生产顺利发展的重要内容。
随着转座子在家蚕转基因中的不断完善,转基因技术在家蚕基因功能研究、遗传素材创新和生物反应器开发等领域发挥了重要作用[8-12]。由于转基因家蚕制备需要经过筛选、验证、杂交等多个步骤,还需要经过多代饲养获得纯品系,目前多化性品种的蚕卵仍然是转基因家蚕研究的首选材料。可是,多化性材料必须进行连续饲养,不仅增加了生产成本和转基因系统丢失的风险,而且多化性材料的经济性状跟实用的二化性品种比较起来还有一定差距,在产业应用中受到一定的影响。有研究者曾通过早浸酸(即传统的HCl法)、低温催青[13-14]等方法处理二化性品种的蚕卵,试图获得转基因家蚕的非滞育卵,但是存在早浸酸时间范围与显微注射时间冲突及低温催青时间过长等问题,使得这些方法在科研和生产应用上受到了限制。因此,有必要探寻更为高效的控制蚕卵滞育性的技术和方法,满足蚕桑生产和转基因研究对不同化性品种的需求。
本研究,采用高氧法对不同化性品种蚕卵和转基因蚕卵材料进行阻断滞育,调查处理后二化性蚕卵阻断滞育的效果,对最佳处理条件进行筛选;以高氧法优选的处理条件,对照生产上传统的HCl法处理,比较二者阻断滞育的效果。进而将该方法应用于一化性品种和显微注射的转基因蚕卵阻断滞育,期望为生产上替代传统阻断滞育的HCl法和在家蚕转基因技术中加快转基因材料选育进度提供安全环保的新方法。
1 材料与方法 1.1 试验材料本研究所使用试验材料为二化性家蚕品种‘大造’,由西南大学家蚕基因资源库提供,母代材料在25 ℃条件下催青,戊3胚子前自然光照,戊3胚子后每天18 h长光照。蛹期25 ℃、相对湿度(RH)75%和自然光照保护,羽化后同一饲育区交配制种,产下滞育卵。另一试验材料为一化性家蚕品种‘土耳其’,由中国农业科学院蚕业研究所提供。常规催青、常规饲养,蛹期25 ℃、RH75%和自然光照保护,羽化后同一饲育区交配制种,产下滞育卵。
1.2 载体材料pBac[3xp3EGFP]载体[15]由家蚕基因组国家重点实验室提供。
1.3 主要试剂及仪器纯氧(重庆强胜气体有限公司),HCl(重庆科试),三气培养箱(HF100,力康),人工气候箱(PGX-300C,宁波东南),扫描电镜(JCM 500,NIKON),显微注射仪(Eppendorf, 德国)。
1.4 主要溶液及配制HCl溶液:将HCl原液缓慢倒入纯水中,搅拌均匀,待温度降至室温后用比重计测量其相对密度为1.100。
PBS缓冲液:Na2HPO4 0.72 g,KH2PO4 0.12 g,NaCl 4 g,KCl 0.1 g,ddH2O 400 mL,pH调至7.4,定容至500 mL。
1.5 主要试验方法及步骤 1.5.1 蚕卵的处理1)高氧法:参考Sonobe等[5]的研究,产卵后20 h的蚕卵,用体积分数(φ)为30%、40%、50%、60%、70%和80%的O2分别处理40 h,每处理重复28个蛾圈;产卵后4、12、20、32和48 h的蚕卵,用φ为70%的O2分别处理10、20、30、40、50、60和72 h,每处理重复3个蛾圈,从而筛选最佳条件。
2) HCl法:滞育卵产后20 h用HCl进行处理[室温 25 ℃,相对密度(比重)为 1.100的HCl溶液浸酸70 min],用流水洗净,晾干,各处理均重复3个蛾圈。
高氧法和HCl法的‘大造’蚕卵孵化率、孵化时间比较中,调查3个蛾圈。高氧法应用于‘土耳其’蚕卵时,重复15个蛾圈。为了保证材料的准确性,在所有处理取材的过程中,同一蛾圈取一半蚕卵,观察其滞育性。
1.5.2 蚕卵电镜扫描高氧法和HCl法处理的‘大造’蚕卵和未处理的滞育卵,在产后的20、48 和72 h及5和9 d分别取样,每次取20粒蚕卵,先用 1×PBS 进行清洗,洗去卵壳表面附着物。采用戊二醛和锇酸双固定:取洗净的蚕卵置于φ为2.5%戊二醛中,4 ℃条件下固定2 h,然后用1×PBS缓冲液漂洗3次,每次漂洗10 min;接着用φ为1%的锇酸固定2 h,用0.1 mol/L的PBS 缓冲液漂洗3次,每次漂洗10 min。经过双固定的样品,用乙醇和叔丁醇进行梯度脱水,样品在空气中自然干燥。干燥好的样品用导电胶粘贴在扫描电镜的载物台上,离子溅射仪镀膜后用扫描电镜对蚕卵表面进行观察。
1.5.3 蚕卵显微注射1)以‘大造’品种作为材料,获取滯育蚕卵:将蚕蛾交配拆对后投放于上浆的蚕粘纸,在黑暗或者弱光的环境中产卵,每间隔1 h收集1次蚕卵,获得G0代蚕卵并将其置于室温的环境中保护;
2)将蚕卵用镊子转移至用φ为75%的乙醇溶液消毒的载玻片上,排列整齐,取刚搜集的蚕卵用显微注射仪将1~15 nL、总质量浓度400 ng/μL的piggyBac空载:pBac[3xp3EGFP]转座载体质粒从蚕卵腹面中央注入,并用无毒的胶水封闭卵壳注射留下的小孔,显微注射在产后2~4 h内完成,得到转基因滯育蚕卵;
3)将注射蚕卵在产后20 h经φ为35%的甲醛蒸汽消毒5 min,置于三气培养箱,在25 ℃、RH为75%、密闭条件下,充入φ为70%的氧气,保持充氧40 h,统计转基因滯育蚕卵经充氧处理后的转青及孵化情况,并以未处理的滞育卵为对照。
1.6 统计分析数据结果用平均值±标准差表示,使用GraphPad Prism 5.0软件(GraphPad Software Inc., San Diego, USA)进行统计分析,采用 t 检验比较不同处理组的统计差异。
2 结果与分析 2.1 O2阻断滞育最佳条件的筛选 2.1.1 O2阻断滞育最佳浓度的筛选选择产后20 h的蚕卵处理40 h,对O2的浓度进行调查。结果表明,φ(O2)为40%、50%、60%、70%和80%时,孵化率在70%以上,φ(O2)为60%、70%和80%时,孵化率在85%以上,其中φ(O2)为70%的处理组出现97.88%的最高孵化率(图1)。
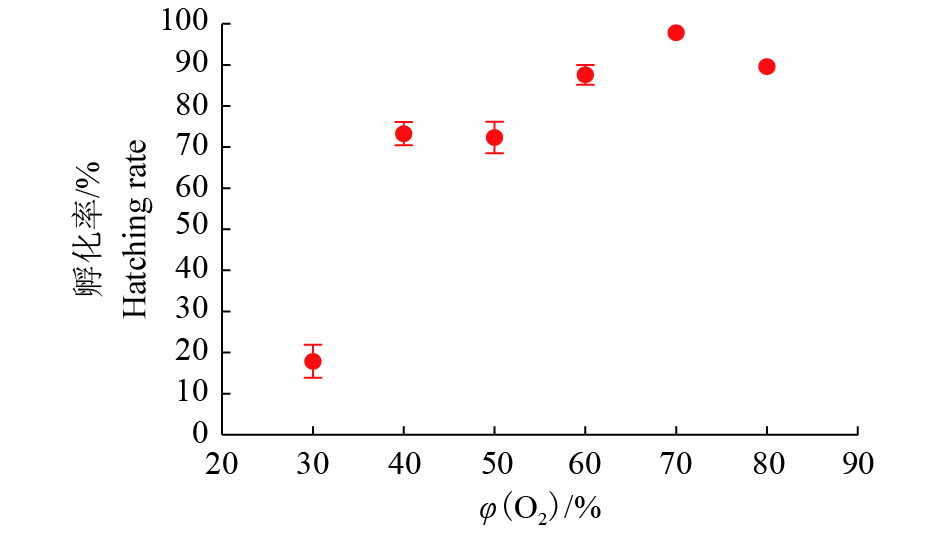
|
图 1 不同浓度O2阻断滞育后的二化性‘大造’蚕卵孵化率 Fig. 1 The hatching rate of bivoltine silkworm ‘Dazao’eggs under O2 treatment with different concentrations |
在获得O2最佳处理浓度(φ为70%)后,对蚕卵产后取样时间和高氧处理时间进一步调查。结果表明,产后4、12 和20 h取样的蚕卵,在30、40和50 h处理时间段里都能取得75%以上的孵化率,其中,产后20 h取样的蚕卵在O2处理40 h后孵化率达到98.67%;数据十分接近的还有产后12 h取样的蚕卵,在O2处理50 h后孵化率达到98.33%,处理时间在30~40 h时孵化率为86.71%~91.13%;产后4 h取样的蚕卵在O2处理40 h后的孵化率达到最高值(86.12%);而产后32 h取样蚕卵的最高孵化率为30.98%,出现在O2处理后40 h;产后48 h取样的蚕卵,无论处理10 h,还是72 h蚕卵都不孵化(图2)。
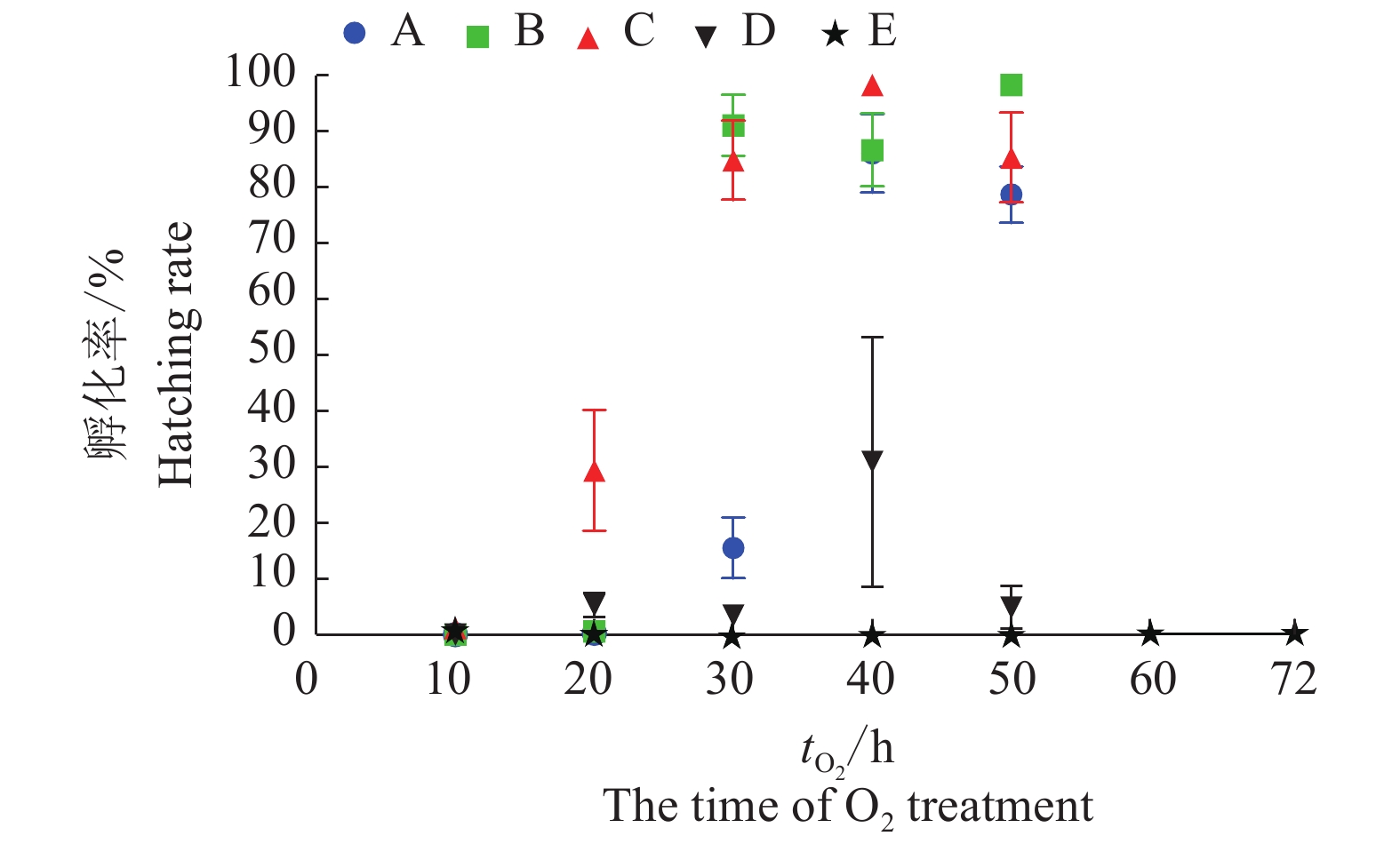
|
图 2 不同产后取卵时间及高氧处理时间的二化性‘大造’蚕卵的孵化率 Fig. 2 The hatching rate of bivoltine silkworm ‘Dazao’ eggs treated after different oviposition time and hyperoxia treating time A:产后4 h取卵;B:产后12 h取卵;C:产后20 h取卵;D:产后32 h取卵;E:产后48 h取卵 A: 4 h after oviposition; B: 12 h after oviposition; C: 20 h after oviposition; D: 32 h after oviposition; E: 48 h after oviposition |
根据以上试验,筛选出O2阻断滞育(高氧法)的最佳条件为:产后20 h的蚕卵在φ(O2)为70%条件下处理40 h。
2.2 高氧法和HCl法的蚕卵孵化率比较采用φ为70%的O2(高氧法)和HCl法处理滞育卵,以产后无处理的滞育卵为对照(CK),比较2种方法阻断滞育的效果。2种方法处理后10 d蚕卵的孵化率调查结果见表1。高氧法和HCl法都能较好地阻断蚕卵滞育。同等条件下,高氧法的效果更好,孵化率为(97±1)%;HCl法的孵化率为(93±1)%。
|
|
表 1 高氧法和HCl法处理后10 d二化性‘大造’蚕卵的孵化率1) Table 1 The hatching rates of bivoltine silkworm ‘Dazao’ eggs treated by hyperoxia and HCl after 10 days |
对高氧法和HCl法的蚕卵孵化时间进行了比较(图3),以产后无处理的滞育卵为对照(CK)。结果表明,高氧法处理的蚕卵在产卵230 h开始孵化;到了248 h孵化率就已经达到了21.9%,但此时的HCl法处理的蚕卵基本才开始有孵化的迹象,2种处理方法的孵化率差异显著;此后,从产后248 h到260 h,2种方法的的蚕卵孵化率都明显上升;一直到278 h,高氧法的蚕卵孵化率始终高于HCl法的蚕卵孵化率。从以上结果可以看出,高氧法的蚕卵孵化开始时间比HCl法的蚕卵早18 h,表明蚕卵在高氧法的处理条件下发育进程快于HCl法处理的蚕卵。
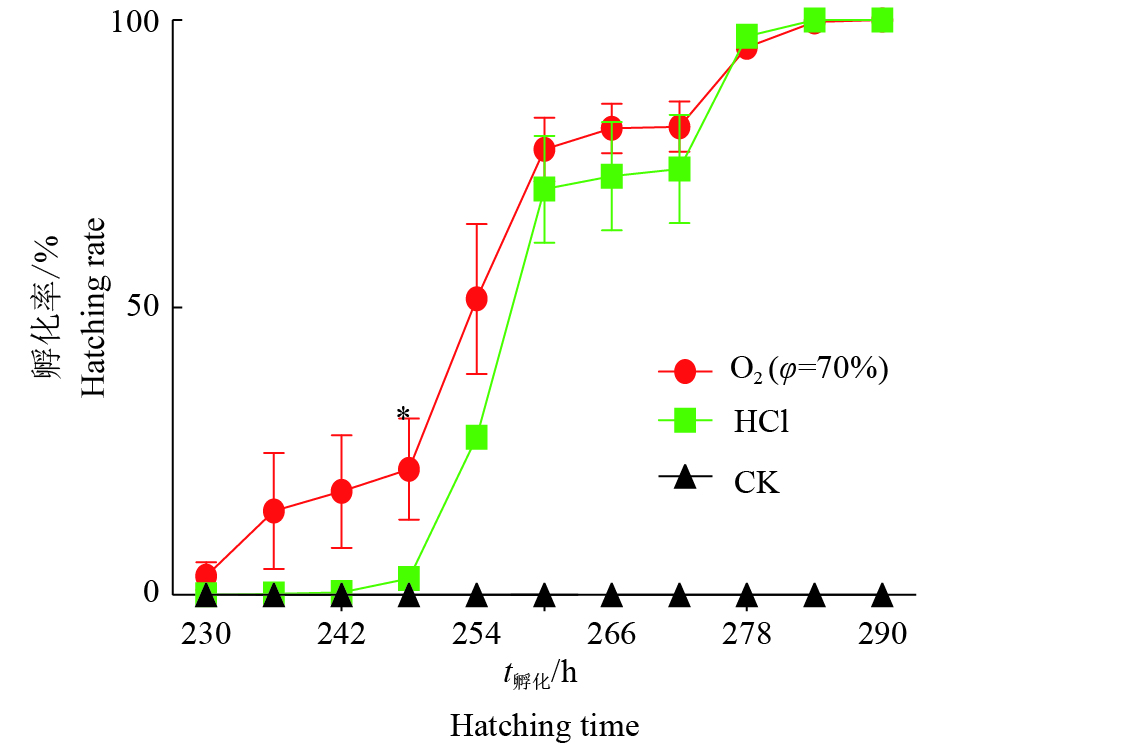
|
图 3 二化性‘大造’蚕卵在不同处理条件下的孵化率 Fig. 3 The hatching rate of bivoltine silkworm ‘Dazao’eggs under different treatment 一个样品大约有116~183粒卵;每个点代表3个独立样品的平均值±标准差;“*”表示相同时间点高氧法和HCl法处理存在显著性差异(P<0.05,t检验) The hatching time is calculated using 116 to 183 eggs per sample; Each point represents the mean ± SD of three independent replicates; “*” indicates significant difference between two treating methods (P<0.05,t test) |
滞育卵分别用高氧法最佳条件和HCl法处理,分别在产后20、48和72 h及5和9 d取样,以产后相同时段的无处理滞育卵为对照进行卵壳表面扫描电镜观察。结果发现,高氧法和HCl法刚处理的蚕卵卵壳表面几乎无变化;48 h时观察到蚕卵卵壳表面有较多“脂质”脱落;72 h时仍然能观察到“脂质”脱落(图4),此后时间点“脂质”脱落迅速减少。而对照中没有观察到此现象。

|
图 4 高氧及HCl法处理后不同发育时间的二化性‘大造’卵壳表面扫描电镜观察 Fig. 4 Scanning electron microscopy observation of eggshell surface of bivoltine silkworm‘Dazao’eggs of different developmental time after hyperoxia and HCl treatments A~C分别为高氧法处理组产后20、48和72 h;D~F分别为HCl法处理组产后20、48和72 h;G~I分别为对照组产后20、48和72 h;图中箭头表示脱落的脂质;标尺=50 µm A-C represent eggshell surface under hyperoxia treatment after spawning for 20, 48, and 72 hours; D-F represent eggshell surface under HCl treatment after spawning for 20, 48, and 72 hours; G-I represent eggshell surface of control group after spawning for 20, 48, and 72 h;The arrow indicates the shedding of lipid;Bar = 50 µm |
高氧法和HCl法处理后与对照组比较卵壳表面气孔大小,最初时差异不大,在48 h时处理组气孔开始增大,72 h~9 d(孵化前)期间处理组气孔进一步增大,而对照组气孔随时间逐渐缩小,到9 d时与处理组形成鲜明对比(图5)。

|
图 5 高氧及HCl法处理后不同发育时间的二化性‘大造’卵壳表面气孔扫描电镜观察 Fig. 5 Scanning electron microscopy observation of aeropyle surface of bivoltine silkworm ‘Dazao’ eggs of different development time after hyperoxia and HCl treatments A~E分别为高氧法处理组产后20、48和72 h及5和9 d;F~J分别为HCl法处理组产后20、48和72 h及5和9 d;K~O分别表示对照组产后20、48和72 h及5和9 d; 图中箭头表示气孔;标尺=5 µm A-E represent eggshell aeropyle under hyperoxia treatment after spawning for 20 hours, 48 hours,72 hours, 5 days and 9 days; D-F represent eggshell aeropyle under HCl treatment after spawning for 20 hours, 48 hours,72 hours, 5 days and 9 days; K-O represent eggshell aeropyle of control group after spawning for 20 hours, 48 hours,72 hours, 5 days and 9 days; The arrow indicates eggshell aeropyle; Bar = 5 µm |
为了了解高氧法阻断滞育在其他品种的效果,用该方法处理一化性品种‘土耳其’,观察其孵化效果。结果表明,一化性的品种同样可以通过高氧法有效阻断滞育,平均孵化率为(71±20)%(表2),但是数据方差较大,最高孵化率可以达到98.82%,而最小孵化率则为42.59%,对照全部为滞育卵。
|
|
表 2 高氧法处理一化性‘土耳其’阻断滞育效果分析 Table 2 Analyses of prevention effects of diapause in univoltine silkworm ‘Tuerqi’eggs by hyperoxia method |
将高氧处理蚕卵阻断滞育的方法应用到家蚕转基因上。经转基因显微注射处理后,以产后20 h的注射滞育蚕卵为试验对象,在φ(O2)为70%的条件下充氧处理40 h,处理后的蚕卵常规催青,约在10 d后开始孵化,孵化时间为5 d。结果(表3)表明,高氧法处理能有效地阻断转基因注射蚕卵滞育,转青率为(61±14)%,孵化率为(49±9)%,而对照孵化率为0。
|
|
表 3 高氧法处理转基因二化性‘大造’蚕卵阻断滞育效果分析 Table 3 Analyses of prevention effects of diapause in transgenic bivoltine silkworm ‘Dazao’ eggs by hyperoxia method |
滞育是生物体度过困难环境而进化来的一种生存策略。家蚕是典型的卵滞育昆虫。在生产上,最常用的家蚕卵阻断滞育的方法是HCl法,有一半以上的蚕种通过此方法打破滞育[16]。该方法在1877年就有过报道,1916年荒本等人逐渐将该方法转化为生产工艺应用于蚕业生产[17],为人类蚕丝业的发展做出了重要的贡献。关于高氧法阻断滞育最早的报道几乎与HCl法在同一个时代[17],20世纪70—80年代少数日韩研究者围绕卵壳通透性、蚕卵呼吸率等问题展开了研究[5,18],此后便鲜有相关研究报道。高氧法之前未能应用于生产实践,可能是当时的试验条件未能达到生产上的要求或各种仪器试剂的限制,不利于在生产上广泛推广使用,或者生产成本偏高。但是,在科技高度发达的今天,环境友好成为了经济发展的前提条件,蚕种场大量使用HCl将逐渐受到限制,因此转而使用更为环保、绿色的方法势在必行。高氧法作为阻断滞育的方法,取样时间和处理时间都比较宽泛,使用密闭的培养箱或容器就可以实现,操作较简单、安全,技术人员也容易掌握。
家蚕滞育机理的研究具有科学和产业上的双重重要性,因此受到人们普遍关注。但是,由于影响因素众多且是独特的跨带传递方式,比较复杂,滞育机理和阻断滞育机理至今仍不十分清楚。在前期研究中,发现高氧法和HCl法处理后获得的差异基因均在氧化还原功能上富集,并且表达模式趋同,推测其阻断滞育的机制相似[19]。在随后的扫描电镜观察中发现HCl法处理后的蚕卵表面有 “脂质”脱落物出现,蚕卵气孔随着发育逐渐增大[20],本文中高氧法处理的蚕卵也出现同样的现象,推测这是蚕卵胚胎从滞育转而发育的表现之一。
在家蚕转基因研究使用的品种中,二化性家蚕品种经济性状优异,不存在保种困难的问题,且已经大量用于蚕业生产,如果使用二化性品种作为家蚕转基因的受体材料,在转基因蚕的推广上将极具优势。然而,二化性家蚕品种用于转基因研究和应用,最重要且最需要解决的问题就是阻断滞育,使之能够连续饲养。目前,低温催青法耗时长,需要超过1个月的时间,且还需要反季节饲养[21-22],这些问题无疑都增加了制备转基因家蚕的难度;而早浸酸法由于浸酸时间过早、脱酸不净等原因影响转基因注射后蚕卵的转青率和孵化率,并且最佳注射时间与浸酸时间冲突[13-14],达不到实际科研生产要求。高氧法应用于转基因二化性家蚕蚕卵阻断滞育,处理注射后的转基因蚕卵,其平均孵化率为(49±9)%,远高于非滞育的多化性蚕品种的孵化水平,与低温催青处理的蚕卵孵化率持平[15],但是高氧法突出优点是用时短,饲育简单。高氧法在转基因家蚕蚕卵制备上的应用为阻断转基因家蚕卵滞育提供了一种高效简便的方法,有利于转基因技术创造出各种性状优良的新的特殊的家蚕品种。
综上所述,本文中高氧法不仅能较好地对二化性蚕品种阻断滞育,而且将该处理条件应用于一化性蚕品种,也取得了不错的孵化效果,说明高氧法阻断滞育是可行的,不局限于某种蚕品种。另外,高氧法是在常温常压下进行的,与传统HCl法相比操作简单,易于掌握,孵化时间短,适合向普通蚕农推广。在基础研究领域中,该方法更能发挥其特有优势,显著缩短转基因家蚕培育时间,突破了转基因家蚕的技术障碍,为家蚕转基因研究注入新活力。当然,在生产上推广该方法还需要更多品种、更大范围的进一步调查,开发适合于生产上使用的相关设备或者工艺条件是我们下一步需要研究的内容。
| [1] |
黄君霆,朱万民,夏建国,等. 中国蚕丝大全[M]. 成都: 四川科学技术出版社, 1996:573-575.
(  0) 0) |
| [2] |
徐卫华. 昆虫滞育的研究进展[J]. 昆虫学报, 1999, 42(1): 100-107. DOI:10.3321/j.issn:0454-6296.1999.01.018 (  0) 0) |
| [3] |
杨邦杰, 郑庭杏, 邹良华. 二化性白茧种浸温水孵化试验(预报)[J]. 广东蚕业, 1983(2): 10-13. (  0) 0) |
| [4] |
沈爱英, 赵林川, 刘慧婷. 外源H2O2活化家蚕滞育性卵的研究
[J]. 蚕业科学, 2003, 29(3): 311-313. DOI:10.3969/j.issn.0257-4799.2003.03.022 (  0) 0) |
| [5] |
SONOBE H, MATSUMOTO A, FUKUZAKI Y, et al. Carbohydrate-metabolism and restricted oxygen-supply in the eggs of the silkworm, Bombyx mori
[J]. J insect physiol, 1979, 25(5): 381-388. DOI:10.1016/0022-1910(79)90003-9 (  0) 0) |
| [6] |
徐世清, 刘建潮, 沈小明. 产后100小时内蚕卵的即时浸酸试验[J]. 江苏蚕业, 1990(2): 19-25. (  0) 0) |
| [7] |
YAMAMOTO T, MASE K, SAWADA H. Diapause prevention effect of Bombyx mori by dimethyl sulfoxide[J/OL]. PLoS One, 2013, 8(5):e64124. [2019-03-05] https://doi.org/10.1371/journal.pone.0064124.
(  0) 0) |
| [8] |
TAMURA T, THIBERT C, ROYER C, et al. Germline transformation of the silkworm Bombyx mori L. using a piggyBac transposon-derived vector
[J]. Nat Biotechnol, 2000, 18: 81-84. DOI:10.1038/71978 (  0) 0) |
| [9] |
刘春, 徐汉福, 陈玉琳, 等. 家蚕转基因研究及肌动蛋白A3启动子的表达分析[J]. 蚕学通讯, 2007, 27(3): 1-6. DOI:10.3969/j.issn.1006-0561.2007.03.001 (  0) 0) |
| [10] |
WANG F, WANG R, WANG Y, et al. Remobilizing deleted piggyBac vector post-integration for transgene stability in silkworm
[J]. Mol Genet Genom, 2015, 290(3): 1181-1189. (  0) 0) |
| [11] |
YANG C, HILLAS P J, BÁEZ J A, et al. The application of recombinant human collagen in tissue engineering[J]. Biodrugs, 2004, 18(2): 103-119. DOI:10.2165/00063030-200418020-00004 (  0) 0) |
| [12] |
SEONG J, KIM M J, LEE S W, et al. Analysis of transgenic silkworms producing insulin-like growth factor-I in Bombyx mori
[J]. Genes Genom, 2013, 35: 623-630. DOI:10.1007/s13258-013-0112-6 (  0) 0) |
| [13] |
唐顺明, 沈兴家, 赵巧玲, 等. 家蚕二化性品种(品系)转基因用蚕卵的预处理技术研究[J]. 蚕业科学, 2009, 35(4): 872-876. DOI:10.3969/j.issn.0257-4799.2009.04.029 (  0) 0) |
| [14] |
徐汉福, 马三垣, 王峰, 等. 适用于实用家蚕品种转基因的蚕卵滞育解除方法[J]. 蚕业科学, 2011, 37(1): 64-68. DOI:10.3969/j.issn.0257-4799.2011.01.011 (  0) 0) |
| [15] |
马三垣, 徐汉福, 段建平, 等. 家蚕转基因技术中若干因素对转基因效率的影响[J]. 昆虫学报, 2009, 52(6): 595-603. DOI:10.3321/j.issn:0454-6296.2009.06.001 (  0) 0) |
| [16] |
徐世清, 郑必平, 司马杨虎, 等. 家蚕滞育性卵盐酸处理的靶物质[J]. 昆虫学报, 2001, 44(1): 51-55. DOI:10.3321/j.issn:0454-6296.2001.01.009 (  0) 0) |
| [17] |
徐世清. 盐酸刺激活化家蚕滞育性卵的机理研究进展[J]. 江苏蚕业, 1991(3): 1-5. (  0) 0) |
| [18] |
KIM S E. Changes in eggshell permeability to oxygen during the early developmental stages in diapause eggs of Bombyx mori[J]. J Ins Physiol, 1987, 330(4): 229-235. (  0) 0) |
| [19] |
GONG J, TIAN S, ZHOU X, et al. Transcriptional response of silkworm (Bombyx mori) eggs to O2 or HCl treatment
[J]. Int J Mol Sci, 2016, 17: 1838. DOI:10.3390/ijms17121838 (  0) 0) |
| [20] |
龚竞, 田莎, 侯勇, 等. HCl和DMSO阻断滞育条件下桑蚕卵壳电镜观察[J]. 华南农业大学学报, 2017, 38(2): 1-5. (  0) 0) |
| [21] |
徐卫华, 张元琪, 王盈, 等. 昆虫滞育的分子机理: Ⅰ: 家蚕胚子发育期的温度条件与滞育激素基因表达[J]. 中国科学: C辑, 1998, 28(2): 154-159. (  0) 0) |
| [22] |
赵林川, 时连根. 不同催青处理的二化性家蚕体内过氧化氢代谢[J]. 蚕业科学, 2006, 32(1): 52-57. DOI:10.3969/j.issn.0257-4799.2006.01.009 (  0) 0) |
 2020, Vol. 41
2020, Vol. 41

