2. 广东省植物分子育种重点实验室,广东 广州 510642;
3. 华南农业大学 生命科学学院,广东 广州 510642
2. Guangdong Provincial Key Laboratory of Plant Molecular Breeding, Guangzhou 510642, China;
3. College of Life Sciences, South China Agricultural University, Guangzhou 510642, China
近年来,在我国经济迅速发展的过程中,矿山开采和工业废物等带来的土壤和环境重金属污染日益严重,对农业生产和人们的身体健康构成严重威胁。其中,重金属Cd是毒性很强的环境污染物,通过空气沉降、灌溉和施肥等途径进入土壤,引起土壤污染。土壤中高含量Cd对植物的毒性主要表现为植物褪绿、坏疽、落叶、生长量减少、根伸长受阻等[1]。Cd污染农业环境后会不同程度地影响水稻生长及籽粒Cd含量,由此对以稻米为食的人们的生活与健康造成严重危害,如20世纪60年代日本稻田Cd污染导致的骨痛病。水稻在各个生长阶段都会受到土壤中Cd的胁迫,正常的生长发育受到严重影响。水稻种子萌发过程中,Cd对种子发芽率影响较小,但会显著抑制胚根及胚芽的生长,对胚根的抑制作用明显大于胚芽[2-4]。水稻幼苗期遭受Cd胁迫后,根系生长受到抑制,苗高和根长增长减慢[5]。水稻籽粒Cd积累在不同品种间存在显著差异,研究发现了控制籽粒Cd积累的主效基因[6-7]。籽粒低Cd积累是水稻耐Cd研究的重点,从水稻育种和生产需要来看,各个生育时期均耐Cd的材料是最理想的材料。因此,前期耐Cd性与籽粒低Cd积累的相关性研究有助于早期筛选籽粒低Cd积累的材料。程旺大等[8]利用苗期耐Cd性和籽粒Cd含量差异明显的4个晚粳稻品种研究了Cd胁迫对水稻生长和营养代谢的影响,发现Cd胁迫下各品种的产量、每株穗数、每穗粒数、结实率、粒质量及地上部干物质质量等显著降低,苗期耐Cd性强的品种受到的抑制作用小于耐Cd性弱的品种,耐性相近的品种中,籽粒Cd富集程度较高的品种也严重受害。该研究预示可以探索用苗期耐Cd性评价不同品种籽粒Cd含量的差异。
水稻耐Cd性是多基因控制的数量性状,在耐Cd种质资源筛选、QTL定位、耐Cd基因克隆与功能等研究方面已取得一定进展[6-7, 9-21],上述研究有助于解析水稻耐Cd性的遗传控制基因及作用机理,为育种改良水稻耐Cd性提供重要的指导依据。野生稻是栽培稻的祖先,在长期自然进化过程中适应了多种自然环境,积累了较强的抗逆性,是天然的基因库[22]。但是目前野生稻耐Cd性研究的报道还较少。广东省植物分子育种重点实验室前期构建了以展颖野生稻Oryza glumaepatula为供体的染色体单片段代换系(Single-segment substitution lines, SSSLs)文库[23],本研究对部分SSSLs在芽期进行了不同浓度CdCl2溶液的胁迫处理,对发芽第7天的种子根长及芽长进行分析,以相对根长与相对芽长为指标,筛选出多份芽期耐Cd性强的SSSLs,并根据代换片段的信息,进行初步的QTL鉴定分析。本研究有助于扩大水稻耐Cd资源的范围,获得新的优异基因,为水稻耐Cd育种提供参考。
1 材料与方法 1.1 试验材料栽培稻品种‘华粳籼74’、‘新黄占’、‘中花11’、‘台中65’、‘粤晶丝苗2号’和‘象牙香占’用于确定芽期耐Cd试验中Cd溶液处理浓度与培养条件及Cd耐性分析指标。以‘华粳籼74’为受体、展颖野生稻IRGC104387为供体构建的SSSLs材料共37份。
1.2 试验方法 1.2.1 种子发芽试验与处理方法挑选颖壳光亮、大小均匀、无斑点、饱满无损伤的水稻种子,用蒸馏水洗涤1遍后用70%(φ)乙醇溶液浸泡20 s,倒去乙醇溶液,用蒸馏水洗去残留的乙醇溶液,重复3次,用培养皿法进行发芽试验。栽培稻品种试验中,CdCl2浓度设为0(对照,只加蒸馏水)、30、50、100和500 μmol·L−1。根据栽培稻品种的浓度梯度的试验结果,将野生稻SSSLs CdCl2处理浓度设为0(对照,只加蒸馏水)、50、100 μmol·L−1。每个培养皿放置20~30粒种子,1个培养皿为1次重复,每份材料每个浓度重复3次。浸种时,在各培养皿中加入相同体积蒸馏水或CdCl2溶液以淹没种子,放在(25±1) ℃的光照培养箱中培养,每日观察,待露白后,将露白的种子转移到垫有2层无菌滤纸的培养皿中。每天补充处理溶液,保持滤纸湿润。每日光照/黑暗时间设为16/8 h,光照强度为5 000 lx。
1.2.2 水稻幼苗形态指标的测量以胚芽达到种子长度一半作为发芽的标准。于发芽后第7天统计发芽率,并用直尺测量已发芽种子的根长与芽长。测量根长时,测量最长根长。每份材料每个浓度测30棵幼苗。统计分析不同材料在不同CdCl2浓度处理下的根长、芽长,并计算根芽比、相对根长及相对芽长,以反映其耐Cd特性。
| $ {\text{根芽比}}={\text{根长}}/{\text{芽长}}{\text{,}} $ |
| $\begin{aligned} {\text{相对根长}}= & {\text{不同}}{{\rm{CdCl}}_2}{\text{浓度处理的根长}}/{\text{对应材料}}\\ & {\text{在对照条件下的根长}}{\text{,}} \end{aligned} $ |
| $ \begin{aligned} {\text{相对芽长}}= & {\text{不同}}{{\rm{CdCl}}_2}{\text{浓度处理的芽长}}/{\text{对应材料}}\\ & {\text{在对照条件下的芽长}}{\text{。}} \end{aligned} $ |
以P=0.01为差异显著标准,将供试材料的性状值进行单因素方差分析及Duncan’s多重比较,筛选出性状值与‘华粳籼74’差异显著的SSSLs,以这些SSSLs进行耐Cd性QTL鉴定。在本研究中,分别对衡量耐Cd性的相对根长与相对芽长进行QTL鉴定。对有重叠片段的SSSLs通过代换作图[24]的方法确定QTL的最小区间。QTL的命名参考McCouch等[25]的命名原则。参考Eshed等[26]的方法计算QTL的加性效应及表型贡献率:
| $ {\text{加性效应}}= ({\rm{SSSL}}{\text{表型值}}-{\text{‘华粳籼}}74{\text{’表型值}})/2{\text{,}} $ |
| $ \begin{aligned} {\text{加性效应表型贡献率}}= & {\text{加性效应}}/{\text{‘华粳籼}}74{\text{’}}\\ & {\text{表型值}}\times 100{\text{%}}{\text{。}} \end{aligned} $ |
数据用Excel软件处理,方差分析用SPSS 21.0软件进行单因素方差分析(One-way ANOVA),多重比较采用Duncan’ s字母标记法,QTL在染色体上的分布图用Mapchart2.2软件绘制。
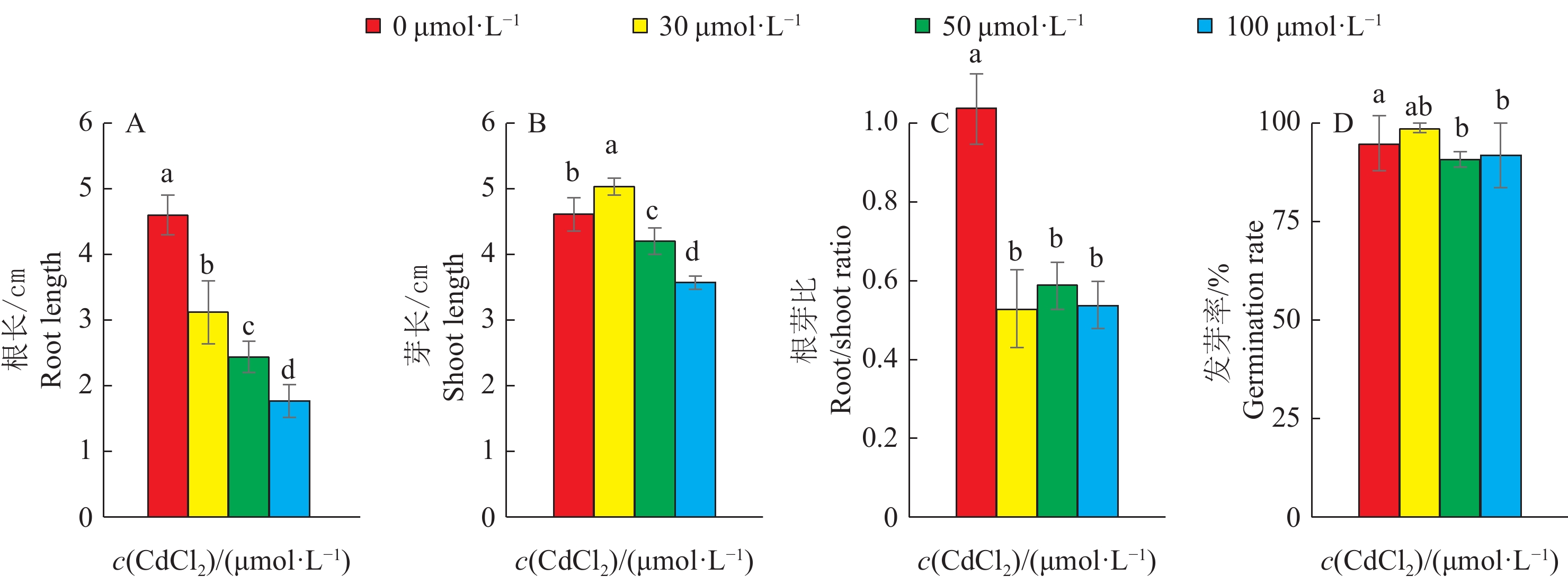
2 结果与分析 2.1 栽培稻品种在CdCl2溶液中发芽结果比较对‘华粳籼74’、‘新黄占’、‘中花11’、‘台中65’、‘粤晶丝苗2号’、‘象牙香占’6个栽培稻品种的种子进行了5个CdCl2浓度的处理。分析发芽后第7 天发芽率、根长、芽长、根芽比4个性状指标。其中在500 μmol·L−1浓度下,水稻种子几乎不发芽(图1)。在0、30、50和100 μmol·L−1 4个浓度下,6个栽培稻品种的种子发芽率为91%~95%,虽然在P=0.05水平,50和100 μmol·L−1浓度下的发芽率与0 μmol·L−1下的发芽率有显著差异,但30、50和100 μmol·L−1 3个浓度下发芽率没有显著差异(图2)。6个栽培稻品种的根芽伸长生长明显受到CdCl2的抑制。随着CdCl2浓度升高,根长和芽长均显著变短;在不同CdCl2浓度处理下,各品种种子根长较芽长更短,表明种子根的生长受到更大程度的抑制。在对照条件下,6个品种的根芽比接近1,CdCl2处理下的根芽比均小于0.5,比对照显著变小(图2)。总体来看,CdCl2胁迫处理条件下,供试水稻品种种子根、芽的伸长生长均明显受到抑制,相同处理浓度下CdCl2对根的抑制程度大于对芽的抑制程度。

|
图 1 部分栽培稻品种种子萌发后第7天的根芽生长状况 Fig. 1 Root and shoot growth of some cultivated rice varieties on the 7th day after germination |
|
图 2 栽培稻品种在CdCl2各处理浓度下的发芽结果 Fig. 2 Germination results of cultivated rice varieties at different CdCl2 concentrations 相同性状不同柱子上的小写字母表示不同处理浓度间差异显著(P<0.05,Duncan’ s法) Different lowercase letters on the columns of the same trait indicate significant differences (P<0.05,Duncan’ s test) |
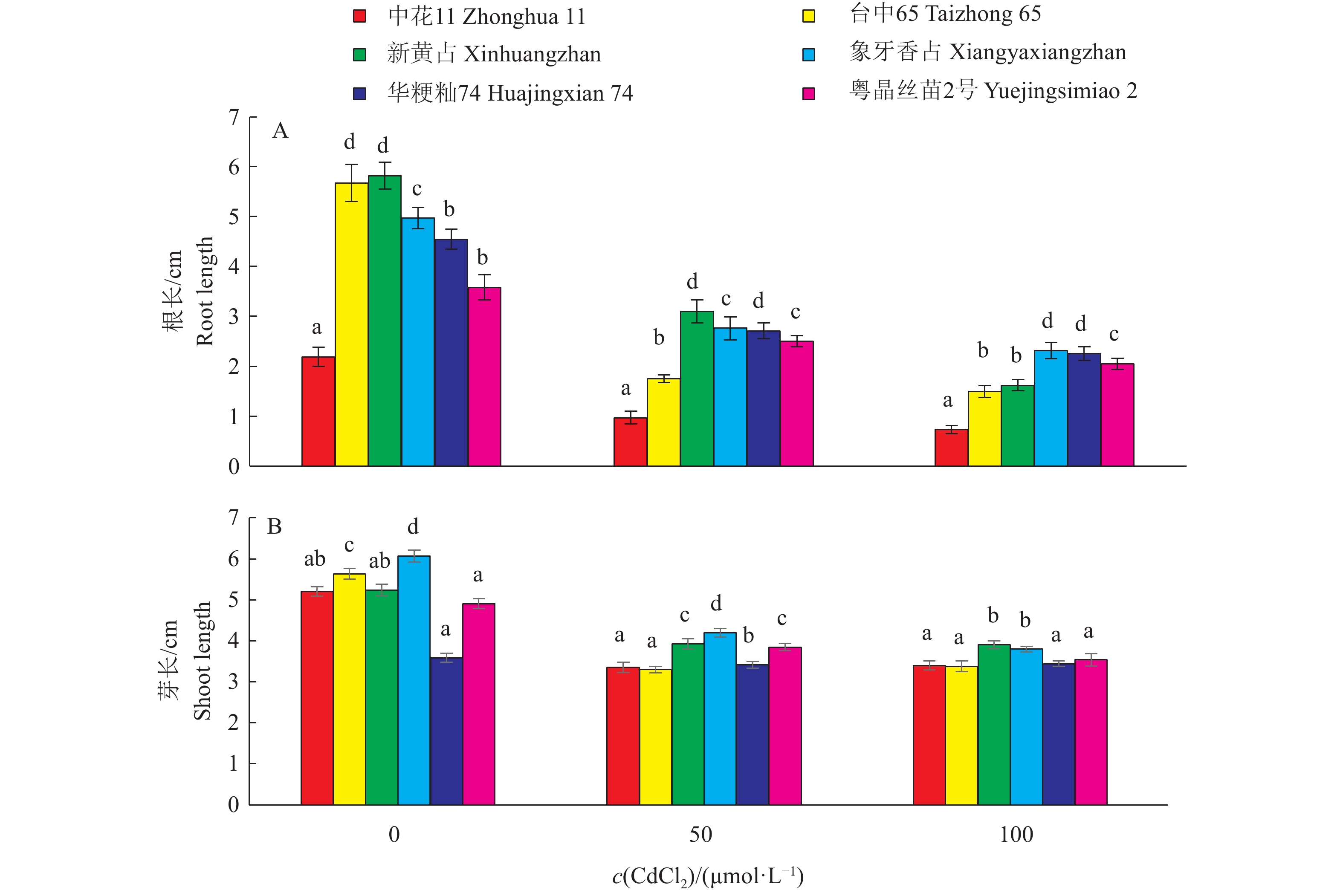
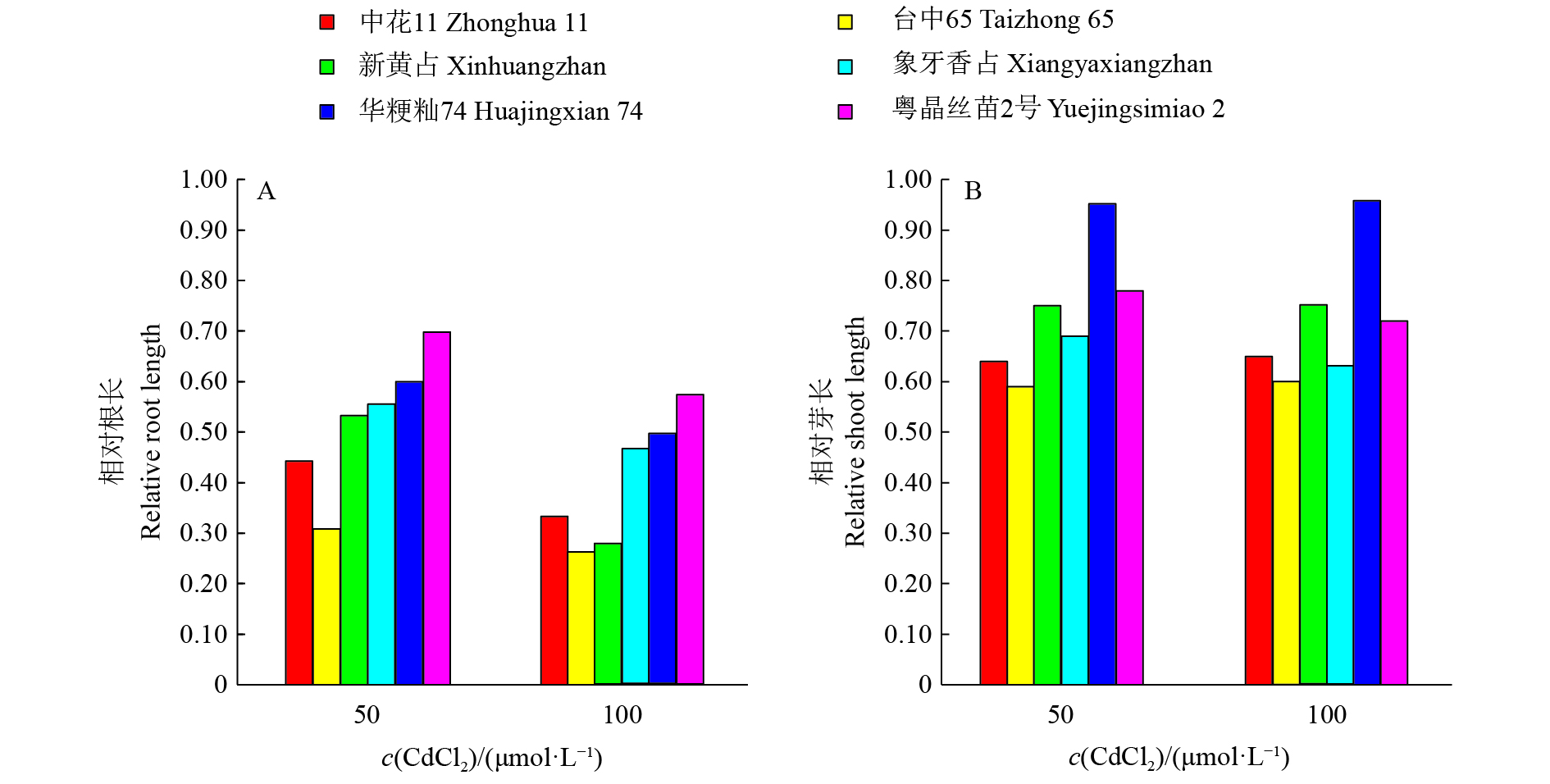
此外,不同品种的根芽生长对Cd胁迫的反应表现出差异(图3)。首先,正常发芽条件下,发芽第7天供试品种种子根长与芽长有显著差异。‘台中65’和‘新黄占’的根长最长,‘中花11’的根长最短;‘象牙香占’的芽长最长,‘华粳籼74’的芽长最短。其次,在Cd胁迫条件下,在不同CdCl2处理浓度下6个品种种子的根长均比对照短,且品种间差异显著,随着处理浓度升高,根长越来越短(图3A);不同品种间及不同CdCl2处理浓度间芽长的差异较小(图3B)。这说明根长能更好地反映栽培稻品种间耐Cd性差异。就相对长度而言,各处理浓度下各品种的相对芽长均大于相对根长(图4)。
|
图 3 栽培稻品种在不同CdCl2处理浓度下的根长与芽长 Fig. 3 Root and shoot length of cultivated rice varieties at different CdCl2concentrations 相同CdCl2浓度不同柱子上的小写字母表示不同品种间差异显著(P<0.05,Duncan’ s法) Different lowercase letters on the columns of the same CdCl2 concentration indicate significant differences (P<0.05,Duncan’ s test) |
|
图 4 栽培稻品种在不同CdCl2处理浓度下的相对根长与相对芽长 Fig. 4 Relative root and shoot length of cultivorted rice varieties at different CdCl2 concentrations |
以上分析结果表明,6个供试品种芽期耐Cd性存在显著差异,籼稻品种(‘华粳籼74’、‘新黄占’、‘粤晶丝苗2号’、‘象牙香占’)较粳稻品种(‘中花11’、‘台中65’)更耐Cd胁迫。就耐Cd性的分析而言,本研究CdCl2处理浓度为50、100 μmol·L−1时,相对根长和相对芽长能够较好反映水稻品种间的耐Cd性差异。因此,在本研究SSSLs耐Cd处理筛选及QTL鉴定时,CdCl2处理浓度采用50和100 μmol·L−1。
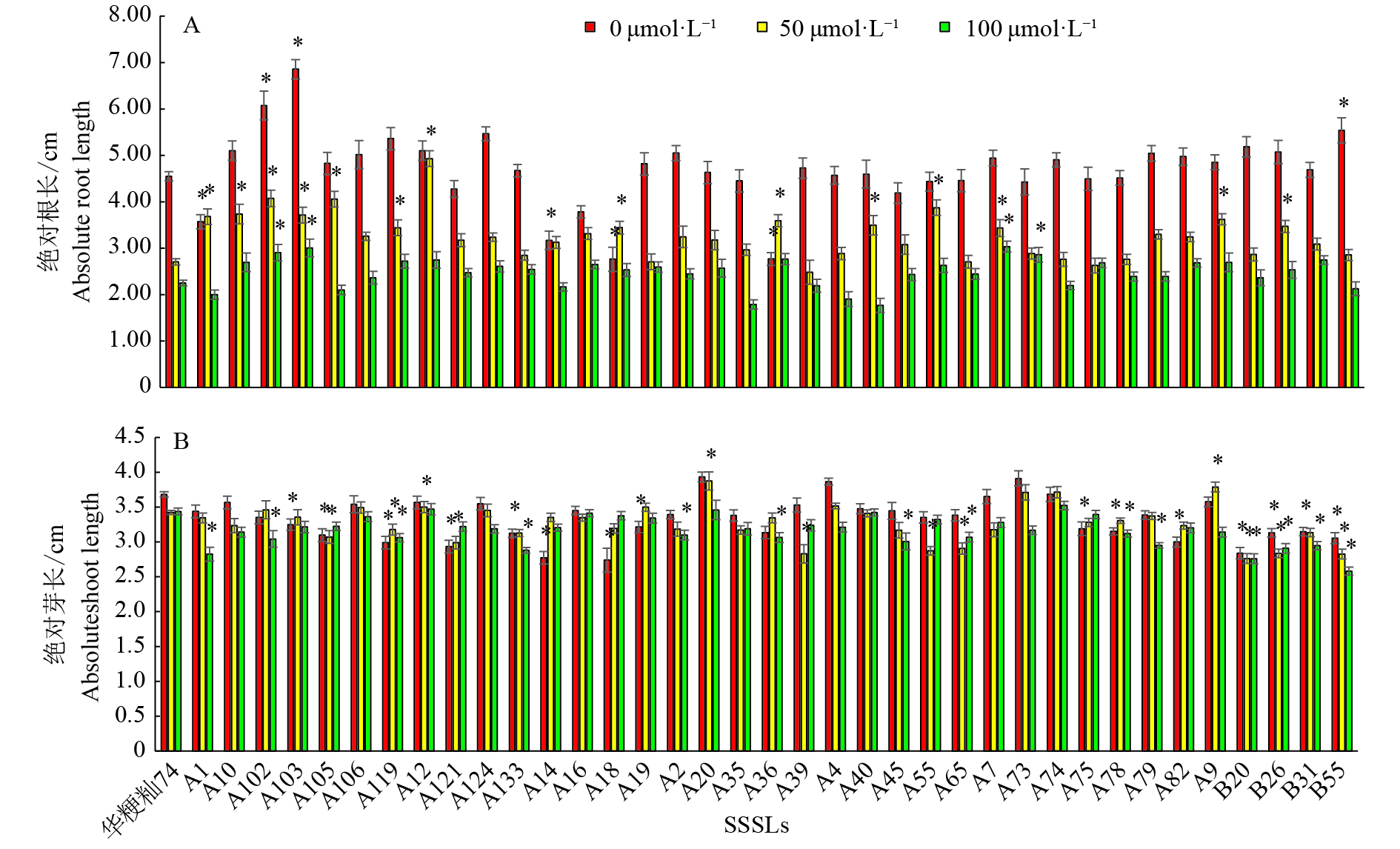
2.2 耐Cd SSSLs材料的筛选对37个SSSLs材料和受体亲本‘华粳籼74’做了多个批次的发芽试验。P=0.01水平的方差分析结果表明,在CdCl2胁迫下,供试材料种子发芽第7天的根长、相对根长、芽长及相对芽长等存在显著差异(数据尚未发表)。以根长与芽长为性状指标时,在P=0.01水平,CdCl2浓度为50和100 μmol·L−1时,供试SSSLs的平均根长分布范围分别为2.48~4.93 cm及1.77~3.03 cm,分别有14个和4个SSSLs的根长显著长于‘华粳籼74’(图5A);供试SSSLs的平均芽长分布范围分别为2.76~3.88 cm及2.58~3.52 cm,50 μmol·L−1处理浓度下有2个SSSLs的芽长显著长于‘华粳籼74’(图5B)。由于本研究中各基因型材料在对照条件下发芽第7天的根长与芽长存在显著差异,因此以各材料的相对根长与相对芽长为指标进行耐Cd SSSLs筛选与QTL鉴定。
|
图 5 不同SSSLs在不同CdCl2处理浓度下根长和芽长的差异 Fig. 5 Differences of root and shoot length in SSSLs at different CdCl2 concentrations “*”表示供试材料的相关性状值与‘华粳籼74’在P=0.01水平差异显著(单因素方差分析) “*” represents significant difference of relative character between experimental material and ‘Huajingxian 74’ at P=0.01 level (One-way ANOVA) |
在P=0.01水平,以相对根长为性状指标时,CdCl2浓度为50 μmol·L−1时筛选出7个相对根长显著长于‘华粳籼74’的SSSLs,分别为A1、A12、A124、A14、A18、A36、A9;CdCl2浓度为100 μmol·L−1时筛选出6个相对根长显著长于‘华粳籼74’的SSSLs,分别为A16、A14、A124、A18、A36、A9(图6A)。以相对芽长为性状指标时,CdCl2浓度为50 μmol·L−1时筛选出5个相对芽长显著长于‘华粳籼74’的SSSLs,分别为A9、A14、A18、A19、A36;CdCl2浓度为100 μmol·L−1时筛选出4个相对芽长显著长于‘华粳籼74’的SSSLs,分别为A9、A14、A18、A19(图6B)。
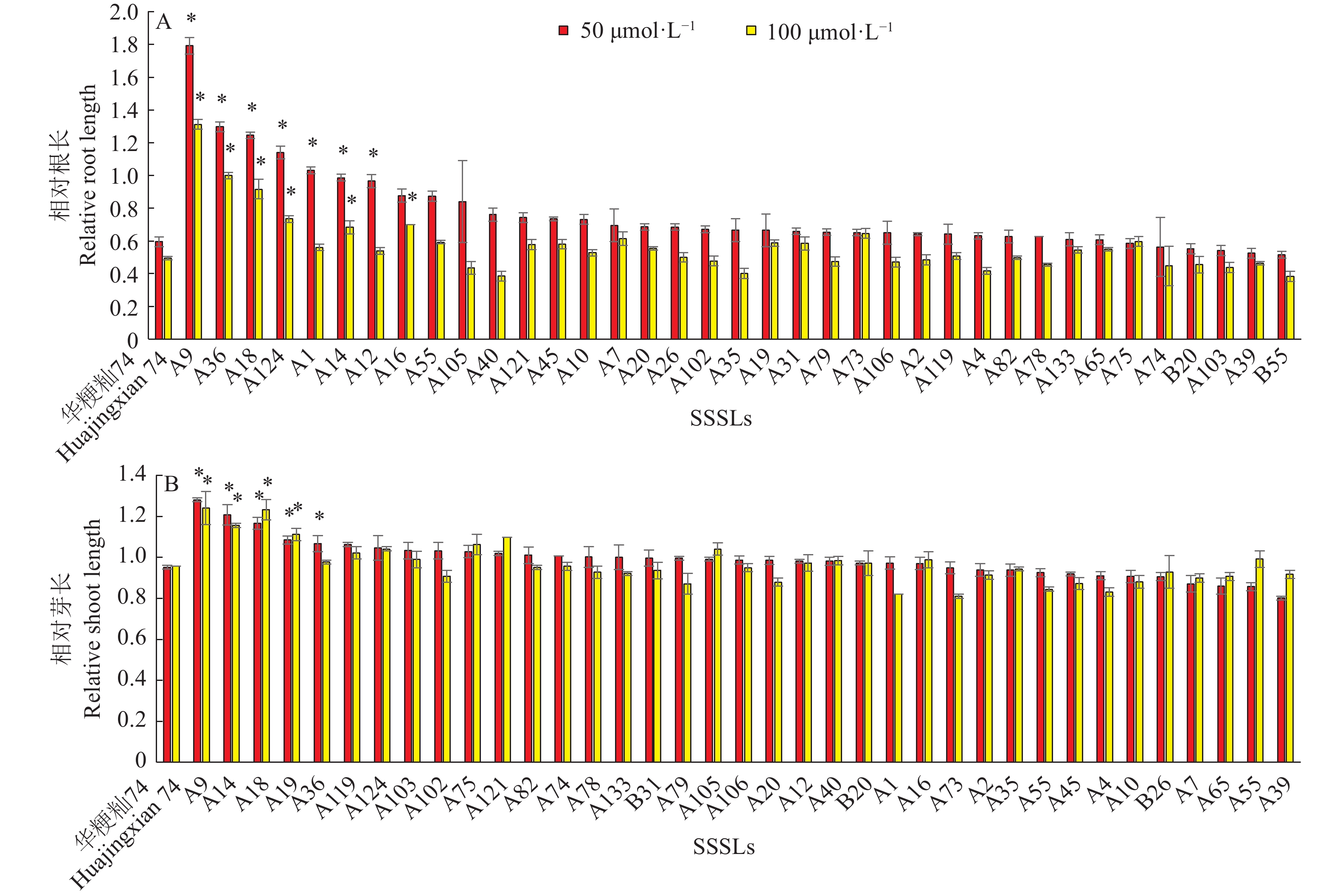
|
图 6 不同SSSLs在不同CdCl2处理浓度下相对根长和相对芽长的差异 Fig. 6 Differences of relative root and shoot length in SSSLs at different CdCl2 concentrations “*”表示供试材料的相关性状值与‘华粳籼74’在P=0.01水平差异显著(单因素方差分析) “*” represents significant difference of relative character between experimental material and ‘Huajingxian 74’ at P=0.01 level (One-way ANOVA) |
在P=0.01水平、2个Cd处理浓度下,A9、A14、A18、A36及A124相对根长均显著长于‘华粳籼74’,表明其耐Cd性强且稳定。根据SSSLs QTL鉴定的原理,认为以上这些SSSLs的代换片段上携带有来自展颖野生稻的耐Cd QTLs(表1,图7)。此外,根据各SSSLs代换片段的染色体分布及重叠关系,A9、A12、A14及A36的代换片段均在1号染色体上,片段重叠区间是RM490-RM572,因此,这4个SSSLs携带相同的1个相对根长QTL qRRL1-1。A18、A16、A1及A124分别在第2、3、3及6号染色体上携带QTLs qRRL2-1、qRRL3-1、qRRL3-2及qRRL6-1。其中qRRL1-1、qRRL2-1及qRRL6-1在2个CdCl2胁迫浓度均能鉴定到,而qRRL3-1只在100 μmol·L−1浓度出现,qRRL3-2只在50 μmol·L−1浓度出现,说明qRRL1-1、qRRL2-1及qRRL6-1是相对稳定的QTLs。从各QTL的加性效应来看,在50 μmol·L−1 CdCl2浓度条件下,各QTL的加性效应分布范围为0.19~0.60,表型贡献率为31.18%~100.59%。qRRL1-1的平均加性效应为0.33,表型贡献率为55.92%,为遗传效应最大的QTL。在100 μmol·L−1 CdCl2浓度条件下,各QTL的加性效应及表型贡献率均小于50 μmol·L−1 CdCl2,其中qRRL1-1的平均加性效应为0.25,表型贡献率为50.84%,依然是遗传效应最大的QTL。
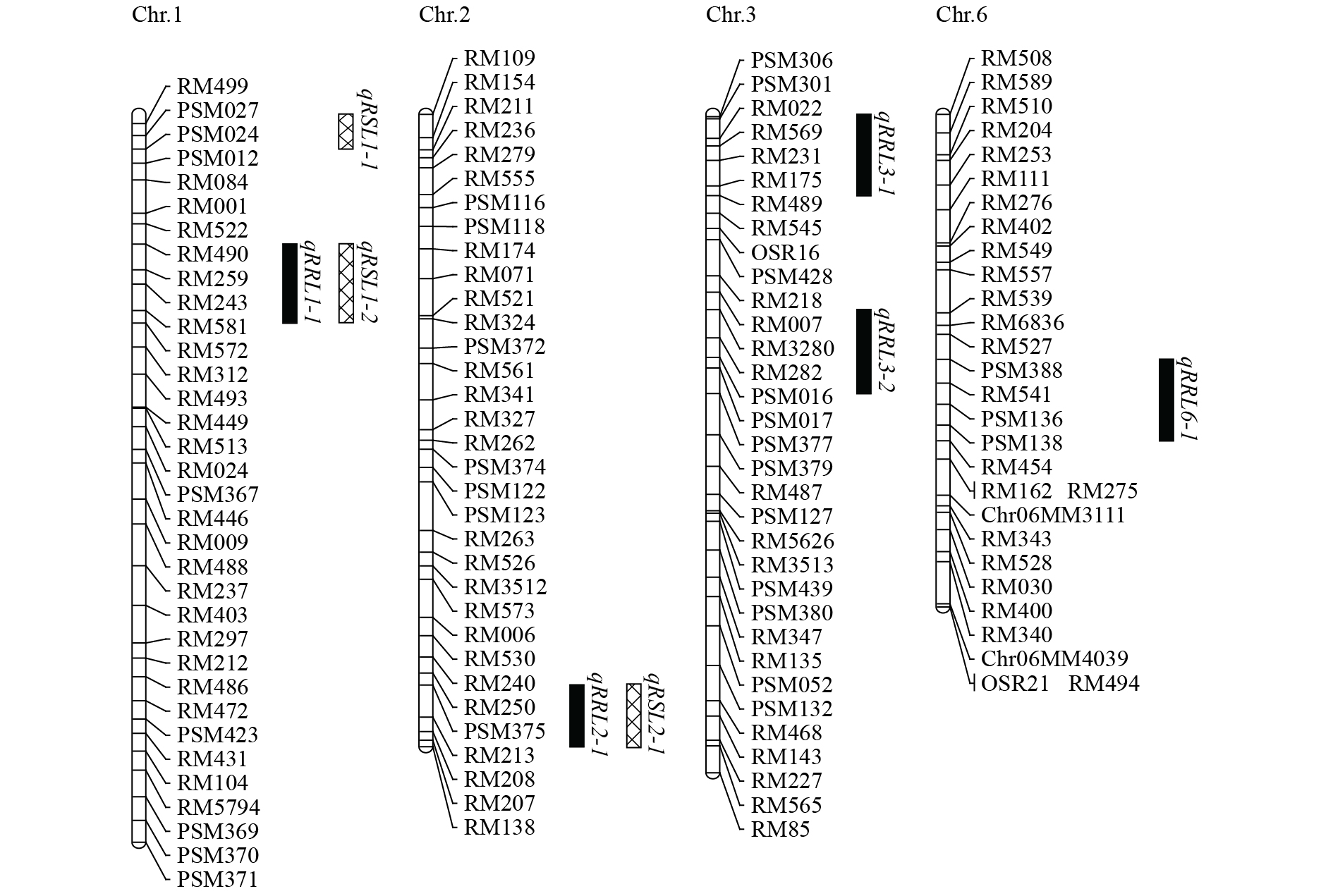
|
图 7 耐Cd QTLs染色体分布 Fig. 7 Chromosome distribution of identified QTLs for Cd tolerance |
|
|
表 1 相对根长及相对芽长QTLs及其遗传效应1) Table 1 Identified QTLs and genetic effects for relative root and shoot length |
在P=0.01水平、CdCl2浓度为50和100 μmol·L−1时,分别筛选出5个(A9、A14、A18、A19、A36)和4个(A9、A14、A18、A19)SSSLs的相对芽长显著长于‘华粳籼74’,本研究认为这些SSSLs携带相对芽长的QTLs,具体见表1及图7。A19在1号染色体短臂端end-PSM024区间携带QTL qRSL1-1;A36、A14及A9的代换片段在1号染色体上有重叠区间RM490-RM572,因此这3个SSSLs在重叠区间有1个共同的QTL,为qRSL1-2;A18在2号染色体长臂端PSM375-end区间携带QTL qRSL2-1。对各QTL遗传效应分析表明,3个QTLs加性效应均较小,分布范围为0.08~0.18,表型贡献率为7.43%~18.95%。其中A9携带的qRSL1-2在2个胁迫处理条件下均具有最大的加性效应和表型贡献率,这与其在相对根长中的QTL表现一致。
3 讨论与结论土壤Cd污染严重影响水稻的正常生长,而大米又是我国居民Cd摄入的主要途径,约占Cd摄入总量的56%[27],Cd的摄入对人体健康破坏特别大[28],所以水稻耐Cd研究以及培育高耐Cd水稻品种十分关键。目前关于水稻种子萌发及根芽生长过程对Cd胁迫响应的研究报道不多,孟桂元等[3]研究表明Cd胁迫对水稻种子的发芽率、发芽指数影响不显著,对种子活力指数及根芽生长具有显著影响;Cd胁迫对根的抑制作用明显大于对芽的抑制。Cd对水稻生长的影响存在浓度效应和时间效应,对根系的抑制程度大于对苗的抑制程度[29]。本研究以相对根长和相对芽长为指标分析不同基因型栽培稻品种芽期耐Cd性,结果表明,6个供试品种的相对根长在2个CdCl2处理浓度下耐Cd性顺序相同,即:‘台中65’<‘中花11’<‘新黄占’<‘象牙香占’<‘华粳籼74’<‘粤晶丝苗2号’;供试品种相对芽长在2个Cd处理浓度下耐Cd性的变化存在差别。陈毓瑾等[30]对30个常规稻品种在发芽期进行2 mg·L−1 Cd胁迫处理,以发芽率、发芽指数、幼苗根长和幼苗芽长等指标进行耐Cd性研究及低Cd积累种质的筛选,结果表明Cd胁迫对水稻种子的根长具有明显的抑制效应,对种子发芽率、发芽指数、幼苗芽长等指标无显著影响,水稻根长可以作为评价水稻种质耐Cd性的参考指标,水稻品种间根长指数有显著差异,‘IR24’是耐Cd性最强的品种。同时,孙亚莉等[4]以50个水稻品种(系)为材料,研究了不同Cd浓度胁迫对种子发芽率、发芽指数、活力指数、胚芽长、胚根长、胚芽鲜质量与胚芽干质量等性状的影响,表明0.5 mmol·L−1 Cd胁迫浓度对各水稻品种种子的发芽率和发芽指数影响不显著,不同Cd胁迫浓度对水稻种子胚根的抑制作用明显大于胚芽,50个供试品种(系)分为Cd胁迫敏感型、中间型和耐受型等。在水稻芽期耐Cd性指标分析及选择上,本研究结果与陈毓瑾等[30]及孙亚莉等[4]的结果较为一致,说明以相对根长为指标筛选耐Cd种质是可靠的。
近年来,水稻耐Cd QTL的鉴定与定位研究取得一定进展,主要是苗期耐Cd QTL定位[15-18]及籽粒低Cd积累含量QTL/基因的定位与克隆[6-7, 14, 19-21]等研究,但未见芽期耐Cd QTL定位的报道。在水稻幼苗期耐Cd QTL定位研究中,林辉锋等[15]以‘Lemont’和‘Dular’杂交建立的RIL群体,对水培条件下水稻幼苗耐Cd胁迫的QTL进行了初步定位,利用根长和株高作为抗性指标分别检测到QTLs qRAP-1a和qSAP-1b,均位于1号染色体RM243-RM578区间(在染色体上的物理区间:7 971 722~8 411 145 bp),经与本研究1号染色体定位QTL qRRL1-1及qRSL1-2的标记区间RM490-RM572 (6 677 153~9 866 595 bp)进行比对,发现RM243-RM578包含在标记区间RM490-RM572内,因此,本研究鉴定的相对根长QTL qRRL1-1与林辉锋等[15]定位的qRAP-1a很可能是同一个QTL,相对芽长QTL qRSL1-2与林辉锋等[15]定位的qSAP-1b很可能是同一个QTL。该区间与李炜星等[18]利用籼稻品种‘昌恢121’与粳稻品种‘越光’构建的RIL群体在幼苗期以根长作为抗性指标所定位到的QTL的位置(1号染色体RM8111处)非常接近,因此,认为在1号染色体RM490-RM572附近应该存在控制水稻耐Cd性的QTL。此外,陈志德等[17]利用‘韭菜青’בIR26’构建的RIL群体在幼苗耐Cd胁迫QTL定位中,在2号染色体长臂端标记RM6312-RM3860 (物理区间:35 390 710~35 431 667 bp) 之间定位了一个控制相对苗高的QTL qRSH-2,该区间包含在本研究鉴定的相对芽长QTL qRSL2-1的区间PSM375 -end(物理区间:33 175 495 bp~35 680 037 bp)内,表明水稻2号染色体该区间存在与水稻地上部耐Cd相关的QTL。综合来看,本研究鉴定到的其余5个QTLs,即qRRL2-1、qRRL3-1、qRRL3-2、qRRL6-1及qRSL1-1,所在染色体区间与前人已定位的水稻苗期或芽期耐Cd QTL不存在重叠区域,表明这5个QTLs可能为新的QTLs,且各QTL来自展颖野生稻的等位基因产生了增效作用,增强了SSSL的耐Cd性。水稻不同生育期耐Cd性及其籽粒Cd积累特性极其复杂,目前研究者们对其遗传及生理机制的研究尚在进行。对本文鉴定的QTLs进一步进行精细定位与克隆将有助于揭示展颖野生稻SSSLs芽期耐Cd性的机理;此外,对携带芽期耐Cd QTL的SSSLs进一步开展苗期耐Cd性以及籽粒Cd积累的研究也有助于探索QTL的多效性,为开展水稻耐Cd性的分子育种奠定基础。
| [1] |
陶战. 农业环境中的Cd[J]. 环境保护, 1978(6): 31-33. (  0) 0) |
| [2] |
何俊瑜, 任艳芳, 任明见, 等. 不同品种水稻种子萌发和幼苗生长的耐Cd性评价[J]. 中国农学通报, 2010, 26(9): 184-189. (  0) 0) |
| [3] |
孟桂元, 唐婷, 周静, 等. 不同水稻品种种子萌发及根芽生长的耐Cd性差异研究[J]. 杂交水稻, 2015, 30(5): 65-69. (  0) 0) |
| [4] |
孙亚莉, 刘红梅, 徐庆国. Cd胁迫对不同水稻品种种子萌发特性的影响[J]. 中国水稻科学, 2017, 31(4): 425-431. (  0) 0) |
| [5] |
江淼, 余海娟, 李亮, 等. 水稻核心种质的耐Cd性鉴定[J]. 植物生理学报, 2015, 51(10): 1617-1624. (  0) 0) |
| [6] |
ISHIKAWA S, ABE T, KURAMATA M, et al. A major quantitative trait locus for increasing cadmium-specific concentration in rice grain is located on the short arm of chromosome 7[J]. J Exp Bot, 2010, 61(3): 923-934. DOI:10.1093/jxb/erp360 (  0) 0) |
| [7] |
HU D W, SHENG Z H, LI Q L, et al. Identification of QTLs associated with cadmium concentration in rice grains[J]. J Integr Agr, 2018, 17(7): 1563-1573. DOI:10.1016/S2095-3119(17)61847-1 (  0) 0) |
| [8] |
程旺大, 姚海根, 张国平, 等. Cd胁迫对水稻生长和营养代谢的影响[J]. 中国农业科学, 农学通报, 2017, 33(17): 76-81. (  0) 0) |
| [9] |
DUAN G, SHAO G, TANG Z, et al. Genotypic and environmental variations in grain cadmium and arsenic concentrations among a panel of high yielding rice cultivars[J]. Rice, 2017, 10. doi: 10.1186/S12284-017-0149-2.
(  0) 0) |
| [10] |
姚春馨, 隆四清, 和立忠, 等. 水稻镉积累基因型差异及其对镉胁迫的反应[J]. 湖南农业大学学报, 2007, 8(33): 37-41. (  0) 0) |
| [11] |
林晗, 徐江民, 胡珊倩, 等. 水稻耐金属离子胁迫的QTL分析[J]. 中国水稻科学, 2018, 32(1): 23-34. (  0) 0) |
| [12] |
ZHANG M, PINSON S R M, TARPLEY L, et al. Mapping and validation of quantitative trait loci associated with concentrations of 16 elements in unmilled rice grain[J]. Theor App Gene, 2014, 127(1): 137-165. DOI:10.1007/s00122-013-2207-5 (  0) 0) |
| [13] |
LUO J, HUANG J, ZENG D, et al. A defensin-like protein drives cadmium efflux and allocation in rice[J]. Nat Commun, 2018, 9(1): 645-654. DOI:10.1038/s41467-018-03088-0 (  0) 0) |
| [14] |
SUI F Q, ZHAO D K, ZHU H T, et al. Map-based cloning of a new total loss-of-function allele of OsHMA3 causes high cadmium accumulation in rice grain
[J]. J Exp Bot, 2019, 70(10): 2857-2871. DOI:10.1093/jxb/erz093 (  0) 0) |
| [15] |
林辉锋, 熊君, 林文熊. 水稻苗期耐Cd胁迫的QTL定位分析[J]. 中国农学通报, 2009, 25(9): 26-31. (  0) 0) |
| [16] |
XUE D, CHEN M, ZHANG G. Mapping of QTLs associated with cadmium tolerance and accumulation during seedling stage in rice (Oryza sativa L.)
[J]. Euphytica, 2009, 165(3): 587-596. DOI:10.1007/s10681-008-9785-3 (  0) 0) |
| [17] |
陈志德, 仲维功, 王军, 等. 水稻苗期耐Cd2+胁迫的QTL定位研究
[J]. 南京农业大学学报, 2010, 33(3): 1-5. (  0) 0) |
| [18] |
李炜星, 欧阳林娟, 文文, 等. 水稻幼苗耐镉胁迫QTL的定位研究[J]. 江西农业大学学报, 2019, 41(1): 19-24. (  0) 0) |
| [19] |
ISHIKAWA S, AE N, YANO M. Chromosomal regions with quantitative trait loci controlling cadmium concentration in brown rice (Oryza sativa)
[J]. New Phytol, 2005, 168(2): 345-350. DOI:10.1111/j.1469-8137.2005.01516.x (  0) 0) |
| [20] |
ABE T, NONOUE Y, ONO N, et al. Detection of QTLs to reduce cadmium content in rice grains using LAC23/Koshihikari chromosome segment substitution lines[J]. Breed Sci, 2013, 63(3): 284-291. DOI:10.1270/jsbbs.63.284 (  0) 0) |
| [21] |
ZHAO J, YANG W, ZHANG S, et al. Genome-wide association study and candidate gene analysis of rice cadmium accumulation in grain in a diverse rice collection[J]. Rice, 2018, 11. doi: 10.1186/s12284-018-0254-x.
(  0) 0) |
| [22] |
钟代彬, 罗利军, 应存山. 野生稻有利基因转移研究进展[J]. 中国水稻科学, 2000, 14(2): 103-106. DOI:10.3321/j.issn:1001-7216.2000.02.008 (  0) 0) |
| [23] |
ZHAO H, SUN L, XIONG T, et al. Genetic characterization of the chromosome single-segment substitution lines of O. glumaepatula and O. barthii and identification of QTLs for yield-related traits[J]. Mol Breed, 2019, 39(4). doi: 10.1007/s11032-019-0960-0.
(  0) 0) |
| [24] |
PATERSON A H, DeVERNA J W, LANINI B, et al. Fine mapping of quantitative trait loci using selected overlapping recombinant chromosomes, in an interspecies cross of tomato[J]. Genetics, 1990, 124(3): 735-742. (  0) 0) |
| [25] |
McCOUCH S R, CHO Y G, YANO M, et al. Report on QTL nomenclature[J]. Rice Genet Newsl, 1997, 14: 11-13. (  0) 0) |
| [26] |
ESHED Y, ZAMIR D. An introgression line population of Lycopersicon pennellii in the cultivated tomato enables the identification and fine mapping of yield-associated QTL
[J]. Genetics, 1995, 141(3): 1147-1162. (  0) 0) |
| [27] |
SONG Y, WANG Y, MAO W, et al. Dietary cadmium exposure assessment among the Chinese population[J]. PLoS One, 2017, 12(5): e0177978. DOI:10.1371/journal.pone.0177978 (  0) 0) |
| [28] |
NORDBERG G F. Historical perspectives on cadmium toxicology[J]. Toxicol Appl Pharmacol, 2009, 238(3): 192-200. DOI:10.1016/j.taap.2009.03.015 (  0) 0) |
| [29] |
马孟莉, 卢丙越, 刘艳红, 等. 镉对云南省主栽水稻品种幼苗生长的影响[J]. 江苏农业科学, 2014, 42(3): 50-52. (  0) 0) |
| [30] |
陈毓瑾, 欧阳林娟, 朱红, 等. 常规水稻耐镉性及镉低积累种质的筛选[J]. 石河子大学学报(自然科学版), 2017, 35(6): 701-706. (  0) 0) |
 2020, Vol. 41
2020, Vol. 41


