随着纳米生物技术的迅速发展,纳米材料可作为基因载体,通过包裹、静电吸附及化学键作用等方式负载外源基因[1-3],通过细胞吞噬作用将其传送到细胞内,使基因成功表达[4]。与其他纳米载体相比,磁性纳米载体具有超顺磁性优势[5],在磁场作用下可快速负载、运输目的基因[6]。有研究表明外源基因成功整合到基因组中需要通过3个细胞屏障:细胞膜、溶酶体和细胞核[7],影响整合效率的关键因素是避开溶酶体的消化作用[8-9],纳米载体的表面电荷[10]、粒径大小[11]和修饰功能基团[12]等是影响整合效率的重要因素。有学者提出纳米载体基因复合物可通过“质子海绵效应”免受溶酶体的消化作用[13-14]。
纳米载体基因传输技术为动植物遗传育种提供了新思路,Wang等[15]将磁性纳米载体与精子介导的基因转染相结合,获得了转基因小鼠。Zhao等[16]利用磁性纳米颗粒(Magnetic nanoparticle,MNP)作为基因载体,负载pGBIF4ABCΔα质粒,在磁场作用下磁转染棉花花粉,成功筛选到转融合抗虫基因的棉花。随着CRISPR基因编辑和修饰技术的使用,磁性纳米颗粒会是将生物分子传送到植物体内进行基因编辑和修饰的最佳平台[17]。
本研究选用MNP作为基因载体,负载质粒pRGEB32,构建了不同质量比的纳米载体−基因复合物MNP−pRGEB32。通过琼脂糖凝胶电泳阻滞试验评价和分析了MNP对pRGEB32的结合和保护能力。通过纳米粒度分析仪、Zeta电位分析仪、透射电子显微镜和原子力显微镜对MNP和MNP−pRGEB32复合物的粒径、表面电位、形貌、分布等进行了检测和观察,研究了MNP−pRGEB32复合物的生物物理特性、基因负载形态与负载机理,以期为MNP负载CRISPR/Cas9表达载体的应用提供依据。
1 材料与方法 1.1 试验材料MNP poly MAG1000购自德国Chemicell公司;DNase I购自TaKaRa公司;无内毒素质粒大提试剂盒购自TIANGEN生物技术有限公司;含CRISPR/Cas9表达载体pRGEB32[18]的大肠埃希菌 Escherichia coli DH5α由国家植物航天育种工程技术研究中心保存;核酸染料GelRed购自美国Biotium公司。
1.2 质粒DNA的提取与纯化取pRGEB32(15 888 bp)大肠埃希菌菌液加入到含50 ng/µL卡那霉素的LB液体培养基(每升培养基含酵母提取物5 g、胰蛋白胨10 g、NaCl 10 g)中,于37 ℃、220 r/min培养16 h,按照TIANGEN无内毒素质粒大提试剂盒说明书提取质粒。利用超微量紫外分光度计测定质粒DNA的浓度和纯度,选取D260 nm/D280 nm≈1.8的质粒DNA于−20 ℃贮存备用。
1.3 磁性纳米颗粒−DNA复合物的制备pRGEB32质量固定为4 μg,将poly MAG1000和pRGEB32按照质量比为1∶1、1∶4、1∶8、1∶16、1∶24、1∶40、1∶50混合,于37 ℃条件下培育30 min,连接制备MNP−DNA复合物。
1.4 琼脂糖凝胶阻滞试验将MNP−pRGEB32复合物点样在8 g/L的琼脂糖凝胶(含7 µL 荧光染料GelRed)上,在TAE缓冲液中于130 V电泳30 min,然后在凝胶成像仪上观察,分析MNP对pRGEB32的负载能力;同时,将MNP−pRGEB32复合物在37 ℃分别用DNase I酶切4 h,用Hind III和Bsa I双酶切16 h,然后电泳跑胶,分析对MNP对pRGEB32的保护能力。
1.5 粒度分布及Zeta电位分析将MNP和pRGEB32按照质量比为1∶1、1∶4、1∶8制备的MNP−pRGEB32复合物分别用超纯水稀释至0.001 µg/µL,采用纳米粒度分析仪及Zeta电位分析仪分析粒度分布及Zeta电位。
1.6 透射电子显微镜观测吸取MNP和MNP、pRGEB32质量比为1∶1的MNP−pRGEB32复合物,用超纯水分别稀释至0.001 μg/μL,各取10 μL均匀滴加到干净的碳膜覆盖的铜网上,用滤纸吸干多余的液体,静置晾干30 min,用20 g/L的磷钨酸负染1 min,置于干净的培养皿中自然干燥,然后在透射电子显微镜下观测形态并拍照。
1.7 原子力显微镜观测吸取MNP和pRGEB32质量比为1∶1的MNP−pRGEB32复合物,用超纯水稀释至0.01 μg/μL,取10 μL均匀滴加到新剥离的云母片表面,置于干净的培养皿中自然干燥,然后在原子力显微镜下扫描成像,用NanoScope Analysis 1.5在Height Sensor模式下分析图像。
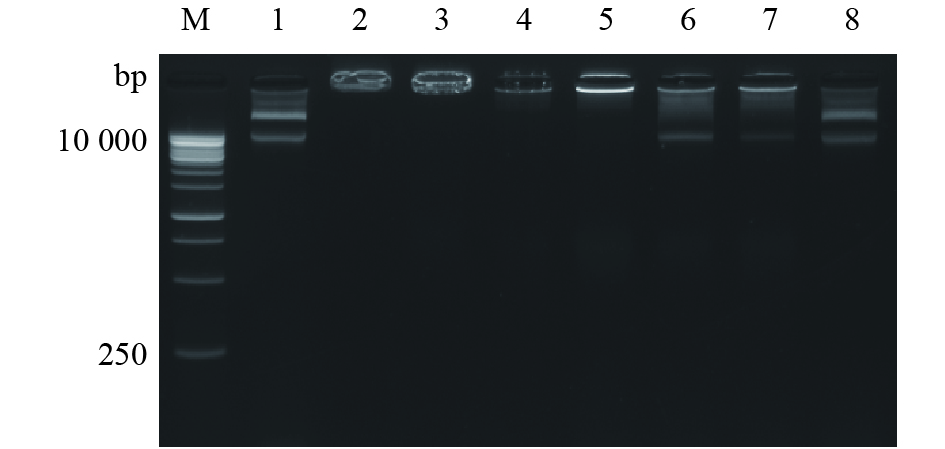
2 结果与分析 2.1 磁性纳米颗粒对质粒DNA负载和保护能力分析 2.1.1 磁性纳米颗粒对质粒DNA的负载能力分析MNP和pRGEB32质量比为1∶1、1∶4、1∶8、1∶16时,MNP与pRGEB32完全结合,泳道中无游离的pRGEB32;质量比为1∶24、1∶40、1∶50时,逐渐减少的MNP难以负载逐步增多的pRGEB32,形成的MNP−pRGEB32复合物较少,过量的pRGEB32在泳道中呈现明显条带(图1)。结果表明MNP能有效装载相当于自身质量16倍的pRGEB32。
|
图 1 MNP−pRGEB32复合物电泳分析 Fig. 1 Electrophoreses analyses of MNP-pRGEB32 complexes M:DNA marker; 1:纯质粒pRGEB32; 2~8:MNP−pRGEB32复合物,质量比分别为1∶1、1∶4、1∶8、1∶16、1∶24、1∶40、1∶50 M: DNA marker; 1: Pure plasmid pRGEB32; 2-8: MNP-pRGEB32 complexes at mass ratios of 1∶1, 1∶4, 1∶8, 1∶16, 1∶24, 1∶40 and 1∶50 respectively |
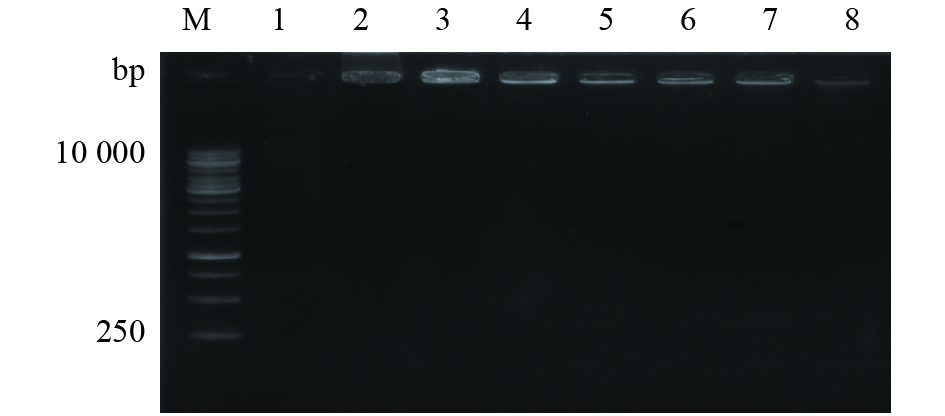
MNP−pRGEB32复合物用核酸酶DNase I处理4 h后,质量比为1∶1、1∶4、1∶8、1∶16的复合物样品仍停留在点样孔,纯质粒及质量比为1∶24、1∶40、1∶50的复合物样品中过量的DNA被完全消化,完全结合的MNP−pRGEB32复合物停留在点样孔(图2)。MNP−pRGEB32复合物用Hind III和Bsa I双酶切16 h后,纯质粒及质量比为1∶24、1∶40、1∶50的复合物样品中过量的DNA随电场迁移,被限制性内切酶 Hind III和Bsa I切开形成2条线性质粒条带,MNP−pRGEB32复合物质量比为1∶1、1∶4、1∶8、1∶16的泳道没有DNA痕迹,说明MNP−pRGEB32复合物没有被酶切割(图3)。结果证明MNP能保护其负载的pRGEB32免受酶促降解。
|
图 2 MNP−pRGEB32复合物用DNase I酶切处理的电泳分析 Fig. 2 Electrophoresis analyses of MNP-pRGEB32 complexes digested with DNase I M:DNA marker; 1:纯质粒pRGEB32; 2~8:MNP−pRGEB32复合物,质量比分别为1∶1、1∶4、1∶8、1∶16、1∶24、1∶40、1∶50 M: DNA marker; 1: Pure plasmid pRGEB32; 2-8: MNP-pRGEB32 complexes at mass ratios of 1∶1, 1∶4, 1∶8, 1∶16, 1∶24, 1∶40 and 1∶50 respectively |

|
图 3 MNP−pRGEB32复合物用Hind III和Bsa I双酶切处理的电泳分析 Fig. 3 Electrophoresis analyses of MNP-pRGEB32 complexes digested with Hind III and Bsa I M:DNA marker; 1:纯质粒pRGEB32; 2~8:MNP−pRGEB32复合物,质量比分别为1∶1、1∶4、1∶8、1∶16、1∶24、1∶40、1∶50 M: DNA marker; 1: Pure plasmid pRGEB32; 2-8: MNP-pRGEB32 complexes at mass ratios of 1∶1, 1∶4, 1∶8, 1∶16, 1∶24, 1∶40 and 1∶50 respectively |
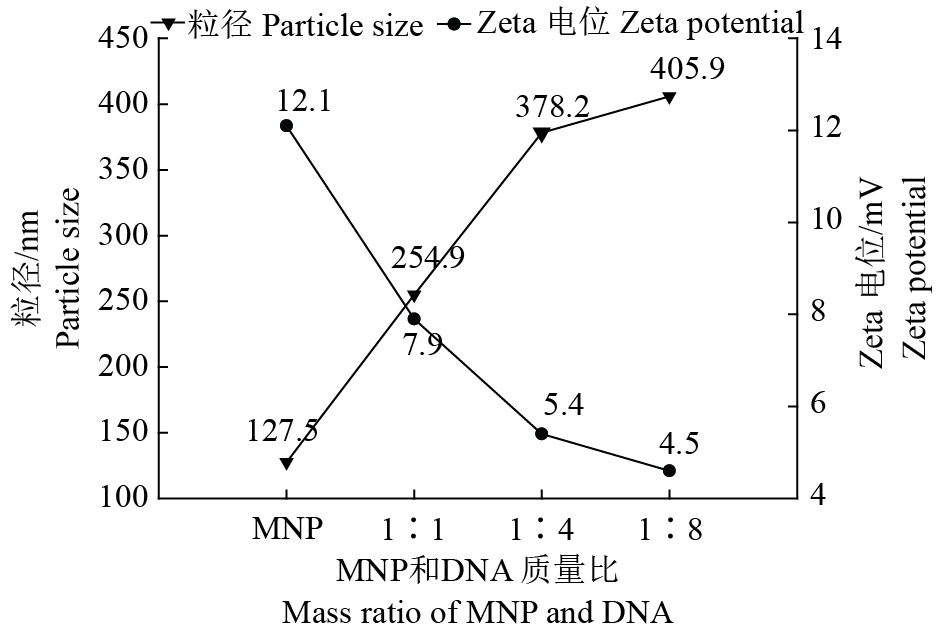
纳米粒度及Zeta电位分析仪结果显示,MNP的平均疏水粒径为127.5 nm,Zeta电位为12.1 mV,在结合带负电的pRGEB32后,MNP−pRGEB32复合物的粒径增大,Zeta电位降低(图4)。随着结合的pRGEB32的量逐渐增加,MNP−pRGEB32复合物的粒径也逐渐增加,Zeta电位逐渐降低。结果说明MNP能通过静电作用负载pRGEB32,并能有效地结合和负载pRGEB32形成纳米载体基因复合物。
|
图 4 MNP和MNP−pRGEB32复合物的粒径及Zeta电位分析 Fig. 4 Size distribution and Zeta potential of MNP and MNP-pRGEB32 complex |
透射电镜下MNP为规则球形,分散性较好,粒径约10~150 nm(图5a)。中心深色部分为磁性氧化铁核心,外层附有阳离子PEI膜包裹(图5b)。MNP与pRGEB32结合后大量的pRGEB32被压缩、吸附、聚集在纳米颗粒表面(图5c和5d)。试验表明MNP可携带大量的pRGEB32,从而作为外源基因转移的载体。

|
图 5 MNP和MNP−pRGEB32复合物的透射电镜图像 Fig. 5 Transmission electron microscope images of MNP and MNP-pRGEB32 complex |
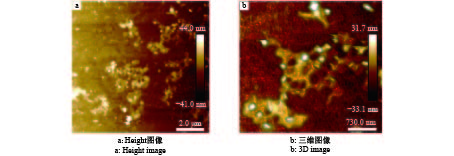
原子力显微镜观察到MNP周围吸附了杆状的pRGEB32,以载体颗粒为中心,越靠近中心浓度越高,呈放射状向外扩展(图6),与透射电镜观测的形态相符合。这种高浓度的聚集有利于载体颗粒携带大量的pRGEB32,从而通过细胞的吞噬作用将外源基因传送至细胞内部。
|
图 6 MNP−pRGEB32复合物的原子力显微镜图像 Fig. 6 Atomic force microscope images of MNP and MNP-pRGEB32 complex |
纳米技术已经与许多学科交叉研究,具有巨大的潜在价值,已经广泛应用于生物及医学领域[19-21]。理想的基因载体应该能有效地负载外源核酸,具有较高的生物相容性,在细胞质内可以有效保护外源核酸免受酶促降解,使其最终能实现高效表达[22-23]。琼脂糖凝胶电泳阻滞试验显示了MNP高效负载pRGEB32的能力,并能够有效保护pRGEB32免受核酸酶降解作用。有研究推测可能是DNA和纳米载体结合后导致DNA构象发生变化,阻止Mg2+、核酸酶与DNA接触,从而保护DNA免受酶的消化作用[24-25]。通过粒度分布和Zeta电位测试显示MNP结合pRGEB32后,粒径增大,电位降低,说明二者通过静电相互作用形成了MNP−pRGEB32复合物。透射电镜和原子力显微镜的观测证实pRGEB32被吸附压缩后聚集在MNP表面[26],这种压缩和高浓度的聚集,使载体能够有效地负载和保护pRGEB32。通过上述结果可知,MNP在负载、聚集和保护pRGEB32方面表现优越,是一种理想的基因载体。
有研究通过磁性纳米载体负载外源基因,将外源基因整合到生殖细胞中,外源基因能在后代稳定遗传[16]。同时有研究证明可以利用CRISPR/Cas9编辑性细胞基因组,如Chapman等[27]利用CRISPR/Cas9直接编辑大鼠的精原细胞,产生纯合非镶嵌突变后代。若能将纳米材料和CRISPR基因编辑技术有效结合,直接对动植物生殖细胞定向编辑,将克服传统方式中部分物种基因转化困难、育种周期长等瓶颈问题。本试验证实磁性纳米载体能有效结合CRISPR编辑系统,为探索基于磁性纳米载体定向编辑技术的研究奠定了基础。
| [1] |
韩旭, 丁冠宇, 董青, 等. 基于脂质体的纳米基因载体的研究进展[J]. 应用化学, 2018, 35(7): 735-744. DOI:10.11944/j.issn.1000-0518.2018.07.180031 (  0) 0) |
| [2] |
卢艳敏. 磁性纳米颗粒作为载体在基因转染中的研究进展[J]. 生物技术通讯, 2013, 24(5): 736-740. DOI:10.3969/j.issn.1009-0002.2013.05.032 (  0) 0) |
| [3] |
古晓晓, 杜宝吉, 李云辉, 等. 基于纳米材料的基因载体[J]. 化学进展, 2015, 27(8): 1093-1101. (  0) 0) |
| [4] |
KHALAJ-KONDORI M, SADEGHIZADEH M, BEHMANESH M, et al. Chemical coupling as a potent strategy for preparation of targeted bacteriophage-derived gene nanocarriers into eukaryotic cells[J]. J Gene Med, 2011, 13(11): 622-631. DOI:10.1002/jgm.1617 (  0) 0) |
| [5] |
郭大伟, 朱玲英, 顾宁. 磁性纳米颗粒作为基因递送载体的研究进展[J]. 中国材料进展, 2013, 32(10): 605-610. (  0) 0) |
| [6] |
MacDONALD C, FRIEDMAN G, ALAMIA J, et al. Time-varied magnetic field enhances transport of magnetic nanoparticles in viscous gel[J]. Nanomedicine, 2010, 5(1): 65-76. DOI:10.2217/nnm.09.97 (  0) 0) |
| [7] |
孙茂蕾, 徐晓薇, 顾中一, 等. 纳米载体逃逸溶酶体机制及其调控的研究进展[J]. 吉林大学学报(医学版), 2017, 43(4): 845-848. (  0) 0) |
| [8] |
NAMGUNG R, SINGHA K, YU M K, et al. Hybrid superparamagnetic iron oxide nanoparticle-branched polyethylenimine magnetoplexes for gene transfection of vascular endothelial cells[J]. Biomaterials, 2010, 31(14): 4204-4213. DOI:10.1016/j.biomaterials.2010.01.123 (  0) 0) |
| [9] |
NEL A E, MADLER L, VELEGOL D, et al. Understanding biophysicochemical interactions at the nano-bio interface[J]. Nat Mater, 2009, 8(7): 543-557. DOI:10.1038/nmat2442 (  0) 0) |
| [10] |
AKINC A, QUERBES W, DE S, et al. Targeted delivery of RNAi therapeutics with endogenous and exogenous ligand-based mechanisms[J]. Mol Ther, 2010, 18(7): 1357-1364. DOI:10.1038/mt.2010.85 (  0) 0) |
| [11] |
WEISSLEDER R, KELLY K, SUN E Y, et al. Cell-specific targeting of nanoparticles by multivalent attachment of small molecules[J]. Nat Biotechnol, 2005, 23(11): 1418-1423. DOI:10.1038/nbt1159 (  0) 0) |
| [12] |
PETROS R A, DeSIMONE J M. Strategies in the design of nanoparticles for therapeutic applications[J]. Nat Rev Drug Discov, 2010, 9(8): 615-627. DOI:10.1038/nrd2591 (  0) 0) |
| [13] |
MINDELL J A. Lysosomal acidification mechanisms[J]. Annu Rev Physiol, 2012, 74: 69-86. DOI:10.1146/annurev-physiol-012110-142317 (  0) 0) |
| [14] |
GUO S, HUANG L. Nanoparticles escaping res and endosome: Challenges for siRNA delivery for cancer therapy[J]. J Nanomater, 2011. doi: 10.1155/2011/742895.
(  0) 0) |
| [15] |
WANG Y, ZHAO X, DU W, et al. Production of transgenic mice through sperm-mediated gene transfer using magnetic nano-carriers[J]. J Biomed Nanotechnol, 2017, 13(12): 1673-1681. DOI:10.1166/jbn.2017.2456 (  0) 0) |
| [16] |
ZHAO X, Meng Z, WANG Y, et al. Pollen magnetofection for genetic modification with magnetic nanoparticles as gene carriers[J]. Nat Plants, 2017, 3(12): 956-964. DOI:10.1038/s41477-017-0063-z (  0) 0) |
| [17] |
CUNNINGHAM F J, GOH N S, DEMIRER G S, et al. Nanoparticle-mediated delivery towards advancing plant genetic engineering[J]. Trends Biotechnol, 2018, 36(9): 882-897. DOI:10.1016/j.tibtech.2018.03.009 (  0) 0) |
| [18] |
XIE K, MINKENBERG B, YANG Y. Boosting CRISPR/Cas9 multiplex editing capability with the endogenous tRNA-processing system[J]. Proc Natl Acad Sci USA, 2015, 112(11): 3570-3575. DOI:10.1073/pnas.1420294112 (  0) 0) |
| [19] |
KWAK S Y, LEW T T S, SWEENEY C J, et al. Chloroplast-selective gene delivery and expression in planta using chitosan-complexed single-walled carbon nanotube carriers[J]. Nat Nanotechnol, 2019, 14(5): 447-455. DOI:10.1038/s41565-019-0375-4 (  0) 0) |
| [20] |
白华荣, 范换换, 张晓兵, 等. 核酸适体-纳米材料复合物用于癌症的诊断与靶向治疗研究进展[J]. 物理化学学报, 2018, 34(4): 348-360. DOI:10.3866/PKU.WHXB201708311 (  0) 0) |
| [21] |
冯婷婷, 郭建花. 纳米材料在生物医学中的应用[J]. 当代化工研究, 2018(2): 159-162. DOI:10.3969/j.issn.1672-8114.2018.02.098 (  0) 0) |
| [22] |
宋瑜, 李颖, 崔海信, 等. 两种阳离子纳米基因载体及植物基因介导效果的研究[J]. 生物技术通报, 2009(6): 75-80. (  0) 0) |
| [23] |
李瑶, 崔海信, 刘琪, 等. 磁性纳米颗粒作为基因载体的研究发展概况[J]. 功能材料, 2010, 41(S1): 14-19. (  0) 0) |
| [24] |
RHAESE S, Von BRIESEN H, RUBSAMEN-WAIGMANN H, et al. Human serum albumin-polyethylenimine nanoparticles for gene delivery[J]. J Control Release, 2003, 92(1/2): 199-208. (  0) 0) |
| [25] |
HE X X, WANG K M, TAN W H, et al. Bioconjugated nanoparticles for DNA protection from cleavage[J]. J Am Chem Soc, 2003, 125(24): 7168-7169. DOI:10.1021/ja034450d (  0) 0) |
| [26] |
VIJAYANATHAN V, THOMAS T, ANTONY T, et al. Formation of DNA nanoparticles in the presence of novel polyamine analogues: A laser light scattering and atomic force microscopic study[J]. Nucleic Acids Res, 2004, 32(1): 127-134. DOI:10.1093/nar/gkg936 (  0) 0) |
| [27] |
CHAPMAN K M, MEDRANO G A, JAICHANDER P, et al. Targeted germline modifications in rats using CRISPR/Cas9 and spermatogonial stem cells[J]. Cell Rep, 2015, 10(11): 1828-1835. DOI:10.1016/j.celrep.2015.02.040 (  0) 0) |
 2020, Vol. 41
2020, Vol. 41


