2. 华南农业大学 林学与风景园林学院/广东省森林植物种质资源创新与利用重点实验室,广东 广州 510642
2. College of Forestry and Landscape Architecture, South China Agricultural University/Guangdong Key Laboratory for Innovative Development and Utilization of Forest Plant Germplasm, Guangzhou 510642, China
采矿活动产生了大量的矿山废弃地,其废水的排放导致土壤酸度增加,有机质含量下降,破坏了中国多个地区的生态环境[1-2]。前期研究报道,很多农作物受到采矿活动的影响,导致产量逐年降低[3],因此,急需修复被矿山严重破坏土地的生态功能[4]。近年来,已有研究指出化学肥料与硅酸钠或蚯蚓的结合施用可以有效地保持土壤生产力和降低不良环境对植物的危害[5-6]。然而,关于这些外源添加物是否对土壤细菌群落结构造成影响的分析却少有报道[2]。
土壤微生物不仅能够通过促进养分吸收和转化(如碳汇集、氮固定)、分泌多种化学物质(如有机酸、氨基酸)等提高植物对胁迫环境的抵抗能力,还能通过降解多种污染物进行土壤修复[3,7-9]。例如,丛枝菌根(Arbuscular mycorrhiza,AM)可以显著提高大豆对Gu的吸收,从而减轻因矿区开发造成土壤Gu过量的危害[10-11]。还有研究表明,根际促生菌(Plant growth promoting rhizobacteria,PGPR)不仅可以改善植物生理状况,还可以与植物协同修复石油污染的土壤[12]。总的来说,植物是土壤修复的主体部分,当植物不能有效地富集污染物时,可以直接利用土壤微生物对污染物进行分解,改善植物生长环境和土壤营养状况,从而为接下来的植物–微生物协同修复土壤做好准备[9]。因此,土壤修复很大程度上依赖于土壤微生物,并且土壤微生物也已经被认为是评估土壤质量的重要指标之一[13]。
化学肥料、硅酸钠和蚯蚓作为非生物和生物肥料对采矿活动破坏过的土壤具有一定的改良作用[14-16]。一些研究已经表明化学肥料和蚯蚓对土壤微生物群落的影响,然而,关于硅酸钠对土壤中微生物群落结构所产生的影响的研究却很少报道[17-18]。施用化学肥料可以增加土壤中有机质的含量,为微生物的生长提供能源,促进土壤微生物的代谢功能[19]。蚯蚓能够调节土壤pH,从而间接影响土壤微生物群落结构[20-22]。前人研究表明,大豆是改良土壤质量的先锋作物,是矿区土地修复与生态重建的重要物种之一[23-25]。然而,化学肥料与硅酸钠结合施用和化学肥料与蚯蚓结合施用对大豆根际细菌群落产生的影响,尤其是在废弃矿区条件下的影响鲜见报道。
本研究通过16S rRNA高通量测序技术,对施用化学肥料结合硅酸钠或蚯蚓的废弃矿区土壤的根际细菌群落进行比较分析。从细菌多样性、群落结构及其与土壤化学性质的相互关系等方面评估废弃矿区大豆根际土壤微生物对施肥制度的响应特征。以期为矿区土壤修复提供理论依据和技术支持。
1 材料与方法 1.1 试验地点和试验设计试验区位于广东省梅州市平远县仁居镇黄畲村(117°98′N,24°57′E)西北部的稀土矿山。该地区的年平均气温为21.2 ℃,年平均降水量为1 383 mm,属亚热带季风气候区。此矿山至今已废弃20多年,之前的采矿活动造成了矿区及周边农田的土壤重金属镉(Cd)污染严重、土壤有机碳含量低和强烈酸化,矿区生态环境破坏问题严重。
试验区于2016年春季在废弃矿区建立,在此之前除生长稀疏的野草外,无其他植被种植。大豆种植共设置25垄,每垄高0.5 m、长24 m,垄间距0.8 m,厢面宽1.0 m。每个区组的田地尺寸为2 m×5 m,以随机区组设计排列,并由0.5 m缓冲区分开,种植密度为30 m×15 cm(行距×种植距离)。肥料选取由尿素(217 mg·kg−1)、过磷酸钙(219 mg·kg−1 P2O5)和氯化钾(86 mg·kg−1 K2O)组成的氮磷钾(NPK)无机肥,并配施硅酸钠或蚯蚓。大豆品种为‘华春9号’。于2016年5月上旬种植大豆的同时施加肥料,其中无机肥为(4.8±0.05) kg·m−2,硅酸钠为0.2 kg·m−2,蚯蚓为20条·m−2,试验过程中只施加1次肥料。在施肥后3和5个月时对大豆根际土壤进行采样。本研究设置4个施肥处理,每个处理3个重复:NPK肥结合硅酸钠(3NPK+S和5NPK+S)、NPK肥结合蚯蚓20条·m−2(每条蚯蚓鲜质量为0.55~0.75 g,在试验中每个处理分为单独的1个小区,小区间设置50 cm的隔离,试验后期的观察发现只有小部分蚯蚓逃离试验区,对总体试验影响微小)(3NPK+E和5NPK+E),以不施肥的大豆根际土壤为对照(3CK和5CK),各处理编号中的3和5分别代表采样时间为施肥后3和5个月。
1.2 根际土壤采样试验地于2015年11月进行整地,2016年5月上旬种植大豆,分别在2016年8月和2016年10月进行土壤采样。每垄选取3个地点,采样时选择大小一致的大豆植株通过抖根法在大豆根部采集土样,将其收集在已灭菌的2 mL离心管中,随即放入液氮中冷冻,带回实验室后一部分储存在−80 ℃进行DNA提取。另一部分储存在4 ℃用于测定土壤化学性质。
1.3 土壤化学性质测定采用pH计测定土壤悬浮液(水︰土质量比为5︰1)pH[26]。土壤有机质采用重铬酸钾–外加热法测定,土壤全碳和全氮通过德国的元素分析仪测定,全钾通过原子吸收分光光度计测定。碱解氮采用扩散法测定,速效钾采用火焰光度法测定,有效磷采用钼蓝法测定。全磷、铵态氮(NH4+-N)和硝态氮(NO3−-N)通过荷兰的连续流动分析仪测定。全镉采用湿式消化法测定,速效镉采用原子吸收光谱法测定[25]。供试土壤未种植大豆前的初始化学性质:pH 4.87、有机质、全碳、全氮、全磷和全钾质量分数分别为0.59、3.65、0.05、0.04和50.62 g·kg−1,碱解氮、有效磷、速效钾、全镉、速效镉、铵态氮和硝态氮质量分数分别为18.25、4.87、29.86、0.25、0.02、29.53和1.82 mg·kg−1。
1.4 DNA提取和PCR扩增利用Fast kit DNA试剂盒提取根际土壤总DNA,提取的DNA在去离子水中稀释,并储存于−20 ℃冰箱中保存备用。使用具有12nt barcode引物338F(5′-ACTCCTACGGGAGGCAGCAG-3′)和806R(5′-GGACTACHVGGGTWTCTAAT-3′)扩增16S rRNA基因的V3-V4高变区[27]。PCR反应体系包括10 μL SYBR Premix Ex TaqTM、1.0 μL正向和1.0 μL反向引物、7.0 μL无菌水、1.0 μL模板DNA。PCR扩增体系:95 ℃变性3 min;95 ℃ 30 s,55 ℃ 30 s,72 ℃ 45 s,28个循环;72 ℃10 min[28]。
1.5 数据分析通过MiSeq测序平台测序后,使用QIIME1 Pipeline V1.9.0处理和分析原始序列。剔除低质量序列,然后将高质量序列聚类到操作分类单元(OTU)中。在QIIME1中计算根际细菌Alpha–多样性(Chao1和Shannon指数)。基于Bray-Curtis距离矩阵进行主坐标分析(PCoA)用于表现不同处理之间细菌群落组成的相似性或相异性[29]。采用非参数多元方差分析(Adonis)计算细菌群落结构的差异。Manteltest分析和典型关联分析(Canonical correlation analysis,CCA)用于评估细菌群落结构和土壤化学性质之间的相关性。采用t检验(Student’ s t test)对相对丰度在前50的属进行差异性分析。方差分析(ANOVA)中的Duncan’s法用来确定所有组间的显著性差异。Venn分析用于统计不同处理样本中所共有和独有的细菌属的数量。其中优势菌门和优势菌属分别选取所有土壤样品中相对丰度最高的5个门和5个属。
2 结果与分析 2.1 根际土壤化学性质由表1可知,相比于对照3CK,3NPK+S和3NPK+E处理均显著增加大豆根际土壤有机质、全碳、全氮、全磷、铵态氮和有效磷的含量,显著降低全钾和全镉含量;而在3NPK+E处理下的全碳含量显著高于3NPK+S处理,有效磷和速效镉含量显著低于3NPK+S处理。相比于对照5CK,5NPK+S和5NPK+E处理均会显著增加有机质、全碳、全氮、碱解氮和有效磷的含量;在5NPK+E处理下的有机质和全碳含量显著高于5NPK+S处理,有效磷和速效钾含量显著低于5NPK+S处理。总的来说,NPK+S和NPK+E处理显著增加了有机质、全碳、全氮和有效磷的含量。
|
|
表 1 根际土壤化学性质1) Table 1 Chemical properties of rhizosphere soil |
由表2可知,在施肥3个月的土壤样品中,Shannon指数为:3NPK+E>3NPK+S>3CK (P< 0.05);相比于对照3CK,3NPK+E处理的Chao1指数显著更高。5NPK+S处理下根际土壤的Chao1和Shannon指数在所有处理中最大,并且其Shannon指数显著大于5NPK+E处理下的该指数。
|
|
表 2 根际土壤样品的细菌群落多样性指数1) Table 2 Indexes of bacterial community diversity in rhizosphere soil samples |
基于细菌在OTU水平的相对丰度,对细菌群落结构进行PCoA分析。结果显示,所有样品的根际土壤细菌群落被聚为6组,相同处理的根际细菌被聚在一起(图1A)。分别对施肥3和5个月的根际细菌进行PCoA分析发现,不同施肥方式的根际细菌群落组成显著分离(P < 0.01)( 图1B、1C)。3NPK+E与3NPK+S处理的根际细菌群落组成分离程度较小,而5NPK+E与5NPK+S处理的根际细菌群落组成分离程度较大(图1B、1C)。
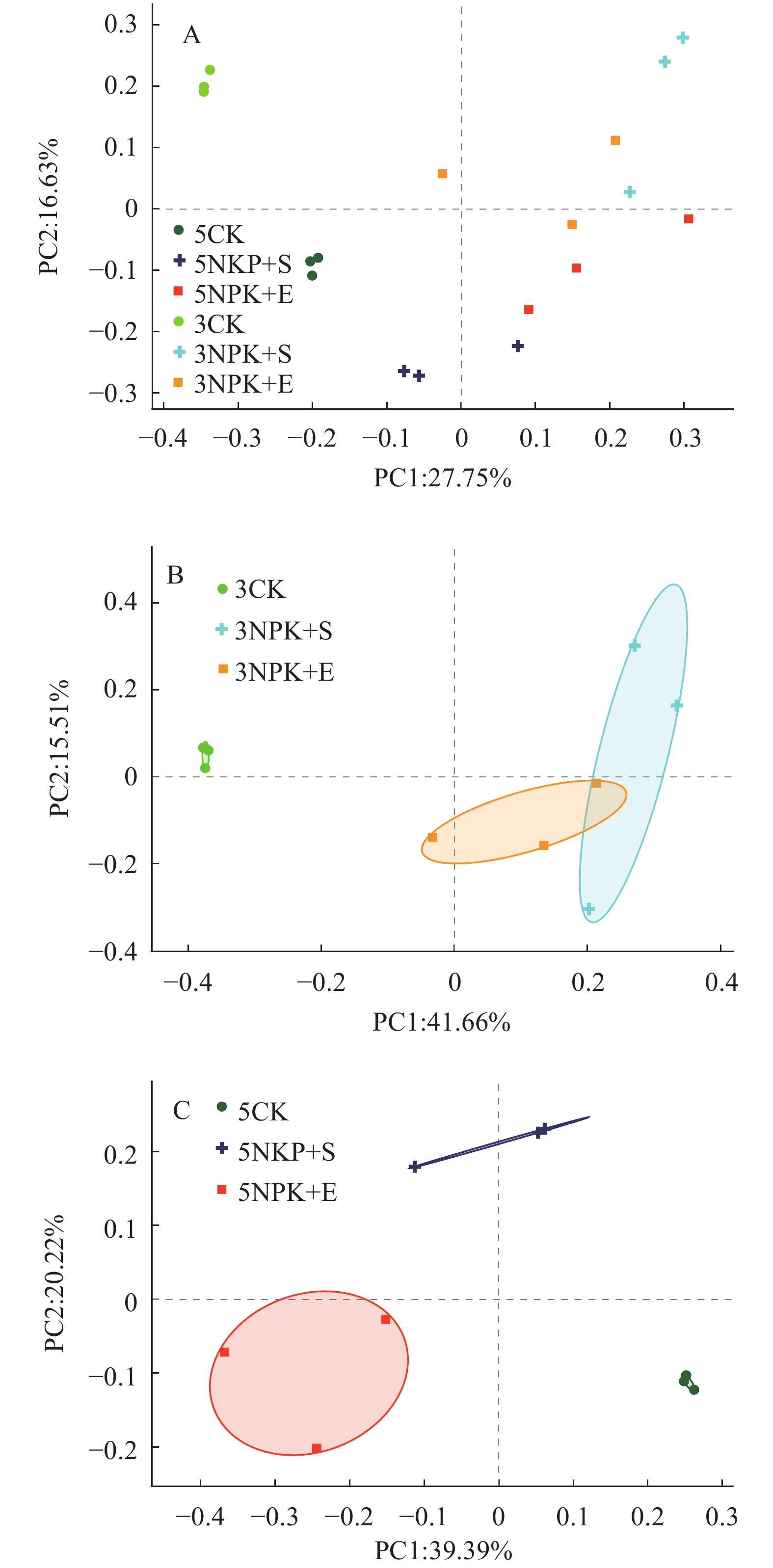
|
图 1 根际土壤细菌群落的主坐标分析 Fig. 1 Principal coordinate analyses of bacterial communities in rhizosphere soil |
采用16S rRNA测序技术对施肥3和5个月的大豆根际土壤样品分析,前者得到37门84纲190目389科788属1 639种以及4 715个OTU;后者得到36门83纲182目380科781属1 648种以及5 125个OTU。
对细菌门水平的相对丰度进行分析发现,前5个优势类群为变形菌门Proteobacteria、放线菌门Actinobacteria、绿弯菌门Chloroflexi、酸杆菌门Acidobacteria和拟杆菌门Bacteroidetes。此外,螺旋体菌门Saccharibacteria、蓝藻门Cyanobacteria、芽单胞菌门Gemmatimonadetes、厚壁菌门Firmicutes和疣微菌门Verrucomicrobia等也能在所有土壤样品中被检测到(图2)。施肥5个月的土壤中,变形菌门在5CK的相对丰度显著更高,绿弯菌门在5NPK+S和5NPK+E处理下的相对丰度显著更高;而施肥3个月的土壤中只有绿弯菌门的相对丰度出现显著性差异(表3)。
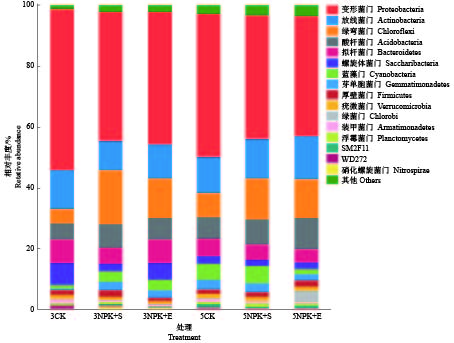
|
图 2 不同施肥处理下根际土壤细菌在门水平的相对丰度 Fig. 2 Relative abundance of rhizosphere soil bacteria at phylum level under different fertilization treatments |
|
|
表 3 不同施肥处理下根际土壤优势菌门的相对丰度1) Table 3 Relative abundance of rhizosphere soil dominant bacteria at phylum level under different fertilization treatments |
属的差异性分析表明,在不同施肥方式下,施肥3和5个月的根际土壤所检测到的细菌中出现显著性差异的属分别有5个和6个(图3A、3B)。在3CK土壤样品中,戴氏菌属Dyella、Unclassified_f_Xanthomonadaceae、Rhizomicrobium、马西利亚菌属Massilia和鞘脂菌属Sphingobium的相对丰度显著高于3NPK+S和3NPK+E处理(图3A)。在施肥5个月的土壤样品中,5NPK+E处理下的根际土壤中细菌属的相对丰度显著高于其他处理的有Uncultured_f_Anaerolineaceae、Norank_o_Subgroup_6和Norank_f_SJA-28;而玫瑰弯菌属Roseiflexus、Norank_c_Cyanobacteria和Pseudolabrys的相对丰度在5NPK+S处理下显著高于5CK和5NPK+E处理(图3B)。不同施肥处理时间的土壤在NPK+S处理下进行比较,发现根际细菌中有Norank_o_JG30-KF-AS9、Norank_c_KD4-96、Norank_o_C0119、Norank_FFCH7168、链霉菌属Streptomyces和Rhizomicrobium共6个属的相对丰度在5NPK+S处理时显著高于3NPK+S处理(图3C);而在NPK+E处理下,根际细菌中有鞘脂单胞菌属Sphingomonas、芽单胞菌属Gemmatimonas、Ramlibacter和单胞菌属Arenimonas共4个属的相对丰度在3NPK+E处理时显著高于5NPK+E处理,只有Uncultured_f_Nitrosomonadaceae的相对丰度在5NPK+E处理时显著高于3NPK+E处理(图3D)。
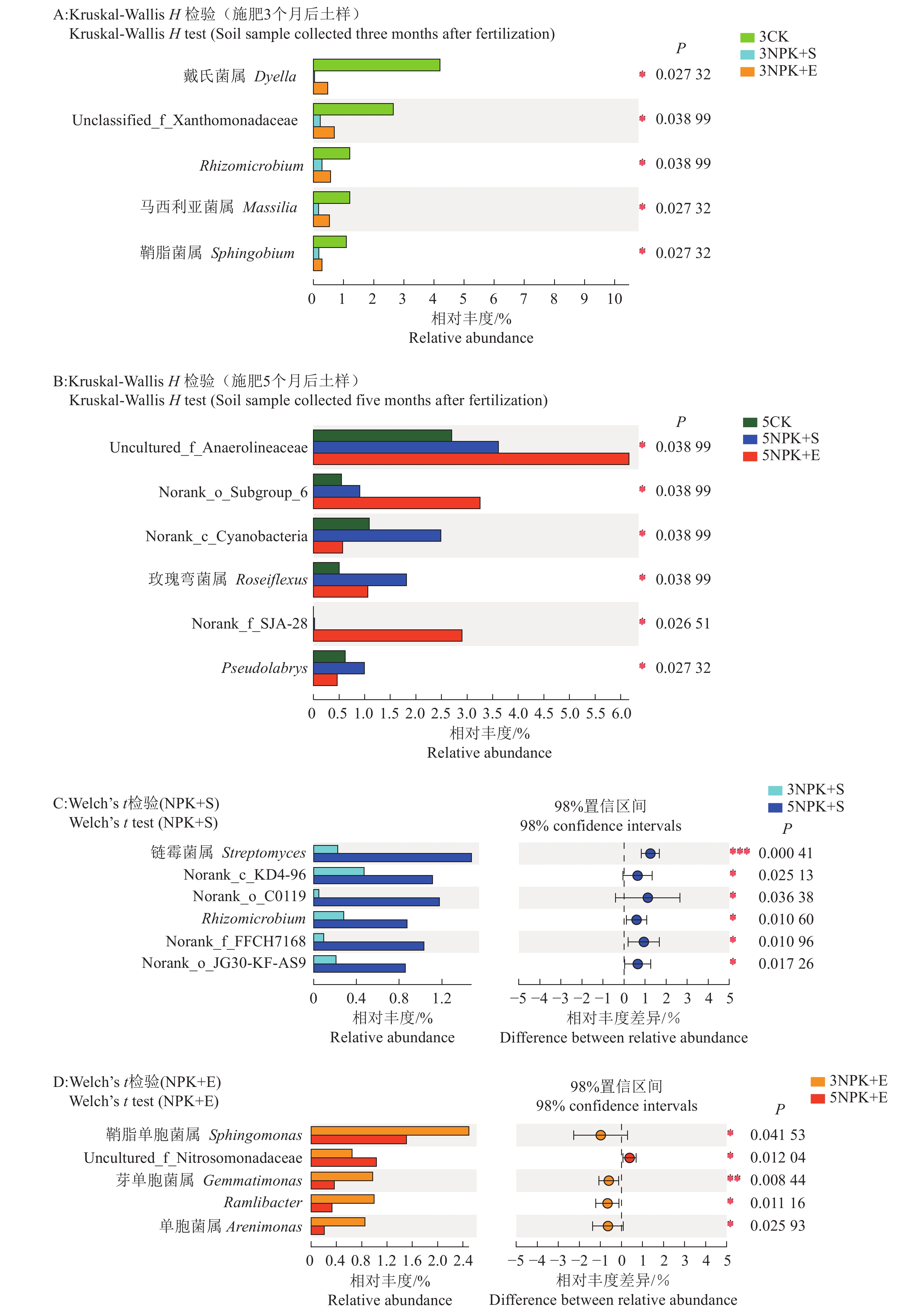
|
图 3 不同施肥处理下根际土壤细菌属水平的相对丰度差异性分析 Fig. 3 Relative abundance of rhizosphere soil bacteria at genus level under different fertilization treatments |
从属的相对丰度来看,Uncultured_f_Anaerolineaceae是3NPK+S、3NPK+E、5NPK+S、5NPK+E处理土壤中的优势菌属,相对丰度分别为10.49%、7.46%、3.65%和6.22%(表4)。通过Venn分析4个处理组(3NPK+S、3NPK+E、5NPK+S、5NPK+E)根际土壤样本中所共有和独有的细菌属的数量,结果表明,3NPK+S和3NPK+E处理的根际土壤细菌所特有的属分别为26和19个,5NPK+S和5NPK+E处理的根际土壤细菌所特有的属分别为27和17个(图4)。
|
|
表 4 不同施肥处理下根际土壤优势菌属的相对丰度1) Table 4 Relative abundance of rhizosphere soil dominant bacteria at genus level under different fertilization treatments |
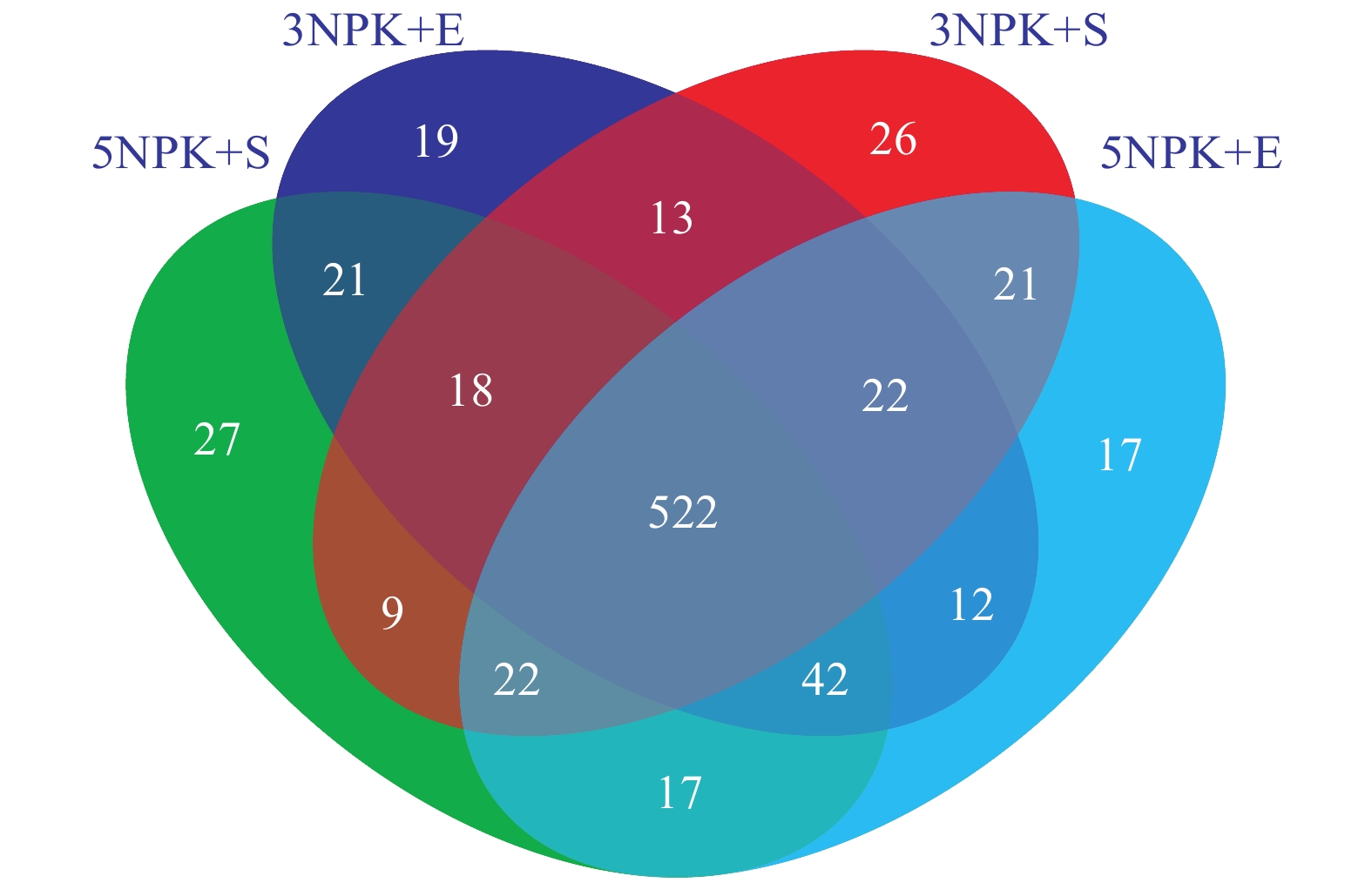
|
图 4 不同施肥处理下根际土壤细菌在属水平的Venn分析 Fig. 4 Venn analysis of rhizosphere soil bacteria at genus level under different fertilization treatments |
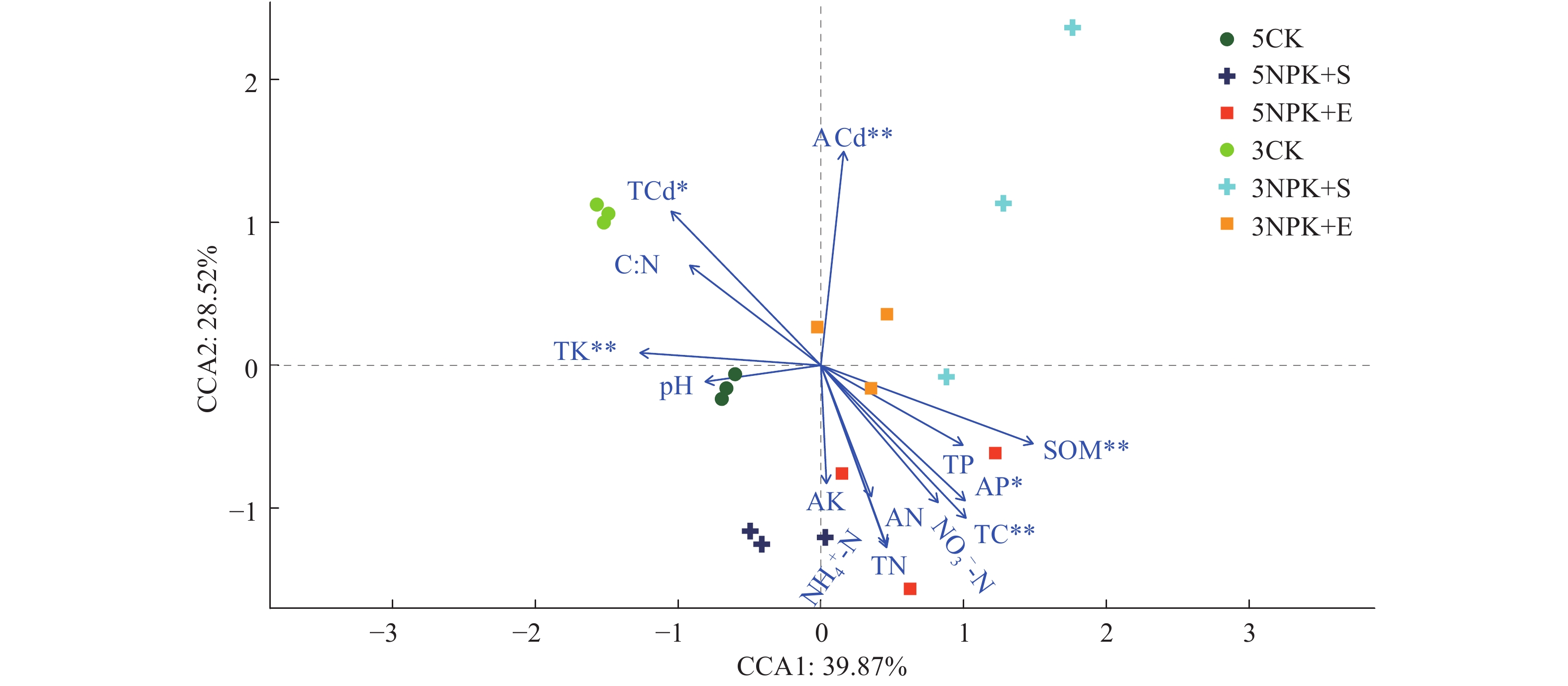
基于Mantel检验和CCA分析的结果表明,根际细菌群落随着施肥方式和处理时间的不同而沿CCA1轴和CCA2轴分布。在所有被测化学性质中,与CCA1轴呈正相关的主要有有机质(R = 0.432 3,P = 0.002),呈负相关的有全钾(R = 0.358 8,P = 0.002);与CCA2轴呈正相关的主要有速效镉(R = 0.366 7,P = 0.003)。有机质、全碳、全钾、有效磷、全镉和速效镉对废弃矿区大豆根际土壤细菌群落结构影响较显著。5NPK+E处理的细菌群落主要集中在第4象限,有机质、有效磷和全碳均对其有显著的正向影响(图5)。
|
图 5 基于CCA分析的根际细菌群落与土壤化学性质之间的关系 Fig. 5 Correlation between rhizosphere bacterial community and soil chemical property based on CCA analysis SOM:土壤有机质,TC:全碳,TN:全氮,C︰N:碳氮质量比,TP:全磷,TK:全钾,AN:碱解氮,AP:有效磷,AK:速效钾,TCd:全镉,ACd:速效镉,NH4+-N:铵态氮,NO3--N:硝态氮;“*”和“**”分别表示差异达0.05和0.01显著水平(Mantel检验) SOM: Soil organic matter, TC: Total carbon, TN: Total nitrogen, C︰N: C︰N mass ratio, TP: Total phosphorus, TK: Total potassium, AN: Alkaline nitrogen, AP: Available phosphorus, AK: Available potassium, TCd: Total cadmium, ACd: Available cadmium, NH4+-N: Ammonium nitrogen, NO3--N: Nitrate nitrogen; “*” and “**” indicated significant differences at 0.05 and 0.01 levels respectively (Mantel test) |
随着采矿活动大量增加,较高的土壤微生物多样性对矿区农业生产至关重要[30]。本研究结果表明,施肥方式和处理时间均对废弃矿区大豆根际土壤细菌多样性影响显著。细菌Alpha–多样性Chao1指数在3NPK+E处理中显著大于3CK处理,而Shannon指数在3NPK+E处理中显著大于3NPK+S和3CK处理,说明施肥时间较短的情况下NPK+E施用更加有利于细菌多样性的增加,这可能是由于蚯蚓在土壤中的分泌和排泄等行为能够提高微生物活性和数量[31]的缘故。在5NPK+S处理下,土壤的Chao1和Shannon指数均大于3NPK+S。有文献表明细菌多样性会随着时间而发生变化[32]。其原因可能是随着时间的推移,硅酸根与重金属形成不易被植物吸收的复合物,降低了重金属毒害,改善了土壤环境并间接有效地提高了微生物的多样性[33-35],并且施加硅酸盐的土壤中有较高的Alpha–多样性[36]。之前的研究表明,微生物群落多样性是反映土壤质量的一个重要生物学指标,对土壤健康具有重要作用[37]。总的来说,NPK+E和NPK+S处理分别有利于在短期内和长期提高细菌多样性,因此不论是NPK+E还是NPK+S施肥处理都能够间接对土壤修复起促进作用。
3.2 施肥方式和处理时间对根际土壤细菌群落结构的影响不同施肥方式和处理时间不仅对根际细菌群落的Alpha–多样性有显著影响,也对根际细菌群落结构(Beta–多样性)有显著影响。基于PCoA结果发现,在2个施肥处理时间下,随着施肥方式的不同,细菌群落分别沿PC1轴呈现出显著分离,说明细菌群落结构对不同施肥方式的响应不同。这些发现与多个研究的结果类似,即添加化学肥料、硅酸钠和蚯蚓均会改变土壤微生物群落结构[36,38-39]。所有土壤样本根据施肥处理时间沿PC2轴被显著分离成2组,说明细菌群落发生了变化。这与以前的研究结果类似,即施肥处理时间的长短对微生物群落结构具有较大的影响[40]。
本研究发现在不同施肥方式下,施肥5个月的根际土壤细菌中相对丰度出现显著性差异的门有变形菌门和绿弯菌门;而施肥3个月时,只有绿弯菌门相对丰度出现显著性差异。推测可能是对比于施肥方式,施肥处理时间对细菌优势门组成的影响较大,并且土壤中不同肥料的施入会随着时间延长而对细菌群落组成影响逐渐增大。在属水平上,Uncultured_f_Anaerolineaceae是3NPK+S、3NPK+E、5NPK+S和5NPK+E处理土壤中的优势菌属,并且在5NPK+E处理下的土壤中富集。前人的研究证实Anaerolineaceae在烷烃的降解过程中起着至关重要的作用,对土壤污染具有很好的微生物修复潜力[41-42]。Anaerolineaceae还被发现可能是促使碳转化为土壤有机碳的主要因素,这不仅会间接影响细菌群落组成,也有利于植物吸收营养[43]。本研究表明,5NPK+E处理下的根际土壤中有机质含量在所有处理中最高,这对于Anaerolineaceae可能促使碳转化提供了更有利的证据。同时,在5NPK+E处理下,蚯蚓存在于土壤中的时间越长,产生的蚯蚓粪越多,这类粪肥是植物养分的有效来源[44]。
3.3 施肥方式和处理时间对根际细菌群落与土壤化学性质相互关系的影响环境因子对根际土壤细菌群落结构和组成有重要影响[45]。本研究中,分别在不同时间段,施加不同肥料都会显著增加有机质、有效磷和全碳的含量,并且对5NPK+E处理的细菌群落具有正向作用。该结果与一些研究[46-48]部分一致,其原因可解释为硅酸钠的添加提高了土壤有效磷含量,而蚯蚓在土壤中活动时间延长,产生了更多的蚯蚓粪,从而会显著增加有机质含量[46-48]。总之,本研究结果表明,不同施肥方式和处理时间均会改变土壤环境条件,从而间接驱动细菌群落组成和结构的变化。
3.4 结论本研究表明,施肥方式和处理时间对废弃矿区大豆根际土壤细菌群落的影响较为显著。NPK+S和NPK+E处理均能够有效地提高矿区土壤细菌多样性,从而间接对土壤修复起到促进作用。随着时间的延长,NPK+S处理对提高细菌多样性效果更好;而NPK+E处理在短期内能够有效地提高细菌多样性。综合来说,本研究的这2种施肥方式相结合更能够提高细菌多样性,从而有效修复土壤。相比于施肥后3个月,施肥后5个月的5NPK+E与5NPK+S处理的根际细菌群落分离程度更大,说明随着时间的延长施肥方式对细菌群落的影响越大。Uncultured_f_Anaerolineaceae在施肥处理下的土壤中富集,很可能在促使碳转化的过程中起着重要作用,并且具有修复土壤污染的潜力。NPK+E处理下产生的蚯蚓粪会增加有机质含量,对细菌群落有正向影响,也为植物提供更多的有效养分。综上所述,建议施肥结合硅酸盐的同时加入蚯蚓对土壤的修复效果会更好。
| [1] |
王娟, 王正海, 耿欣, 等. 大宝山多金属矿区土壤–植被稀土元素生物地球化学特征[J]. 中国地质大学学报(地球科学版), 2014, 39(6): 733-740. (  0) 0) |
| [2] |
ZHAO J, NI T, LI Y, et al. Responses of bacterial communities in arable soils in a rice-wheat cropping system to different fertilizer regimes and sampling times[J/OL]. PLoS One, 2014, 9(1), e85301[2019-06-10]. https://doi.org/10.1371/journal.pone.0085301.
(  0) 0) |
| [3] |
NANNIPIERI P, ASCHER J, CECCHERINI MT, et al. Microbial diversity and soil functions[J]. Eur J Soil Sci, 2003, 54(4): 655-670. DOI:10.1046/j.1351-0754.2003.0556.x (  0) 0) |
| [4] |
吴国伟, 赵艳玲, 付艳华, 等. 复垦矿区土地利用类型变化对植被碳储量的影响[J]. 中国生态农业学报, 2015, 23(11): 1437-1444. (  0) 0) |
| [5] |
刘杏兰, 高宗, 刘存寿, 等. 有机−无机肥配施的增产效应及对土壤肥力影响的定位研究[J]. 土壤学报, 1996(2): 138-147. DOI:10.11766/trxb199407060204 (  0) 0) |
| [6] |
CLEMENTE R, PAREDES C, BERNAL M P, et al. A field experiment investigating the effects of olive husk and cow manure on heavy metal availability in a contaminated calcareous soil from Murcia (Spain)[J]. Agric Ecosyst Environ, 2007, 118(1/2/3/4): 319-326. (  0) 0) |
| [7] |
LI X, RUI J, MAO Y, et al. Dynamics of the bacterial community structure in the rhizosphere of a maize cultivar[J]. Soil Biol Biochem, 2014, 68: 392-401. DOI:10.1016/j.soilbio.2013.10.017 (  0) 0) |
| [8] |
DIMKPA C, WEINAND T, ASCH F. Plant-rhizobacteria interactions alleviate abiotic stress conditions[J]. Plant Cell Environ, 2009, 32(12): 1682-1694. DOI:10.1111/j.1365-3040.2009.02028.x (  0) 0) |
| [9] |
王梦姣, 杨国鹏, 乔帅, 等. 植物−根际微生物协同修复有机物污染土壤的研究进展[J]. 江苏农业科学, 2017, 45(1): 5-8. (  0) 0) |
| [10] |
LAMBERT D H, WEIDENSAUL F C. Element uptake by myeorrhizal soybean from sewage-sludge-treated soil[J]. Soil Sci Soc Am J, 1991, 55(2): 393-398. DOI:10.2136/sssaj1991.03615995005500020017x (  0) 0) |
| [11] |
李建华, 郜春花, 卢朝东, 等. 丛枝菌根和根瘤菌双接种对矿区土地复垦的生态效应[J]. 中国土壤与肥料, 2009(5): 77-80. (  0) 0) |
| [12] |
DONG R, GU L, GUO C, et al. Effect of PGPR Serratiamarcescens BC-3 and AMF glomusintraradices on phytoremediation of petroleum contaminated soil[J]. Ecotoxicology, 2014, 23(4): 674-680. DOI:10.1007/s10646-014-1200-3 (  0) 0) |
| [13] |
杨海君, 肖启明, 刘安元. 土壤微生物多样性及其作用研究进展[J]. 南华大学学报(自然科学版), 2005, 19(4): 21-31. DOI:10.3969/j.issn.1673-0062.2005.04.006 (  0) 0) |
| [14] |
范继香, 郜春花, 张强, 等. 施肥措施对矿区复垦土壤活性有机碳库的影响[J]. 中国农学通报, 2012, 28(36): 119-123. DOI:10.3969/j.issn.1000-6850.2012.36.020 (  0) 0) |
| [15] |
邓晓霞, 黎其万, 米艳华, 等. 云南个旧矿区Pb污染稻田土壤钝化修复[J]. 环境工程学报, 2017, 11(8): 4831-4837. DOI:10.12030/j.cjee.201606017 (  0) 0) |
| [16] |
张池, 周波, 吴家龙, 等. 蚯蚓在我国南方土壤修复中的应用[J]. 生物多样性, 2018, 26(10): 1091-1102. DOI:10.17520/biods.2018151 (  0) 0) |
| [17] |
张变华, 靳东升, 张强, 等. 不同施肥处理下工矿复垦区大豆根际效应分析[J]. 大豆科学, 2018, 37(6): 93-100. (  0) 0) |
| [18] |
NECHITAYLO T Y, YAKIMOV M M, GODINHO M, et al. Effect of the earthworms Lumbricus terrestris and Aporrectodea caliginosa on bacterial diversity in soil
[J]. Microb Ecol, 2010, 59(3): 574-587. DOI:10.1007/s00248-009-9604-y (  0) 0) |
| [19] |
孟庆英, 于忠和, 贾绘彬, 等. 不同施肥处理对大豆根际土壤微生物及土壤肥力影响[J]. 大豆科学, 2011, 30(3): 471-474. (  0) 0) |
| [20] |
BASKER A, KIRKMAN J H, MACGREGOR A N. Changes in potassium availability and other soil properties due to soil ingestion by earthworms[J]. Biol Fert Soil, 1994, 17(2): 154-157. DOI:10.1007/BF00337748 (  0) 0) |
| [21] |
YU X, CHENG J, WONG M H. Earthworm-mycorrhiza interaction on Cd uptake and growth of ryegrass[J]. Soil Biol Biochem, 2005, 37(2): 195-201. DOI:10.1016/j.soilbio.2004.07.029 (  0) 0) |
| [22] |
庞宇飞. 蚯蚓粪对城镇污泥降解过程中理化指标及微生物群落结构的影响[D]. 兰州: 兰州交通大学, 2018.
(  0) 0) |
| [23] |
刘胜洪, 周玲艳, 杨妙贤, 等. 十种耐逆植物在和平县稀土矿区生态修复中的应用[J]. 天津农业科学, 2013, 19(7): 92-96. DOI:10.3969/j.issn.1006-6500.2013.07.023 (  0) 0) |
| [24] |
王崇臣, 王鹏, 黄忠臣. 盆栽玉米和大豆对铅、镉的富集作用研究[J]. 安徽农业科学, 2008, 36(24): 10383. DOI:10.3969/j.issn.2095-0446.2015.10.129 (  0) 0) |
| [25] |
鲍士旦. 土壤农化分析[M]. 北京: 中国农业出版社, 1982: 25-114.
(  0) 0) |
| [26] |
LIAN T, MA Q, SHI Q, et al. High aluminum stress drives different rhizosphere soil enzyme activities and bacterial community structure between aluminum-tolerant and aluminum-sensitive soybean genotypes[J]. Plant Soil, 2019, 440(1/2): 409-425. (  0) 0) |
| [27] |
CASTRILLO G, TEIXEIRA P J P L, PAREDES S H, et al. Root microbiota drive direct integration of phosphate stress and immunity[J]. Nature, 2017, 543(7646): 513-518. DOI:10.1038/nature21417 (  0) 0) |
| [28] |
LI J, LIN J, PEI C, et al. Variation of soil bacterial communities along a chronosequence of Eucalyptus plantation[J/OL]. Peer J, 2018, 6:e5648[2019-06-11].https://doi.rog/10.7717/peerj.5648.
(  0) 0) |
| [29] |
LI L, TILMAN D, LAMBERS H, et al. Plant diversity and overyielding: Insights from belowground facilitation of intercropping in agriculture[J]. New Phytolog, 2014, 203(1): 63-69. DOI:10.1111/nph.12778 (  0) 0) |
| [30] |
SUN R, ZHANG X X, GUO X, et al. Bacterial diversity in soils subjected to long-term chemical fertilization can be more stably maintained with the addition of livestock manure than wheat straw[J]. Soil Biol Biochem, 2015, 88(5): 9-18. DOI:10.1016/j.soilbio.2015.05.007 (  0) 0) |
| [31] |
郝月崎, 孙扬, 李晓晶, 等. 赤子爱胜蚓对乙草胺污染土壤微生物群落的影响[J]. 农业环境科学学报, 2018, 37(11): 2456-2466. DOI:10.11654/jaes.2018-0504 (  0) 0) |
| [32] |
陈来红, 乔光华, 董红丽, 等. 准格尔露天矿区复垦对土壤细菌多样性的影响研究[J]. 干旱区资源与环境, 2012, 26(2): 119-125. (  0) 0) |
| [33] |
单世平, 郭照辉, 付祖姣, 等. 降低水稻镉吸收原位钝化修复技术及其作用机理[J]. 生态科学, 2015, 34(4): 175-179. (  0) 0) |
| [34] |
李淑仪, 林翠兰, 许建光, 等. 施硅对污染土壤中铬形态及其生物有效性的影响[J]. 生态环境, 2008, 17(1): 227-231. DOI:10.3969/j.issn.1674-5906.2008.01.044 (  0) 0) |
| [35] |
刘晶鑫, 迟凤琴, 许修宏, 等. 长期施肥对农田黑土微生物群落功能多样性的影响[J]. 应用生态学报, 2015, 26(10): 3066-3072. (  0) 0) |
| [36] |
ZHOU X, SHEN Y, FU X, et al. Application of sodium silicate enhances cucumber resistance to fusarium wilt and alters soil microbial communities[J]. Front Plant Sci, 2018, 9: 624. DOI:10.3389/fpls.2018.00624 (  0) 0) |
| [37] |
KENNEDY A C, SMITH K L. Soil microbial diversity and the sustainability of agricultural soils[J]. Plant Soil, 1995, 170(1): 75-86. DOI:10.1007/BF02183056 (  0) 0) |
| [38] |
于冰, 宋阿琳, 李冬初, 等. 长期施用有机和无机肥对红壤微生物群落特征及功能的影响[J]. 中国土壤与肥料, 2017(6): 58-65. DOI:10.11838/sfsc.20170609 (  0) 0) |
| [39] |
ENAMI Y, OKANO S, YADA H, et al. Influence of earthworm activity and rice straw application on the soil microbial community structure analyzed by PLFA pattern[J]. Eur J Soil Biol, 2001, 37(4): 269-272. DOI:10.1016/S1164-5563(01)01096-2 (  0) 0) |
| [40] |
YU Z H, WANG G H, JIN J, et al. Soil microbial communities are affected more by land use than seasonal variation in restored grassland and cultivated mollisols in Northeast China[J]. Eur J Soil Biol, 2011, 47(6): 357-363. DOI:10.1016/j.ejsobi.2011.09.001 (  0) 0) |
| [41] |
LIANG B, WANG L Y, ZHOU Z C, et al. High frequency of Thermodesulfovibrio spp. and Anaerolineaceae in association with Methanoculleus spp. in a long-term incubation of n-alkanes-degrading methanogenic enrichment culture[J]. Front Microb, 2016, 7: 1431. doi:10.3389/fmicb.2016.01431
(  0) 0) |
| [42] |
蔡萍萍, 宁卓, 何泽, 等. 采油井场土壤微生物群落结构分布[J]. 环境科学, 2018, 39(7): 3329-3338. (  0) 0) |
| [43] |
LIAN T, JIN J, WANG G, et al. The fate of soybean residue-carbon links to changes of bacterial community composition in mollisols differing in soil organic carbon[J]. Soil Biol Biochem, 2017, 109: 50-58. DOI:10.1016/j.soilbio.2017.01.026 (  0) 0) |
| [44] |
CHAOUI H I, ZIBILSKE L M, OHNO T. Effects of earthworm casts and compost on soil microbial activity and plant nutrient availability[J]. Soil Biol Biochem, 2003, 35(2): 295-302. DOI:10.1016/S0038-0717(02)00279-1 (  0) 0) |
| [45] |
HORNER-DEVINE M C, CARNEY K M, BOHANNAN B J. An ecological perspective on bacterial biodiversity[J]. Biol Sci, 2004, 271(1535): 113-122. DOI:10.1098/rspb.2003.2549 (  0) 0) |
| [46] |
SINGH K P, SARKAR M C. Phosphorus availability in soils as affected by fertilizer phosphorus, sodium silicate and farmyard manure[J]. Indian J Agr Sci, 1992, 40(4): 762-767. (  0) 0) |
| [47] |
BOSSUYT H, SIX J, HENDRIX P F. Protection of soil carbon by microaggregates within earthworm casts[J]. Soil Biol Biochem, 2005, 37(2): 251-258. DOI:10.1016/j.soilbio.2004.07.035 (  0) 0) |
| [48] |
OYEDELE D J, SCHJØNNING P, AMUSAN A A. Physicochemical properties of earthworm casts and uningested parent soil from selected sites in Southwestern Nigeria[J]. Ecol Eng, 2006, 28(2): 106-113. DOI:10.1016/j.ecoleng.2006.05.002 (  0) 0) |
 2020, Vol. 41
2020, Vol. 41


