2. 吉安市烟草公司,江西 吉安 343000;
3. 广东省微生物信号与作物病害防控重点实验室,广东 广州 510642
2. Ji'an Tobacco Company, Ji′an 343000, China;
3. Key Laboratory of Microbial Signals and Disease Control of Guangdong Province, Guangzhou 510642, China
茄科劳尔氏菌Ralstonia solanacearum,俗称青枯菌,引起的烟叶青枯病是烟草生产中的重要细菌病害,该病在我国大多数烟叶种植区普遍发生且为害严重,已造成巨大的经济损失。目前烟草青枯病的防治主要以轮作和化学防治为主,但效果不理想。噬菌体是侵染细菌的病毒,具有高度的特异性及快速裂解宿主(寄主)的能力,可用于动物和人体细菌疾病的治疗[1-4]。由于细菌对抗生素的抗性日趋增强,“超级细菌”对细菌病害防治具有严重的潜在威胁,利用噬菌体来防治植物细菌病害受到广泛关注,已有较多的相关研究[5-13]。例如,利用噬菌体防治番茄和辣椒细菌性疮痂病Xanthomonas campestris pv. vesicatoria[6]、天竺葵细菌性枯萎病Xanthomonas campestris pv. pelargonii[7]、柑橘溃疡病Xanthomonas citri pv. citri[8]、梨火疫病Erwinia amylovora[9]和大白菜软腐病Pectobacterium carotovora subsp. carotovora[10]等植物细菌病害,已取得了一定的成效。在作物青枯病防治方面,Addy等[11]发现感染噬菌体φRSM1和φRSM3后,青枯菌毒性明显减弱,丝状噬菌体φRSM3的施用可明显减轻番茄青枯病的发病率;施用裂解性噬菌体可以有效防治作物青枯病[13]。
对于寄主范围广、遗传多样性丰富的青枯菌来说,噬菌体具有高度的特异性,因此利用噬菌体来防治青枯病受到寄主范围的限制。这也是噬菌体未能广泛地实际应用的原因。此外,有关青枯菌噬菌体的抗性机制及作用受体尚不完全清楚,本文探究噬菌体与青枯菌的互作,分析青枯菌对噬菌体的敏感性与抗性,研究噬菌体的作用受体,以期为利用噬菌体防治作物青枯病提供参考。
1 材料与方法 1.1 供试菌株与噬菌体供试的4种青枯菌噬菌体P1556-1、P1556-2、P7-1和P1521分离自江西省吉安市烟叶种植区土壤,以烟草青枯菌Tb1556作为噬菌体寄主,所有噬菌体和青枯菌均由华南农业大学农学院细菌研究室保存和提供。
1.2 培养基及试剂LB液体培养基:酵母提取物5 g,氯化钠10 g,胰蛋白胨10 g,蒸馏水1 000 mL,LB固体培养基加15 g琼脂。
普通细菌固体培养基:牛肉膏3 g,酵母膏3 g,蛋白胨3 g,硫酸镁0.25 g,磷酸氢二钾2 g,磷酸二氢钾0.5 g,蔗糖15 g,琼脂18 g,蒸馏水1 000 mL。
普通细菌半固体培养基:牛肉膏3 g,酵母膏3 g,蛋白胨3 g,硫酸镁0.25 g,磷酸氢二钾2 g,磷酸二氢钾0.5 g,蔗糖15 g,琼脂8 g,蒸馏水 1 000 mL。
TTC培养基:水解干酪素1 g,蛋白胨10 g,甘油5 mL,琼脂32 g,蒸馏水1 000 mL,使用前加入10 g/L三苯基四氮唑(TTC)10 mL。
8.5 g/L的氯化钠溶液。
1.3 青枯菌及噬菌体的培养青枯菌Tb1556在TTC平板上划线,培养24~48 h后,挑取典型单菌落于LB液体培养基中,30 ℃条件下,200 r/min培养24 h,获得青枯菌悬液。−80 ℃活化噬菌体并制成含单个噬菌斑的双层平板。取单个噬菌斑与100 μL青枯菌悬液接种到10 mL LB培养基中,30 ℃条件下培养24 h,得到纯化的单一噬菌体。
1.4 噬菌体双层平板制备及效价测定将噬菌体与青枯菌共培养24 h后,10 000 r/min 10 min,取上清进行10倍梯度稀释。取100 μL噬菌体稀释液、100 μL青枯菌悬液和15 mL普通细菌半固体培养基充分混合,随即倒入预先制备好的普通细菌培养基平板上,30 ℃条件下培养24 h,根据平板上的噬菌斑个数,计算噬菌体效价。
1.5 噬菌体混合对青枯菌裂解能力的影响取D600 nm=0.6的青枯菌液100 μL与普通细菌半固体培养基混合,倒入空白培养皿中,吹干备用。分别将过滤后效价为1.0×1010 PFU/mL的噬菌体(单一噬菌体及1∶1两两混合)各3 μL,点接至含青枯菌的普通细菌半固体培养基,30 ℃条件下培养24 h后,测量噬菌斑直径,试验重复3次。
1.6 抗噬菌体菌株分析取D600 nm=0.6的青枯菌液100 μL分别与4个噬菌体(效价为1.0×1010 PFU/mL)及以体积比1∶1混合的噬菌体各100 μL接种于10 mL LB液体培养基中,30 ℃条件下,200 r/min振荡培养,并于24、48 和72 h测定青枯菌的D600 nm,若青枯菌的D600 nm越大,说明青枯菌对噬菌体产生抗性的菌株数量越多,以不加噬菌体的青枯菌培养为对照。每个处理重复3次。
1.7 噬菌体受体分析 1.7.1 青枯菌脂多糖提取采用热酚法提取青枯菌脂多糖,参考康洁[14]的方法进行。将培养至D600 nm=0.6的青枯菌悬液,5 000 r/min 10 min,弃上清,菌体用8.5 g/L NaCl溶液20 mL洗涤2次,离心,沉淀悬浮于20 mL 8.5 g/L的NaCl溶液中。66 ℃水浴,并加入等量的预热的φ为90%的苯酚溶液,搅拌25 min,4 ℃静置过夜,2 000 r/min 15 min,取上层水相,按此方法重复1次。取2次水相混合、透析,直至氯化铁检测不到酚为止,即得到粗制脂多糖。
1.7.2 噬菌体作用于青枯菌的受体为明确噬菌体的作用受体,选择青枯菌的脂多糖和菌体表面膜蛋白进行分析。将青枯菌Tb1556加入蛋白酶K至终浓度为100 mg/mL,37 ℃条件下处理30 min,以消化青枯菌细胞表面蛋白。
将100 μL噬菌体分别与900 μL无菌水、青枯菌、蛋白酶K处理后的青枯菌及脂多糖提取液混合,30 ℃条件下静置30 min后,10 000 r/min 10 min,取上清,按1.4的方法,测定噬菌体效价,每个处理重复3次,并计算噬菌体吸附率。
1.8 数据处理测定噬菌体双层平板各处理组的噬菌体效价(PFU/mL),分别计算脂多糖吸附率及表面蛋白吸附率,公式如下:
噬菌体效价=平板噬菌斑个数×10×稀释倍数,
脂多糖吸附量=空白组效价−脂多糖处理组效价,
表面蛋白吸附量=青枯菌处理组效价−蛋白酶K处理组效价,
青枯菌吸附量=空白组效价−青枯菌处理组效价,
脂多糖(蛋白)吸附率=脂多糖(蛋白)吸附量/青枯菌吸附量×100%。
研究数据使用SPSS 18.0软件进行差异显著性分析。
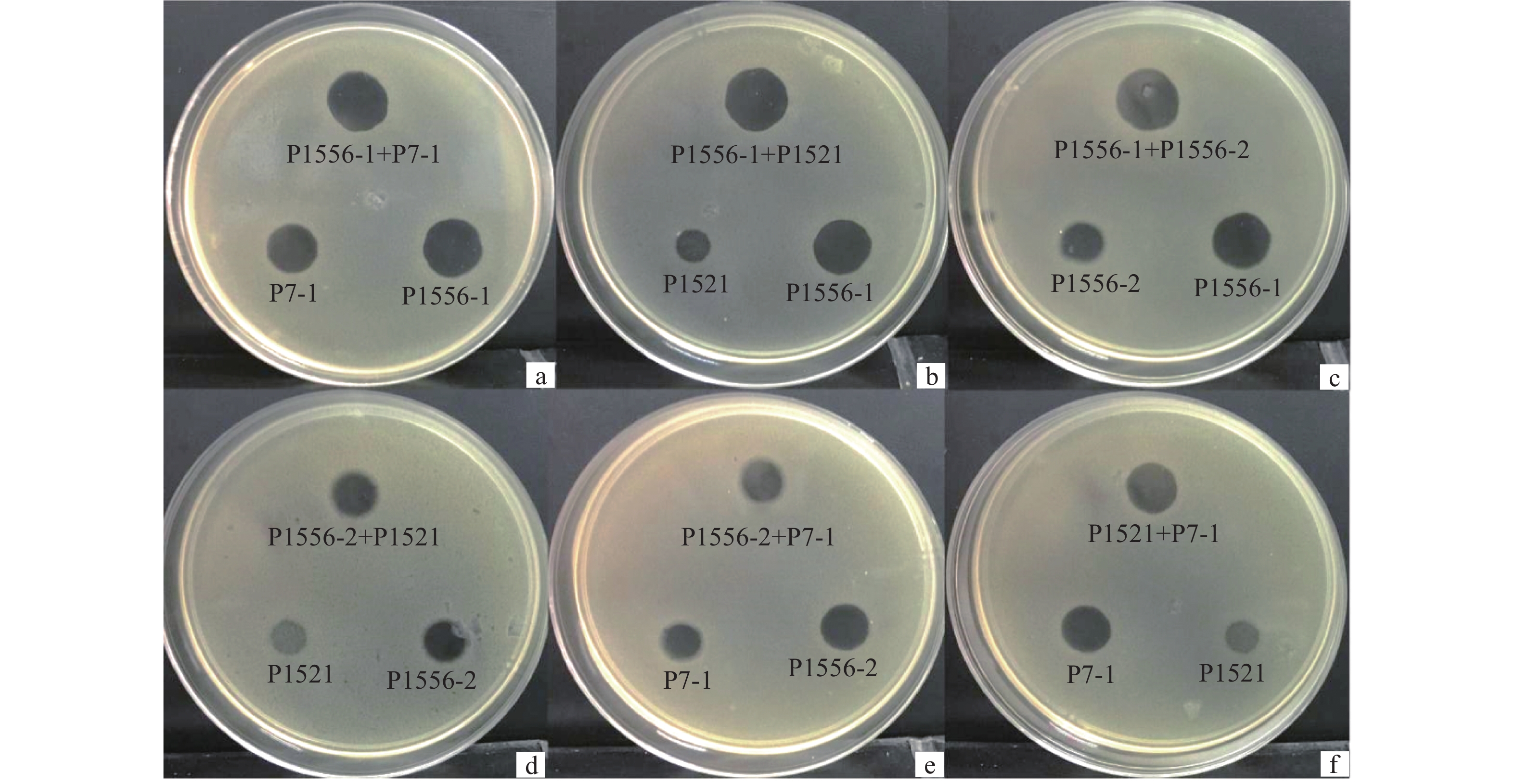
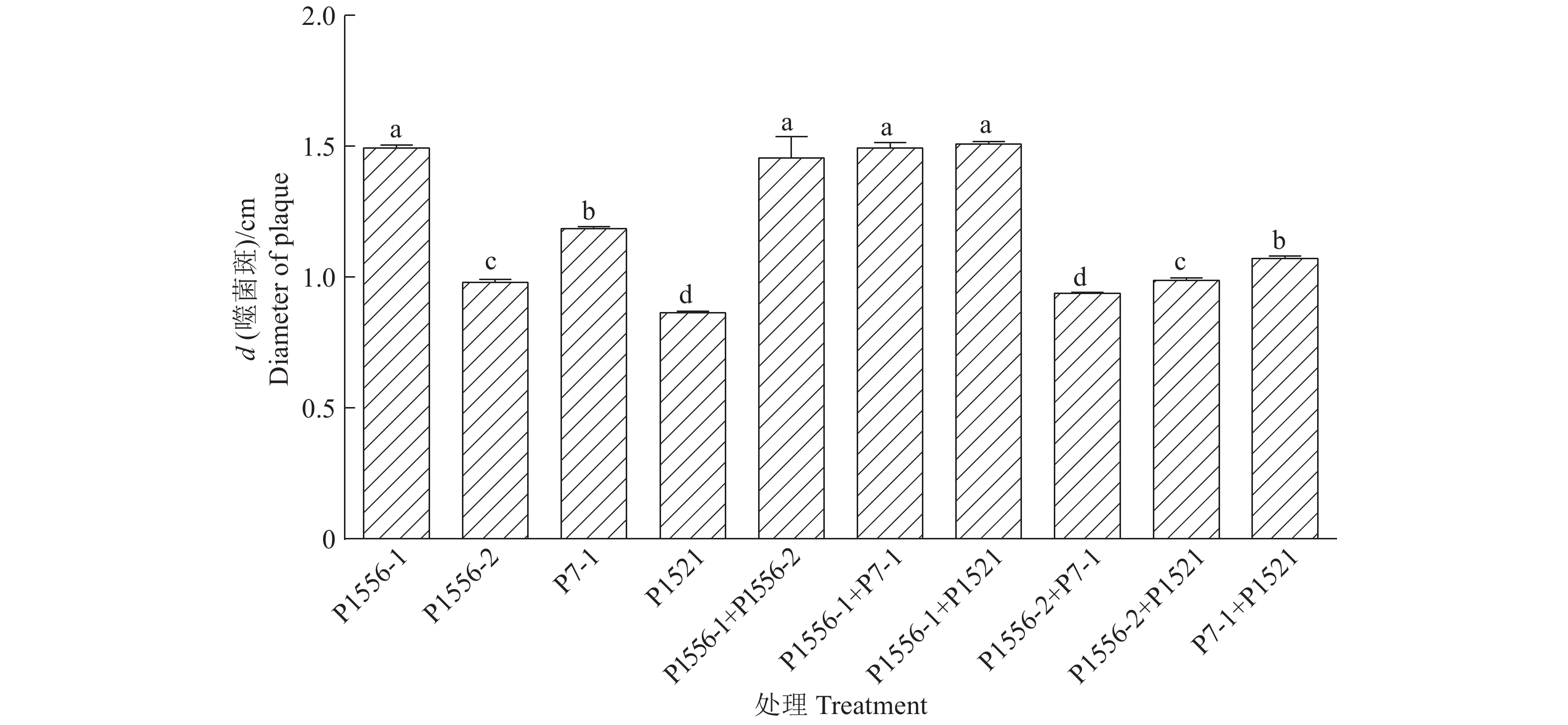
2 结果与分析 2.1 噬菌体混合对青枯菌裂解能力的影响图1为4种不同噬菌体及其两两混合后对青枯菌Tb1556平板产生噬菌斑的示意图。单一噬菌体及噬菌体两两混合后在平板上产生噬菌斑的直径见图2,由图2可知,单一噬菌体形成噬菌斑的直径由大到小分别为P1556-1>P7-1>P1556-2>P1521,且在统计上具有显著差异(P<0.05);除P1556-2与P1521混合后产生的噬菌斑略大于各自形成的噬菌斑外,其他噬菌体混合后并不能形成更大的噬菌斑,结果表明,噬菌体的混合并不能显著提高其对青枯菌的裂解能力。
|
图 1 4种不同噬菌体及两两混合对青枯菌Tb1556平板产生的噬菌斑 Fig. 1 The plaques of four types of phages and their mixtures in pairs on Ralstonia solanacearum Tb1556 plates |
|
图 2 4种不同噬菌体及其两两混合对青枯菌Tb1556生长的影响 Fig. 2 Effects of four types of phages and their mixtures in pairs on Ralstonia solanacearum Tb1556 growth 柱子上不同小写字母表示差异显著(P<0.05,LSD法) Different lowercase letters on bars indicate significant difference (P<0.05,LSD method) |
在与噬菌体斗争的过程中,青枯菌进化出多种抵抗噬菌体的机制,从而避免被噬菌体消灭殆尽。本试验通过单一噬菌体及噬菌体两两混合后与青枯菌共培养,在不同时间段测定青枯菌的D600 nm,来探究青枯菌对不同噬菌体产生抗性的时间和概率。
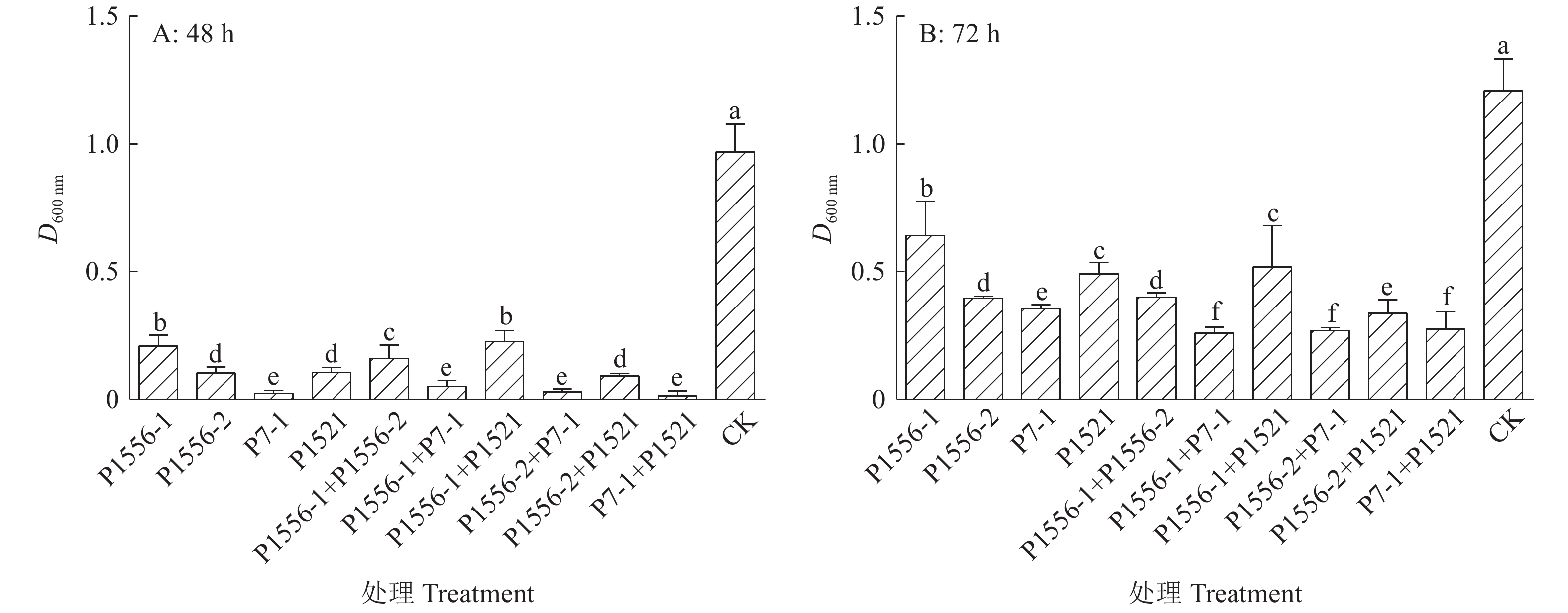
在培养24 h后,含有噬菌体的处理组D600 nm均接近0,表明在该时间范围内,各噬菌体处理组均没有产生抗性青枯菌,或产生量极其少而未能检测出。当噬菌体与青枯菌共培养48 和72 h后,均发现有抗噬菌体的青枯菌产生。其中P1556-1在共培养48 h后,D600 nm达到0.210,72 h达到0.641,表明青枯菌对P1556-1的抗性增长最快;其次为P1556-2和P1521,在培养48 h后,D600 nm分别为0.104和0.106,培养72 h后,D600 nm分别为0.396和0.492;培养48 h内,青枯菌抗P1556-1、P1556-2与P1521菌株便开始产生,而P7-1在72 h后才开始大量产生抗性菌株,其D600 nm在48 h为0.023,72 h为0.355(图3)。
|
图 3 噬菌体与青枯菌Tb1556共培养下的青枯菌D600 nm Fig. 3 D600 nm of Ralstonia solanacearum Tb1556 after co-culturing with phages 柱子上方的不同小写字母表示差异显著(P<0.05,LSD法) Different lowercase letters on bars indicate significant difference (P<0.05,LSD method) |
噬菌体混合测定结果(图3)表明,含有噬菌体P7-1能有效降低抗性菌的产生速度,且比单一噬菌体效果更明显;与单一噬菌体处理组相比,含有噬菌体P1556-2和P1521的处理组在共培养48 h时,产生抗性菌株的差异不明显,但在共培养72 h后,却能减缓抗性菌的产生速度。
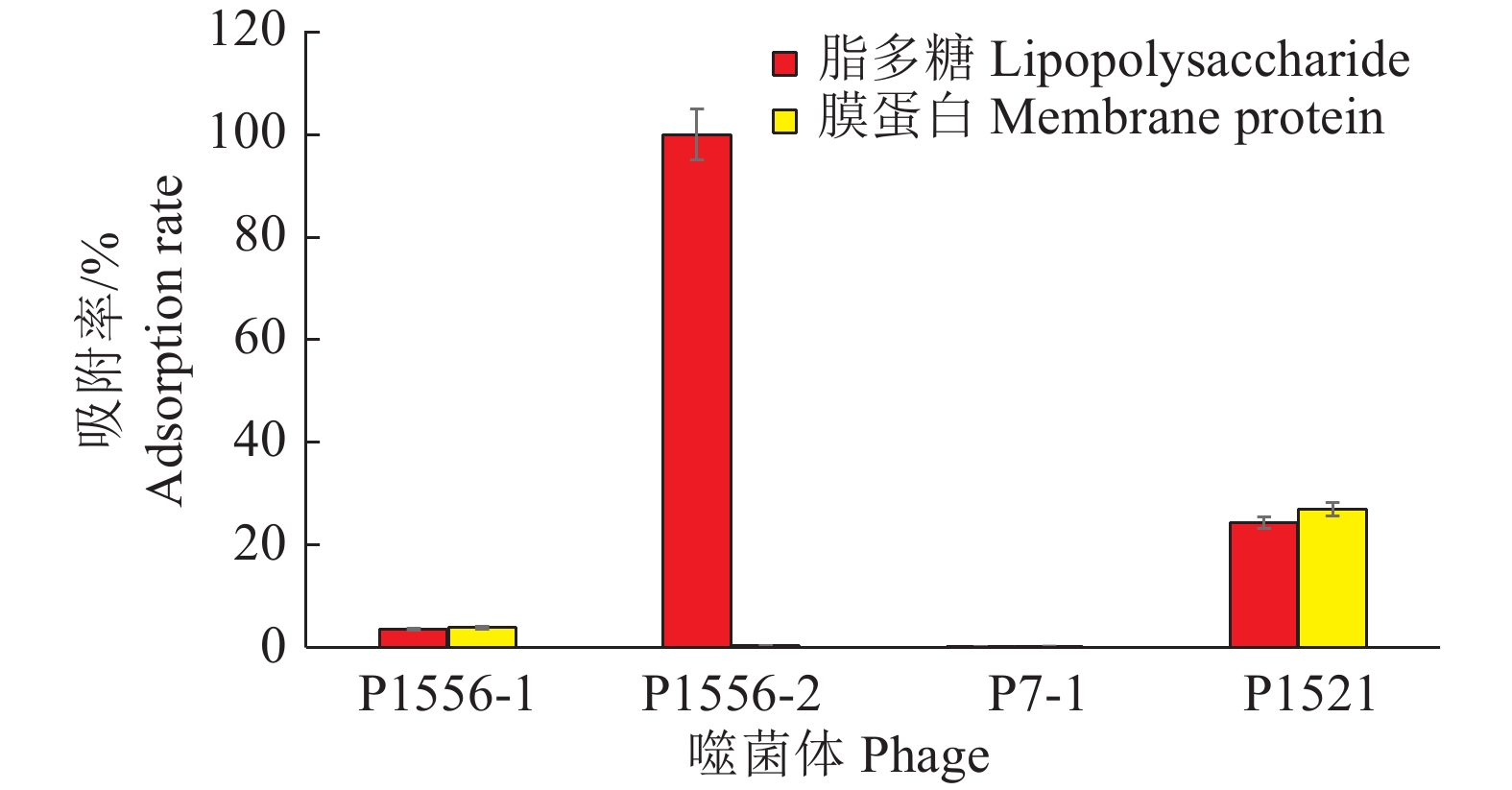
2.3 噬菌体作用受体分析噬菌体吸附试验结果发现,噬菌体P1556-2能够被寄主菌的脂多糖吸附,而且吸附率高达99.80%,但不吸附表面蛋白,表明脂多糖是该噬菌体的作用受体;P1521既可以吸附脂多糖,也能吸附表面蛋白,或细菌鞭毛等其他受体,说明该噬菌体可能具有多种作用受体,侵染机制更为复杂;噬菌体P1556-1和P7-1对脂多糖和膜蛋白的吸附率较低,属于其他种类受体(图4)。
|
图 4 噬菌体对脂多糖和膜蛋白的吸附率 Fig. 4 Adsorption rates of lipopolysaccharide and membrane protein by phages |
随着噬菌体成功应用于治疗人类疾病,利用噬菌体防治植物细菌病害已经受到广泛关注。噬菌体的寄主范围以及抗噬菌体菌株的产生,在一定程度上影响噬菌体防治植物细菌病害的效果。筛选寄主范围广泛、裂解能力强、且不易使寄主产生抗性的噬菌体,对于应用噬菌体防治植物病害具有重要意义。
本研究选择的P1556-1、P1521、P7-1和P1556-2噬菌体寄主范围较广,前期研究表明,对来自不同地区的75个青枯菌菌株,P1556-1、P1521、P7-1和P1556-2分别能侵染其中86.7%、84.0%、81.3%和77.3%的菌株[15]。本研究结果发现,寄主范围最为广泛的噬菌体P1556-1在平板上产生的噬菌斑最大,说明它裂解青枯菌的能力强,表明噬菌体的裂解能力可能与寄主范围存在一定关系。
用噬菌体治疗疾病或防治植物细菌病害,可通过噬菌体间的混合及噬菌体与其他化学物质或生物的混配来实现,以达到更好的防治效果。噬菌体混合已被证明具有较好的预防青枯病的效果[16],将噬菌体与表面活性剂混合后能够将噬菌体有效地吸附在番茄根部,从而加强噬菌体的预防作用[17]。然而,本研究结果发现,除P1521外,噬菌体两两混合后形成的噬菌斑大小与其单一噬菌体所能形成最大噬菌斑的噬菌体有关,尽管P1556-2与P1521混合后略高于P1556-2单独形成的噬菌斑,但效果不明显。因此,噬菌体的混合并不能明显提高其对青枯菌的裂解能力,但是否能够提高作物青枯病的防治效果,需要进一步的田间防治试验验证。
在噬菌体与青枯菌相互作用的过程中,往往会出现抗噬菌体菌株,这将极大影响噬菌体的防治效果。本研究发现,当噬菌体与青枯菌共培养48 和72 h后,均发现抗噬菌体的青枯菌产生。其中青枯菌对P1556-1的抗性产生最快,其次是P1556-2和P1521,而P7-1最慢。当噬菌体两两混合后发现,含有P7-1能有效降低抗性菌株的产生,P1556-2和P1521混合72 h也能减少抗性菌株产生的数量。噬菌体与寄主受体结合后,寄主能够通过注入阻滞、CRISPR-Cas系统、限制修饰系统(Restriction-modification system, R-M system)、流产感染系统(Abortive infection system,Abi system)等抵抗噬菌体复制及繁殖。CRISPR序列是一段高度保守的序列[18],与Cas蛋白构成CRISPR-Cas系统,当发现外源核酸时,通过编辑将外源基因整合至CRISPR前端[19],产生crRNA诱导细菌裂解外源核酸实现免疫[20-21]。空肠弯曲杆菌Campylobacter jejuni 11168R菌株的cj1521基因从9个G突变为10个G后,对噬菌体F336表现出抗性[22];流感嗜血杆菌Haemophilus influenzae能够改变lic2A基因的重复序列从而改变受体组成,对噬菌体HP1c1表现出抗性[23];大肠埃希菌Escherichia coli的btuB基因在插入IS2序列后,噬菌体SPC35无法与之结合[24]。本研究结果表明,将不同噬菌体两两混合,可以延缓抗性青枯菌的产生,这在实际应用中具有参考价值,但其抗性机理有待进一步研究。
噬菌体受体识别是噬菌体侵染细菌的第一步。噬菌体能够特异性识别寄主受体并与之结合,然后将自身遗传物质注入寄主体内进行侵染。细菌在与噬菌体长期斗争的进化过程中,会通过改变受体来应对噬菌体的侵染。革兰阴性菌的噬菌体受体包括脂多糖、膜蛋白、菌毛、鞭毛、荚膜等,其中以脂多糖和膜蛋白为主[25],铜绿假单胞菌Pseudomonas aeruginosa[26]和青枯菌[27]噬菌体能够与细菌的鞭毛结合。本研究结果发现,噬菌体P1556-2的作用受体为青枯菌的脂多糖,噬菌体P1521能被脂多糖吸附,也能被膜蛋白吸附,表明它能与多种受体结合,侵染机制更为复杂,而噬菌体P1556-1和P7-1则不被脂多糖和膜蛋白吸附,其作用受体有待进一步研究。
本文关于4种青枯菌噬菌体及其两两混合后的裂解能力、抗噬菌体青枯菌菌株的产生,以及噬菌体的作用受体等研究结果,将为利用噬菌体防治作物青枯病的实际应用提供参考。
| [1] |
RAHMANI R, ZARRINI G, SHEIKHZADEH F, et al. Effective phages as green antimicrobial agents against antibiotic-resistant hospital Escherichia coli
[J]. Jundishapur J Microbiol, 2015, 8(2): e17744. (  0) 0) |
| [2] |
SARKER S A, SULTANA S, REUTELER G, et al. Oral phage therapy of acute bacterial diarrhea with two coliphage preparations: A randomized trial in children from Bangladesh[J]. Ebiomedicine, 2016, 4: 124-137. DOI:10.1016/j.ebiom.2015.12.023 (  0) 0) |
| [3] |
WALL S, ZHANG J, ROSTAGNO M, et al. Phage therapy to reduce preprocessing Salmonella infections in market-weight swine
[J]. Appl Environ Microb, 2010, 76(1): 48-53. DOI:10.1128/AEM.00785-09 (  0) 0) |
| [4] |
WANG Y, BARTON M, ELLIOTT L, et al. Bacteriophage therapy for the control of Vibrio harveyi in greenlip abalone (Haliotis laevigata)
[J]. Aquaculture, 2017, 473: 251-258. DOI:10.1016/j.aquaculture.2017.01.003 (  0) 0) |
| [5] |
SUSIANTO G, FARID M M, DHANY N R, et al. Host range for bacteriophages that infect bacterial blight pathogen on soybean[J]. Proc Environ Sci, 2014, 20: 760-766. DOI:10.1016/j.proenv.2014.03.091 (  0) 0) |
| [6] |
FLAHERTY J E, JONES J B, HARBAUGH B K, et al. Control of bacterial spot on tomato in the greenhouse and field with H-mutant bacteriophages[J]. Hortscience, 2000, 35(5): 882-884. DOI:10.21273/HORTSCI.35.5.882 (  0) 0) |
| [7] |
FLAHERTY J E, HARBAUGH B K, JONES J B, et al. H-mutant bacteriophages as a potential biocontrol of bacterial blight of geranium[J]. Hortscience, 2001, 36(1): 98-100. DOI:10.21273/HORTSCI.36.1.98 (  0) 0) |
| [8] |
BALOGH B, CANTEROS B I, STALL R E, et al. Control of citrus canker and citrus bacterial spot with bacteriophages[J]. Plant Dis, 2008, 92(7): 1048-1052. DOI:10.1094/PDIS-92-7-1048 (  0) 0) |
| [9] |
SCHNABEL E L, FERNANDO W G D, MEYER M P, et al. Bacteriophage of Erwinia amylovora and their potential for biocontrol
[J]. Acta Hortic, 1999, 489(489): 649-654. (  0) 0) |
| [10] |
RAVENSDALE M, BLOM T J, GRACIAl-GARZA J A, et al. Bacteriophages and the control of Erwinia carotovora subsp. carotovora
[J]. Can J Plant Pathol, 2007, 29(2): 121-130. DOI:10.1080/07060660709507448 (  0) 0) |
| [11] |
ADDY H S, ASKORA A, KAWASAKI T, et al. Loss of virulence of the phytopathogen Ralstonia solanacearum through infection by φRSM filamentous phages
[J]. Phytopathology, 2012, 102(5): 469. DOI:10.1094/PHYTO-11-11-0319-R (  0) 0) |
| [12] |
ADDY H S, ASKORA A, KAWASAKI T, et al. Utilization of filamentous phage phi RSM3 to control bacterial wilt caused by Ralstonia solanacearum
[J]. Plant Dis, 2012, 96(8): 1204-1209. DOI:10.1094/PDIS-12-11-1023-RE (  0) 0) |
| [13] |
FUJIWARA A, FUJISAWA M, HAMASAKI R, et al. Biocontrol of Ralstonia solanacearum by treatment with lytic bacteriophages
[J]. Appl Environ Microb, 2011, 77(12): 4155-4162. DOI:10.1128/AEM.02847-10 (  0) 0) |
| [14] |
康洁. 3种方法提取大肠杆菌E.coli脂多糖的比较
[J]. 中国农学通报, 2010, 26(21): 12-15. (  0) 0) |
| [15] |
余成鹏, 胡蓉花, 陈小强, 等. 江西和广东烟草青枯菌对噬菌体的敏感性及聚类分析[J]. 江西农业大学学报, 2018(4): 699-707. (  0) 0) |
| [16] |
WEI C H, LIU J L, MAINA A N, et al. Developing a bacteriophage cocktail for biocontrol of potato bacterial wilt[J]. Virol Sin, 2017, 32(6): 476-484. DOI:10.1007/s12250-017-3987-6 (  0) 0) |
| [17] |
BAE J Y, WU J, LEE H J, et al. Biocontrol potential of a lytic bacteriophage PE204 against bacterial wilt of tomato[J]. J Microbiol Biotechn, 2012, 22(12): 1613-1620. DOI:10.4014/jmb.1208.08072 (  0) 0) |
| [18] |
MARRAFFINI L A. CRISPR-Cas immunity against phages: Its effects on the evolution and survival of bacterial pathogens[J]. PLoS Pathog, 2013, 9(12): e1003765. DOI:10.1371/journal.ppat.1003765 (  0) 0) |
| [19] |
BARRANGOU R, FREMAUX C, DEVEAU H, et al. CRISPR provides acquired resistance against viruses in prokaryotes[J]. Science, 2007, 315(5819): 1709. DOI:10.1126/science.1138140 (  0) 0) |
| [20] |
HYNES A P, VILLION M, MOINEAU S. Adaptation in bacterial CRISPR-Cas immunity can be driven by defective phages[J]. Nat Commun, 2014, 5: 4399. DOI:10.1038/ncomms5399 (  0) 0) |
| [21] |
WEI Y, CHESNE M T, TERNS R M, et al. Sequences spanning the leader-repeat junction mediate CRISPR adaptation to phage in Streptococcus thermophilus
[J]. Nucleic Acids Res, 2015, 43(3): 1749-1758. DOI:10.1093/nar/gku1407 (  0) 0) |
| [22] |
SORENSEN M C H, van ALPHEN L B, HARBOE A, et al. Bacteriophage F336 recognizes the capsular phosphoramidate modification of Campylobacter jejuni NCTC11168
[J]. J Bacteriol, 2011, 193(23): 6742-6749. DOI:10.1128/JB.05276-11 (  0) 0) |
| [23] |
ZALESKI P. The role of Dam methylation in phase variation of Haemophilus influenzae genes involved in defence against phage infection
[J]. Microbiology, 2005, 151(10): 3361-3369. DOI:10.1099/mic.0.28184-0 (  0) 0) |
| [24] |
KIM M, RYU S. Characterization of a T5-Like coliphage, SPC35, and differential development of resistance to SPC35 in Salmonella enteric serovar Typhimurium and Escherichia coli
[J]. Appl Environ Microb, 2011, 77(6): 2042-2050. DOI:10.1128/AEM.02504-10 (  0) 0) |
| [25] |
毛普加, 洪愉, 毛小萍, 等. 噬菌体受体及其鉴定方法[J]. 中国微生态学杂志, 2014(6): 731-734. (  0) 0) |
| [26] |
BAE H, CHO Y. Complete genome sequence of Pseudomonas aeruginosa podophage MPK7, which requires type IV pili for infection
[J]. Genome Announc, 2013, 1(5): e00744-13. (  0) 0) |
| [27] |
NARULITA E, ADDY H S, KAWASAKI T, et al. The involvement of the PilQ secretin of type IV pili in phage infection in Ralstonia solanacearum
[J]. Biochem Bioph Res Co, 2016, 469(4): 868-872. DOI:10.1016/j.bbrc.2015.12.071 (  0) 0) |
 2020, Vol. 41
2020, Vol. 41


