2. 深圳职业技术学院 应用化学与生物技术学院/博士后创新实践基地,广东 深圳 518055;
3. 华南农业大学 工程基础教学与训练中心,广东 广州 510642;
4. 华南农业大学 农学院/广东省微生物信号与作物病害防控重点实验室,广东 广州 510642
2. Department of Applied Chemistry and Biotechnology/Postdoctoral Innovation Practice Base, Shenzhen Polytechnic College, Shenzhen 518055, China;
3. Engineering Fundamental Teaching and Training Center, South China Agricultural University, Guangzhou 510640, China;
4. College of Agriculture, South China Agricultural University/Guangdong Province Key Laboratory of Microbial Signals & Disease Control, Guangzhou 510642, China
荔枝霜疫病由荔枝霜疫霉Peronophythora litchii引起,是造成荔枝果实褐变腐烂、产量降低和产量不稳定的主要病害,在我国荔枝栽培区普遍发生[1-2];该病为害荔枝新梢、嫩叶及花穗,在气候条件适宜发病的年份,可引起荔枝产业经济损失高达80%以上,严重限制了荔枝产业的发展[3]。
关于荔枝霜疫霉对温湿度适应性的研究多为温度或者湿度单独对荔枝霜疫霉孢子囊萌发和侵染的影响,Chen等[4]研究台湾地区的荔枝霜疫霉在V8汁培养基中,菌丝生长的温度范围为8~32 ℃,最适生长温度为24~28 ℃;Liu等[5]研究华南地区的荔枝霜疫霉在PDA培养基中,菌丝生长温度为12~32 ℃,最适生长温度为28~30 ℃;蔡学清等[6]研究认为在24~28 ℃条件下,果实最易被荔枝霜疫霉侵染且发病最重;黄河等[7]认为荔枝霜疫霉孢子囊遇水立即脱落。荔枝霜疫病的发生和流行与日照时数、降雨天数有关,日照时数和降雨天数直接影响果园的温度和寄主露时,连续降雨数天即可造成该病害流行,且病害来势凶猛,一旦发生便迅速扩展蔓延[8]。因此,监测种植区环境条件,结合物候期对病害发生进行有效的预测预报,在其发病前期和初期采取有效的防治措施,对遏制病害的流行为害至关重要。Montone 等[9]通过监测草莓叶片露时得到相应的预测模型应用于草莓病害的预警系统中;Roubal等[10]依据降雨量、温度及相对湿度等环境因素预测Fusicladium oleagineum对橄榄的侵染及潜伏期;Uysal等[11]探索了温度、露时及叶龄对菠菜炭疽病菌侵染及扩展的影响。而有关荔枝霜疫病发生的流行条件、预测预报方法等报道较少[12]。
农作物病虫害预测预报是植物保护工作的基础,是实现防灾减害的重要保证。本研究在人工控温、控湿条件下,研究温度、露时(即寄主湿润持续时间)对荔枝霜疫霉孢子囊萌发和侵染的影响,以期为荔枝霜疫病监测预警提供依据,提高预测预报准确性。
1 材料和方法 1.1 材料叶片和果实接种试验选取的荔枝品种均为‘怀枝’。
荔枝霜疫霉菌株(编号SHS3)由华南农业大学植物病理学系真菌研究室分离、鉴定和保存。菌株培养用PDA培养基。
1.2 方法 1.2.1 温度和露时对孢子囊萌发的影响叶片和果实上孢子囊萌发的观察参考蒋继志等[13]的方法并稍作改动:选取长势一致的嫩叶和成熟果实置于保鲜盒中,将玻璃纸剪成均等大小(2 cm×2 cm),于无菌水中浸湿后附着于叶片或果实表面;然后吸取10 μL的孢子囊悬浮液(1×104 mL−1)滴于玻璃纸上,每个叶片或果实滴5滴,将叶片或果实分别放置在15、20、25和30 ℃条件下培养,待达到相应的露时2、4、8、12和24 h后,置玻璃纸于载玻片上,在显微镜下观察孢子囊的萌发情况。每个处理设置3次重复,每次重复至少计数100个孢子囊。
1.2.2 温度和露时对叶片和果实感病的影响荔枝叶片的接种方法参考Neufeld 等[14]和Arauz 等[15]的方法并稍作改动。将孢子囊悬浮液喷雾接种于嫩叶上,至有液滴滴落。荔枝果实的接种方法:取新鲜的荔枝成熟果实用清水清洗后晾干,将果实在孢子囊悬浮液中浸泡1 min后取出。
将接种过的叶片分别于15、20、25和30 ℃条件下培养,接种过的果实分别于20、25和30 ℃条件下培养,待达到相应的露时2、4、8、12和24 h后,用强风吹干叶片和果实,重新置于各自的培养温度下,24 h后将所有的处理移至白天24 ℃、晚上20 ℃、12 h光暗交替、75%~90% 相对湿度下继续培养7 d。每天观察叶片或果实的发病情况并记录发病等级,计算接种3 d的病情指数。每个处理设置3次重复,每次重复至少接种50片叶片或30颗果实。
叶片发病分级标准:0级,无病斑;1级,病斑面积占叶片面积的1%~25%;2级,病斑面积占叶片面积的26%~50%;3级,病斑面积占叶片面积的51%~75%;4级,病斑面积占叶片面积的75%以上。
果实发病分级标准参考Qu等[16]的方法并稍作修改。0级:果皮未出现病斑;1级:病斑面积占整个果皮面积的5%以下;3级:病斑面积占整个果皮面积的6%~15%;5级:病斑面积占整个果皮面积的16%~25%;7级:病斑面积占整个果皮面积的26%~50%;9级:病斑面积占整个果皮面积的50%以上。
病害发生严重度计算公式如下:
| $ {\text{严重度}} = \frac{{\sum {\left( {{\text{叶片数}}/{\text{果实数}} \times {\text{病级值}}} \right)} }}{{{\text{总叶片数}}/{\text{果实数}} \times {\text{制定的最高病级值}}}}{\text{。}} $ |
模型拟合采用SAS(9.4版本)软件进行分析。在Neufeld等[14]分析方法的基础上略作修改,首先用初步方差分析法分析孢子囊萌发试验的3组重复、孢子囊侵染叶片试验的3组重复、侵染果实的2组重复是否有明显差异,若无明显差异,后续则取各组重复试验的平均值进行分析。其次对孢子囊在叶片、果实上萌发及侵染试验分两步进行分析,第一步使用SAS中的PROC GLM过程分析比较温度(θ)、露时(t)以及它们的交互效应(θ×t)对孢子囊萌发和寄主发病严重度的影响;第二步则以方程f(t, θ) ={1−exp[−(B×t)2]}/cosh[(θ−F)×G/2] 拟合模型。该模型是韦布尔函数的修正式,其中斜体小写字母为自变量,大写斜体字母为参数。B代表变量y响应自变量露时(t)的固有增长率,F和G分别代表变量y响应最佳温度和温度(θ)的固有变化率。使用SAS中的PROC NLIN过程,将孢子囊平均萌发率和寄主平均发病严重度分别拟合至非线性模型。使用SAS PROC REG过程分析孢子囊萌发率和寄主发病严重度观察值和预测值的相关性,评估模型拟合的可靠性。根据参数估计的显著性、渐近标准误差的大小评估模型的拟合优度,使用MATLAB MESH制作孢子囊在叶片、果实上萌发和侵染的三维曲面图。
1.4 病害风险预测模型通过拟合模型f (t, θ)产生t和θ的函数,预测发病严重程度。根据最终模型参数估算温度和露时的范围,使用 MATLAB CONTOUR 制作等高线图,预测荔枝嫩叶和成熟果实霜疫病发生的严重度。
2 结果与分析 2.1 孢子囊萌发及寄主发病程度响应温度和露时的方差分析方差分析结果(表1)表明孢子囊萌发、孢子囊侵染嫩叶和孢子囊侵染成熟果实响应温度和露时的重复试验之间的差异不显著(P>0.05),因此可使用试验数据平均值进行后续分析。温度、露时极显著影响孢子囊的萌发及叶片、果实接种3 d后的病害严重度(P<0.000 1);温度和露时的交互作用也可以显著影响孢子囊的萌发及寄主发病的严重度(P<0.01)。
|
|
表 1 温度和露时对荔枝霜疫霉孢子囊萌发及荔枝叶片、果实发病程度影响的方差分析 Table 1 Analysis of variance for the effects of temperature and wetness duration on sporangia germination of Peronophythora litchii and disease severities of litchi leaf and fruit |
荔枝霜疫霉孢子囊在温度为15~30 ℃时,露时为2 h时即开始萌发,且萌发率随着露时的延长而逐渐增大;在温度为25 ℃时,所有露时处理条件下的孢子囊萌发率达到最大值。孢子囊在叶片上萌发率大于0.2的温度为25 ℃,露时≥2 h或温度20和30 ℃,露时≥4 h(图1A);在果实上孢子囊萌发率大于0.6的温度为20和30 ℃,露时≥12 h或温度25 ℃,露时≥8 h(图1C)。
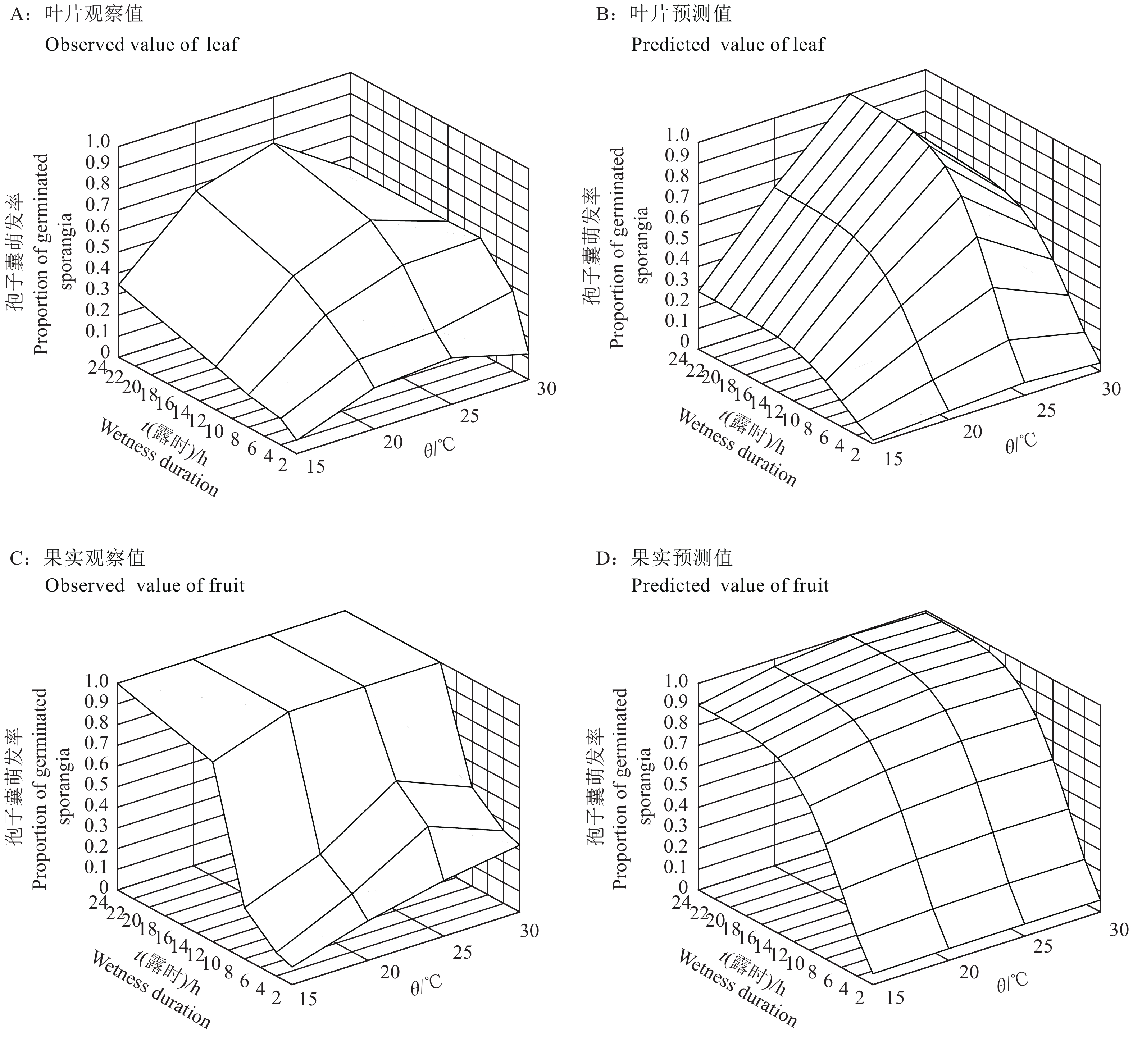
|
图 1 不同温度和露时处理下荔枝霜疫霉孢子囊在荔枝叶片和果实上的萌发率 Fig. 1 Sporangia germination rates of Peronophythora litchii on litchi leaf and fruit under the conditions of different temperature and wetness duration |
露时相同的条件下,当温度为25 ℃时,孢子囊为害荔枝嫩叶和成熟果实最为严重;所有的温度处理下,叶片和果实的发病程度随着露时延长而加重。相同的处理条件下,孢子囊为害果实比叶片更为严重和迅速(图2)。荔枝叶片接种孢子囊后,温度为25 ℃,露时≥2 h时,病害严重度可达0.2;或者温度为20或30 ℃时,露时≥4 h;而温度为15 ℃时,则需露时≥12 h(图2A)。果实接种孢子囊后,温度为25 ℃、露时≥2 h或者温度为20和30 ℃、露时≥4 h,果实的病情指数即可超过0.6(图2C)。
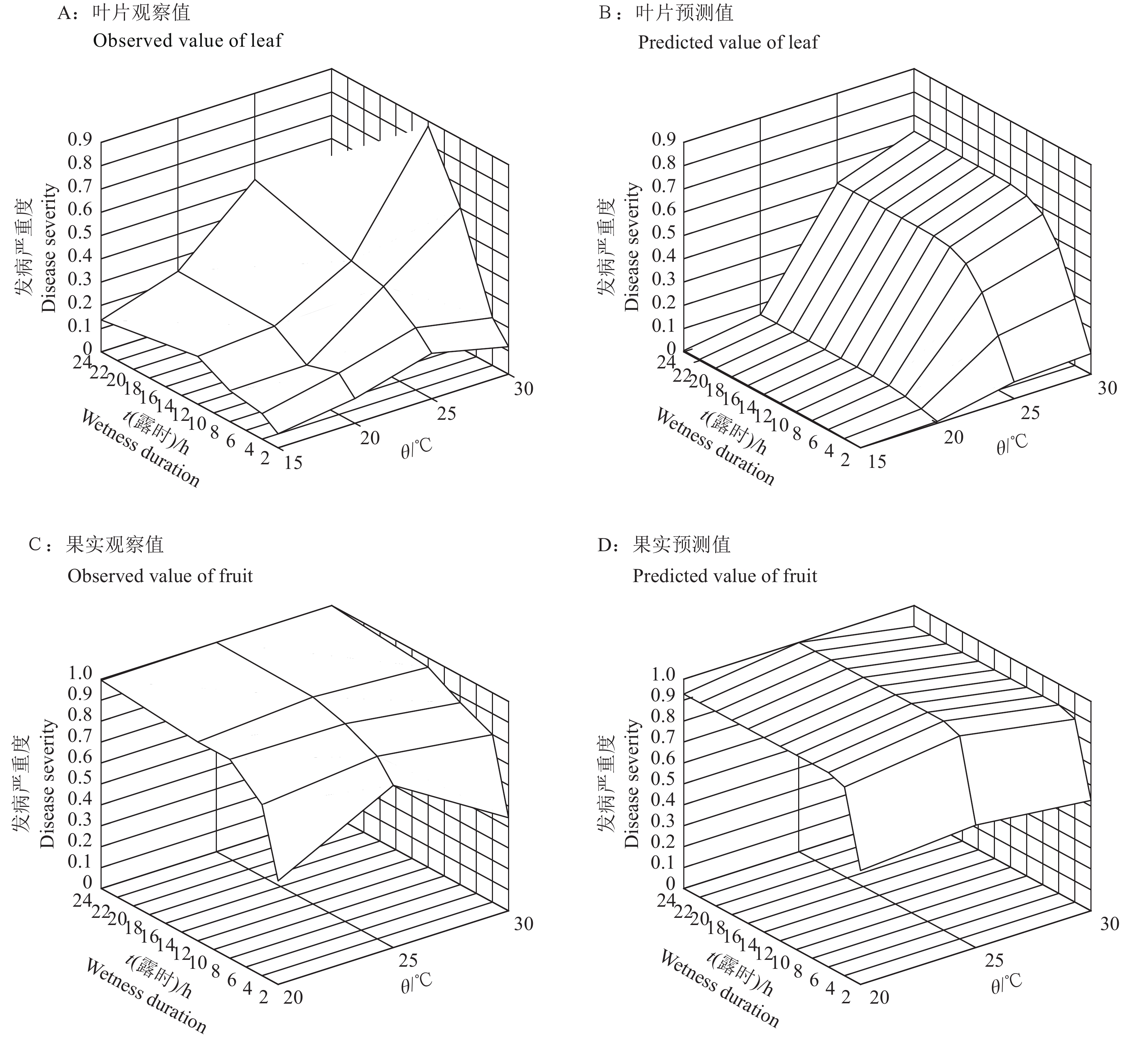
|
图 2 荔枝叶片和果实接种荔枝霜疫霉孢子囊3 d后的病情指数 Fig. 2 Disease severity of litchi leaf and fruit at three days after inoculation with Peronophythora litchii sporangia |
选用韦布尔模型的修正式,在SAS软件中拟合得到了准确度较好的孢子囊萌发和发病严重度模型f(t, θ) ={1−exp[−(B×t)2]}/cosh[(θ−F)×G/2]。模型很好地描述了温度和露时对荔枝霜疫霉孢子囊萌发和侵染的影响。孢子囊萌发率和病害严重度随露时变化呈S形曲线,随温度变化呈单峰形曲线(图1B、1D和图2B、2D)。模型拟合的渐进参数估计值均有效且差异显著(P<0.05),近似标准误差均较小(表2)。
|
|
表 2 模型参数估计1) Table 2 Parameter estimates for the model |
从预测值和观测值相关性分析来看,孢子囊对叶片和果实萌发率的预测值和观测值差异不显著(P> 0.05),即可认为预测值与观测值无差异,模型拟合效果较好,其决定系数(r2)分别为0.931 2和0.948 4;孢子囊侵染叶片和果实病害严重度的预测值和观测值差异不显著(P>0.05),即可认为预测值与观测值无差异,模型拟合效果较好,决定系数分别为0.814 7和0.991 6(表3)。
|
|
表 3 模型检验与拟合公式 Table 3 Verification and fitting formula of model |
根据荔枝嫩叶和成熟果实接种孢子囊3 d后的病害严重度的模型,制得相应的风险预测等高线图(图3)。依据荔枝霜疫霉侵染叶片风险预测图可以推算出病害严重度从0.1~0.9变化所对应的温度和露时。当温度为22~30 ℃、露时约为3~24 h时,叶片的病害严重度达到0.2以上(图3A)。依据侵染果实风险预测图可以推算出病害严重度从0.5~0.9变化所对应的温度和露时。由图3B可知,荔枝霜疫霉为害果实更易成灾,当温度为15~30 ℃、露时约2~3 h时,果实发病的严重度高达0.6。因此,在荔枝果实接近成熟时,必须严格监控温度和露时,及时发布霜疫病发生流行的预警信息。
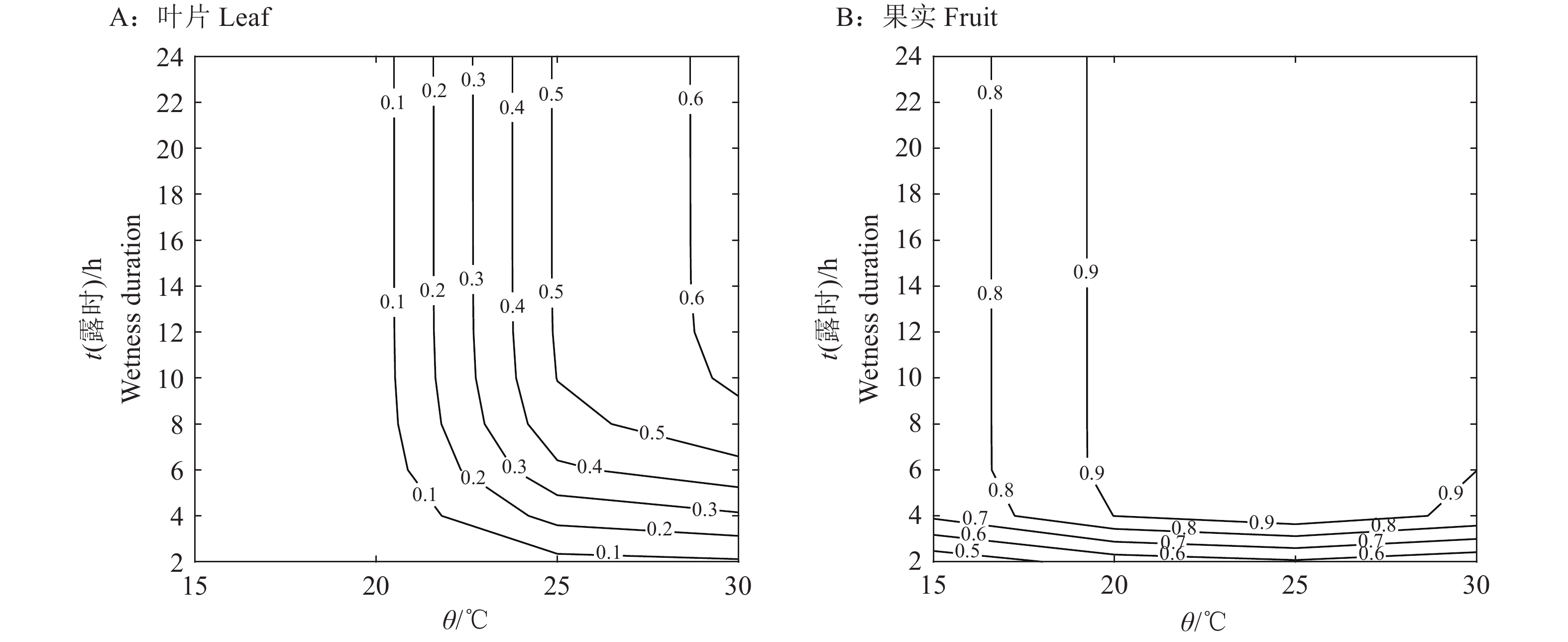
|
图 3 荔枝霜疫霉侵染荔枝叶片和果实的风险预测图 Fig. 3 Risk prediction charts for Peronophythora litchi infecting litchi leaf and fruit |
温度和湿度在病原孢子产生和病害的发生过程中起着至关重要的作用[17]。据报道,病原真菌孢子的近距离传播在一定程度上依赖于局部的温度和湿度[18]。近年来,多用定量分析模型研究温度和露时对病原菌孢子萌发侵染的影响。在卵菌病害的研究中,Arauz等[15]通过定量分析模型研究了温度和露时对黄瓜霜霉病菌Pseudoperonospora cubensis孢子萌发和侵染的影响;Rakotonindraina等[19]则结合分析模型研究了不同气象条件、土质等外界因素影响下马铃薯晚疫病菌Phytophthora infestans对马铃薯的为害。在果园病害的研究中,Li等[20]定量研究了温度和相对湿度对梨黑星病菌Venturia nashicola分生孢子萌发和侵染的影响。本研究在人工控温、控湿条件下,定量分析了4组温度(15~30 ℃)、5组露时(2~24 h)对荔枝霜疫霉孢子囊萌发和侵染的影响,利用SAS软件构建了以温度和露时为自变量的函数。并在此基础上,制得荔枝霜疫霉侵染嫩叶和成熟果实相对应的风险预测图。在卵菌侵染叶片的试验中,Neufeld等[14]研究认为病害严重度不大于0.1时,为轻度发病,病害严重度为0.1~0.2时属于中度发病,不小于0.2则为重度发病。参考此标准,本研究认为霜疫霉侵染荔枝嫩叶时,当温度为22~30 ℃、露时为3~24 h时,叶片的病害严重度达到0.2以上,认定为嫩叶发病严重,应及时防治。孢子囊为害成熟果实则更加迅速和严重,当温度为15~30 ℃、露时约2~3 h时,果实的病害严重度即高达0.6,足可为害成灾。
本研究获得的荔枝霜疫霉侵染荔枝嫩叶和成熟果实的风险预测图可为实际生产中的荔枝霜疫病预测预报提供参考,但仍存在不足,例如在构建模型后,使用SAS PROC REG过程分析孢子囊萌发率和寄主发病严重度观察值和预测值的相关性,认为预测值与观测值无差异,模型拟合效果较好。模型的准确性,还要结合生产实际中病害发生流行期的温度和露时进行进一步验证。
| [1] |
ANN P, KO W. Blossom blight of litchi in Taiwan caused by Peronophythora litchii
[J]. Plant Dis, 1984, 68(9): 826. (  0) 0) |
| [2] |
戚佩坤. 广东果树真菌病害志[M]. 北京: 中国农业出版社, 2000.
(  0) 0) |
| [3] |
WANG H, SUN H, STAMMLER G, et al. Generation and characterization of isolates of Peronophythora litchii resistant to carboxylic acid amide fungicides
[J]. Phytopathology, 2010, 100(5): 522-527. DOI:10.1094/PHYTO-100-5-0522 (  0) 0) |
| [4] |
CHEN L C, LAI S C, LEE C C, et al. Effect of environmental factors on mycelial growth of Peronophythora litchii
[J]. Plant Pathol Bul, 1998, 7(3): 128-133. (  0) 0) |
| [5] |
LIU J, LIU A Y, CHEN W X. Studies on the biological characteristics of lychee downy blight[J]. Acta Hortic, 2005, 665: 415-420. (  0) 0) |
| [6] |
蔡学清, 吴昌镇, 林通, 等. 环境因子对荔枝霜疫霉生长及侵染的影响[J]. 中国农学通报, 2010, 26(9): 283-288. (  0) 0) |
| [7] |
黄河, 王春平, 徐大雅. 荔枝霜疫霉的研究[J]. 真菌学报, 1983, 2(4): 201-206. (  0) 0) |
| [8] |
张荣. 荔枝霜疫霉侵染过程研究及农业措施控制作用初探[D]. 广州: 华南农业大学, 2012: 63-64.
(  0) 0) |
| [9] |
MONTONE V O, FRAISSE C W, PERES N A, et al. Evaluation of leaf wetness duration models for operational use in strawberry disease-warning systems in four US states[J]. Int J Biometeorol, 2016, 60(11): 1-14. (  0) 0) |
| [10] |
ROUBAL C, REGIS S, NICOT P C. Field models for the prediction of leaf infection and latent period of Fusicladium oleagineum on olive based on rain, temperature and relative humidity
[J]. Plant Pathol, 2013, 62(3): 657-666. DOI:10.1111/j.1365-3059.2012.02666.x (  0) 0) |
| [11] |
UYSAL A, SENER K. Influence of inoculum density, temperature, wetness duration, and leaf age on infection and development of spinach anthracnose caused by the fungal pathogen Colletotrichum spinaciae
[J]. Eur J Plant Pathol, 2017(S1): 1-12. (  0) 0) |
| [12] |
张荣, 吕华强, 姜子德, 等. 落花落果对荔枝园霜疫霉初侵染源萌发的作用[J]. 中国植保导刊, 2014, 34(3): 13-16. DOI:10.3969/j.issn.1672-6820.2014.03.003 (  0) 0) |
| [13] |
蒋继志, 郑小波. 用纤维素膜技术研究致病疫霉侵入前与植物相互作用的新方法[J]. 植物病理学报, 1996, 3: 269-275. DOI:10.3321/j.issn:0412-0914.1996.03.004 (  0) 0) |
| [14] |
NEUFELD K N, OJIAMBO P S. Interactive effects of temperature and leaf wetness duration on sporangia germination and infection of cucurbit hosts by Pseudoperonospora cubensis
[J]. Plant Dis, 2012, 96(3): 345-353. DOI:10.1094/PDIS-07-11-0560 (  0) 0) |
| [15] |
ARAUZ L F, NEUFELD K N, LLOYD A L, et al. Quantitative models for germination and infection of Pseudoperonospora cubensis in response to temperature and duration of leaf wetness
[J]. Phytopathology, 2010, 100(9): 959-967. DOI:10.1094/PHYTO-100-9-0959 (  0) 0) |
| [16] |
QU H X, SUN G C, JIANG Y M, et al. Pathogenesis-related proteins in litchi after inoculation with Peronophythora lithii
[J]. Acta Hort, 2001, 558: 439-442. (  0) 0) |
| [17] |
GRANKE L L, HAUSBECK M M. Influence of environment on airborne spore concentrations and severity of asparagus purple spot[J]. Plant Dis, 2010, 94(7): 843-850. DOI:10.1094/PDIS-94-7-0843 (  0) 0) |
| [18] |
PAN Z, LI X, YANG X B, et al. Prediction of plant disease through modelling and monitoring airborne pathogen dispersal[J]. CAB Reviews, 2010, 5(18): 1-11. (  0) 0) |
| [19] |
RAKOTONINDRAINA T, CHAUVIN J É, PELLÉR, et al. Modeling of yield losses caused by potato late blight on eight cultivars with different levels of resistance to Phytophthora infestans
[J]. Plant Dis, 2012, 96(7): 935-942. DOI:10.1094/PDIS-09-11-0752 (  0) 0) |
| [20] |
LI B, ZHAO H, LI B, et al. Effects of temperature, relative humidity and duration of wetness period on germination and infection by conidia of the pear scab pathogen (Venturia nashicola)
[J]. Plant Pathol, 2003, 52(5): 546-552. DOI:10.1046/j.1365-3059.2003.00887.x (  0) 0) |
 2020, Vol. 41
2020, Vol. 41


