维持正常的肠道屏障功能对动物机体健康具有重要意义。肠道屏障功能的影响因素包括生理、病理、营养、应激和环境等[1],其中高脂饮食对机体肠道健康具有重要影响[2]。有研究表明,高脂饮食会对小鼠肠道黏膜屏障功能造成损伤,导致肠道形态与黏液层的破坏,肠道紧密连接蛋白的表达降低,肠道通透性增加,最终引起动物腹泻[3]。此外,高脂饮食还可增加肠道上皮细胞中促炎因子TNF-α和IL-1β的表达[4-8]。因此,通过营养调控提高动物机体肠道健康对于促进动物养殖提质增效具有重要意义。
最近研究表明,多不饱和脂肪酸对动物肠道健康具有良好的促进作用[9-10]。其中鱼油富含的长链n-3多不饱和脂肪酸(n-3 Polyunsaturated fatty acid,n-3 PUFA),如二十碳五烯酸(Eicosapentaenoic acid,EPA)和二十二碳六烯酸(Docosahexaenoic acid,DHA),是人和动物生长发育所必需的营养物质[11]。鱼油中含有丰富的n-3 PUFA,具有保护心脏、抗炎和降低甘油三酯的作用[12-13]。此外,n-3 PUFA还有助于治疗和预防肥胖,维持细胞正常生理功能,调节机体免疫功能[14]。目前有关鱼油对机体的抗炎、保健功能研究相对较多,但其对高脂日粮(High-fat diet,HFD)造成的动物肠道损伤是否有改善作用尚不清楚。
本试验以C57BL/6J小鼠作为研究对象,研究日粮添加质量分数为5%的鱼油对高脂日粮饲喂小鼠肠道屏障功能的影响。研究旨在揭示鱼油对高脂日粮导致的小鼠肠道屏障功能损伤的改善作用,为提高动物肠道屏障功能和肠道健康提供理论基础和试验依据。
1 材料和方法 1.1 试验动物与试验设计选用36只4周龄C57BL/6J雌性小鼠(购于广东省医学实验动物中心),随机分为对照组、高脂组和高脂+鱼油组,每组12只小鼠,分别饲喂基础日粮、高脂日粮、高脂日粮添加质量分数为5%的鱼油(等能替换高脂日粮中脂肪),小鼠日粮组成见表1。试验持续21周,每周测定小鼠采食量和体质量,期间测定小鼠肠道通透性,收集小鼠粪便,测定粗脂肪含量和能值;采集小鼠血液,检测血清中内毒素水平;采集肠道组织,检测小鼠肠道形态和杯状细胞的数量,检测肠道闭锁小带蛋白1 (Zonula, ZO-1)、闭合蛋白(Occludens-1,OCC)、紧密连接蛋白(Claudin-1)以及炎症因子的表达。
|
|
表 1 小鼠日粮成分组成 Table 1 The dietary composition for mice |
鱼油由广州市优百特饲料科技有限公司赠送;内毒素检测试剂盒购于南京建成生物工程研究所有限公司;荧光葡聚糖(FITC-Dextran)购于美国Sigma公司;β-actin和ZO-1抗体购于北京博奥森生物技术有限公司;OCC和Claudin-1抗体购于美国Santa Cruz公司。
1.3 测定指标及方法 1.3.1 小鼠肠道通透性的检测将荧光葡聚糖粉末溶于75 mg/mL磷酸盐缓冲液(HBSS),避光保存备用。将小鼠固定,以600 mg/kg体质量的剂量对小鼠进行灌胃,4 h后进行小鼠上颌采血100~150 μL,将血液避光室温静置30 min,4 ℃、3 000 r/min离心取血清,然后根据等比稀释做标准曲线,将血清和HBSS缓冲液以1∶4的体积比加入酶标板内,测定D517 nm,计算血清中荧光葡聚糖的质量浓度。
1.3.2 HE染色和PAS染色剪取1 cm左右的小鼠肠段,放在40 g/L的多聚甲醛中固定24~36 h,脱水之后用石蜡进行包埋。然后切片(5 μm厚)、贴片、烘片,酒精脱蜡,进行HE染色[15],在显微镜中观察染色效果,并选3个以上不同的视野,记录每个视野里每根绒毛高度(lV)和隐窝深度(dC),计算绒毛高度与隐窝深度比值(lV/dC)。
PAS染色[16]样品采集与保存同HE染色,在显微镜中观察染色效果,并选3以上个不同的视野,记录每个视野里每根绒毛上杯状细胞的数量。
1.3.3 Western blot检测紧密连接蛋白表达使用含1 mmol/L蛋白酶抑制剂(Phenyl methyl sulfonyl fluoride,PMSF)的放射免疫沉淀法(Radioimmunoprecipitation assay,RIPA)裂解液裂解小鼠空肠和回肠黏膜样品,离心取上清,根据二喹啉甲酸(Bicinchoninic acid, BCA)法测定蛋白浓度。取等量样品,利用SDS−聚丙烯酰胺凝胶电泳分离蛋白,转聚偏二氟乙烯膜(Polyvinylidene fluoride,PVDF)。50 g/L脱脂奶粉室温孵育膜2 h。然后取1 μL的ZO-1、OCC、Claudin-1和β-actin等一抗,分别加入2 000、500、500和5 000 μL的缓冲溶液稀释,进行膜孵育一抗,4 ℃条件下过夜。室温孵育二抗90 min,电化学发光(Electrochemiluminescence,ECL)显色、曝光。保存图片,利用Image J软件统计条带灰度。
1.3.4 实时荧光定量PCR检测炎症因子表达提取小鼠空肠和回肠黏膜组织RNA,反转录合成cDNA,利用实时荧光定量PCR检测促炎因子IL-8、TNF-α、IL-6和IL-1β和抗炎因子IL-10的mRNA表达。引物序列及产物长度见表2。
|
|
表 2 小鼠炎症因子引物序列 Table 2 Sequences for primers of mouse inflammation factors |
收集1周内小鼠排出的粪便,烘干、称质量,将粪便研磨粉碎,利用氧弹式测热计C200测定粪便的能值。1周内小鼠能量排出(kJ)=粪便能值(kJ/g)×粪便质量(g)。
1.4 统计分析试验数据结果用平均值和标准误表示。利用SigmaPlot 12.5软件,采用单因素方差分析(One-way ANOVA)对各组均值之间的差异进行分析,采用Duncan’s法进行多组数据之间的比较。
2 结果与分析 2.1 日粮添加鱼油对小鼠生长性状的影响与对照组相比,高脂组的小鼠采食量显著降低、体质量显著升高;与高脂组相比,高脂+鱼油组的小鼠采食量显著升高、体质量显著降低(P<0.05)(图1A、1B)。在能量摄入和排出方面,与高脂组相比,高脂+鱼油组的小鼠能量摄入显著升高、能量排出显著减少(图1C、1D)。同时,高脂+鱼油显著降低了粪便中粗脂肪的含量(图1E)。
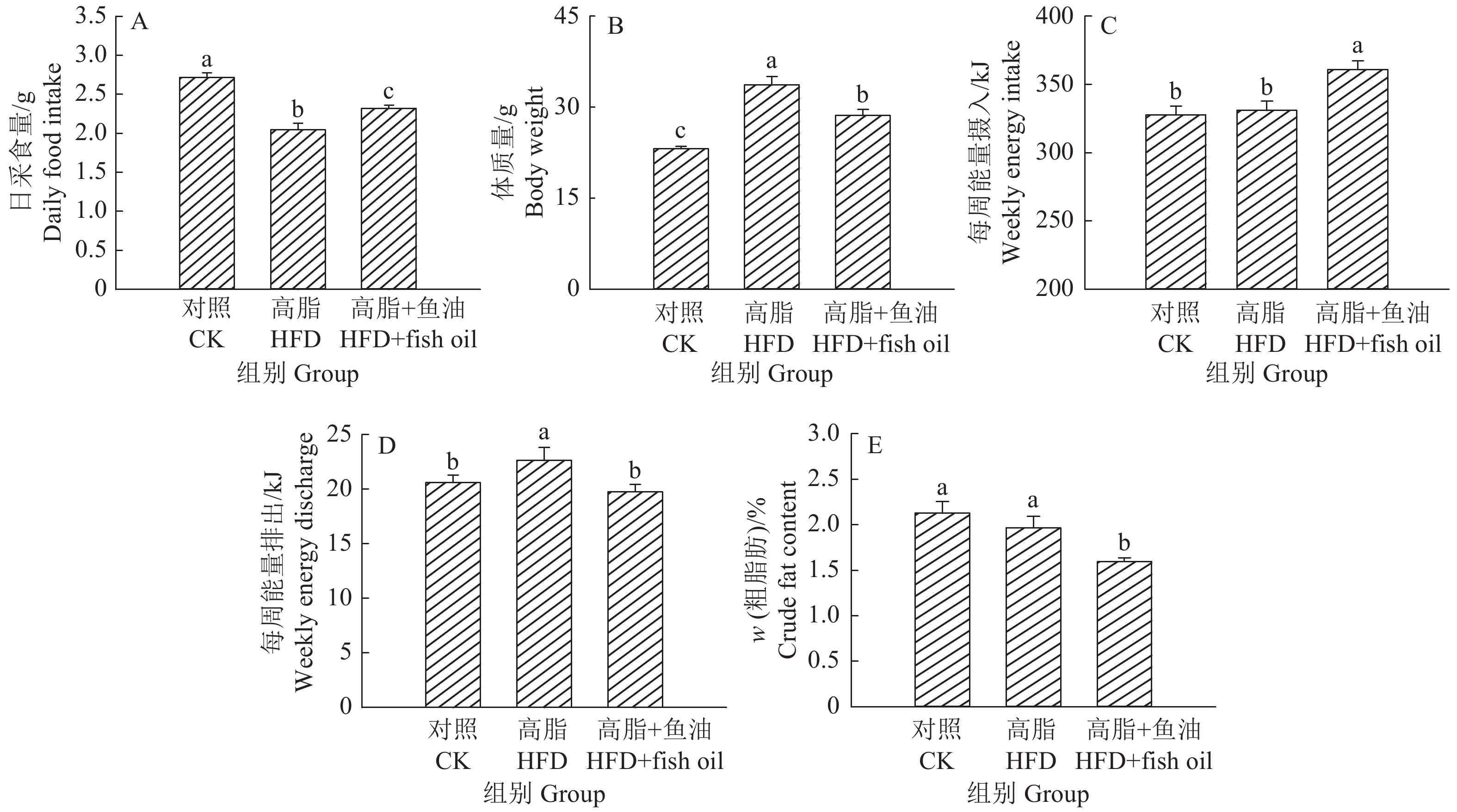
|
图 1 日粮添加鱼油对小鼠生长性状的影响 Fig. 1 Effect of dietary supplementation of fish oil on mouse growth 各图中,柱子上方的不同小写字母表示差异显著(P<0.05,Duncan’s法) In each graph, different lowercase letters on bars indicate significant differences(P<0.05,Duncan’s method) |
小鼠肠道HE染色如图2所示,与对照组相比,高脂组肠道绒毛明显变短,而添加鱼油可改善高脂对绒毛造成的损伤。绒毛高度与隐窝深度比值(lV/dC)统计结果如图3所示,与对照组相比,高脂组空肠和回肠的lV/dC分别降低了13.8%和19.2%,差异显著;与高脂组相比,高脂+鱼油组空肠和回肠的lV/dC分别提高了43.1%和67.5%,差异显著。
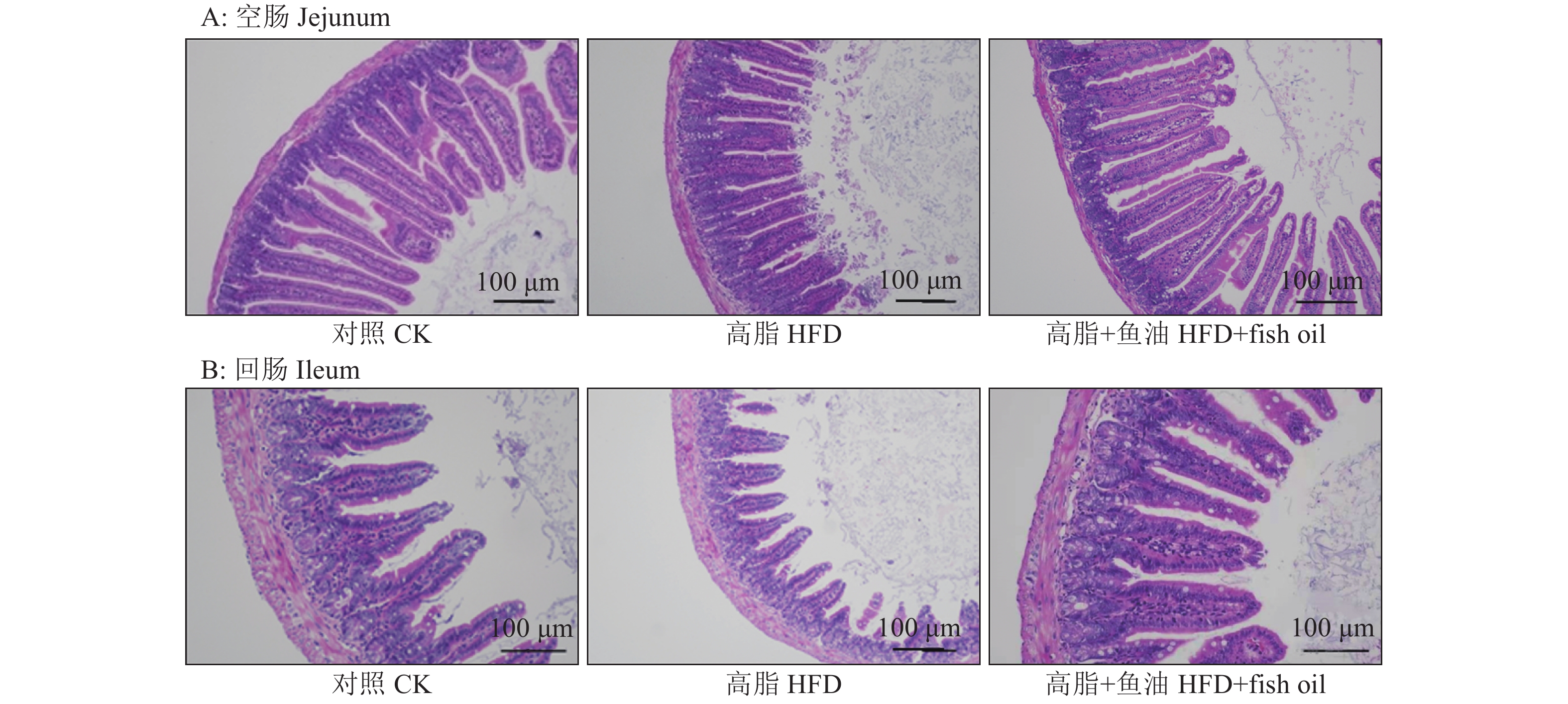
|
图 2 日粮添加鱼油对小鼠空肠和回肠绒毛形态的影响 Fig. 2 Effect of dietary supplementation of fish oil on the villus morphology of mouse jejunum and ileum |
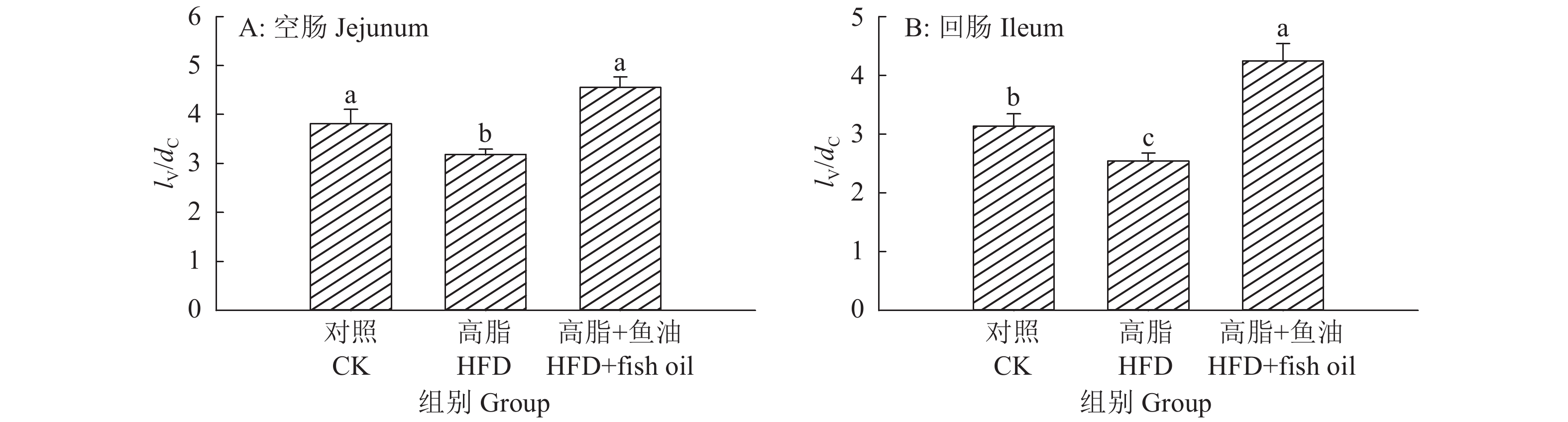
|
图 3 日粮添加鱼油对小鼠空肠和回肠的绒毛高度与隐窝深比值(lV/dC)的影响 Fig. 3 Effect of dietary supplementation of fish oil on the ratio of villus length to crypt depth (lV/dC) in mouse jejunum and ileum 各图中,柱子上方的不同小写字母表示差异显著(P<0.05,Duncan’s法) In each graph, different lowercase letters on bars indicate significant differences(P<0.05, Duncan’s method) |
PAS染色结果如图4所示。与对照组相比,高脂组小鼠回肠杯状细胞数量减少了14.2%,差异显著;与高脂组相比,高脂+鱼油组的杯状细胞数量增加了16.7%,差异显著(图5)。

|
图 4 小鼠回肠PAS染色图 Fig. 4 PAS staining of mouse ileum |

|
图 5 日粮添加鱼油对小鼠回肠杯状细胞数量的影响 Fig. 5 Effect of dietary supplementation of fish oil on goblet cell number in mouse ileum 柱子上方的不同小写字母表示差异显著(P<0.05,Duncan’s法) Different lowercase letters on bars indicate significant differences (P<0.05, Duncan’s method) |
如图6所示,与对照组相比,高脂组的小鼠血清中荧光葡聚糖和内毒素质量浓度分别升高了50.3%和82.0%,差异显著;与高脂组相比,高脂+鱼油组血清中荧光葡聚糖和内毒素质量浓度分别降低了34.3%和50.4%,差异显著。以上结果表明,鱼油可逆转高脂导致的小鼠肠道通透性的增加。

|
图 6 日粮添加鱼油对小鼠血清中荧光葡聚糖和内毒素含量的影响 Fig. 6 Effects of dietary supplementation of fish oil on fluorescent glucan and endotoxin contents in mouse serum 各图中,柱子上方的不同小写字母表示差异显著(P<0.05,Duncan’s法) In each graph, different lowercase letters on bars indicate significant differences(P<0.05, Duncan’s method) |
如图7和图8所示,与对照组相比,高脂组小鼠空肠和回肠中紧密连接蛋白ZO-1、Claudin-1和Occludin的表达量显著降低;与高脂组相比,高脂+鱼油组空肠和回肠紧密连接蛋白ZO-1、Claudin-1和Occludin的表达量显著升高。

|
图 7 小鼠空肠和回肠紧密连接蛋白的Western blot检测结果 Fig. 7 Western blot results of tight junction proteins in mouse jejunum and ileum |
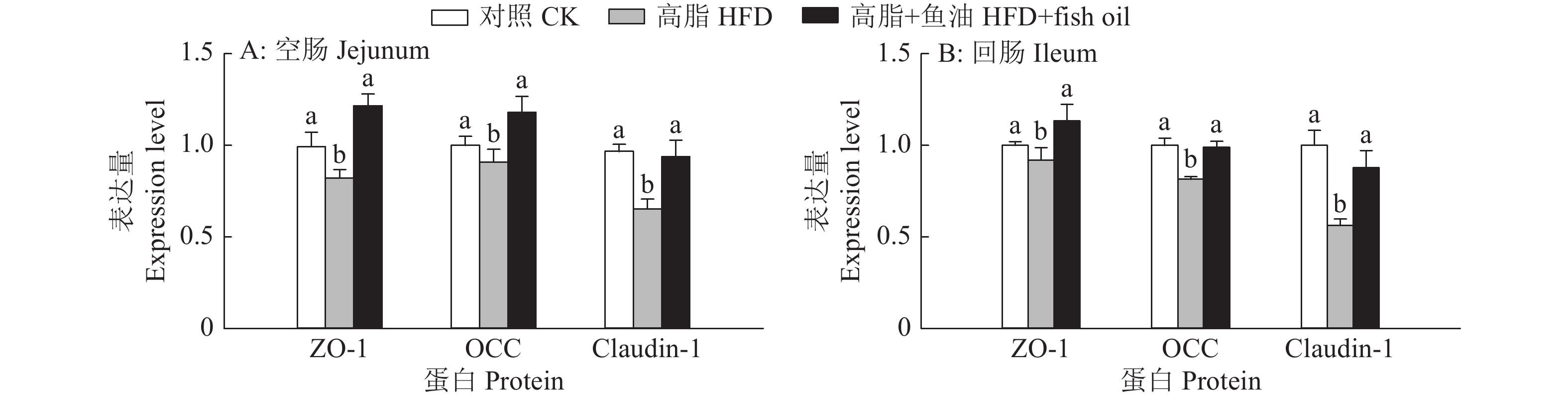
|
图 8 日粮添加鱼油对小鼠空肠和回肠紧密连接蛋白表达的影响 Fig. 8 Effect of dietary supplementation of fish oil on the expression of tight junction protein in mouse jejunum and ileum 各图中,相同蛋白柱子上方的不同小写字母表示组间差异显著(P<0.05,Duncan’s法) In each graph, different lowercase letters on bars of the same protein indicate significant differences among groups(P<0.05, Duncan’s method) |
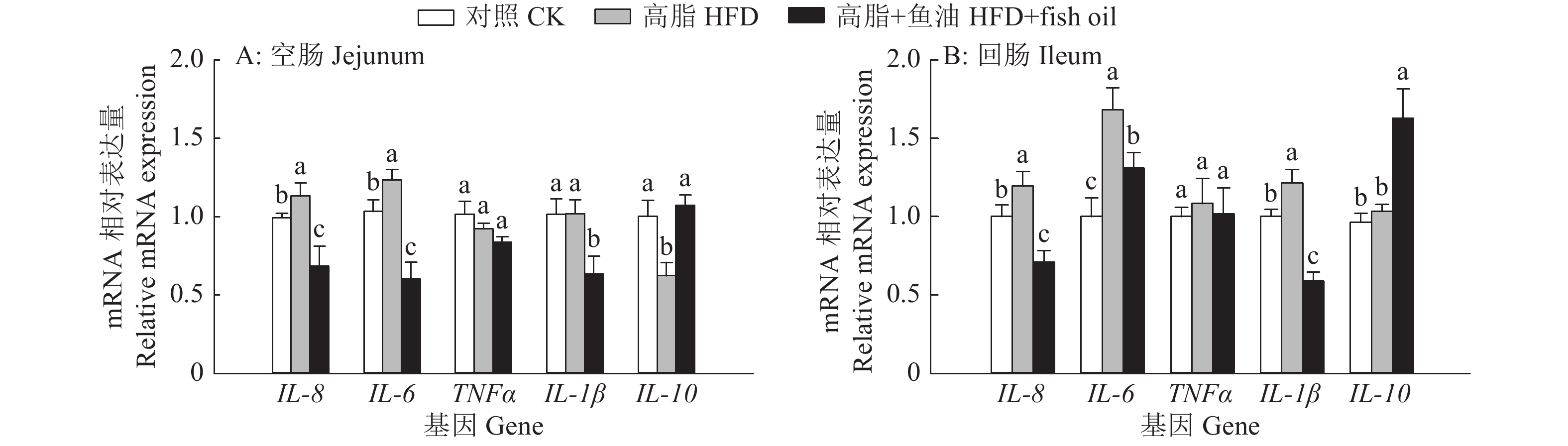
如图9所示,与对照组相比,高脂组小鼠空肠中促炎因子IL-8和IL-6的mRNA表达量显著升高,抗炎因子IL-10的mRNA表达量显著降低,回肠中促炎因子IL-8、IL-6和IL-1β的mRNA表达量显著升高。与高脂组相比,高脂+鱼油组小鼠空肠和回肠中促炎因子IL-8、IL-6、IL-1β的mRNA表达量显著降低,抗炎因子IL-10 mRNA表达量显著增加。
|
图 9 日粮添加鱼油对小鼠空肠和回肠炎症因子表达的影响 Fig. 9 Effect of dietary supplementation of fish oil on the expression of inflammatory factor in mouse jejunum and ileum 各图中,相同基因柱子上方的不同小写字母表示组间差异显著(P<0.05,Duncan’s法) In each graph, different lowercase letters on bars of the same gene indicate significant differences among groups(P<0.05, Duncan’s method) |
有文献报道,在高脂饮食诱导的小鼠肥胖试验中,鱼油可以显著降低高脂日粮诱导的小鼠肥胖效应[17]。本试验研究结果发现,与高脂组相比,日粮添加鱼油能显著降低高脂引起的小鼠体质量的增加,同时能显著提高小鼠的能量摄入、降低能量排出和粪便中粗脂肪的含量,提示鱼油可促进营养物质的吸收。此外,鱼油可在提高小鼠的能量摄入同时显著降低体质量,这可能与鱼油促进动物运动和增加能量代谢有关。
3.2 日粮添加鱼油对高脂饲喂小鼠肠道形态及黏膜屏障的影响鱼油主要成分为EPA和DHA,可通过降低γ−干扰素(Interferon-γ, IFN-γ)和肿瘤坏死因子(Tumor necrosis factor,TNF)的表达保护肠道屏障的完整性。有文献报道,在高脂日粮诱导的小鼠肥胖试验中,高脂可导致肠道形态的破坏[4,18]。在本试验中,HE染色结果显示,高脂日粮显著降低肠道绒毛高度与隐窝深的比值(lV/dC),而高脂日粮添加鱼油能显著提高肠道lV/dC。这与鱼油能够增加营养物质吸收的结果是相一致的。此外有报道称,高脂可导致小鼠肠道内杯状细胞数量减少、肠道黏液屏障损坏[19]。与该报道结果一致,本试验研究发现高脂日粮能够减少小鼠肠道杯状细胞数量,而高脂+鱼油组则较高脂组的肠绒毛上杯状细胞的数量显著增加。以上结果提示,鱼油能够改善高脂导致的肠道绒毛形态与黏液屏障的损伤。
3.3 日粮添加鱼油对高脂饲喂小鼠肠道通透性及紧密连接蛋白的影响有报道指出,高脂与肠道通透性增加密切相关,高脂日粮可导致脂多糖(Lipopolysaccharide,LPS)在循环系统中增加,改变肠道通透性[20]。本研究发现,高脂日粮显著提高血清中荧光葡聚糖和内毒素的水平,说明高脂增加了小鼠肠道的通透性。而高脂添加鱼油可逆转高脂导致的小鼠肠道通透性的增加。此外,与肠道通透性的结果相一致,我们的结果显示,高脂日粮显著降低紧密连接蛋白Occludin、ZO-1和Claudin-1的表达,而高脂添加鱼油能显著增加紧密连接蛋白的表达。以上结果表明,鱼油可缓解或改善由高脂引起的肠道紧密连接屏障的损伤。
3.4 日粮添加鱼油对高脂饲喂小鼠肠道炎症的影响研究显示,过多脂肪沉积可诱导肠腔内LPS水平升高,导致肠道微生态平衡失调,激活Toll样受体(Toll-like receptor 4,TLR4)和NOD样受体蛋白(Nucleotide binding oligomerization domain,NOD)炎症信号通路[21],引发动物肠道产生炎症,改变肠道形态结构,增加肠道通透性,进而影响肠道健康[22]。与基础日粮相比,饲喂高脂日粮4周以后,血清中的LPS水平增加,进而引起全身性的炎症反应[23]。为了证实鱼油是否能降低肠道炎症反应,本研究检测了小鼠肠道中炎症因子的表达,结果发现,高脂日粮可增强小鼠肠道中炎症反应,破坏屏障功能,而添加鱼油则显著降低促炎因子IL-8、IL-6和IL-1β的表达,增加抗炎因子IL-10的表达,提示鱼油可改善高脂造成的肠道炎症反应。
综上所述,高脂日粮可导致小鼠肠道屏障功能损伤和肠道炎症反应,而高脂+鱼油可改善高脂造成的屏障功能损伤,该过程可能与鱼油降低肠道炎症有关。以上研究结果揭示了鱼油对高脂日粮导致的小鼠肠道屏障功能损伤的改善作用,为鱼油在提高动物肠道屏障功能和肠道健康中的应用提供理论基础和试验依据。
| [1] |
彭凯, 吴薇, 龙蕾, 等. 断奶仔猪的腹泻研究进展[J]. 饲料研究, 2015(13): 10-15. (  0) 0) |
| [2] |
JI Y, SAKATA Y, TSO P. Nutrient-induced inflammation in the intestine[J]. Curr Opin Clin Nutr, 2011, 14(4): 315-321. DOI:10.1097/MCO.0b013e3283476e74 (  0) 0) |
| [3] |
DONG L, ZHANG Y, YANG L, et al. Effects of a high-fat diet on adipose tissue CD8+ T cells in young vs adult mice[J]. Inflammation, 2017, 40(6): 1944-1958. DOI:10.1007/s10753-017-0635-0 (  0) 0) |
| [4] |
CREMONINI E, WANG Z W, BETTAIEB A, et al. (-)-Epicatechin protects the intestinal barrier from high fat diet-induced permeabilization: Implications for steatosis and insulin resistance[J]. Redox Biol, 2018, 14: 588-599. DOI:10.1016/j.redox.2017.11.002 (  0) 0) |
| [5] |
HAMILTON M K, BOUDRY G, LEMAY D G, et al. Changes in intestinal barrier function and gut microbiota in high-fat diet-fed rats are dynamic and region dependent[J]. Am J Physiol-Gastr L, 2015, 308(10): G840-G851. (  0) 0) |
| [6] |
DING S L, CHI M M, SCULL B P, et al. High-fat diet: Bacteria interactions promote intestinal inflammation which precedes and correlates with obesity and insulin resistance in mouse[J]. PLoS One, 2010, 5(8): e12191. DOI:10.1371/journal.pone.0012191 (  0) 0) |
| [7] |
PETERSON L W, ARTIS D. Intestinal epithelial cells: Regulators of barrier function and immune homeostasis[J]. Nat Rev Immunol, 2014, 14(3): 141-153. DOI:10.1038/nri3608 (  0) 0) |
| [8] |
BENÍTEZ-PÁEZ A, GÓMEZ DEL PULGAR E M, KJØLBÆK L, et al. Impact of dietary fiber and fat on gut microbiota re-modeling and metabolic health[J]. Trends Food Sci Technol, 2016, 57: 201-212. DOI:10.1016/j.jpgs.2016.11.001 (  0) 0) |
| [9] |
MUHLROTH A, LI K S, RØKKE G, et al. Pathways of lipid metabolism in marine algae, co-expression network, bottlenecks and candidate genes for enhanced production of EPA and DHA in species of chromista[J]. Mar Drugs, 2013, 11(11): 4662-4697. DOI:10.3390/md11114662 (  0) 0) |
| [10] |
左正三, 郭东升, 纪晓俊, 等. 肠道中多不饱和脂肪酸及其衍生物研究进展[J]. 中国生物工程杂志, 2018, 38(11): 66-75. (  0) 0) |
| [11] |
李启艳, 谢强胜, 刁飞燕, 等. 鱼油的化学成分及其药理活性研究进展[J]. 药物分析杂志, 2016, 36(7): 1157-1161. (  0) 0) |
| [12] |
MORI T A, BEILIN L J. Omega-3 fatty acids and inflammation[J]. Curr Atheroscler Rep, 2004, 6(6): 461-467. DOI:10.1007/s11883-004-0087-5 (  0) 0) |
| [13] |
TONTONOZ P, SPIEGELMAN B M. Fat and beyond: The diverse biology of PPARγ[J]. Annu Rev Biochem, 2008, 77(1): 289-312. DOI:10.1146/annurev.biochem.77.061307.091829 (  0) 0) |
| [14] |
龙烁, 王浩, 武书庚, 等. 二十二碳六烯酸的生理学功能及其在家禽生产中的应用[J]. 动物营养学报, 2017, 29(4): 1101-1109. DOI:10.3969/j.issn.1006-267x.2017.04.003 (  0) 0) |
| [15] |
唐军旺, 方倩倩, 邵荣益, 等. 不同油脂对填饲期朗德鹅生产性能、血清指标及肝脏脂肪酸组成的影响[J]. 动物营养学报, 2018, 30(7): 2550-2560. DOI:10.3969/j.issn.1006-267x.2018.07.015 (  0) 0) |
| [16] |
银忠. 地衣芽孢杆菌对菌群失调大鼠肠道微生态、黏膜结构和免疫细胞的影响[D]. 武汉: 华中农业大学, 2009.
(  0) 0) |
| [17] |
HASAN A U, OHMORI K, KONISHI K, et al. Eicosapentaenoic acid upregulates VEGF-A through both GPR120 and PPARγ mediated pathways in 3T3-L1 adipocytes[J]. Mol Cell Endocrinol, 2015, 406: 10-18. DOI:10.1016/j.mce.2015.02.012 (  0) 0) |
| [18] |
贺显晶, 孙东波, 武瑞. 鱼油对断奶SD大鼠生产性能、脏器指数及肠道形态的影响[J]. 黑龙江畜牧兽医, 2011(9): 144-146. (  0) 0) |
| [19] |
张智, 单庆文, 王琳琳, 等. 培菲康对高脂饮食诱导脂肪肝病大鼠肠黏膜屏障的保护作用[J]. 世界华人消化杂志, 2013, 21(2): 130-137. (  0) 0) |
| [20] |
MOREIRA A P B, TEXEIRA T F S, FERREIRA A B, et al. Influence of a high-fat diet on gut microbiota, intestinal permeability and metabolic endotoxaemia[J]. Br J Nutr, 2012, 108(5): 801-809. DOI:10.1017/S0007114512001213 (  0) 0) |
| [21] |
TAKAHASHI Y, ISUZUGAWA K, MURASE Y, et al. Up-regulation of NOD1 and NOD2 through TLR4 and TNF-α in LPS-treated murine macrophages[J]. J Vet Med Sci, 2006, 68(5): 471-478. DOI:10.1292/jvms.68.471 (  0) 0) |
| [22] |
GREGOR M F, HOTAMISLIGIL G S. Inflammatory mechanisms in obesity[J]. Annu Rev Immunol, 2011, 29(1): 415-445. DOI:10.1146/annurev-immunol-031210-101322 (  0) 0) |
| [23] |
GEURTS L, NEYRINCK A M, DELZENNE N M, et al. Gut microbiota controls adipose tissue expansion, gut barrier and glucose metabolism: Novel insights into molecular targets and interventions using prebiotics[J]. Benef Mirbobes, 2014, 5(1): 3-17. DOI:10.3920/BM2012.0065 (  0) 0) |
 2020, Vol. 41
2020, Vol. 41


