四环素类抗生素包括四环素、土霉素、金霉素等,是一类广谱抗生素。近年来畜牧业和水产养殖业发展迅速,大量四环素类抗生素以饲料的形式用于其中。四环素类抗生素已成为我国畜禽业抗生素中使用量最大的一类抗生素[1]。据报道,2007年我国各类抗生素的年生产量为21万t,其中约46.1%应用于畜牧养殖业中[1],而2013年我国的四环素类抗生素使用量达到1.2万t[2]。无论人用或是兽用抗生素进入动物或人体内后,有质量分数约30%~90%是以母体化合物的形式直接被排出体外[3],最终又通过施肥等方式进入土壤环境或者通过渗漏和污水排放进入水体环境。我国土壤[4]、水产养殖[5]、地下水[6]、牛奶[7]中都有监测到土霉素的残留。环境中残留的抗生素对土壤微生物的群落结构和微生物活性[8]、植物生长[9]都会产生影响,同时也会对人体健康造成危害。当人体内的四环素类抗生素积累到一定程度时会造成肝和肾脏的损伤,引起过敏或中毒反应,还会引起牙釉质发育不全、牙齿发黄[10-11]。因此开展土霉素残留降解的研究很有必要。
生物降解抗生素是当下的研究热点,相对于物理、化学方法降解抗生素,生物降解方法具有环保、简单、高效等特点[12]。孟应宏等[13]从堆肥中筛选出1株土霉素降解菌,经鉴定为假单胞菌Pseudomonas sp.。翟辉[14]从土壤中筛选出1株土霉素降解菌,鉴定为曲霉菌Aspergillus sp.,但国内外关于酵母菌降解土霉素的报道较少。同时铜和锌离子作为最常用的饲料添加剂多数随畜禽粪便排出体外,流入自然环境中。环境中的重金属元素对微生物抗生素抗性的形成起到了协同选择作用,进一步促进抗生素抗性基因库的稳定、扩大和抗性基因的传播[15]。因此本研究旨在筛选出具有耐铜锌离子的土霉素降解菌,并研究其降解特性,为该菌在土霉素污染环境治理中的应用奠定基础。
1 材料与方法 1.1 样品与试剂试验样品为安徽省芜湖市水产养殖废水;盐酸土霉素(C22H24O9N2·HCl)标准品购自于Solarbio公司;甲醇、乙腈和草酸购自于上海麦克林生化科技有限公司;五水硫酸铜购自于上海市试剂一厂综合经营公司;七水硫酸锌购自于上海麦克林生化科技有限公司。
EDTA-Mcllvaine缓冲液:将0.1 mol/L的柠檬酸溶液1 000 mL和0.1 mol/L的磷酸氢二钠溶液625 mL混合,制得Mcllvaine缓冲液,并向Mcllvaine缓冲液中加入EDTA-Na2 60.05 g。配制EDTA-Mcllvaine缓冲液所需药品均购自于上海麦克林生化科技有限公司。
1.2 培养基基础培养基:牛肉膏蛋白胨、高氏1号、PDA培养基[16]。筛选培养基:在灭过菌的基础培养基中加入土霉素母液(1 000 mg/L)。
1.3 试验方法 1.3.1 土霉素降解菌的筛选取10 mL样品装入含有90 mL液体基础培养基的250 mL三角瓶中,30 ℃、150 r/min富集培养24 h,吸取0.1 mL菌液涂布在含微量铜锌离子、土霉素质量浓度为50 mg/L的基础固体培养基上,30 ℃培养2 d,将上述平板上生长的菌落挑出接种在100 mg/L的固体基础培养基上,按50 mg/L的梯度逐渐提高培养基中土霉素的质量浓度至 200 mg/L,培养步骤同上。经驯化后将长势良好、菌落规则、耐高浓度土霉素的菌株挑出,接种于含50 mg/L土霉素的筛选培养基上,检测其降解土霉素的效果,同时设置不接菌的培养基作为对照。挑选出5 d降解效率最高的菌株,划线纯培养,菌株编号,保存于4 ℃冰箱,备用。
1.3.2 降解菌降解效果的测定将土霉素母液用甲醇稀释至0.5、1.0、5.0、10.0、20.0、40.0、80.0、100.0 mg/L等系列质量浓度,作标准曲线;向不接菌的PDA液体培养基中添加土霉素标准液,制得土霉素质量浓度为10和40 mg/L的溶液,同时用流动相制得相应浓度的标准工作液,采用岛津Prominence LC-20A型高效液相色谱仪对土霉素含量进行检测。取2 mL培养液,向其中加入6 mL EDTA-Mcllvaine缓冲液,然后分别相继加入1 mL正己烷,1 mL三氯甲烷,旋涡混匀1 min,超声30 s使溶质均匀,5 000 r/min离心10 min,上清液经0.22 μm微孔滤膜过滤,其滤液用于高效液相色谱(HPLC)分析。色谱条件为:色谱柱Zorbax C18(250 mm×4.6 mm,5 μm,美国)流动相:0.01 mol·L−1 草酸/乙腈/甲醇(体积比为70 /20/10);流速:0.8 mL.min−1;柱温:30 ℃;检测波长:350 nm;进样量:20 μL。回收率的计算公式为:回收率=A/As×100%(A和As分别对应培养基和相应标准工作液中的土霉素峰面积)。
1.3.3 降解菌的鉴定对筛选出的降解效果较好的菌株进行形态观察和生理生化鉴定。利用基因组试剂盒提取酵母基因组,用10 g/L的琼脂糖凝胶电泳对基因组进行验证分析,再送样测序。18S rDNA序列鉴定由上海通用生物技术有限公司完成。所测得的18S rDNA序列在NCBI进行BLAST搜索找到相似度较高的菌株序列,利用MEGA6.0软件构建系统发育树(邻接法)。
1.3.4 MIC检测检测所筛的菌株在土霉素质量浓度分别为50、100、200、300、…、1 000 mg/L的液体培养基中被抑制的浓度,并用培养基平板进一步缩小其最低抑菌浓度(Minimum inhibitory concentration,MIC)的范围;同样的试验条件下,检测降解菌对四环素、金霉素、氯霉素、Cu2+、Zn2+的MIC范围。
1.3.5 理化因素对菌株降解土霉素效果的影响以pH、温度、接种量、装液量、底物质量浓度为研究对象,研究所筛的菌株对土霉素的降解效果。以下试验中每个处理均设置3个重复。
1) pH:调节pH分别为5、6、7、8和9,接种量为1%(φ),装液量50 mL,30 ℃、150 r/min摇床培养5 d,测定含50 mg/L土霉素的培养液中土霉素的残留量。
2)温度:调节pH为7,接种量为1%(φ),装液量50 mL,设置20、25、30、35和40 ℃共计5个温度梯度,150 r/min摇床培养5 d,测定含50 mg/L土霉素的培养液中土霉素的残留量。
3)接种量:调节pH为7,装液量50 mL,接种量(φ)分别为0.5%、1.0%、2.0%、3.0%和4.0%,30 ℃、150 r/min摇床培养5 d,测定含50 mg/L土霉素的培养液中土霉素的残留量。
4)装液量:调节pH为7,接种量为1%(φ),在250 mL三角瓶中的装液量分别为25、50、75、100和125 mL,30 ℃、150 r/min摇床培养5 d,测定含50 mg/L土霉素的培养液中土霉素的残留量。
5)底物质量浓度:调节pH为7,装液量50 mL,接种量为1%(φ),土霉素的质量浓度分别为25、50、100、150和200 mg/L,30 ℃、150 r/min摇床培养5 d,测定含不同质量浓度底物的培养液中土霉素的残留量。
1.3.6 铜、锌离子对菌株降解土霉素的影响在含低(50 mg/L)和高(200 mg/L)质量浓度土霉素的最适选择培养基中分别添加50 mg/L的Cu2+和Zn2+,以空白培养基为对照,30 ℃、150 r/min摇床培养5 d。测定培养液中土霉素残留量,计算土霉素的降解率。每个处理设置3个重复。
1.3.7 数据分析数据处理使用EXCEL 2010程序和SPSS 19.0等统计分析软件。采用新复极差法(Duncan’s法)对试验数据结果进行多重比较。
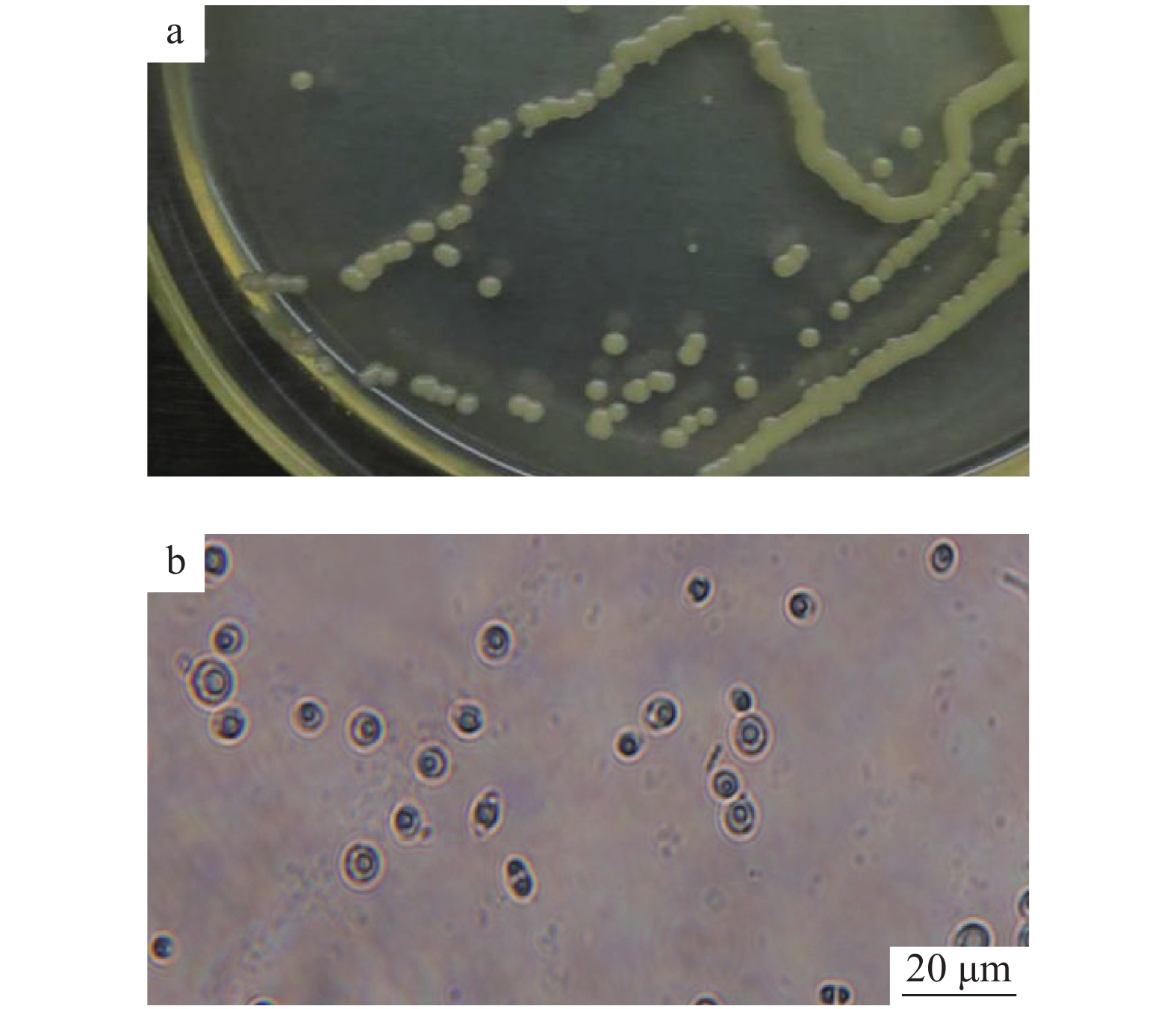
2 结果与分析 2.1 降解菌株的形态特征经驯化、纯化后从基础培养基上分离出1株土霉素的高效降解菌,编号记为DJ1。在PDA平板上DJI菌落呈圆形,乳白色,湿润,黏稠,易挑起(图1a)。菌体呈椭圆形,出芽生殖(图1b),为酵母菌。
|
图 1 菌株DJ1的菌落形态(a)和显微形态(b) Fig. 1 Colonial and microscopic morphology of strain DJ1 |
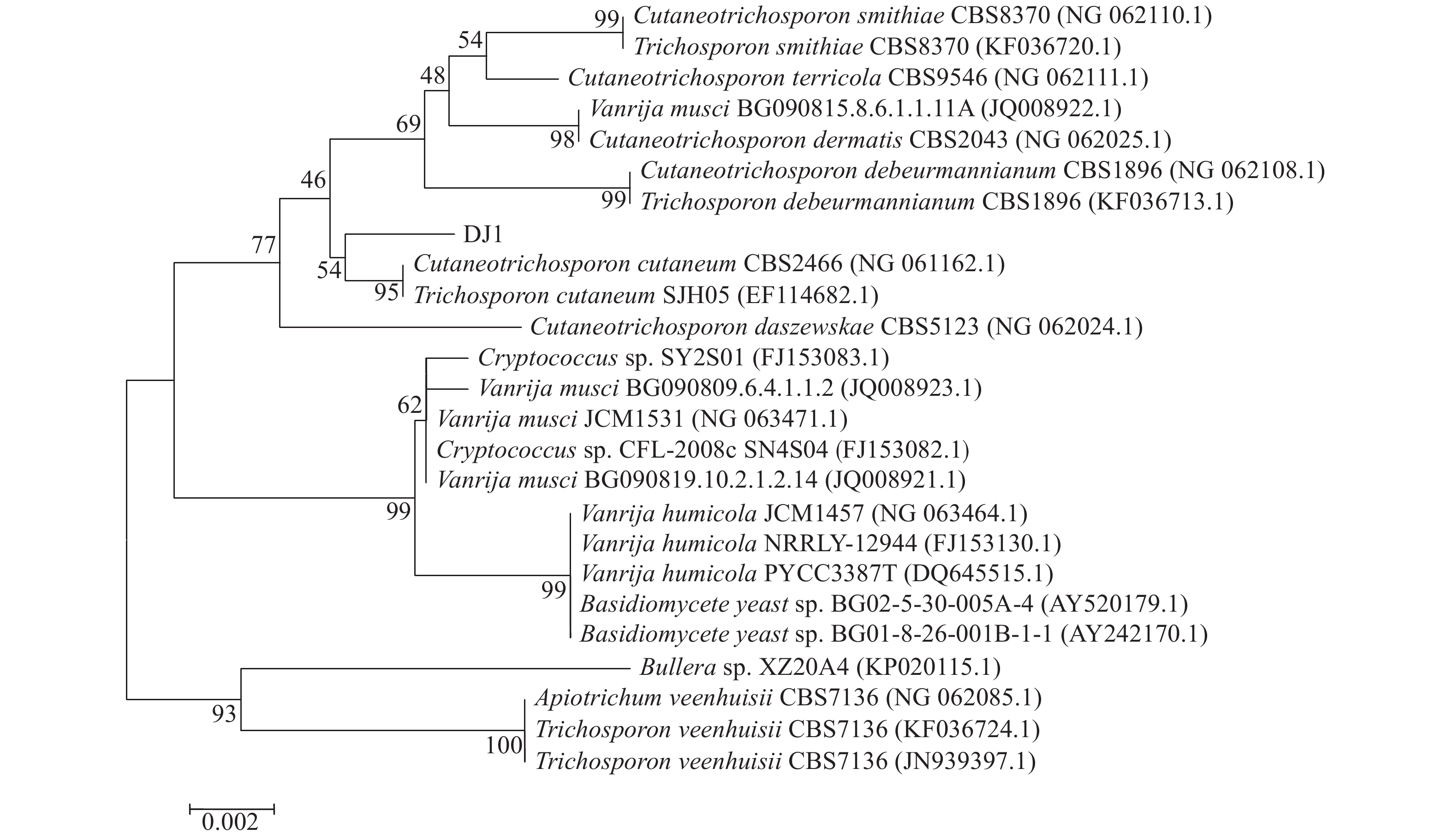
DJ1菌株的18S rDNA序列长度为1 020 bp,将序列通过NCBI网站进行BLAST比对,由MEGA6.0软件构建的系统发育树(图2)可知,菌株DJ1为Cutaneotrichosporon cutaneum。GenBank登录号为MN809497。
|
图 2 DJ1菌株的18S rDNA系统发育树 Fig. 2 The 18S rDNA phylogenetic tree of strain DJ1 |
在所建立的HPLC方法下,土霉素的保留时间为4.96 min。结果表明在土霉素质量浓度为0.5~80.0 mg/L的范围内,各质量浓度与其对应的色谱峰面积具有良好的线性关系,进行相关性分析后得出土霉素的回归方程y=38 086x−14 224,决定系数R2=0.999 9。空白PDA液体培养基中经预处理后,在10和50 mg/L土霉素质量浓度下的平均回收率为101.20%和91.97%,变异系数为4.93%和4.92%。
2.4 MIC的检测DJ1菌株对四环素类抗生素具有很高的耐受性,MIC检测均超过700 mg/L,且对土霉素、四环素和氯霉素的MIC均在1 000 mg/L以上。同时在铜、锌离子质量浓度分别为400和500 mg/L时才抑制生长,说明DJ1菌对铜锌离子也具有较高的耐受性。且在重金属铜锌离子与土霉素共存的二元交叉培养基平板上能生长,具有重金属铜锌与抗生素的交叉耐性。
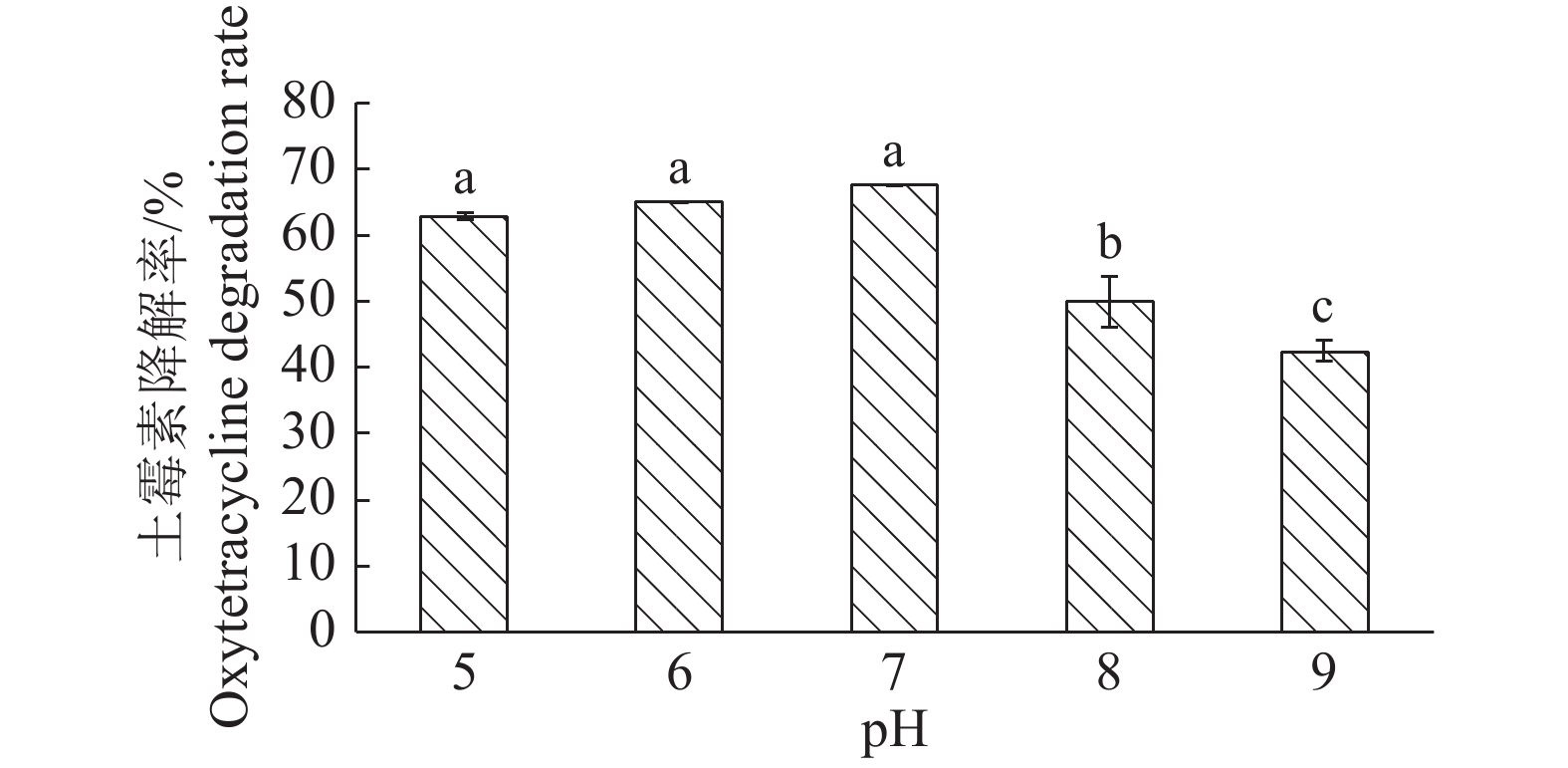
2.5 理化因素对DJ1菌株降解土霉素的影响 2.5.1 pHpH对DJ1菌株降解土霉素效果的影响如图3所示。在pH 5~9的范围内,DJ1对土霉素的降解率呈现先增大后减小的趋势,其降解率分别为pH7>pH6>pH5>pH9>pH10。pH7为最适pH,该pH条件下降解率最高,达67.36%。这表明DJ1菌株适宜生长的环境是中性偏酸,且酸性环境中的土霉素降解率高于碱性环境中,这可能是因为土霉素在酸性条件下结构不稳定,部分土霉素C环破裂,形成内酯型异构体,无法被检测出[13]。同时,水体、土壤等环境的pH范围大多都是中性,与本试验的最适pH一致,本试验对于环境中污染修复具有一定的意义。
|
图 3 pH对DJ1菌株降解土霉素的影响 Fig. 3 Effect of pH on the degradation of oxytetracycline by strain DJ1 柱子上方的不同小写字母表示差异显著(P<0.05,Duncan’s法) Different lowercase letters on bars indicate significant differences (P<0.05, Duncan’s method) |
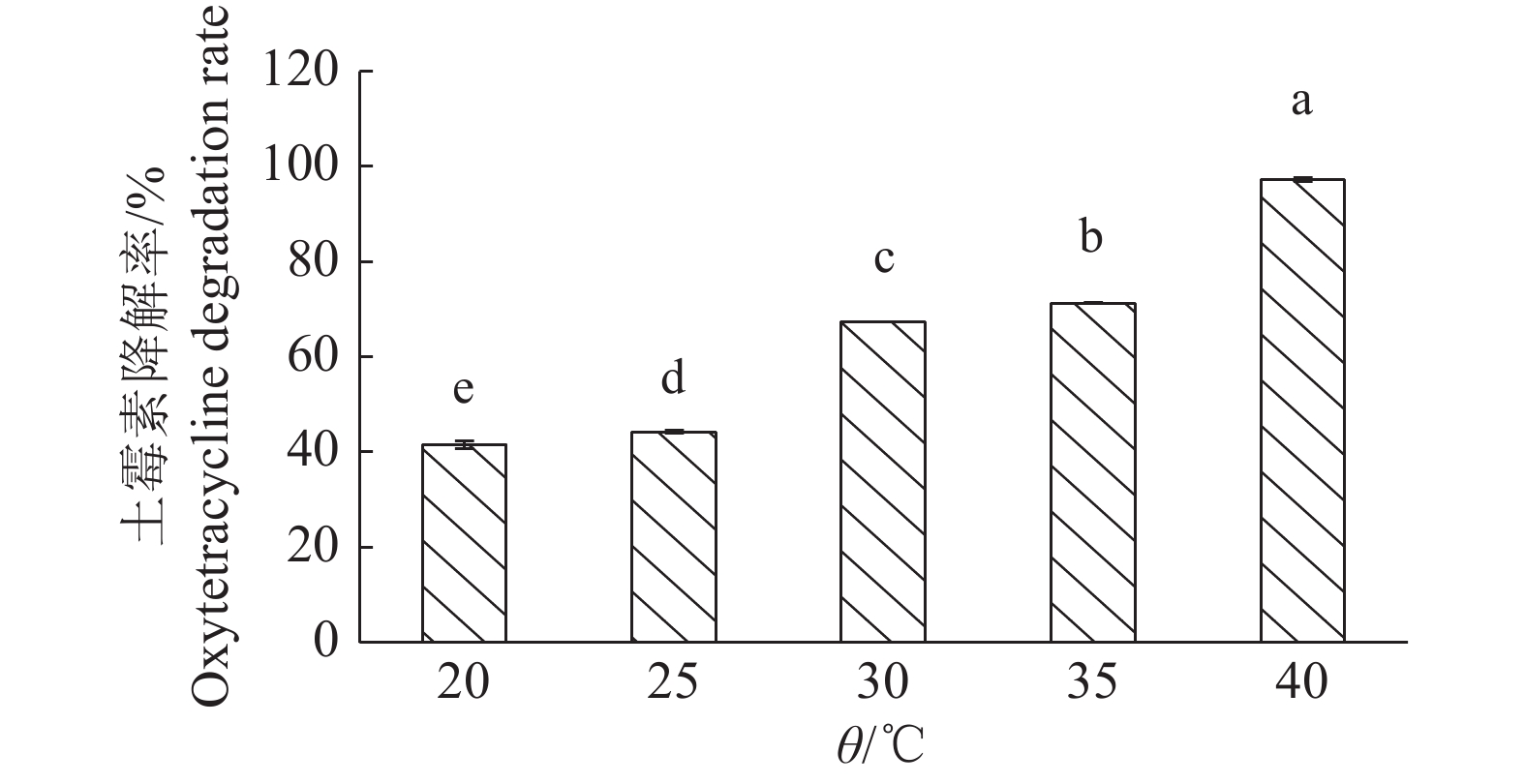
温度对DJ1降解土霉素的效果如图4所示。DJ1菌株对温度较为敏感,当温度在20~25 ℃时,降解率均不超过45%,之后降解率逐渐增大。当温度达到40 ℃时,降解率急剧增加到90%以上,这可能是因为高温加剧了土霉素的自然分解[17]。在温度30和35 ℃时,土霉素降解率分别为67.36%和71.30%,但当温度升高至35 ℃时,DJ1菌株的生长量逐渐减少,因此在此范围内选择30 ℃作为DJ1菌株生长的最适温度。
|
图 4 接种温度对DJ1菌株降解土霉素的影响 Fig. 4 Effect of incubation temperature on the degradation of oxytetracycline by strain DJ1 柱子上方的不同小写字母表示差异显著(P<0.05,Duncan’s法) Different lowercase letters on bars indicate significant differences (P<0.05, Duncan’s method) |
不同接种量(φ)对DJI菌株降解土霉素效果的影响如图5所示。在0.5%~4.0%的范围内,当接种量为1.0%时,降解率最高,为68.67%。随着接种量的增加,DJ1的降解率出现了先增加后减小的趋势,但差异并不显著。赵永斌[18]报道的四环素降解菌也表现出了相似的现象,其在0.5%~4.0%的范围内,选择2.0%作为最佳接种量,对土霉素的降解率达66.33%。这可能因为菌体会竞争培养液中的营养物质所致。故在此范围内选取1.0%为最适接种量。
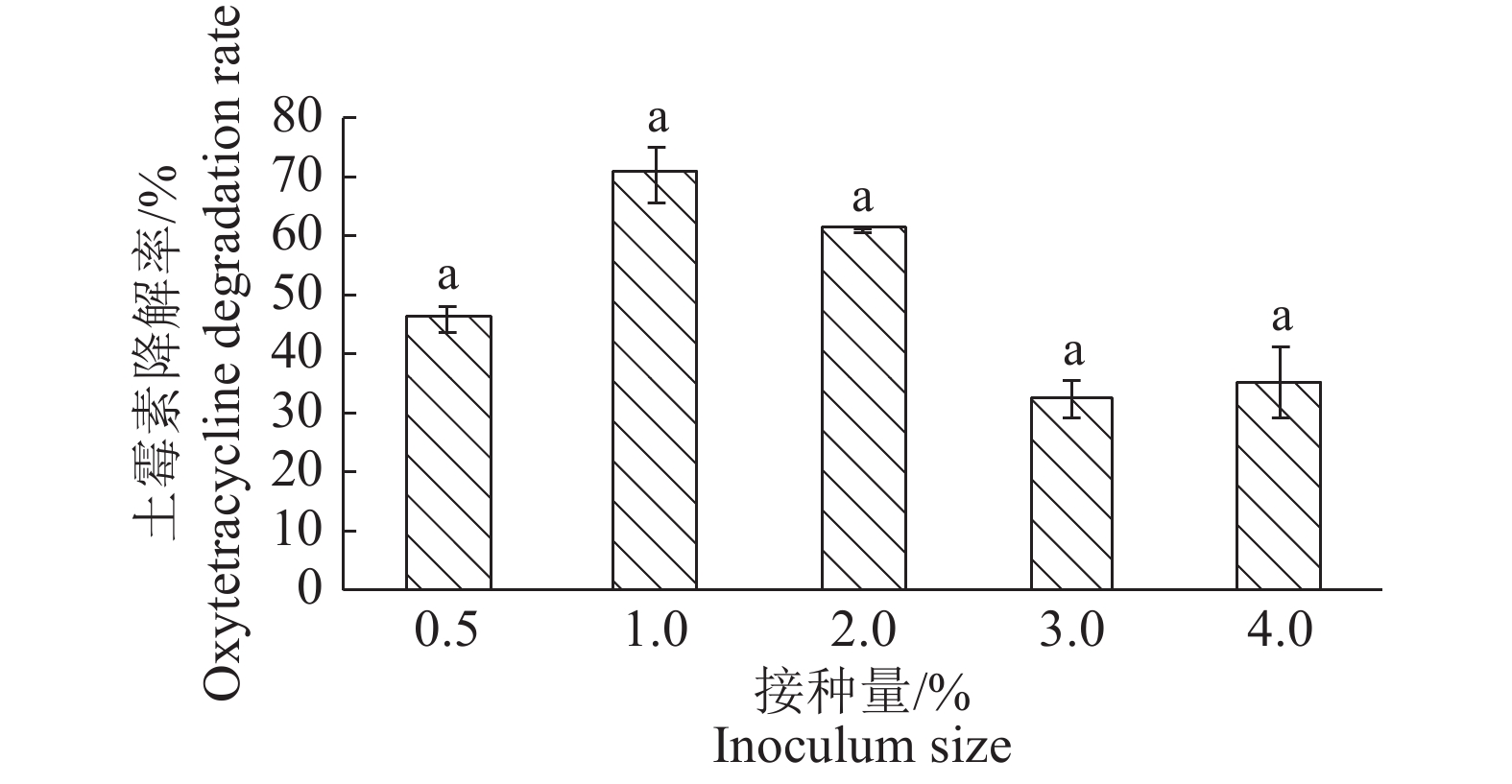
|
图 5 接种量对DJ1菌株降解土霉素的影响 Fig. 5 Effect of inoculum size on the degradation of oxytetracycline by strain DJ1 柱子上方的不同小写字母表示差异显著(P<0.05,Duncan’s法) Different lowercase letters on bars indicate significant differences (P<0.05, Duncan’s method) |
装液量实际反映的是细胞混合的均匀度和需要量的多少[19]。装液量对DJI菌株降解土霉素的效果如图6所示。不同装液量对土霉素的降解率具有一定的差异,降解率大小分别为50 mL>75 mL>100 mL>125 mL>25 mL。即在250 mL三角瓶中装液量为50 ~100 mL的条件下,DJ1降解率较高,降解率在67.36%~59.80%。初步表明该菌是兼性厌氧菌,且选取50 mL为最适装液量。
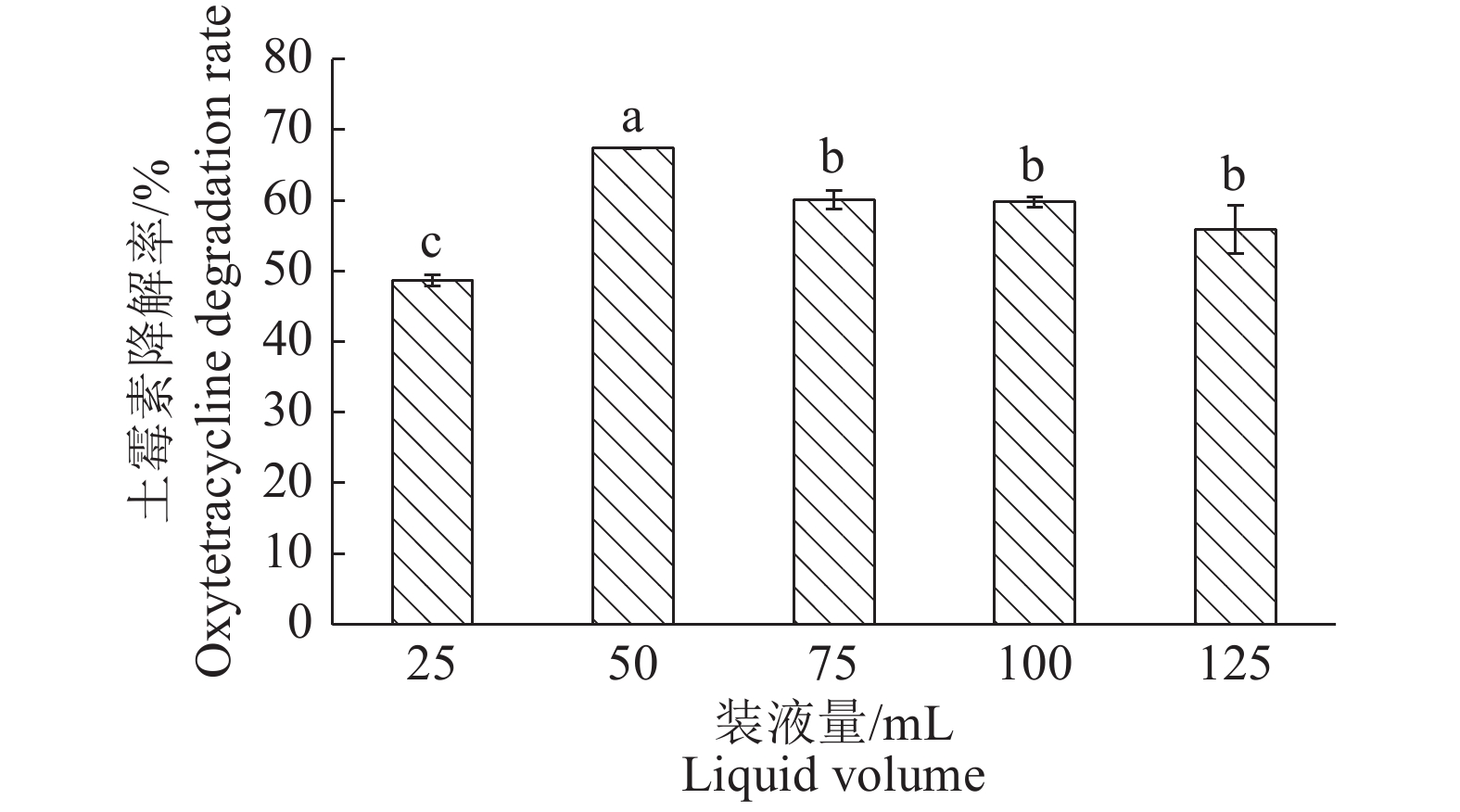
|
图 6 装液量对DJ1菌株降解土霉素的影响 Fig. 6 Effect of substrate volume on the degradation of oxytetracycline by strain DJ1 柱子上方的不同小写字母表示差异显著(P<0.05,Duncan’s法) Different lowercase letters on bars indicate significant differences (P<0.05, Duncan’s method) |
兽药国际协调委员提出土壤中的抗生素生态毒害效应的触发值达到100 µg/kg时,具有一定的生态风险。有研究表明中国农业土壤中残留土霉素的含量范围为0~8 400 µg/kg[20],而水体残留土霉素的浓度一般在µg/kg,甚至是ng/kg级别。本研究中的DJ1菌对土霉素具有较高的耐受性,但综合环境中土霉素残留量的因素,本试验选取在0~200 mg/L的底物质量浓度范围内,探索DJ1降解土霉素的效果。如图7所示,土霉素的降解率呈现一个随底物浓度增加而逐渐升高的趋势,当土霉素质量浓度为25 mg/L时,降解率为63.14%,说明DJ1菌株能够耐受高质量浓度的土霉素。且当土霉素质量浓度为200 mg/L时,降解率最高,为78.83%。因此在0~200 mg/L的范围内,选择200 mg/L为最适底物质量浓度。
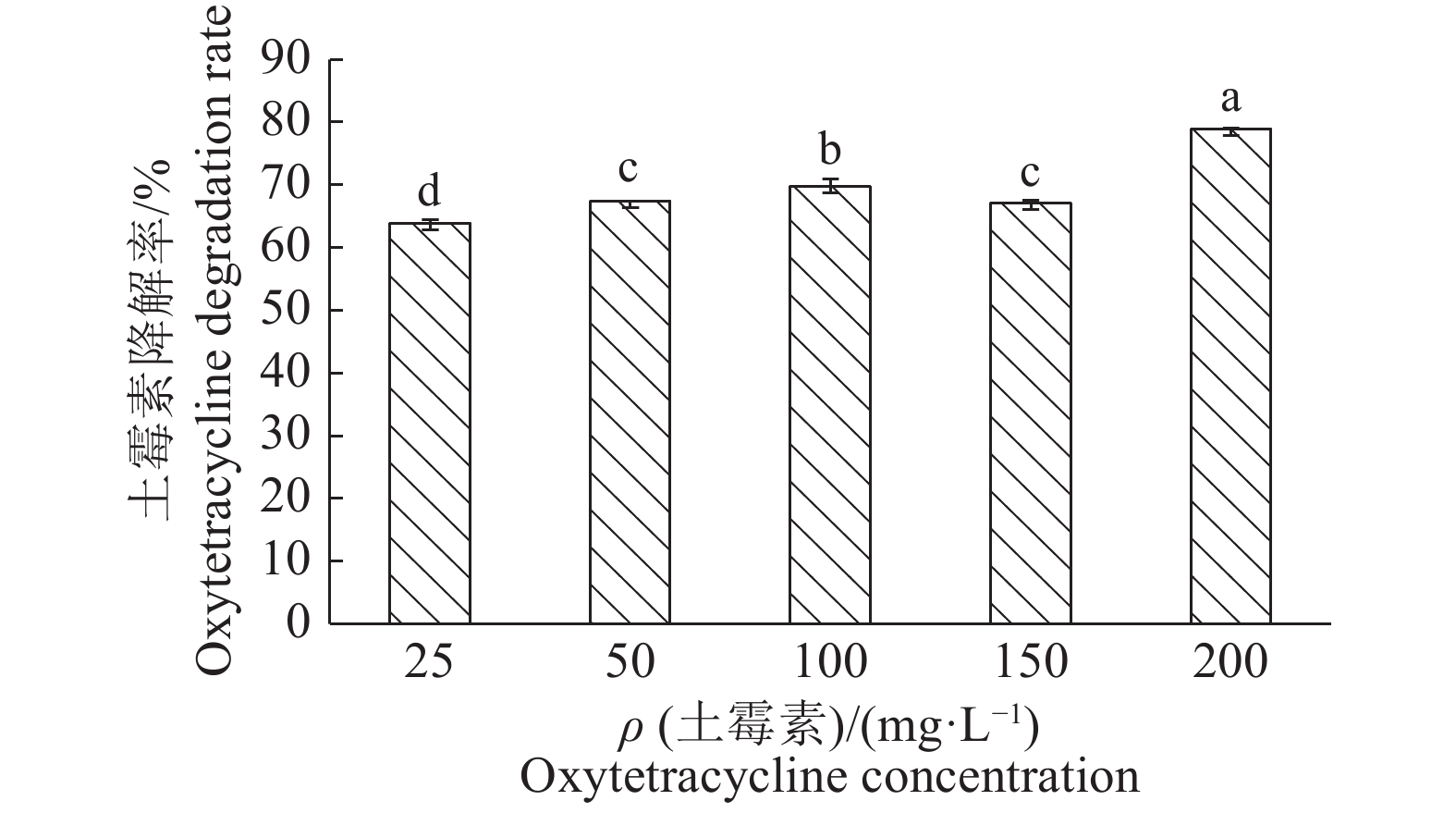
|
图 7 土霉素浓度对DJ1菌株降解土霉素的影响 Fig. 7 Effect of oxytetracycline concentration on the degradation of oxytetracycline by strain DJ1 柱子上方的不同小写字母差异表示显著(P<0.05,Duncan’s法) Different lowercase letters on bars indicate significant differences (P<0.05, Duncan’s method) |
由图8可知,在含有50 mg/L土霉素的培养基中,与没有加铜、锌离子的空白对照相比,Cu2+稍微促进了DJ1对土霉素的降解,降解率为71.58%,但效果不显著,Zn2+则抑制了DJ1对土霉素的降解;在含有200 mg/L土霉素的培养基中,Cu2+抑制了土霉素的降解。因重金属对微生物的生长起着重要的作用,尤其铜、锌离子是饲料中主要的重金属,因此这在实际应用中很有意义。
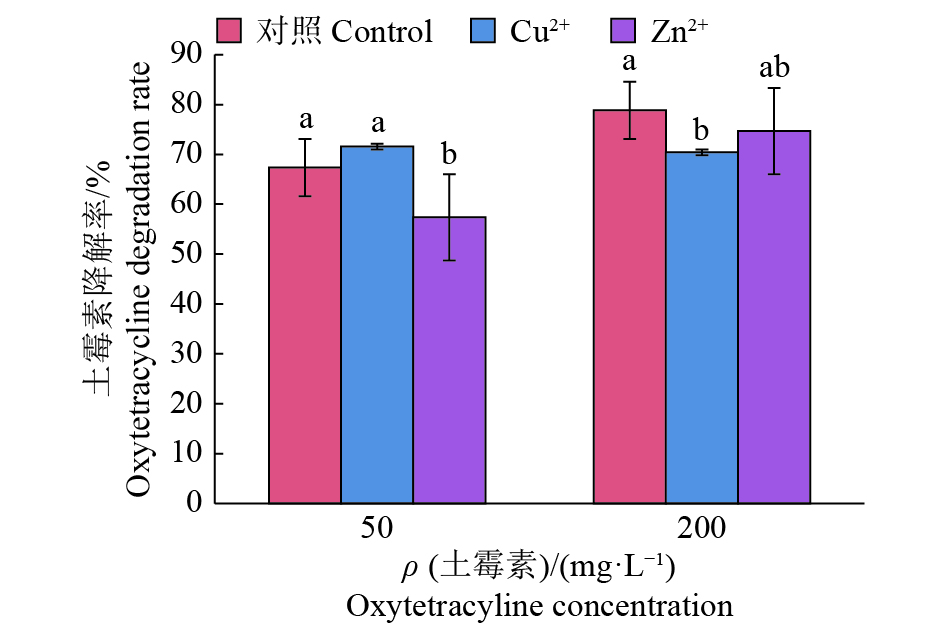
|
图 8 铜、锌离子对DJ1菌株降解土霉素的影响 Fig. 8 Effect of Cu2+ and Zn2+ on the degradation of oxytetracycline by strain DJ1 |
环境中存在的重金属离子会改变抗生素污染物的生态危害,并最终影响环境污染的治理和防护。本文从养殖废水中筛选出1株耐重金属铜、锌离子的土霉素降解菌C. cutaneum。从养殖废水中筛选降解菌,是因为这类污染物残留的抗生素会对繁殖的微生物产生胁迫,只有具有强耐受抗生素性质的微生物才能得以生存,故更能从其中筛选出降解菌。有研究表明,光解抗生素产生的产物毒性高于亲本化合物[21],相比之下,利用真菌漆酶降解的抗生素则毒性较低[22]。故从环境角度来看,微生物降解抗生素比物理化学的过程更可取,因为它降低了抗生素的生物活性。目前关于四环素类抗生素降解菌,国内外已有些报道。Huang等[23]从药厂分离出降解四环素高效酵母菌,对600 mg/L的四环素降解率最高可达83.63%。王志强等[24]从某污水池底泥中分离出土霉素降解菌蜡样芽孢杆菌Bacillus cereus。黄建凤等[25]研究装液量对蜡样芽孢杆菌降解土霉素的影响时发现,在250 mL三角瓶中采用100 mL的装液量时的降解率比50 mL和150 mL的都要高,此时降解率为56.2%。Qi等[26]研究了Cu2+、Fe2+对土霉素降解的影响,结果表明Fe2+显著促进了土霉素的降解,而Cu2+并不明显。而于浩等[27]研究发现Cu2+能促进短波单胞菌属Brevundimonas sp.对土霉素的降解。有研究报道C. cutaneum是一种产油酵母,具有降解木质素来源抑制物及弱酸、呋喃醛、酚醛等的能力[28],而鲜见C. cutaneum降解土霉素的报道。本研究从pH、温度、接种量、装液量、底物质量浓度等方面研究了DJ1菌株的降解特性,探寻最适的降解条件。但在实际应用中受到的影响因素更多,还需进一步探讨其影响机制和降解机理。本文还检测了DJI菌株的MIC,发现其对抗生素和重金属都有较强的耐受性,在后续的研究中初步检测到DJI菌株具有tet(A)、tet(c)、tet(M)、tet(Q)这4种耐药基因,使其对四环素类抗生素表现出较强的抗性(未发表数据),因此,DJ1可作为研究抗生素和重金属复合污染的模式菌株。
综上所述,菌株DJ1是一种新发现的能降解土霉素的微生物资源,对于保护生态平衡及对畜牧业的可持续发展均具有重要的科学意义和应用价值。
4 结论1)本研究在铜、锌离子的胁迫下筛选出1株降解土霉素的菌株DJ1,经18S rDNA鉴定后为酵母菌Cutaneotrichosporon cutaneum,GenBank登录号为MN809497。
2)菌株DJ1在pH7、温度30 ℃,装液量50 mL(使用250 mL三角瓶),底物质量浓度200 mg/L,接种量为1%(φ)的条件下,培养5 d后对土霉素的降解率为78.83%。在含50 mg/L土霉素的培养基中,添加Zn2+抑制了土霉素的降解,在含200 mg/L土霉素的培养基中,添加Cu2+抑制了土霉素的降解。
3)菌株DJ1对四环素类抗生素和铜、锌离子有较高的耐性,具有重金属铜、锌与抗生素的交叉耐性。
| [1] |
HVISTENDAHL M. Public health. China takes aim at rampant antibiotic resistance[J]. Science, 2012, 336(6083): 795. DOI:10.1126/science.336.6083.795 (  0) 0) |
| [2] |
ZHANG Q Q, YING G G, PAN C G, et al. Comprehensive evaluation of antibiotics emission and fate in the river basins of China: Source analysis, multimedia modeling, and linkage to bacterial resistance[J]. Environ Sci Technol, 2015, 49(11): 6772-6782. DOI:10.1021/acs.est.5b00729 (  0) 0) |
| [3] |
ZHANG H, LUO Y, ZHOU Q X. Research advancement of eco-toxicity of tetracycline antibiotics[J]. J Agro-Environ Sci, 2008, 27(2): 407-413. (  0) 0) |
| [4] |
邰义萍, 莫测辉, 李彦文, 等. 东莞市蔬菜基地土壤中四环素类抗生素的含量与分布[J]. 中国环境科学, 2011, 31(1): 90-95. (  0) 0) |
| [5] |
KUMMERER K. Antibiotics in the aquatic environment-A review-Part II[J]. Chemosphere, 2009, 75(4): 417-434. DOI:10.1016/j.chemosphere.2008.11.086 (  0) 0) |
| [6] |
那广水, 陈彤, 张月梅, 等. 中国北方地区水体中四环素族抗生素残留现状分析[J]. 中国环境监测, 2009, 25(6): 78-80. DOI:10.3969/j.issn.1002-6002.2009.06.022 (  0) 0) |
| [7] |
陈小燕, 牛玉玲, 朱敏, 等. 固相萃取−高效液相色谱法测定牛奶中四环素类抗生素[J]. 中国抗生素杂志, 2017, 42(2): 129-133. DOI:10.3969/j.issn.1001-8689.2017.02.009 (  0) 0) |
| [8] |
陈智学. 土霉素对酶活性及微生物群落代谢的影响[D]. 杨凌: 西北农林科技大学, 2013.
(  0) 0) |
| [9] |
WANG Y, ZHANG H, ZHANG J H, et al. Degradation of tetracycline in aqueous media by ozonation in an internal loop-lift reactor[J]. J Hazard Mater, 2011, 192(1): 35-43. (  0) 0) |
| [10] |
杨旭, 刘美娇, 林深, 等. 限进材料固相萃取−高效液相色谱在线联用检测牛奶中四环素类抗生素残留[J]. 分析化学, 2016, 44(1): 146-151. (  0) 0) |
| [11] |
CONZUELO F, GAMELLA M, CAMPUZANO S, et al. Disposable amperometric magneto-immunosensor for direct detection of tetracyclines antibiotics residues in milk[J]. Anal Chem Acta, 2012, 737(15): 29-36. (  0) 0) |
| [12] |
唐礼庆, 何成达, 罗亚红, 等. 四环素类抗生素生产废水处理技术进展[J]. 环境科学与管理, 2006, 31(7): 99-102. DOI:10.3969/j.issn.1673-1212.2006.07.031 (  0) 0) |
| [13] |
孟应宏, 冯瑶, 黎晓峰, 等. 土霉素降解菌筛选及降解特性研究[J]. 植物营养与肥料学报, 2018, 24(3): 720-727. (  0) 0) |
| [14] |
翟辉. 土霉素降解菌的筛选、鉴定及其在污染土壤中的修复模拟[D]. 杨凌: 西北农林科技大学, 2016.
(  0) 0) |
| [15] |
HÖLZEL C S, SCHWAIGER K, HARMS K, et al. Sewage sludge and liquid pig manure as possible sources of antibiotic resistant bacteria[J]. Environ Res, 2010, 110(4): 318-326. DOI:10.1016/j.envres.2010.02.009 (  0) 0) |
| [16] |
刘爱民. 微生物学实验[M]. 合肥: 安徽人民出版社, 2009: 120-138.
(  0) 0) |
| [17] |
ARIKAN O, MULBRY W, INGRAM D, et al. Minimally managed composting of beef manure at the pilot scale: Effect of manure pile construction on pile temperature profiles and on the fate of oxytetracycline and chlortetracycline[J]. Bioresour Technol, 2009, 100(19): 4447-4453. DOI:10.1016/j.biortech.2008.12.063 (  0) 0) |
| [18] |
赵永斌. 3种四环素类抗生素降解菌的筛选及降解特性的研究[D]. 太谷: 山西农业大学, 2015.
(  0) 0) |
| [19] |
LENG Y, BAO J, CHANG G, et al. Biotransformation of tetracycline by a novel bacterial strain Stenotrophomonas maltophilia DT1
[J]. J Hazard Mater, 2016, 318: 125-133. DOI:10.1016/j.jhazmat.2016.06.053 (  0) 0) |
| [20] |
曾巧云, 丁丹, 檀笑. 中国农业土壤中四环素类抗生素污染现状及来源研究进展[J]. 生态环境学报, 2018, 27(9): 194-202. (  0) 0) |
| [21] |
GUO R X, CHEN J Q. Phytoplankton toxicity of the antibiotic chlortetracycline and its UV light degradation products[J]. Chemosphere, 2012, 87(11): 1254-1259. DOI:10.1016/j.chemosphere.2012.01.031 (  0) 0) |
| [22] |
SUDA T, HATA T, KAWAI S, et al. Treatment of tetracycline antibiotics by laccase in the presence of 1-hydroxybenzotriazole[J]. Bioresour Technol, 2012, 103(1): 498-501. DOI:10.1016/j.biortech.2011.10.041 (  0) 0) |
| [23] |
HUANG X, ZHANG X, FENG F, et al. Biodegradation of tetracycline by the yeast strain Trichosporon mycotoxinivorans XPY-10
[J]. Prep Biochem Biotechnol, 2016, 46(1): 15-22. DOI:10.1080/10826068.2014.970692 (  0) 0) |
| [24] |
王志强, 张长青, 王维新. 土霉素降解菌的筛选及其降解特性研究[J]. 中国兽医科学, 2011, 41(5): 536-540. (  0) 0) |
| [25] |
黄建凤, 张发宝, 逄玉万, 等. 1株四环素降解菌的分离鉴定及降解特性研究[J]. 微生物学杂志, 2017, 37(1): 50-56. DOI:10.3969/j.issn.1005-7021.2017.01.008 (  0) 0) |
| [26] |
QI W, LONG J, FENG C, et al. Fe3+ enhanced degradation of oxytetracycline in water by pseudomonas
[J]. Water Res, 2019, 160: 361-370. DOI:10.1016/j.watres.2019.05.058 (  0) 0) |
| [27] |
于浩, 李晔, 程全国. 土霉素降解菌的筛选及其降解条件优化[J]. 沈阳大学学报(自然科学版), 2017, 29(1): 21-25. (  0) 0) |
| [28] |
WANG J, GAO Q, ZHANG H, et al. Inhibitor degradation and lipid accumulation potentials of oleaginous yeast Trichosporon cutaneum using lignocellulose feedstock
[J]. Bioresour Technol, 2016, 218: 892-901. DOI:10.1016/j.biortech.2016.06.130 (  0) 0) |
 2020, Vol. 41
2020, Vol. 41


