2. 广东省农业科学院 动物卫生研究所/广东省兽医公共卫生公共实验室,广东 广州 510640
2. Institute of Animal Health, Guangdong Academy of Agricultural Sciences/ Guangdong Open Laboratory of Veterinary Public Health, Guangzhou 510640, China
动物流行性出血病(Epizootic haemorrhagic disease,EHD)是由流行性出血病病毒(Epizootic haemorrhagic disease virus,EHDV)通过吸血库蠓Culicoides spp.进行传播的一种动物虫媒病毒病[1]。EHDV可感染多种野生与家养反刍动物,南美洲、北美洲、欧洲、亚洲、非洲、大洋洲均有EHD疫情报道[1-3]。白尾鹿(White tail deer)与不同品种的牛对EHDV均具有很高的易感性。牛感染EHDV后可表现发热,鼻孔和嘴唇发红、结痂,鼻腔和眼睛有分泌物,口腔炎,流涎,跛行,口腔、鼻腔糜烂,呼吸困难[2-3]。妊娠期母牛出现早产与流产,奶牛产奶量急剧减少。近年来EHD多次在中东地区的牛群中暴发,引起了国际上的高度重视[4]。
EHDV属呼肠孤病毒科Reoviridae环状病毒属Orbivirus,病毒基因组由10个大小不同的双链RNA节段(Seg-1~Seg-10)组成[5]。EHDV的外层衣壳由VP2(Seg-2编码)与VP5(Seg-6编码)蛋白构成,VP2是诱导EHDV血清型特异性中和抗体的主要蛋白,决定病毒的血清型;VP5可影响VP2蛋白的构象,进而影响中和抗体的产生[6-7]。Seg-2/VP2与Seg-6/VP5序列在不同血清型EHDV之间高度变异,不同血清型毒株之间核酸序列差异可达55%,氨基酸序列差异可达70%[6]。根据Seg-2与Seg-6的序列变异,可将其分为A~D 4种基因群(Group)[8]。Seg-3编码EHDV的内层衣壳蛋白VP3,具有高度保守性,由于三联密码子第3位的沉默突变,Seg-3核酸序列在不同地域的分离毒株间存在一定差异。系统发生树分析显示,世界范围的EHDV分Eastern与Western 2种地域型(Topotype)[8],分离自中国、日本和澳大利亚的毒株属Eastern型,分离自北美洲、南美洲和欧洲的毒株属Western型[8]。
目前世界范围内报道了9种血清型的EHDV(EHDV-1、-2、-4、-5、-6、-7、-8、-9和-10)[1, 9-10]。近年来EHDV-6型在中东地区土耳其、非洲阿尔及利亚与摩洛哥的牛群中多次引起疫病暴发和流行[3],特别是2015年EHDV-6型在日本的牛群中再次引起疫病暴发[11],提示我国很可能也将面临EHDV-6型引起的疫病的威胁。2012年,我们在全国范围内开展了EHDV的血清学调查,在内蒙古、广东、广西和云南的牛群中均监测到EHDV-6型特异性中和抗体[12-14],表明该血清型病毒在我国南方与北方均呈广泛流行趋势。分离我国流行的EHDV-6型毒株并掌握病毒的遗传背景,对我国EHD的防控具有重要意义。2012—2016年,本研究在云南省和广东省设立的哨兵动物上分离到多株EHDV-6型毒株,为开展我国流行EHDV-6型毒株的病原学与流行病学特征分析、掌握国内外EHDV-6型毒株之间的关系提供了宝贵的材料。本文对2012—2016年我国云南省和广东省EHDV-6型毒株的分离及病毒的序列特征进行了报道,研究结果为我国开展EHDV-6病原学诊断、流行病学和致病性研究等提供了基础。
1 材料与方法 1.1 主要试剂MagMAX-96病毒RNA分离试剂盒购自Thermo公司,胎牛血清与MEM细胞培养基购自Gibco公司,一步法RT-PCR扩增试剂盒与一步法qRT-PCR扩增试剂盒购自大连宝生物公司,病毒RNA/DNA提取试剂盒与DNA胶回收试剂盒购自天根生物科技有限公司。
1.2 细胞、毒株与标准阳性血清BHK-21细胞与C6/36细胞均由云南省畜牧兽医科学院热带亚热带动物病毒病重点实验室保存。6种EHDV血清型(EHDV-1、-2、-5、-6、-7、-8)参考毒株由澳大利亚麦克阿瑟−伊丽莎白农业研究所馈赠[15]。使用经纯化灭活处理的EHDV参考毒株免疫日本大耳兔,制备不同血清型EHDV的标准阳性血清,血清中和抗体效价分别为EHDV-1:1∶453、EHDV-2:1∶320、EHDV-5:1∶226、EHDV-6:1∶453、EHDV-7:1∶320、EHDV-8:1∶640[15]。
1.3 引物设计与合成下载GenBank公布的EHDV-6型毒株序列,使用Oligo 7.0分别设计扩增该毒株Seg-2、Seg-3与Seg-6节段的3对引物,扩增产物大小分别为913、1 095与1 149 bp(表1),引物由上海捷瑞公司合成。
|
|
表 1 中国EHDV-6型分离毒株Seg-2、Seg-3与Seg-6节段扩增引物 Table 1 Primers for amplifying Seg-2, Seg-3 and Seg-6 of EHDV-6 isolates in China |
在广东省汕头市、云南省师宗县与江城县设立牛羊虫媒病毒监控点,筛选蓝舌病病毒和EHDV抗体检测均为阴性的10头黄牛与5只山羊作为哨兵动物,每年5—12月,每隔1周从哨兵动物上采集常规血、肝素钠抗凝血与EDTA抗凝血,采用云南省畜牧兽医科学院热带亚热带动物病毒病重点实验室建立的牛羊虫媒病毒高通量核酸检测方法进行检测,对阳性样品进行病毒分离。
1.5 病毒分离与鉴定取采集的血液样本分别进行血清分离与红细胞离心收集。采用朱建波等[16]建立的EHDV群特异性抗体C-ELISA检测方法与杨振兴等[17]报道的基于EHDV群特异性保守基因Seg5建立的EHDV群特异性高通量qRT-PCR方法分析哨兵动物中EHDV的感染情况。取EHDV核酸阳性且抗体未转阳的动物血液,参照李占鸿等[10]报道的EHDV分离程序,用PBS缓冲液将红细胞洗涤1次后加入灭菌水进行裂解,取500 μL红细胞裂解液接种BHK-21细胞连续盲传培养,逐日观察细胞病变。待出现明显细胞病变后,取200 μL细胞培养液提取核酸,通过EHDV群特异性qRT-PCR对分离的病毒进行鉴定[17]。
1.6 血清中和试验将待鉴定病毒进行10倍梯度稀释后接种96孔板培养的BHK-21细胞,通过Karber法测定病毒的TCID50。参照Batten等[18]报道的方法进行血清中和试验:将不同血清型EHDV的标准阳性血清进行1∶16至1∶1 024倍比稀释,在96孔板中加入50 μL稀释的血清与100个TCID50的待检病毒,在37 ℃条件下作用1 h,然后转至4 ℃孵育过夜;第2天每孔分别加入50 μL密度为2×105/mL的BHK-21细胞;37 ℃条件下培养4~6 d后,观察细胞病变,计算血清对病毒的中和指数。
1.7 EHDV毒株Seg-2、Seg-3与Seg-6节段RT-PCR扩增与测序提取分离EHDV毒株的核酸,于94 ℃变性3 min后立即冰浴。分别取5 μL变性后的核酸为模板,使用表1的引物对,通过一步法RT-PCR进行EDHV毒株Seg-2、Seg-3与Seg-6的扩增。反应体系:2×1 Step Buffer 25 μL,PrimeScript 1 Step Enzyme Mix 2 μL,上游引物(10 μmol/L) 2 μL,下游引物(10 μmol/L) 2 μL,核酸模板 5 μL,加入无RNA酶水补齐至50 μL。反应条件:50 ℃逆转录30 min;94 ℃灭活逆转录酶2 min;94 ℃预变性30 s,55 ℃退火30 s,72 ℃延伸90 s,35个循环。对PCR产物进行电泳胶回收,以PCR扩增的上下游引物作为测序引物,对纯化后的DNA进行双向测序。
1.8 序列分析与系统发生树构建使用DNASTAR软件(Ver 6.0)进行序列拼接,并通过BioEdit软件进行核酸与氨基酸序列的比对分析,核酸与氨基酸序列相似度以平均值±标准差表示。利用MEGA 7.0构建系统发生树,建树方法为邻近法(Neighbor-joining method),选择遗传距离模式(P-distance),自举检验(Bootstrap)取值500[19]。
2 结果与分析 2.1 病毒的分离与鉴定2012—2016年,在我国云南省和广东省相继分离出25株EHDV毒株,对分离毒株进行EHDV群特异性qRT-PCR检测,样品核酸Ct值为18~25。经过血清中和试验鉴定出分离的EHDV血清型包括EHDV-1、-5、-6、-7与-10型5种。EHDV-6型血清共计分离出11株毒株:云南省师宗县5株、云南省江城县1株、广东省汕头市5株(表2)。
|
|
表 2 中国EHDV-6型毒株分离信息表 Table 2 Information of EHDV-6 strains isolated in China |
师宗县2014年未分离到EHDV-6型毒株,2012、2013、2015与2016年均分离出EHDV-6型,表明EHDV-6型在师宗县处于长期流行趋势。除EHDV-6型外,师宗县还分离出EHDV-1、-5、-7与-10型4种血清型毒株,江城县分离出EHDV-1、-5与-7型 3种血清型毒株,表明了云南省流行的EHDV血清型的多样性。广东省汕头市2013年分离出EHDV-1型毒株,2016年连续分离出5株EHDV-6型毒株,未分离到EHDV-1型毒株,表明EHDV-6型可能替代EHDV-1型成为该地区的主要流行血清型。
2.2 EHDV-6型毒株Seg-2、Seg-3与Seg-6的RT-PCR扩增将Seg-2、Seg-3与Seg-6测序结果进行BLAST比对分析,显示中国EHDV-6型毒株Seg-2、-6序列与世界范围EHDV-6型毒株核酸序列相似性最高(>85%),表明我们成功完成了中国11株EHDV-6型毒株Seg-2、Seg-3与Seg-6的测序。
2.3 EHDV-6型毒株Seg-2的序列分析中国不同时间、地域分离的EHDV-6型毒株的Seg-2/VP2序列具有高度保守性,核酸与氨基酸序列相似性均为99.1%。EHDV毒株Seg-2序列的系统发生树显示不同血清型EHDV的Seg-2分为A~D 4种基因群,世界范围分离的EHDV-6、-8型毒株属B群[8, 20]。随着中国EHDV-6型毒株序列加入,世界范围EHDV-6的Seg-2明显分为Eastern与Western 2种地域型(图1):分离自中国、日本、澳大利亚、美国与法国的海外行政区(瓜德罗普岛与马提尼克岛)的EHDV-6型毒株均属Eastern型,来自中东地区与非洲的EHDV-6型共同构成Western型。中国与日本分离的EHDV-6型毒株具有最近的亲缘关系,Seg-2/VP2序列核酸与氨基酸序列相似性高达98.5%和98.9%;与澳大利亚和美国EHDV-6型毒株亲缘关系较远;与非洲和中东地区毒株亲缘关系最远(图1、表3)。
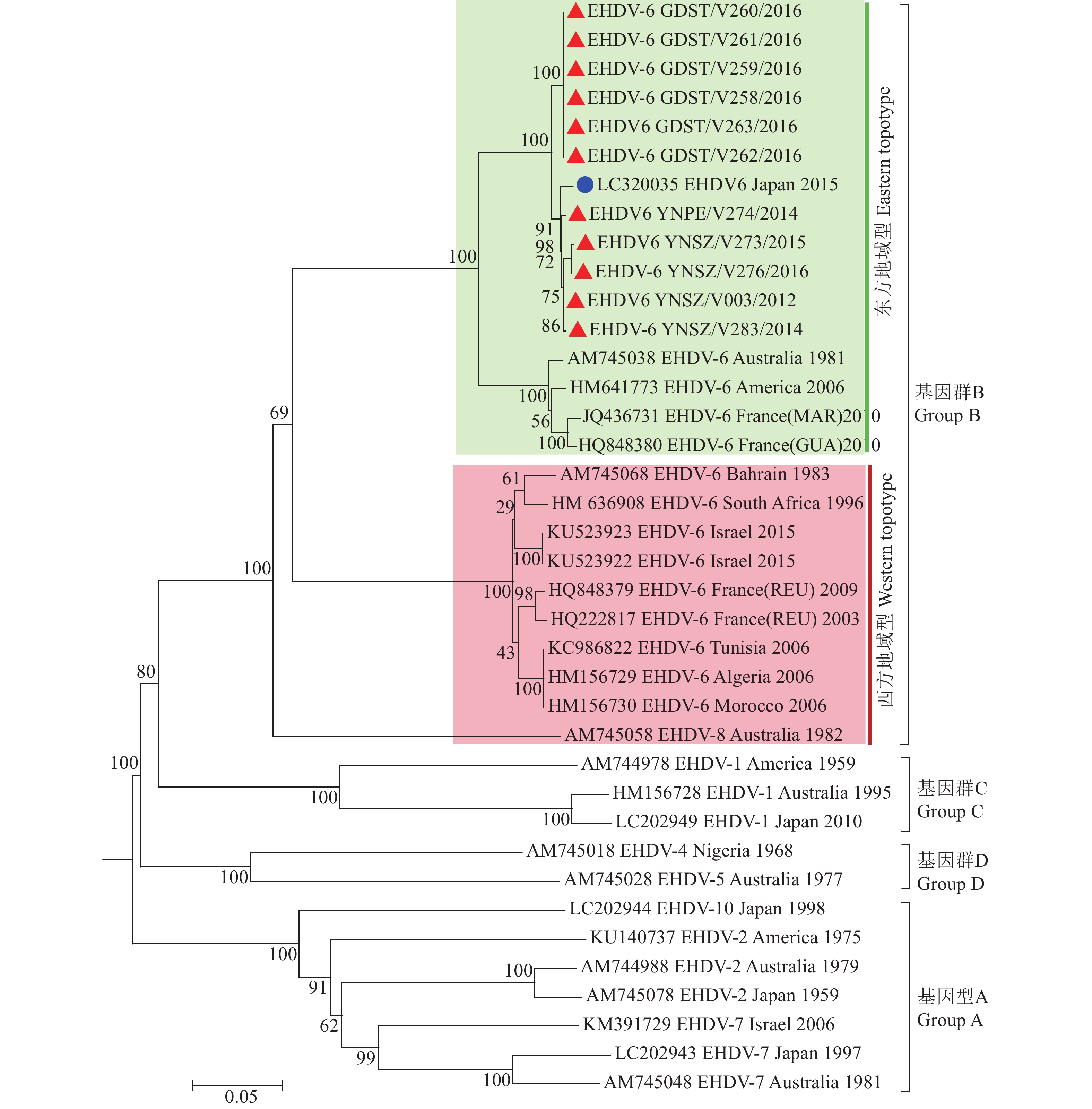
|
图 1 邻近法构建的EHDV-6型毒株Seg-2系统发生树 Fig. 1 Phylogenetic tree of Seg-2 of EHDV-6 strain contructed by Neighbor-joining method “▲”表示本研究获取的中国EHDV-6型毒株序列,“●”表示与中国EHDV-6型毒株具有最近亲缘关系的日本毒株序列 “▲” indicated sequence of Chinese EHDV-6 strain isolated in this study, “●” indicated sequence of Japanese strain that had the closest relationship with Chinese EHDV-6 strain |
|
|
表 3 世界范围内EHDV-6型毒株Seg-2/VP2、Seg-3/VP3和Seg-6/VP5核酸与氨基酸序列相似性1) Table 3 Nucleic acid and amino acid sequence similarities among Seg-2/VP2, Seg-3/VP3 and Seg-6/VP5 of EHDV-6 strains around the world |
与EHDV的Seg-2系统发生树中观察到的情况相似,不同血清型EHDV的Seg-6也分为A~D 4种基因群,世界范围分离的EHDV-6、-8型毒株同属B群[8, 20];EHDV-6型毒株的Seg-6分为Eastern与Western 2种地域型:中国、澳大利亚、美国分离的EHDV-6型毒株均属Eastern型,中东与非洲分离的EHDV-6型毒株属Western型(图2)。中国不同时间、地域分离的EHDV-6型毒株的Seg-6/VP5核酸与氨基酸序列相似性分别为98.8%和99.9%(表3)。由于GenBank中缺少日本EHDV-6型毒株Seg-6序列信息,中国毒株的Seg-6在Eastern地域型中形成1个独立的支系,与澳大利亚和美国分离的毒株具有最近的亲缘关系,与非洲和中东地区的EHDV-6型毒株亲缘关系最远(图2、表3)。
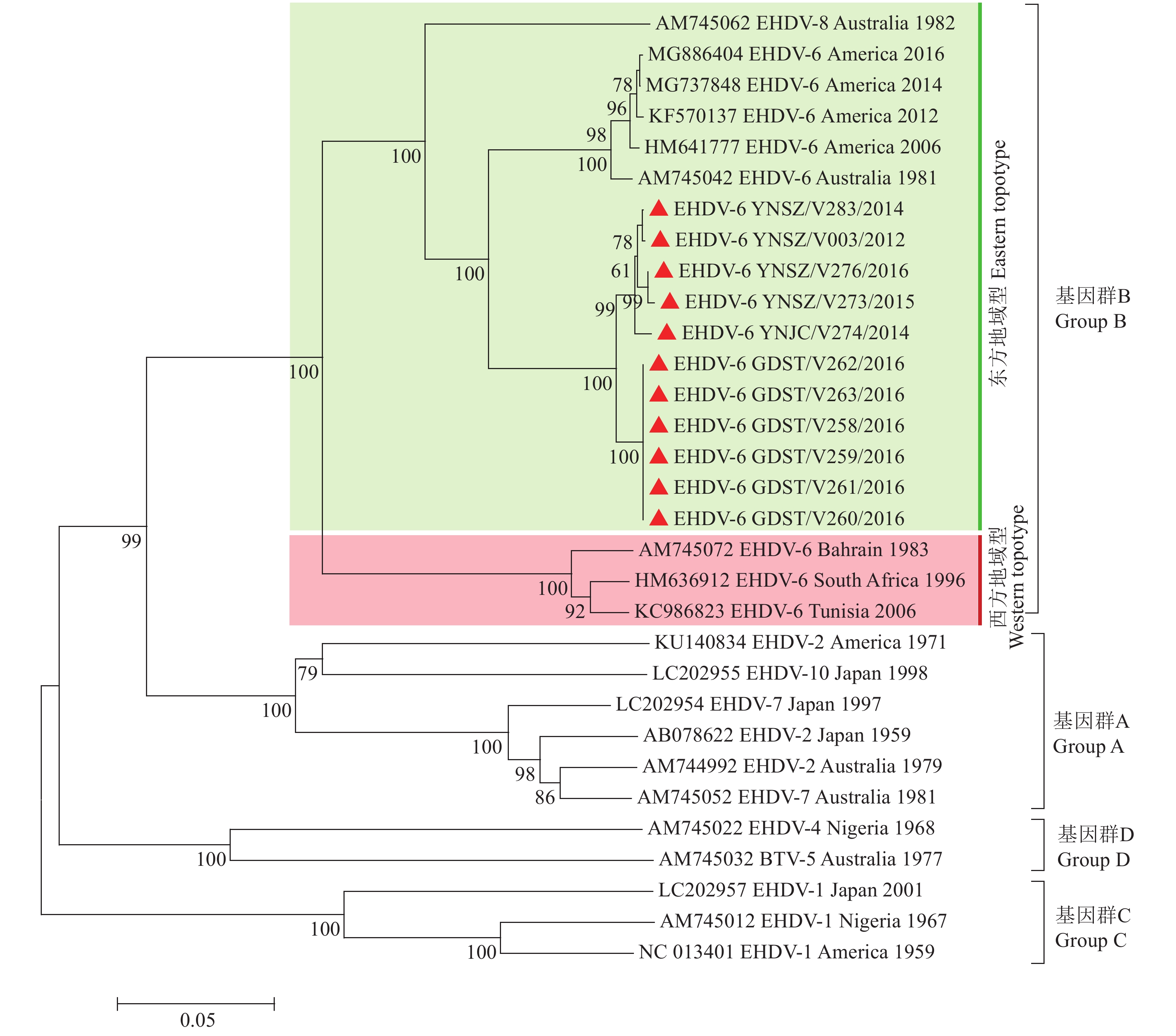
|
图 2 邻近法构建的EHDV-6型毒株Seg-6系统发生树 Fig. 2 Phylogenetic tree of Seg-6 of EHDV-6 strain constructed by Neighbor-joining method “▲”表示本研究获取的中国EHDV-6型毒株序列 “▲” indicated sequence of Chinese EHDV-6 strain isolated in this study |
此次分离的EHDV-6型毒株的Seg-3/VP3序列高度保守,核酸与氨基酸序列相似性分别为98.9%和99.9%。系统发生树显示,世界范围分离的EHDV的Seg-3序列可分为Western与Eastern型。中国与澳大利亚、日本分离的EHDV-6型毒株毒株均属于Eastern型,美国、中东地区和非洲分离的EHDV毒株构成Western型(图3)。中国和日本分离的EHDV-6型毒株具有最近的亲缘关系,核酸与氨基酸序列相似性分别高达93.9%和99.6%;中国与其他Eastern毒株Seg-3/VP3核酸与氨基酸序列相似性分别为92.5%、99.8%;与Western型毒株的亲缘关系最远(图3、表3)。
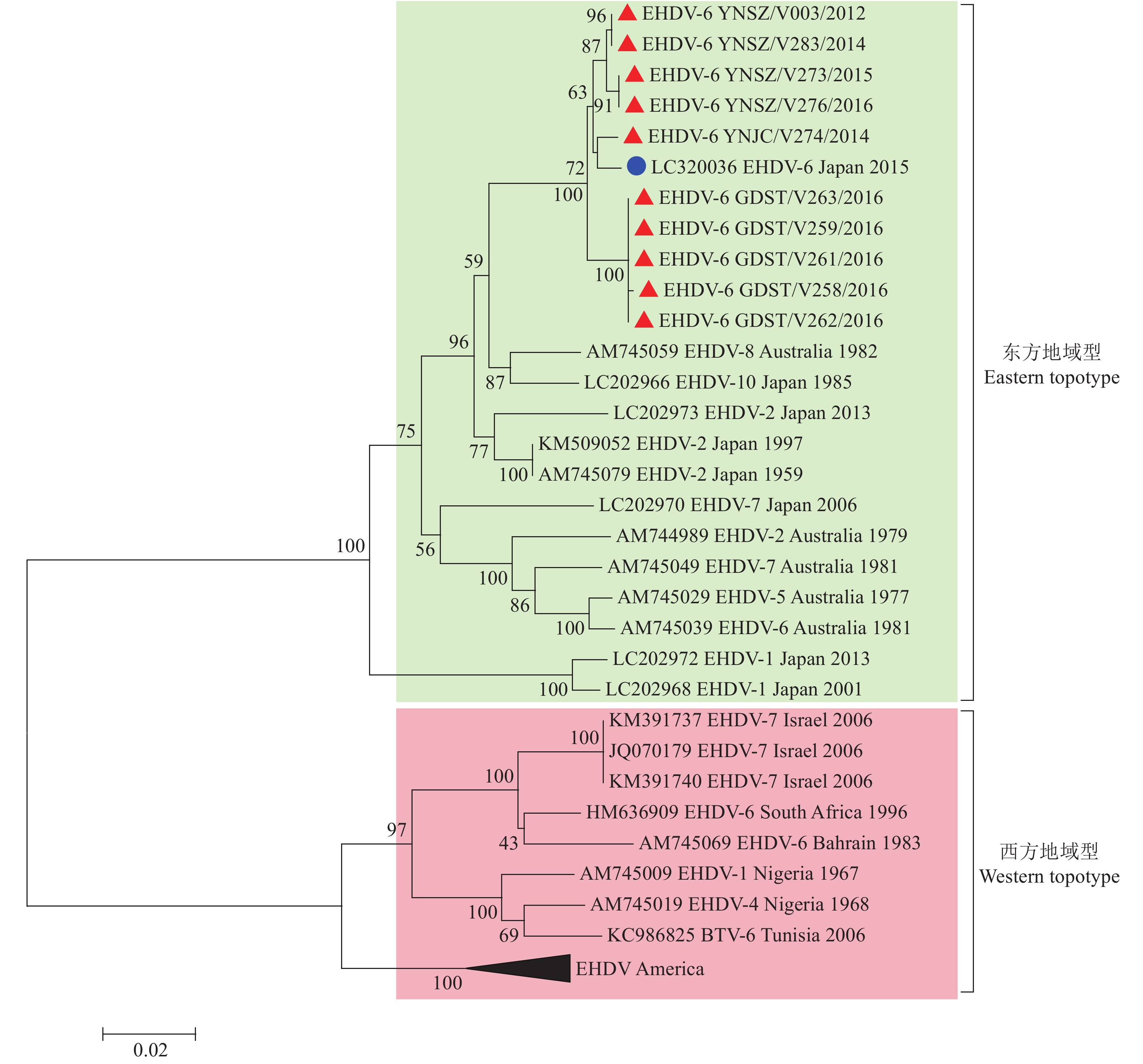
|
图 3 邻近法构建的EHDV-6型毒株Seg-3系统发生树 Fig. 3 Phylogenetic tree of Seg-3 of EHDV-6 strain constructed by Neighbor-joining method “▲”表示本研究获取的中国EHDV-6型毒株序列,“●”表示与中国EHDV-6型毒株具有最近亲缘关系的日本毒株序列 “▲” indicated sequence of Chinese EHDV-6 strain isolated in this study, “●” indicated sequence of Japanese strain that had the closest relationship with Chinese EHDV-6 strain |
EHDV血清型众多,不同血清型毒株对牛的致病性存在较大差异。前期研究认为仅EHDV-2型的其中1个毒株——茨城病病毒(Ibaraki virus,IBAV)对牛有较强致病性[21]。近年来EHDV-6多次在世界多个国家地区的牛群与野生鹿群中引发疫病,如非洲阿尔及利亚(2006年)与突尼斯(2015年)、南美洲留尼汪岛(2003年)与法属圭那亚(2012年)、美国(2016年)、土耳其(2007年)以及日本(2015年)[22-24],引起世界动物卫生组织(OIE)的高度重视。我国是世界上牛羊养殖业大国,2017年肉牛存栏量达7 441万头,奶牛存栏量达1 340万头。面对近年来EHDV-6型在世界范围引起的疫情,掌握EHDV-6型毒株遗传背景及在我国的流行情况,积极开展相应的预防工作,防患于未然,对保障我国肉牛与奶牛行业的安全生产具有十分重要的意义。
从前期血清学调查结果来看,我国北方地区(内蒙古)与南方地区(云南、广东、广西)均有EHDV-6的活动[12-14]。2012—2016年,本研究在云南和广东分离出11株EHDV-6型毒株,一方面为EHDV-6型在我国的流行提供了直接证据,更为深入开展我国EHDV-6型病原学与流行病学研究提供了基础。我国云南与广东流行的EHDV-6型毒株Seg-2/VP2、Seg-3/VP3和Seg-6/VP5核酸与氨基酸序列高度相似,在系统发生树上聚为1个相对独立的进化分支,表明我国云南与广东流行的EHDV-6型毒株来源于同一个祖先病毒,在我国特有的生态环境中演化形成了具有地域特征的EHDV-6型中国支系。日本2015年分离的EHV-6型毒株[11]与中国毒株Seg-2/VP2序列相似性高达98.5%与98.9%,Seg-3/VP3序列相似性高达98.9%与99.9%,在系统发生树上处于中国EHDV-6支系的内部,表明中国与日本的EHDV-6型毒株具有最近的亲缘关系。在我国南方地区分离的EHDV-10型[10]、蓝舌病[22-23]、阿卡斑病[25]、牛流行热病[26]等牛羊虫媒病毒毒株序列与日本分离的毒株存在高度相似性,在进化上具有最近亲缘关系。中国南方地区与日本相隔甚远,两国的虫媒病毒序列高度相似和亲缘关系高度相近的机制值得进一步研究。
本研究首次报道了2012—2016年11株EHDV-6型毒株在我国云南和广东省的分离与遗传特征,研究结果为开展我国EHDV-6遗传特性、致病性、病原学诊断与疫苗制备等研究提供了基础。后续将对我国EHDV-6型代表毒株进行全基因组测序,建立EHDV-6型的血清型特异性病原与抗体的检测技术,在我国北方地区开展EHDV-6型的流行病学调查与病毒分离,为阻断EHDV-6型在我国引起动物疫病暴发提供技术支撑。
| [1] |
SAVINI G, AFONSO A, MELLOR P, et al. Epizootic heamorragic disease[J]. Res Vet Sci, 2011, 91(1): 1-17. DOI:10.1016/j.rvsc.2011.05.004 (  0) 0) |
| [2] |
YADIN H, BRENNER J, BUMBROV V, et al. Epizootic haemorrhagic disease virus type 7 infection in cattle in Israel[J]. Vet Rec, 2008, 162(2): 53-56. DOI:10.1136/vr.162.2.53 (  0) 0) |
| [3] |
TEMIZEL E M, YESILBAG K, BATTEN C, et al. Epizootic hemorrhagic disease in cattle, western Turkey[J]. Emerg Infect Dis, 2009, 15(2): 317-319. DOI:10.3201/eid1502.080572 (  0) 0) |
| [4] |
CORBEL M J, MACMILLAN A P. Office International des Epizooties OIE Manual of standards for diagnostic tests and vaccines[M]. Paris: Office International des Epizooties O.I.E, 2008: 1092-1106.
(  0) 0) |
| [5] |
MERTENS P P C, MAAN S, SAMUEL A, et al. Orbiviruses, Reoviridae[M]. FAUQUET C M, MAYO M A, MANILOFF J, et al. Virus taxonomy: Eighth report of the international committee on taxonomy of viruses. London: Elsevier academic press, 2005: 466-483.
(  0) 0) |
| [6] |
ANTHONY S J, MAAN S, MAAN N, et al. Genetic and phylogenetic analysis of the outer-coat proteins VP2 and VP5 of epizootic haemorrhagic disease virus (EHDV): Comparison of genetic and serological data to characterise the ehdv serogroup[J]. Virus Res, 2009, 145(2): 200-210. DOI:10.1016/j.virusres.2009.07.012 (  0) 0) |
| [7] |
HUISMANS H, BREMER C W, BARBER T L. The nucleic acid and proteins of epizootic haemorrhagic disease virus[J]. Onderstepoort J Vet Res, 1979, 46(2): 95-104. (  0) 0) |
| [8] |
ANTHONY S J, MAAN N, MAAN S, et al. Genetic and phylogenetic analysis of the core proteins VP1, VP3, VP4, VP6 and VP7 of epizootic haemorrhagic disease virus (EHDV)[J]. Virus Res, 2009, 145(2): 187-199. DOI:10.1016/j.virusres.2009.07.011 (  0) 0) |
| [9] |
SHIRAFUJI H, KATO T, YAMAKAWA M, et al. Characterization of genome segments 2, 3 and 6 of epizootic hemorrhagic disease virus strains isolated in Japan in 1985-2013: Identification of their serotypes and geographical genetic types[J]. Infect Genet Evol, 2017, 53: 38-46. DOI:10.1016/j.meegid.2017.05.010 (  0) 0) |
| [10] |
李占鸿, 肖雷, 杨振兴, 等. 牛源流行性出血病病毒(EHDV)血清10型毒株在我国的分离鉴定[J]. 病毒学报, 2019, 35(1): 112-120. (  0) 0) |
| [11] |
YUKA K, MASAHIRO K, YASUYUKI O, et al. Epizootic hemorrhagic disease virus serotype 6 infection in cattle, Japan, 2015[J]. Emerg Infect Dis, 2018, 24(5): 902-905. DOI:10.3201/eid2405.171859 (  0) 0) |
| [12] |
曹颖颖, 吴健敏, 林俊, 等. 广西首例牛源鹿流行性出血热病毒的分离鉴定[J]. 中国预防兽医学报, 2015, 37(10): 746-750. DOI:10.3969/j.issn.1008-0589.2015.10.04 (  0) 0) |
| [13] |
张怡轩, 林俊, 曹颖颖, 等. 广西鹿流行性出血热病毒血清型调查及分布影响分析[J]. 上海畜牧兽医通讯, 2016(4): 19-21. DOI:10.3969/j.issn.1000-7725.2016.04.006 (  0) 0) |
| [14] |
张胜男, 李华春, 朱建波, 等. 2015年内蒙古地区蓝舌病及流行性出血热流行病学调查及血清型鉴定[J]. 中国预防兽医学报, 2016, 38(12): 939-943. (  0) 0) |
| [15] |
杨振兴, 孟锦昕, 肖雷, 等. 流行性出血病病毒(EHDV)血清7型毒株在中国的首次分离与鉴定[J]. 畜牧兽医学报, 2019, 50(3): 150-158. (  0) 0) |
| [16] |
朱建波, 杨振兴, 肖雷, 等. 流行性出血病多克隆抗体C-ELISA检测方法的建立[J]. 畜牧兽医学报, 2018, 49(7): 1440-1450. DOI:10.11843/j.issn.0366-6964.2018.07.013 (  0) 0) |
| [17] |
杨振兴, 朱建波, 李占鸿, 等. 蓝舌病病毒和流行性出血病病毒双重荧光定量RT-PCR检测方法的建立及应用[J]. 中国兽医科学, 2019, 49(9): 1104-1111. (  0) 0) |
| [18] |
BATTEN C A, HENSTOCK M R, BIN-TARIF A, et al. Bluetongue virus serotype 26: Infection kinetics and pathogenesis in Dorset Poll sheep[J]. Vet Microbiol, 2012, 157(1/2): 119-124. (  0) 0) |
| [19] |
TAMURA K, STECHER G, PETERSON D, et al. MEGA6: Molecular evolutionary genetics analysis version 6.0[J]. Mol Biol Evol, 2013, 30(12): 2725-2729. DOI:10.1093/molbev/mst197 (  0) 0) |
| [20] |
MAAN N S, MAAN S, NOMIKOU K, et al. RT-PCR assays for seven serotypes of epizootic haemorrhagic disease virus & their use to type strains from the Mediterranean region and North America[J]. PLoS One, 2010, 5(9): e12782. DOI:10.1371/journal.pone.0012782 (  0) 0) |
| [21] |
ALLISON A B, GOEKJIAN V H, POTGIETER A C, et al. Detection of a novel reassortant epizootic hemorrhagic disease virus (EHDV) in the USA containing RNA segments derived from both exotic (EHDV-6) and endemic (EHDV-2) serotypes[J]. J Gen Virol, 2010, 91(2): 430-439. DOI:10.1099/vir.0.015651-0 (  0) 0) |
| [22] |
LEE F, TING L J, LEE M S, et al. Genetic analysis of two taiwanese bluetongue viruses[J]. Vet Microbiol, 2011, 148(2/3/4): 140-149. (  0) 0) |
| [23] |
YANG H, ZHU J, LI H, et al. Full genome sequence of bluetongue virus serotype 4 from China[J]. J Virol, 2012, 86(23): 13122-13123. DOI:10.1128/JVI.02393-12 (  0) 0) |
| [24] |
BREARD E, BELBIS G, VIAROUGE C, et al. Epizootic hemorrhagic disease virus serotype 6 experimentation on adult cattle[J]. Res Vet Sci, 2013, 95(2): 794-798. DOI:10.1016/j.rvsc.2013.06.026 (  0) 0) |
| [25] |
冯云, 章域震, 杨卫红, 等. 阿卡斑病毒云南分离株全基因组序列特征研究[J]. 病毒学报, 2016, 32(2): 161-169. (  0) 0) |
| [26] |
LIAO Y K, INABA Y, LI N J, et al. Epidemiology of bovine ephemeral fever virus infection in Taiwan[J]. Microbiol Res, 1998, 153(3): 289-295. DOI:10.1016/S0944-5013(98)80014-1 (  0) 0) |
 2020, Vol. 41
2020, Vol. 41


