2. 广州动物园,广东 广州 510070
2. Guangzhou Zoo, Guangzhou 510070, China
星状病毒(Astrovirus)是一种无囊膜二十面体单链正链RNA病毒,于1975年首次在肠炎患儿的粪便中发现,主要引发人和动物的胃肠道疾病[1]。该病毒粒子负染后经透射电子显微镜观察,可见表面具有特征性的五角或六角星状结构,因此命名为星状病毒[2]。该病毒基因组全长为6.1~7.9 kb,基因组结构包括5′UTR、3个开放阅读框(ORF1a、ORF1b和ORF2)及3′UTR、多聚腺苷酸(PolyA)尾。其中ORF1a、ORF1b编码星状病毒的非结构蛋白,包含跨膜域、核定位信号、核糖体移框信号、丝氨酸蛋白酶及RNA依赖性RNA聚合酶(RdRp);ORF2则编码病毒结构蛋白−衣壳蛋白,其全长氨基酸序列可以作为星状病毒种间划分的依据[3]。目前,星状病毒科Astroviridae分2个属:哺乳动物星状病毒属Mamastrovirus和禽类星状病毒属Avastrovirus。哺乳动物感染星状病毒后通常会引起胃肠炎,少数情况下会引起神经综合征和脑炎[4];禽类感染星状病毒后可引起肠炎、肝炎和肾炎等多种疾病[5]。星状病毒在我国哺乳动物及禽类养殖场中普遍存在,在宠物猫狗临床上常与其他病毒发生混合感染。
星状病毒自被发现以来,一直被认为是人和动物胃肠炎的重要病原之一。近年来,随着现代分子检测技术与病原诊断技术的不断进步,越来越多的星状病毒在哺乳动物和禽类中被相继发现。有研究发现星状病毒也可以感染哺乳动物的肠外器官,如脑[6]、肺脏[7]、脾脏[7]、肾脏[7]等,并且高度分化的星状病毒可以越过胃肠道直接感染其他组织或器官[8]。星状病毒感染宿主通常具有种属特异性,然而报道显示该病毒在人和动物上存在跨种传播的现象[9]。目前,星状病毒在世界范围内流行,不仅对经济动物养殖业和珍稀野生动物造成极大损失和危害,也对人类健康产生了巨大的威胁。本研究利用半巢式RT-PCR对1只死亡白狐Alopex lagopus的心脏、肺脏、肝脏及肾脏进行星状病毒RdRp基因的检测,并对扩增鉴定出的病毒株的RdRp基因进行序列测定和分析,以期了解星状病毒的遗传及进化状况,为该病毒的诊断及引发疾病的治疗提供参考。
1 材料与方法 1.1 样品2019年1月采集1只死亡白狐的心脏、肺脏、肝脏及肾脏。
1.2 主要试剂RNAiso Plus购自Takara Bio公司;反转录试剂盒Hiscript 1st Strand cDNA Synthesis Kit、胶回收试剂盒FastPure Gel DNA Extraction Mini Kit购自诺唯赞生物科技股份有限公司(南京);预混酶2×Taq PCR StarMix with Loading Dye购自GeneStar;连接酶pCloneEZ-NRS-Omni-Amp/HC购自中美泰和生物技术(北京)有限公司;感受态细胞DH5α Chemically Competent Cell购自上海唯地技术有限公司。
1.3 引物的设计与合成针对星状病毒RdRp基因的保守区域,参照文献[10]设计引物,预计扩增产物的大小为342 bp,引物由广州天一辉远生物科技有限公司合成。引物序列信息见表1。
|
|
表 1 引物序列信息 Table 1 Primer sequence information |
取50 mg样品加入1 mL RNAiso Plus在液氮匀浆机中充分匀浆,将匀浆液转移至RNase Free管中,室温(15~30 ℃)条件下静置5 min;12 000 r/min、4 ℃条件下离心5 min;小心吸取上清液,转至新的RNase Free管。利用RNAiso Plus对4种样品进行RNA提取,将获得的样品RNA置于−80 ℃保存,备用。
1.5 cDNA的合成反转录体系(总体积为20 μL):样品RNA 7 μL、Random hexamers 1 μL、2×RT Mix 10 μL、HiScript II Enzyme Mix 2 μL。用移液器轻轻吹打混匀,瞬时离心。cDNA合成反应条件:25 ℃ 5 min,50 ℃ 45 min,85 ℃ 2 min。cDNA产物立即用于半巢式RT-PCR反应。
1.6 半巢式RT-PCR检测以合成的cDNA为模版,以asrRdRp2F、asrRdRp1R为第1轮引物进行半巢式扩增。PCR体系(总体积20 μL):样品cDNA 2 μL、上游引物asrRdRp2F 1 μL、下游引物asrRdRp1R 1 μL、2×Taq PCR StarMix with Loading Dye 10 μL、RNase Free ddH2O 6 μL。扩增程序:94 ℃预变性5 min;94 ℃变性30 s,45 ℃退火60 s,72 ℃延伸60 s,共36个循环;72 ℃终延伸10 min。以 asrRdRp2F、asrRdRp2R为第2轮引物,扩增程序与第1轮相同,扩增片段大小约为432 bp。取10 μL扩增产物,用10 g/L琼脂糖凝胶电泳检测。根据RT-PCR检测结果分别分析星状病毒在4种白狐内脏器官中的感染情况。
1.7 目的基因的克隆及测序通过FastPure Gel DNA Extraction Mini Kit试剂盒对阳性扩增产物进行回收,取回收得到的产物与pCloneEZ-NRS-Omni-Amp/HC载体连接,25 ℃条件下反应5 min;将连接产物转化入大肠埃希菌Escherichia coli DH5α感受态细胞中,并接种于含Amp的LB固体培养基中,37 ℃条件下恒温培养12 h;挑取单个菌落接种于1 mL含Amp的营养肉汤培养基中,37 ℃条件下摇床震荡培养6 h。取试剂盒提供的M13F/M13R作为鉴定重组子的引物,取2 μL菌液作为模板进行菌液PCR;将鉴定为阳性的菌液送至广州天一辉远生物科技有限公司测序。
1.8 系统进化树的构建及相似性分析测序结果经DNASTAR Version 7.1拼接后与GenBank上发表的FAstV-K40、GZBY-128、FL-2007等9株病毒分离株进行比较,通过Lasergene DNASTARTM 5.06软件进行序列比对与相似性分析,使用MEGA 7.0软件采用邻接法(Neighbor-Joining method)构建系统进化树。
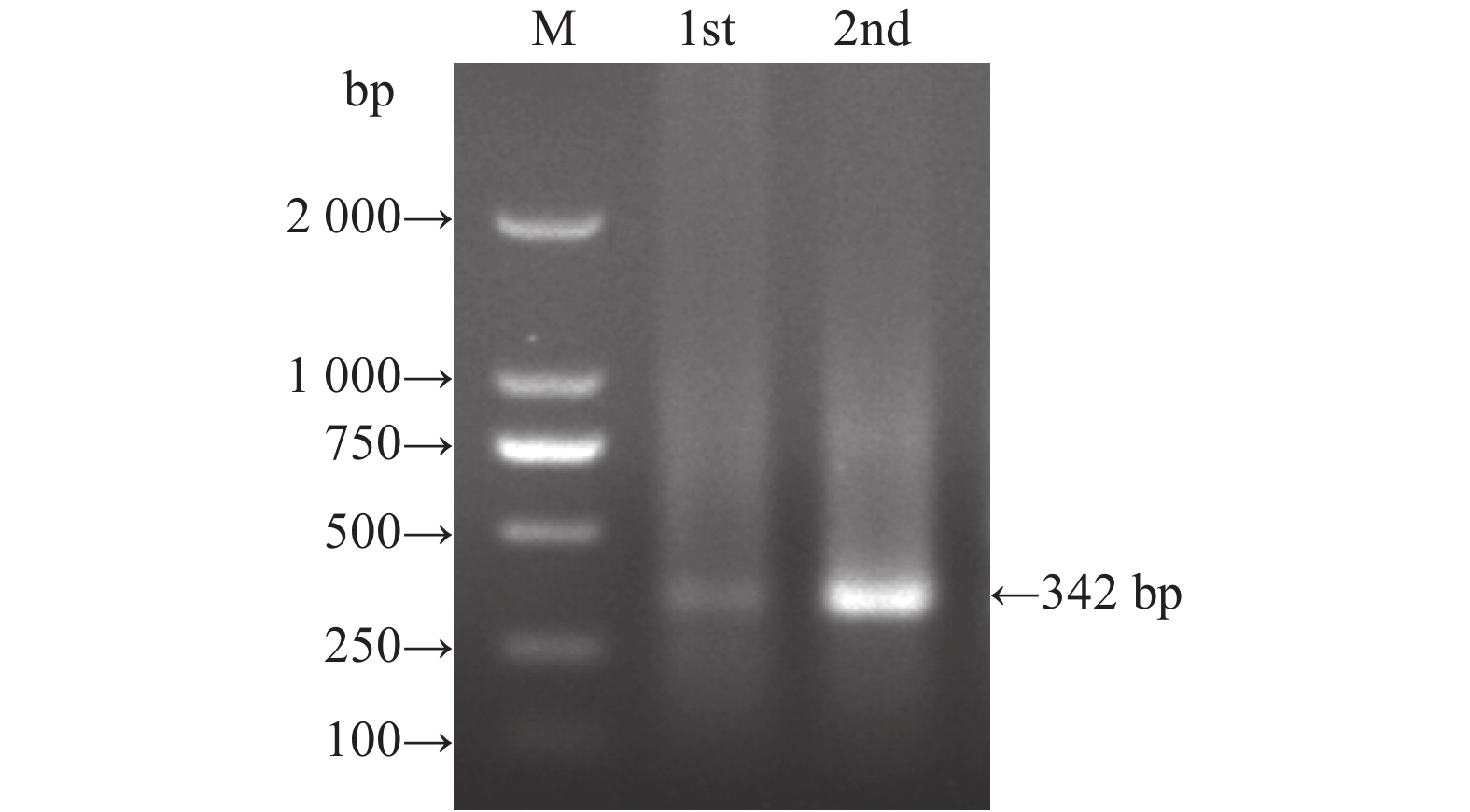
2 结果与分析 2.1 星状病毒RdRp基因半巢式RT-PCR检测通过半巢式RT-PCR对白狐的心脏、肺脏、肝脏及肾脏进行检测,在肾脏样品中扩增得到大小约342 bp的片段,与预期大小相符。琼脂糖凝胶电泳图见图1。
|
图 1 白狐肾脏星状病毒RdRp基因的半巢式 RT-PCR 鉴定 Fig. 1 Semi-nested RT-PCR identification of astrovirus RdRp gene in kidney of Alopex lagopus M:DL2000 DNA marker;1st:第1轮扩增产物;2nd:第2轮扩增产物 M: DL2000 DNA marker; 1st: The first round amplification product; 2nd: The second round amplification product |
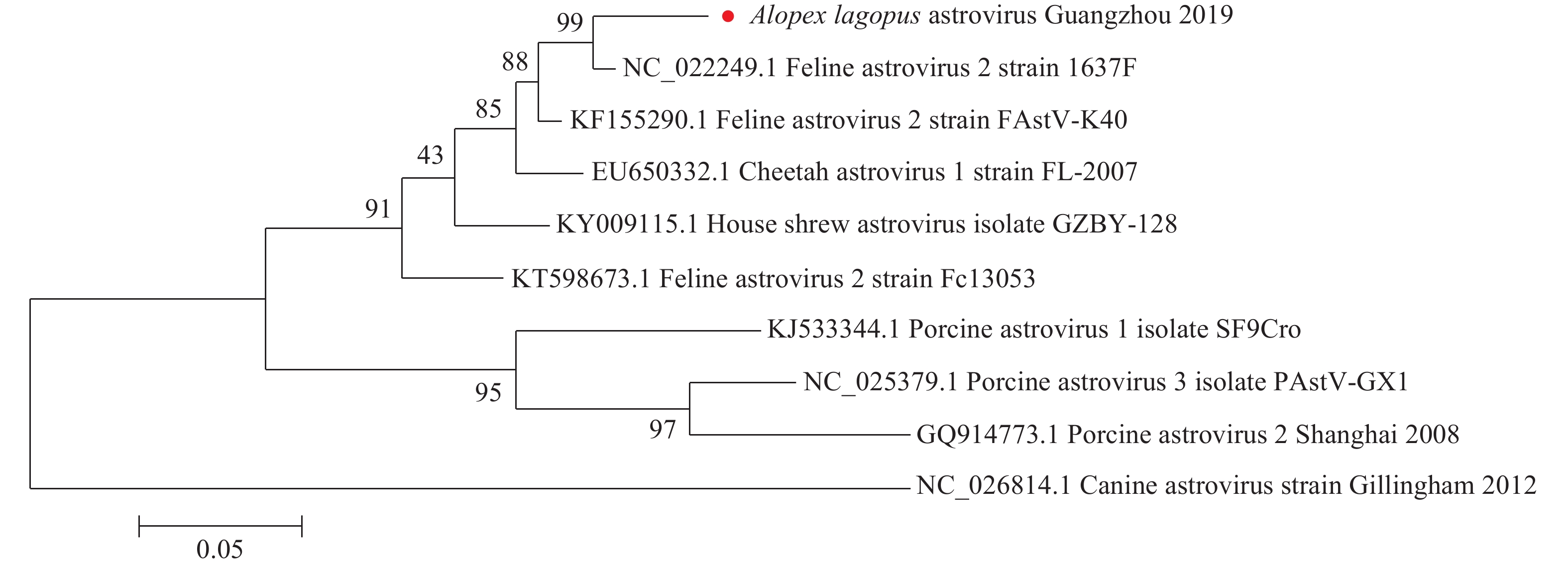
系统进化树(图2)显示,白狐源星状病毒Guangzhou 2019 RdRp基因与猫源星状病毒1637F、FAstV-K40、Fc13053,猎豹源星状病毒FL-2007,家鼩源星状病毒GZBY-128分为同一大支,其中与香港猫源分离株1637F亲缘关系最近;与猪源星状病毒SF9Cro、PAstV-GX1、Shanghai 2008,犬源星状病毒Gillingham 2012的亲缘关系较远。
|
图 2 白狐肾脏星状病毒RdRp基因系统进化树 Fig. 2 Phylogenetic tree of astrovirus RdRp gene in kidney of Alopex lagopus “●”为本研究鉴定出的白狐源星状病毒毒株 “●” represents Alopex lagopus astrovirus strain identified in this study |
目的基因克隆测序结果正确,对测序结果进行相似性比较。结果(表2)显示:白狐源星状病毒 Guangzhou 2019 RdRp基因与猪源星状病毒PAstV-GX1等9株毒株的核苷酸相似性为67.5%~96.2%。其中,与香港猫源星状病毒1637F的相似性最高,为96.2%;与犬源星状病毒Gillingham 2012的相似性最低,为67.5%。
|
|
表 2 白狐肾脏星状病毒RdRp基因核苷酸相似性分析1) Table 2 Nucleotide similarity analysis of astrovirus RdRp gene in kidney of Alopex lagopus |
迄今为止,已在多种禽类和哺乳动物中检测到星状病毒。星状病毒感染宿主通常具有种属特异性,但近年来越来越多的研究表明星状病毒可跨越物种屏障进行传播,其中包括野生动物与人[11]、野生动物与圈养家畜[12]之间的跨种传播。RdRp基因的系统发育分析表明,跨种传播是导致星状病毒长期进化的重要因素[13]。本研究结果显示白狐源星状病毒的RdRp基因与猫源星状病毒具有高度相似性,进一步证明星状病毒跨种传播的可能性。
星状病毒主要感染人和动物的消化系统,通过改变肠上皮细胞屏障的通透性引发肠炎及腹泻等症状[14]。近年来,由星状病毒引起的哺乳动物肠外疾病也相继出现,如人和牛的脑炎及神经系统疾病[15]、水貂颤抖综合征[16]以及仔猪先天性震颤和呼吸系统疾病[17]。哺乳动物肾脏感染的病例报道较少,目前仅在猪和免疫缺陷小鼠的肾脏中鉴定出星状病毒[18]。本研究对1只死亡白狐进行了剖检,发现肾脏苍白肿大,被膜难以剥离,对其进行病原学检测,成功鉴定出一株白狐源星状病毒。
本研究中白狐感染星状病毒可能与园内流浪猫的活动有关。近来有报道称,动物园内发现一例星状病毒在东北虎与猫之间传播的事件,该东北虎表现出严重流涎症状[19]。有调查显示星状病毒在我国家猫中的感染率高达23.4%(46/197),远高于其他国家,其中无症状感染者可达8.7% (8/92)[20]。星状病毒主要通过粪−口途径传播,也可以通过饮用水源或污水传播[21],同时隐性感染动物的存在为该病毒在空间和时间上提供了更多的传播机会。城市中活动自由的流浪猫极有可能成为星状病毒传播过程中的中间宿主,提高野生动物感染该病毒的潜在风险。对于星状病毒的防治,应着手加强对城市内流浪动物的收治管理,降低圈养野生动物与城市流浪动物之间的接触机会,建立有效保护区域,提高食物水源安全性等,以期降低珍稀野生动物感染该病毒的风险。
本研究在白狐肾脏中鉴定出1株星状病毒,该病毒与香港猫源星状病毒1637F的相似性较高,达到96.2%。对其基因序列进行分析,初步了解了病毒的进化情况,为星状病毒在野生哺乳动物间的跨种传播以及肠外器官中的感染提供了依据,有助于了解该病毒在圈养野生动物与城市流浪动物之间的传播情况,以及感染其他动物的潜在可能性。
| [1] |
APPLETON H, HIGGINS P G. Letter: Viruses and gastroenteritis in infants[J]. Lancet, 1975, 1(7919): 1297. (  0) 0) |
| [2] |
BOSCH A, PINTO R M, GUIX S. Human astroviruses[J]. Clinical Microbiology Reviews, 2014, 27(4): 1048-1074. DOI:10.1128/CMR.00013-14 (  0) 0) |
| [3] |
PANTIN-JACKWOOD M J, STROTHER K O, MUNDT E, et al. Molecular characterization of avian astroviruses[J]. Archives of Virology, 2011, 156(2): 235-244. DOI:10.1007/s00705-010-0849-z (  0) 0) |
| [4] |
REUTER G, PANKOVICS P, BOROS A. Nonsuppurative (aseptic) meningoencephalomyelitis associated with neurovirulent astrovirus infections in humans and animals[J]. Clinical Microbiology Reviews, 2018, 31(4): e00040-18. doi: 10.1128/CMR.00040-18.
(  0) 0) |
| [5] |
WU W, XU R, LV Y, et al. Goose astrovirus infection affects uric acid production and excretion in goslings[J]. Poultry Science, 2020, 99(4): 1967-1974. DOI:10.1016/j.psj.2019.11.064 (  0) 0) |
| [6] |
ARRUDA B, ARRUDA P, HENSCH M, et al. Porcine astrovirus type 3 in central nervous system of swine with polioencephalomyelitis[J]. Emerging Infectious Diseases, 2017, 23(12): 2097-2100. DOI:10.3201/eid2312.170703 (  0) 0) |
| [7] |
XIAO C T, LUO Z, LV S L, et al. Identification and characterization of multiple porcine astrovirus genotypes in Hunan province, China[J]. Archives of Virology, 2017, 162(4): 943-952. DOI:10.1007/s00705-016-3185-0 (  0) 0) |
| [8] |
VU D L, CORDEY S, BRITO F, et al. Novel human astroviruses: Novel human diseases?[J]. Journal of Clinical Virology, 2016, 82: 56-63. DOI:10.1016/j.jcv.2016.07.004 (  0) 0) |
| [9] |
NAGAI M, OMATSU T, AOKI H, et al. Full genome analysis of bovine astrovirus from fecal samples of cattle in Japan: Identification of possible interspecies transmission of bovine astrovirus[J]. Archives of Virology, 2015, 160(10): 2491-2501. DOI:10.1007/s00705-015-2543-7 (  0) 0) |
| [10] |
DE BENEDICTIS P, SCHULTZ-CHERRY S, BURNHAM A, et al. Astrovirus infections in humans and animals: Molecular biology, genetic diversity, and interspecies transmissions[J]. Infection Genetics and Evolution, 2011, 11(7): 1529-1544. DOI:10.1016/j.meegid.2011.07.024 (  0) 0) |
| [11] |
QUAN P L, WAGNER T A, BRIESE T, et al. Astrovirus encephalitis in boy with X-linked agammaglobulinemia[J]. Emerging Infectious Diseases, 2010, 16(6): 918-925. DOI:10.3201/eid1606.091536 (  0) 0) |
| [12] |
WANG L, SHEN H, ZHENG Y, et al. Astrovirus in white-tailed deer, United States, 2018[J]. Emerging Infectious Diseases, 2020, 26(2): 374-376. DOI:10.3201/eid2602.190878 (  0) 0) |
| [13] |
MENDENHALL I H, SMITH G J D, VIJAYKRISHNA D. Ecological drivers of virus evolution: Astrovirus as a case study[J]. Journal of Virology, 2015, 89(14): 6978-6981. DOI:10.1128/JVI.02971-14 (  0) 0) |
| [14] |
MOSER L A, SCHULTZ-CHERRY S. Pathogenesis of astrovirus infection[J]. Viral Immunology, 2005, 18(1): 4-10. DOI:10.1089/vim.2005.18.4 (  0) 0) |
| [15] |
SELIMOVIC-HAMZA S, BOUZALAS I G, VANDEVELDE M, et al. Detection of astrovirus in historical cases of European sporadic bovine encephalitis, Switzerland 1958-1976[J]. Frontiers in Veterinary Science, 2016, 3: 91. doi: 10.3389/fvets.2016.00091.
(  0) 0) |
| [16] |
BLOMSTROM A L, WIDEN F, HAMMER A S, et al. Detection of a novel astrovirus in brain tissue of mink suffering from shaking mink syndrome by use of viral metagenomics[J]. Journal of Clinical Microbiology, 2010, 48(12): 4392-4396. DOI:10.1128/JCM.01040-10 (  0) 0) |
| [17] |
BOROS A, ALBERT M, PANKOVICS P, et al. Outbreaks of neuroinvasive astrovirus associated with encephalomyelitis, weakness, and paralysis among weaned pigs, Hungary[J]. Emerging Infectious Diseases, 2017, 23(12): 1999-2010. (  0) 0) |
| [18] |
YOKOYAMA C C, LOH J, ZHAO G, et al. Adaptive immunity restricts replication of novel murine astroviruses[J]. Journal of Virology, 2012, 86(22): 12262-12270. DOI:10.1128/JVI.02018-12 (  0) 0) |
| [19] |
ZHANG H H, QIU Q G, LIU S J, et al. Genomic characterization of a novel astrovirus identified in Amur tigers from a zoo in China[J]. Archives of Virology, 2019, 164(12): 3151-3155. DOI:10.1007/s00705-019-04435-2 (  0) 0) |
| [20] |
YI S, NIU J, WANG H, et al. Molecular characterization of feline astrovirus in domestic cats from northeast China[J]. PLoS One, 2018, 13(10): e205441. doi: 10.1371/journal.pone.0205441.
(  0) 0) |
| [21] |
VU D L, BOSCH A, PINTO R M, et al. Epidemiology of classic and novel human astrovirus: Gastroenteritis and beyond[J]. Viruses, 2017, 9(2): 33. doi: 10.3390/v9020033.
(  0) 0) |
 2021, Vol. 42
2021, Vol. 42


