大肠埃希菌Escherichia coli常会引起禽类典型的继发性局部或全身性感染,鸡吸入污染有大肠埃希菌的灰尘和氨气可使上呼吸道纤毛失去运动能力,从而使吸入的大肠埃希菌易于定植并导致呼吸道感染,普遍认为,大肠埃希菌病是养禽业最广泛存在的感染性细菌病,给养禽业造成了严重的经济损失[1]。对于鸡群体给药,临床一般采用饮水给药的方式,但饮水给药对药物溶解度的要求较高,易受水质影响,此外,还需考虑药物在水溶液中的稳定性、饮水设备、管线的设计、清洁和保养等,以保证药物的有效性和安全性。随着鸡呼吸道疫苗喷雾免疫的逐渐推广与使用,近年来,喷雾给药系统的研究也越来越活跃。喷雾剂是一种药物经特殊的给药装置给药后进入呼吸道深部、腔道黏膜或皮肤发挥全身或局部作用的一种给药系统,对肺部给药具有重要意义[2]。开展喷雾给药新技术研究,通过吸入方式给药,药物可直接黏附于呼吸道黏膜作用靶部位,时间短,见效快,适用于群防群治。而禽饲养过程中,紧闭和较小的饲养环境,也为喷雾剂的使用提供了条件[3]。
恩诺沙星(Enrofloxacin, ENR)是动物专用的第3 代喹诺酮类抗菌药物,抗菌谱广,对多种革兰阳性菌和某些革兰阴性菌均有效,对铜绿假单胞菌Pseudomonas aeruginosa和支原体Mycoplasma也具有一定的抗菌活性[4-6]。由于恩诺沙星具有杀菌活性强、体内分布广泛、组织浓度高、毒副作用小、与其他抗菌药无交叉耐药性等优点[7-9],被广泛用于禽细菌性疾病和支原体感染等病症[10-12],能够有效治疗由鸡滑液囊支原体M. synoviae、大肠埃希菌引起的呼吸道感染和气囊炎等[13]。现有技术将恩诺沙星制成乳剂,虽然该乳剂相对于其他制剂能够增加恩诺沙星的分散度,但为普通乳剂或亚微乳,乳剂中的乳滴粒径较大,乳剂在稀释后不稳定,恩诺沙星容易析出,难以达到肺部对可吸入微粒粒径的要求,无法通过喷雾方式给药。而纳米乳粒径介于10~100 nm之间,是由水相、油相、乳化剂和助乳化剂形成的胶体分散系统,多属热力学稳定系统[14]。
桉叶油作为一种良好的透皮吸收促进剂[15],还具有抗氧化、防腐、抑菌等生物活性[16],无论混饮还是喷雾给药对呼吸道疾病均有很好的辅助治疗功效。本研究以恩诺沙星为主药,桉叶油为油相,进行规模化鸡群喷雾给药新技术研究,制备一种可喷雾给药的兽用纳米乳新制剂,并通过对沙门氏菌Salmonella pullorum和大肠埃希菌引起的全身感染疾病模型的药效研究,初步评价研制的恩诺沙星纳米乳喷雾的临床效果。
1 材料与方法 1.1 药品与试剂恩诺沙星原料药:w为99.4%,上虞京新药业有限公司;恩诺沙星对照品:w为99.5%,中国兽医药品监察所;桉叶油:w为98.0%,成都艾科达化学试剂有限公司;1 g/L恩诺沙星溶液,安徽科尔药业有限公司;LB琼脂、MH 琼脂、LB肉汤和MH肉汤均购自青岛海博生物技术有限公司;其他试剂均为国产分析纯。
1.2 仪器与设备微量移液器和台式高速离心机:德国Eppendorf公司;Thermo Scientific Heraeus恒温培养箱:美国Thermo Fisher Scientific公司;THZ-300 恒温培养摇床:上海一恒科学仪器有限公司;磁力搅拌器:常州澳华仪器有限公司;电子分析天平:BSA224S型,北京赛多利斯科学仪器有限公司;Milli Q超纯水发生器:美国Millipore公司;酸度计:PHS-3C型,上海雷磁仪器厂;纳米粒度及Zeta电位分析仪:Zatasizer Nano ZS 90,英国马尔文公司;高效液相色谱(HPLC)仪:SIL-20A型,日本岛津公司;分光光度计:UV5200,上海元析设备有限公司;超声雾化器:402AI,江苏鱼跃医疗设备股份有限公司。
1.3 试验动物和菌株快速型黄羽肉鸡,1日龄,由广东智威贸易有限公司提供,未经任何疫苗免疫,试验前未给任何药物,自由采食和饮水,临床观察17 d无异常后开始试验。
所用菌株为鸡白痢沙门氏菌CVCC1800和鸡大肠埃希菌临床株O78,均由华南农业大学药理教研室提供。
1.4 禽用恩诺沙星纳米乳的制备 1.4.1 辅料筛选以恩诺沙星为主药,桉叶油为纳米乳油相,对乳化剂、助乳化剂、pH调节剂和抗氧化剂等辅料进行初步筛选。通过单因素试验确定乳化剂为吐温−80,助乳化剂为无水乙醇,pH调节剂为氢氧化钠,用于后续试验。
1.4.2 处方优化步骤1:将处方量的乳化剂吐温−80和助乳化剂无水乙醇涡旋、振荡充分混匀得到混合乳化剂;步骤2:量取处方量的桉叶油加入到混合乳化剂中,用磁力搅拌器进行磁力搅拌,使桉叶油和混合乳化剂充分混合均匀;步骤3:用滴定管将灭菌超纯水逐滴加入到上述混合体系中,边滴加边磁力搅拌使其混合均匀,注意观察乳剂的状态,当乳剂由澄清透明状态转变为浑浊状态时记为滴定终点,记录所需的超纯水量;步骤4:调整乳化剂与助乳化剂的体积比(Km),重复进行上述第2步和第3步的操作步骤,并记录下不同Km条件下所得的滴定终点值即超纯水的量,直至无论滴定多少量的超纯水,该乳剂一直呈现澄清透明状态即达到无限稀释状态,以空白纳米乳剂的性状、物理稳定性(有无分层、析出、絮凝和破乳)和形成自微乳区面积大小作为考察指标,筛选最优Km;步骤5:利用相转化法分别设定混合乳化剂与油相的体积比分别为3∶1、2∶1、3∶2、1∶1、2∶3、1∶2、1∶3、1∶5、1∶7,用超纯水滴定,记录由清至浊的滴定终点状态值,然后将混合乳化剂、水相、油相作为伪三元相图的3 个顶点,根据滴定终点数据值绘制伪三元相图。
1.4.3 纳米乳外观性状及结构类型的鉴别利用亚甲基蓝和苏丹III在纳米乳中的扩散速度来对纳米乳的类型进行鉴别。若亚甲基蓝在纳米乳中的扩散速度快于苏丹III,表明该纳米乳为O/W型纳米乳。
1.4.4 纳米乳粒径大小及Zeta电位的测定将待测恩诺沙星纳米乳剂用超纯水稀释10倍,用纳米粒度及Zeta电位分析仪对其粒径大小和Zeta电位进行测定。记录平均粒径、多分散系数(Polydispersity index,PDI)、粒径分布情况和Zeta电位。
1.5 纳米乳中恩诺沙星的含量测定 1.5.1 色谱条件色谱柱:Phenomenex Gemini C18(4.6 mm×250 mm,5 μm);流动相:0.025 mol/L磷酸溶液(三乙胺调节pH至3.0)∶ 乙腈=83∶17(V/V);流速:1 mL/min;柱温:35 ℃;检测波长:278 nm;进样量:10 μL。
1.5.2 含量检测精密移取1 mL恩诺沙星纳米乳剂供试品置于洁净烧杯中,用超纯水充分稀释,混匀,并转移至100 mL棕色容量瓶中,用超纯水充分洗涤至少3次,将洗涤液转移至容量瓶内,制成每1 mL含恩诺沙星500 μg的溶液,充分摇匀。精密移取上述供试品溶液5 mL至另一50 mL棕色容量瓶中,用超纯水定容至刻度,涡旋混匀,作为供试品溶液。制备相同浓度的恩诺沙星对照品溶液,上机检测并计算纳米乳中恩诺沙星含量。
在纳米乳pH为9.5~10.5范围内,采用正交试验,考察硫酸氢钠、焦亚硫酸钠这2种抗氧化剂的3种质量浓度(2、4、5 g/L)以及不同混合乳化剂和油相体积比(5∶2、3∶1、4∶1)对纳米乳的影响,每种试验做3个重复,记录试验结果,包括乳剂的色泽,有无分层、破乳、析出等现象,然后通过HPLC测定恩诺沙星含量,得出平均含药量。
1.6 喷雾预防试验设计 1.6.1 人工感染剂量的确定采用改良寇氏法对黄羽肉雏鸡进行预试攻毒,鸡白痢沙门氏菌和大肠埃希菌均采用腹腔注射,通过观察雏鸡群发病状态及计算半数致死量,确定试验攻毒方式及感染剂量。
1.6.2 试验分组及处理将210只体况健康、精神状态良好的黄羽肉鸡雏鸡随机分组,分组情况及处理如表1所示,每次雾化给药量均为40 mL,雾化时间为15 min。
|
|
表 1 动物分组及试验处理 Table 1 Animal grouping and experimental treatment |
观察并记录鸡群试验期间的精神状态、食欲、粪便、行为、增质量等,并对死鸡进行尸体剖检,取肺脏、肠黏膜、心包膜、脾脏、肝脏和气囊等组织或病变器官做病理分析及记录,计算发病率、病死率、存活率、保护率以及治愈率。
1.7 数据分析试验数据采用SPSS20.0软件分析,采用卡方检验(χ2)进行差异显著性分析。
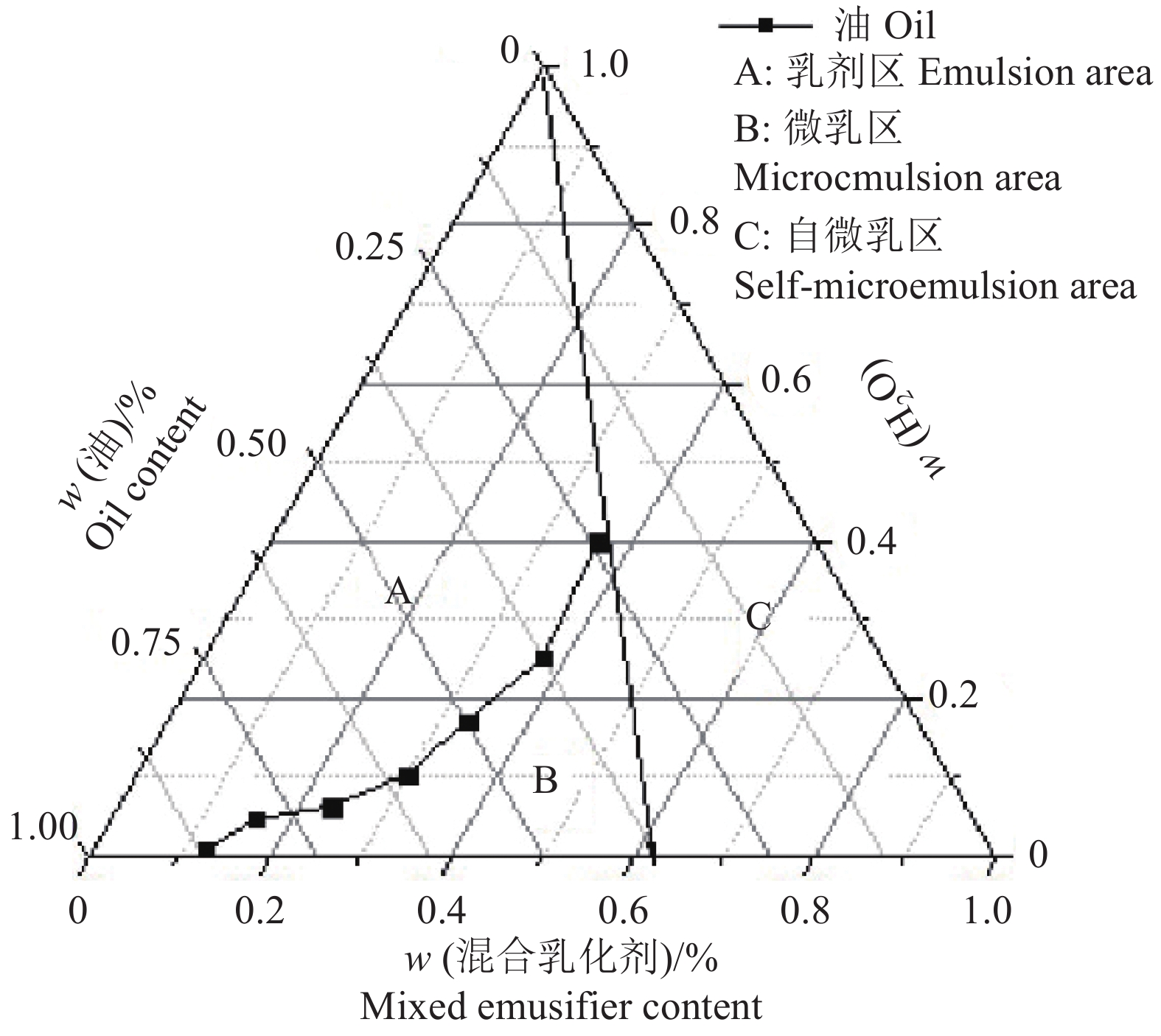
2 结果与分析 2.1 处方筛选与优化通过对滴定过程及滴定结果的记录、分析和纳米乳剂的性状、物理稳定性(有无分层、析出和破乳)、形成自微乳区面积的考察,当Km=3∶2,混合乳化剂∶油相(V/V)=2∶1或 3∶1时均可形成自微乳体系,且纳米乳能够被水无限稀释成澄清透明状态。当混合乳化剂相∶油相(V/V)=3∶1时,在常态及加速离心条件下纳米乳无分层、破乳等现象,稳定性良好。因此,选取乳化剂∶助乳化剂(V/V)=3∶2,即Km为3∶2,滴定结果如表2所示,根据滴定终点数值绘制伪三元相图如图1所示。
|
图 1 乳化剂与助乳化剂体积比(Km)为3∶2时纳米乳的伪三元相图 Fig. 1 Pseudo-ternary phase diagram of nanoemulsion when the volume fraction of emusifier to coemusifier(Km) was 3∶2 |
|
|
表 2 乳化剂与助乳化剂体积比(Km)为3∶2时滴定过程数据记录 Table 2 Data of titration with water when the volume fraction of emusifier to coemusifier(Km) was 3∶2 |
采用单因素试验考察pH对纳米乳的影响,包括乳剂的颜色,有无分层、破乳、析出和药物含量等。结果如表3所示,当乳剂的pH<9.5时,有药物结晶析出;当pH>10.5时,纳米乳状态不稳定,放置一段时间后,易形成普通乳白色不透明的乳剂;当pH介于9.5~10.5之间时,该纳米乳均能维持澄清、透明、均一稳定的状态,且测得平均含药量差异小。
|
|
表 3 乳化剂与助乳化剂体积比(Km)为3∶2时pH对纳米乳的影响 Table 3 The effects of pH on nanoemulsion when the volume fraction of emusifier to coemusifier(Km) was 3∶2 |
正交试验结果如表4所示,选择焦亚硫酸钠为抗氧化剂,且当其质量浓度为0.4%时有较好的抗氧化性。混合乳化剂与桉叶油的比值为3∶1和4∶1时较合适,通过对制剂进行质量评价及稳定性考察(包括影响因素试验、加速试验及长期稳定性试验)的结果,当选取混合乳化剂与桉油的比例为4∶1时,纳米乳的稳定性较比例为3∶1时更强,在相同试验条件下,纳米乳的物理性状及药物含量更稳定。
|
|
表 4 恩诺沙星纳米乳正交试验处方筛选结果 Table 4 Screened formula of enrofloxacin nanoemulsion by orthogonal test |
采用该工艺制备的纳米乳呈淡黄色,为澄清透明且具有良好流动性的清亮液体,无分层、析出、絮凝及破乳等现象出现,成品如图2所示。染色试验结果(图3)显示,亚甲基蓝在该乳剂中的扩散速度大于苏丹III,表明该乳剂为O/W型纳米乳。

|
图 2 恩诺沙星纳米乳成品 Fig. 2 End product of enrofloxacin nanoemulsion |

|
图 3 亚甲基蓝和苏丹III在恩诺沙星纳米乳中的扩散效果 Fig. 3 Diffusion effects of methylene blue and sudan III in enrofloxacin nanoemulsion |
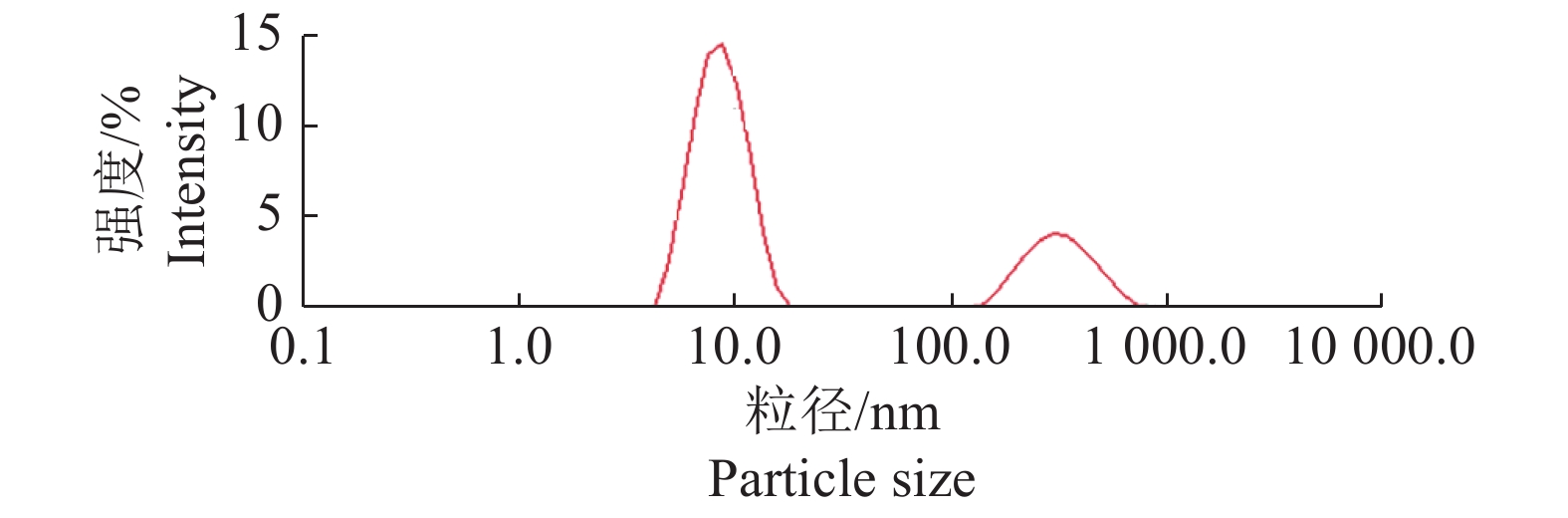
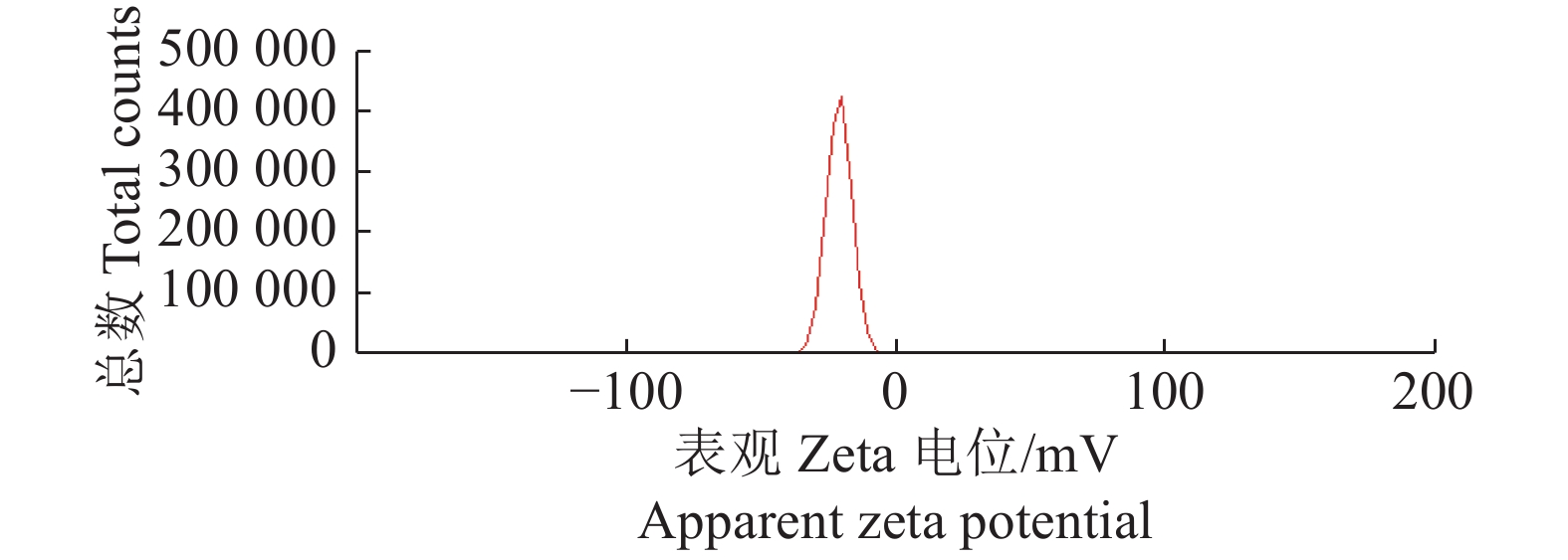
将制备的恩诺沙星纳米乳稀释10倍后经纳米粒度及Zeta电位分析仪的测定,粒度分析仪试验结果(图4)显示,恩诺沙星纳米乳的平均粒径为(10.79±1.5) nm,PDI为0.446,粒径分布范围较窄,且分布比较均匀。Zeta电位为−21.63 mV(图5)。
|
图 4 恩诺沙星纳米乳的粒径分布 Fig. 4 Particle size distribution of enrofloxacin nanoemulsion |
|
图 5 恩诺沙星纳米乳的Zeta电位 Fig. 5 Zeta potential of enrofloxacin nanoemulsion |
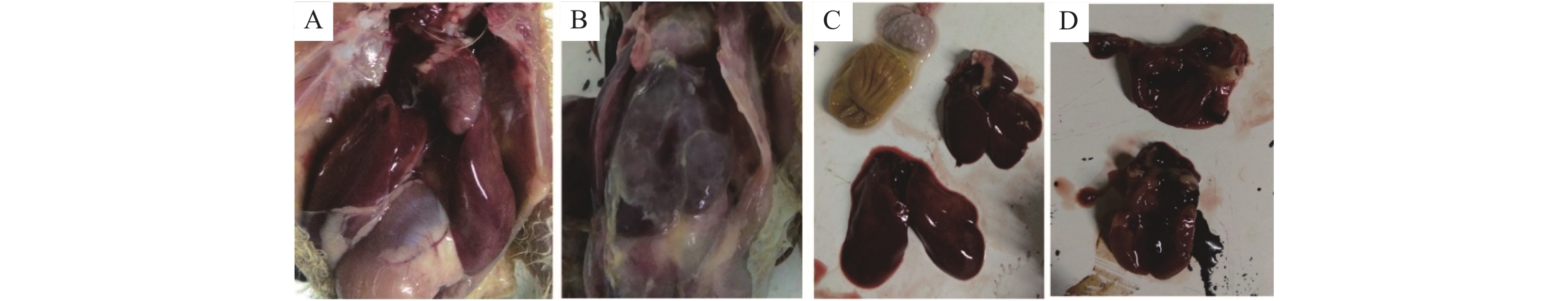
通过观察发现感染对照组全群发病,表现为精神委靡、缩头闭眼、饮水和采食均减少、排绿白色稀粪[17-19];剖检特征如图6所示:纤维素性心包炎,心肌出血点明显,气囊混浊,有干酪样渗出物,肝周炎,肝脏表面有出血点,被膜有纤维素性附着物[20-22]。健康对照组全群健康。试验组数据经统计学软件分析,高、中、低剂量预防给药组的存活率分别为90%、83.3%、73.3%,均极显著高于感染对照组26.7%(P<0.01);高剂量组保护率为83.3%,显著高于低剂量组53.3%的保护率(P<0.05);3组预防给药组的治愈率较低,且差异不显著(P>0.05)。各试验组的防治效果如表5所示。
|
|
表 5 各试验组的预防及治疗效果 Table 5 Preventive and therapeutic effects of each trial |
|
图 6 临床试验病理解剖对比图 Fig. 6 Comparison of pathological anatomy in clinical trials A为健康对照组试验解剖图;B、C和D为感染对照组试验解剖图 A shows the anatomical diagram of the healthy control group; B, C and D show the anatomical diagrams of the infection control group |
喷雾给药能够使药物迅速到达病灶,禽类特殊的呼吸特征有利于喷雾给药的使用,气囊的存在,极大地增大了受药面积[23]。试验采用相转变法,通过单因素试验和正交试验对纳米乳的制备辅料和工艺处方进行优化,制备出了一种可喷雾给药的复方恩诺沙星纳米乳兽用新制剂。桉叶油作为纳米乳的油相,在采取喷雾给药方式时,能够发挥其良好的透皮促渗作用[24],并改善呼吸道功能[25-26]。对纳米乳的物理性状和药剂学特征进行考察,本试验所制得的禽用恩诺沙星纳米乳剂呈淡黄色、澄清透明、均一稳定,pH为9.5~10.5,未有分层、絮凝、药物析出及破乳等现象出现。通过对其粒径及Zeta电位进行测定,该乳剂中乳滴粒径达到10 nm左右,且分布集中,经多次测试,平行性良好。制备出的复方纳米乳制剂性质稳定,在稳定性考察中未出现分层、絮凝、药物析出及破乳等现象,可以避免在超声雾化及其他喷雾给药方式过程中因各种原因堵塞喷头及管道。
对雏鸡的感染预试验确定鸡白痢沙门氏菌CVCC1800的感染剂量为1.0 mL/kg,经平板培养计数法测定其菌落总数为5×108 CFU/mL,按常规饲养方式在12 h后在雏鸡右侧腹腔注射大肠埃希菌O78的感染剂量为2.0 mL/kg,经平板培养计数法测定其菌落总数为1×109 CFU/mL,约为0.3 mL,这与欧阳五庆等[27]报道的对18日龄京白雏鸡腹腔注射大肠埃希菌O2菌液0.3 mL相一致。感染后发病症状明显,通过病理解剖可发现典型症状如纤维素性心包炎、心肌出血点等。通过构建人工感染模型,对研制的禽用恩诺沙星纳米乳进行初步药效评估,试验数据表明,健康对照组全群健康,且健康对照组试验鸡群在喷雾给药过程中未有任何不良反应如咳嗽、喘气、打喷嚏等。采取超声雾化吸入给药方式进行疾病防治对鸡群应激性较小,在对雾化过程进行观察时发现,雾化出的小液滴能够长时间悬浮于鸡舍内,确保了鸡群能够有比较充裕的时间吸入液滴,避免了喷雾后立即下沉或附着在鸡舍周边及鸡羽上等情况的发生。制备的复方恩诺沙星纳米乳采用高、中、低剂量喷雾给药对鸡大肠埃希菌与沙门氏菌侵染均有一定的防护效果,各组保护率明显高于感染对照组,且剂量越高,防护效果越好,但试验中喷雾给药的治疗效果一般,低剂量治疗喷雾给药组的治愈率仅为35.7%,表明该恩诺沙星纳米乳采取喷雾给药方式可用于恩诺沙星敏感菌引起的呼吸道感染和气囊炎等的预防。
本研究以恩诺沙星为主药、桉叶油为油相制备的复方恩诺沙星纳米乳,具有一定的自乳化能力,且稀释液澄清透明、均一稳定,可通过喷雾装置经呼吸道途径吸入给药,适合雏鸡群前期的预防给药,打破了传统给药方式的束缚,对鸡群中常发的鸡白痢沙门氏菌病和大肠埃希菌病有良好的预防效果,该研究为兽药新剂型的研发及新型给药方式的探索提供了参考。
| [1] |
SAIF Y M, 主编. 禽病学: 12版[M]. 苏敬良, 高福, 索勋, 译. 北京: 中国农业出版社, 2012: 811-870.
(  0) 0) |
| [2] |
崔福德, 主编. 药剂学: 6版[M]. 北京: 人民卫生出版社, 2010: 201-213.
(  0) 0) |
| [3] |
CALDERON-NIEVA D, GOONEWARDENE K B, GOMIS S, et al. Veterinary vaccine nanotechnology: Pulmonary and nasal delivery in livestock animals[J]. Drug Deliv Transl Re, 2017, 7(4): 558-570. DOI:10.1007/s13346-017-0400-9 (  0) 0) |
| [4] |
VARGA M. Therapeutics[M]//Textbook of Rabbit Medicine: 2nd ed. Oxford: Butterworth-Heinemann, 2014: 137-177.
(  0) 0) |
| [5] |
PERRY S M, MITCHELL M A. Antibiotic therapy[M]//Mader's reptile and amphibian medicine and surgery: 2nd Edition. Philadelphia: Saunders, 2019: 1139-1154.
(  0) 0) |
| [6] |
陈杖榴. 兽医药理学: 3版[M]. 北京: 中国农业出版社, 2004.
(  0) 0) |
| [7] |
MARTINEZ M, MCDERMOTT P, WALKER R. Pharmacology of the fluoroquinolones: A perspective for the use in domestic animals[J]. The Veterinary Journal, 2006, 172(1): 10-28. DOI:10.1016/j.tvjl.2005.07.010 (  0) 0) |
| [8] |
方炳虎, 曾振灵, 冯淇辉, 等. 恩诺沙星对鸡大肠杆菌病及葡萄球菌病的药效研究[J]. 中国兽医学报, 1997(2): 54-57. (  0) 0) |
| [9] |
GAUTIER-BOUCHARDON A V, REINHARDT A K, KOBISCH M, et al. In vitro development of resistance to enrofloxacin, erythromycin, tylosin, tiamulin and oxytetracycline in Mycoplasma gallisepticum, Mycoplasma iowae and Mycoplasma synoviae
[J]. Veterinary Microbiology, 2002, 88(1): 47-58. DOI:10.1016/S0378-1135(02)00087-1 (  0) 0) |
| [10] |
SCHRODER J. Enrofloxacin: A new antimicrobial agent[J]. Journal of the South African Veterinary Association, 1989, 60(2): 122-124. (  0) 0) |
| [11] |
FLECKENSTEIN E, UPHOFF C C, DREXLER H G. Effective treatment of Mycoplasma contamination in cell lines with enrofloxacin (Baytril)
[J]. Leukemia, 1994, 8(8): 1424-1434. (  0) 0) |
| [12] |
BAUDITZ R. Results of clinical studies with Bytril in poultry[J]. Veterinary Medical Review, 1987, 2: 130-136. (  0) 0) |
| [13] |
SUMANO L H, OCAMPO C L, BRUMBAUGH G W, et al. Effectiveness of two fluoroquinolones for the treatment of chronic respiratory disease outbreak in broilers[J]. British Poultry Science, 1998, 39(1): 42-46. DOI:10.1080/00071669889376 (  0) 0) |
| [14] |
王波臻, 欧阳五庆, 纪俊明, 等. 复方恩诺沙星纳米乳的制备及体外透皮性能考察[J]. 畜牧与兽医, 2016, 48(3): 77-83. (  0) 0) |
| [15] |
毛庆祥, 常文军, 蔡全才. 桉叶油透皮吸收促进剂研究进展[J]. 药学实践杂志, 2003(4): 205-209. DOI:10.3969/j.issn.1006-0111.2003.04.005 (  0) 0) |
| [16] |
DHAKAD A K, PANDEY V V, BEG S, et al. Biological, medicinal and toxicological significance of Eucalyptus leaf essential oil: A review
[J]. Journal of the Science of Food and Agriculture, 2018, 98(3): 833-848. DOI:10.1002/jsfa.8600 (  0) 0) |
| [17] |
朱向波. 鸡白痢沙门氏菌病诊断与防治[J]. 中国畜禽种业, 2015, 11(5): 149-150. DOI:10.3969/j.issn.1673-4556.2015.05.112 (  0) 0) |
| [18] |
郑志新. 张家口地区鸡白痢沙门氏菌的分离鉴定及药敏试验[J]. 河北北方学院学报(自然科学版), 2015, 31(3): 36-38. (  0) 0) |
| [19] |
安辉, 张大华, 陈小玲, 等. 鸡白痢沙门氏菌的分离与鉴定[J]. 安徽农业科学, 2011, 39(32): 19888-19890. DOI:10.3969/j.issn.0517-6611.2011.32.091 (  0) 0) |
| [20] |
刘吉山, 沈志强, 王燕, 等. 我国部分地区禽致病性大肠杆菌的分离鉴定与药敏试验[J]. 中国家禽, 2005(7): 14-16. DOI:10.3969/j.issn.1004-6364.2005.07.004 (  0) 0) |
| [21] |
路卫星. 鸡大肠杆菌病的诊断与治疗[J]. 中国兽医杂志, 2015, 51(8): 43-44. DOI:10.3969/j.issn.0529-6005.2015.08.015 (  0) 0) |
| [22] |
陈洪科. 禽病诊断和防治: 1版[M]. 北京: 中国农业科技出版社, 1996.
(  0) 0) |
| [23] |
刘慕欣, 付领新. 喷雾给药治疗禽类呼吸道疾病的效果观察[J]. 当代畜牧, 2014(8): 76-77. (  0) 0) |
| [24] |
DAS A, AHMED A B. Natural permeation enhancer for transdermal drug delivery system and permeation evaluation: A review[J]. Asian Journal of Pharmaceutical and Clinical Research, 2017, 10(9): 5. DOI:10.22159/ajpcr.2017.v10i9.19389 (  0) 0) |
| [25] |
陈宇. 桉叶挥发油制剂开发及其抗慢性支气管炎的药效研究[D]. 天津: 天津大学, 2008.
(  0) 0) |
| [26] |
SADLON A E, LAMSON D W. Immune-modifying and antimicrobial effects of Eucalyptus oil and simple inhalation devices
[J]. Alternative Medicine Review: A Journal of Clinical Therapeutic, 2010, 15(1): 33. (  0) 0) |
| [27] |
欧阳五庆, 杨增岐, 李雅. 恩诺沙星对人工诱发的鸡大肠杆菌病的疗效[J]. 西北农业大学学报, 1998, 76-79. (  0) 0) |
 2021, Vol. 42
2021, Vol. 42


