2. 中国科学院 近代物理研究所,甘肃 兰州,730000
2. Institute of Modern Physics, Chinese Academy of Sciences, Lanzhou 730000, China
优异种质资源是提升水稻Oryza sativa L.新品种选育效率的物质基础[1-2]。各种物理或化学诱变因素均可诱导生物产生遗传物质的改变,从而产生新的种质资源。空间诱变技术和重离子诱变技术在诱发产生新的基因资源、创造优异新种质和培育作物新品种上已发挥重要作用[3-5]。空间诱变技术利用空间特殊环境诱发遗传物质变异。空间特殊环境具有强辐射、微重力、高真空、弱磁场等特点[6],其中,辐射与生物体的变异关系最为密切,当生物被宇宙高能粒子击中,会产生各种DNA和染色体结构的变化,并影响基因的表达[7-8]。重离子诱变技术通过注入的高能带电粒子与生物体内的分子或原子发生弹性、非弹性的碰撞,导致生物体内的电离损伤,进而使DNA损伤,染色体畸变。重离子束具有传能线密度高和能量峰特点,所产生的生物学效应比传统的X射线及γ射线要大[9]。现有研究表明,空间环境与重离子辐射诱发的变异在细胞、基因及蛋白水平具有一定的相似性。史金铭[8]发现无论是空间飞行还是低剂量(2 Gy)重离子辐射都能够引起水稻种子DNA甲基化的变化。Shi等[10]利用AFLP和MSAP方法检测空间诱变及重离子诱变水稻基因组和表观遗传变异的结果表明,2种方法都能够显著地改变水稻基因组和表观基因组,并且重离子诱变与空间诱变具有20%的相同变异位点。Wei等[11]比较空间诱变和C离子、Ne离子及Fe离子辐照的结果表明,空间环境和重离子诱变均可以影响根尖的有丝分裂,诱发各种染色体畸变,包括微核、染色体桥、染色体落后片段。王巍[12]比较重离子辐射与空间搭载后水稻的蛋白表达谱特征发现,2 mGy、62.2 keV/μm的12C离子辐射蛋白表达特征与空间环境的最为类似。上述结果对于理解空间诱变与重离子诱变效应提供了有益参考,但有关2种诱变技术对于水稻的生物学效应及后代变异频率的比较研究鲜见报道。
本研究对水稻纯系品种‘华航31号’干种子进行空间诱变和重离子诱变处理,并对诱变一代进行了表型及细胞学诱变效应的分析;对诱变二代直链淀粉含量及粒型性状进行了表型和基因型的定向筛选,获得系列候选突变体;比较了2种诱变处理的性状变异频率。为水稻诱变育种以及诱变后代的高效筛选提供理论参考和实践指导。
1 材料与方法 1.1 材料‘华航31号’是华南农业大学国家植物航天育种工程技术研究中心育成的感温型水稻纯系品种,已通过广东省农作物品种审定,农艺性状稳定。
1.2 方法 1.2.1 诱变处理水稻干种子分成3份:一份经“实践十号”返回式科学实验卫星搭载(2016年4月6日发射),在轨时间12 d,轨道高度200~500 km;另一份送往中国科学院兰州近代物理研究所,利用重离子研究装置HIRFL提供的12C6+束流进行干种子辐照处理,重离子能量80.55 MeV/u,辐照剂量率为20 Gy/min,辐照剂量分别为5、10、20、40、80和160 Gy;剩下的作为对照,不进行诱变处理。诱变后的种子为诱变一代(M1),种植于华南农业大学教学科研基地水稻育种试验田,播种前种植田块需翻地浸泡2个月,以避免前茬落粒谷的影响;M1单株主穗收获得诱变二代(M2)种子,种植于华南农业大学增城教学科研基地。2017年3月8日播种M1,尼龙薄膜育秧,秧龄22 d左右;2017年7月20日播种M2,秧龄13 d左右。长势良好的秧苗移栽至大田,大田为完整田块,肥力均匀;秧苗单株插植,行株距20 cm×20 cm;上半年每667 m2施尿素20 kg,下半年每667 m2施尿素21 kg;分蘖期、抽穗期、齐穗期每667 m2用16%(φ)纹病清40 g+20%(φ)三环唑100 g+18%(φ)杀虫双300 g+20%(φ)稻虱净20 g兑水100 kg,喷雾防治稻纵卷叶螟、三化螟、纹枯病、稻瘟病、白叶枯病等病虫害。
1.2.2 种子活力测定取种子发芽盒(12 cm×12 cm×6 cm),垫入2张吸水纸,加入ddH2O充分浸湿。各处理取100粒种子均匀放入发芽盒,30 ℃恒温培养,每个处理3次重复。每天调查发芽种子数量,第3天调查发芽势,第7天调查发芽终期的发芽率,第8天测定芽长。计算各处理种子的发芽率、发芽势、发芽指数、活力指数,估算空间诱变及重离子诱变对‘华航31号’的生理损伤效应[13]。
1.2.3 根尖染色体观察参考刘向东等[14]的压片法制作水稻根尖临时标本,进行染色体观察。取发芽后的水稻根尖(约0.5 cm)经固定、解离、染色、压片后,400倍显微镜观察有丝分裂情况,再用1 000倍显微镜观察有丝分裂染色体异常情况。将诱变种子分为2次重复进行发芽并切取根尖,每个剂量随机观察20~30个水稻根尖,每个根尖观察300~400个细胞。
1.2.4 农艺性状及直链淀粉含量测定调查M1代处理及对照各30株,调查性状包括株高、剑叶长、剑叶宽、穗质量、穗长、有效穗数、结实率、谷粒长、谷粒宽、长宽比、千粒质量。空间诱变和重离子诱变M2各种植约20 000株,成熟期调查所有植株的粒长、粒宽,筛选粒型突变体。计算对照的平均值
将空间诱变及重离子诱变M2群体和对照分别进行单株收获后脱粒,利用砻谷机(大竹FC2K)碾磨成糙米。采用基于波通DA7200型近红外分析仪的糙米直链淀粉含量(AC值)检测模型进行检测。用于直链淀粉含量检测的模型有3个(M5、M6和M32),将3个模型检测出来的AC值的平均值作为该样品的最终AC值。计算对照的平均值及标准差,求出
采用磁珠法提取水稻基因组DNA[15]。将Wxa和Wxb扩增产物分别按1∶1、3∶1、5∶1、7∶1、9∶1、11∶1的比例混合构成6个不同倍率的DNA混合池用于HRM检测(引物见表1),确定最适的DNA混合池倍率。‘华航31号’诱变M2代单株DNA按4株混合提取DNA,采用微孔板分光光度计(EPOCH2T)测定DNA质量浓度并调至50 ng/µL。
|
|
表 1 用于HRM检测的特异引物信息 Table 1 Specific primer information for HRM detection |
根据GRAMENE(
将筛选得到的疑似突变混合池对应单株进行DNA提取并统一稀释至50 ng/µL,将单株DNA与对照DNA按1∶1混合后进行巢式PCR扩增,扩增产物进行HRM检测,检测方法同上。将筛选得到的疑似突变单株进行特异性引物扩增,其引物为用于HRM检测的巢式PCR引物的外引物。PCR反应体系含2×Taq Plus Master Mix 25.0 µL、10.0 µmol/L引物2.0 µL、模板DNA 2.0 µL,加ddH2O至50 µL。PCR反应:95 ℃预变性5 min;95 ℃变性30 s,25 ℃退火30 s,72 ℃延伸30 s,35个循环;72 ℃延伸5 min。PCR产物经20 g/L琼脂糖凝胶电泳检测条带明显且单一后,送至赛默飞世尔科技(中国)有限公司进行测序,序列比对软件为CLC Sequence Viewer 7.7。
2 结果与分析 2.1 空间诱变和重离子诱变处理水稻种子M1代生物学效应 2.1.1 M1代种子活力和农艺性状M1代种子发芽试验结果(表2)表明,空间诱变和重离子诱变均对种子的活力产生了不同程度的影响。与对照相比,重离子辐照后发芽势、发芽率、芽长、发芽指数、活力指数均呈下降趋势,其中,活力指数相对效应为−25.22% ~ −9.01%,表明重离子辐照对种子活力表现为较明显的抑制作用。空间诱变提升了种子的发芽势、发芽率和发芽指数,但芽长比对照降低了16.53%,导致活力指数比对照降低14.62%。此外,不同剂量重离子辐照后,发芽势、芽长、发芽指数和活力指数均表现出马鞍型剂量效应曲线(图1),即在中低剂量(小于20 Gy)下,损伤效应随着剂量的增加而增加,但辐照剂量增加到一定程度后损伤效应反而减少,表明水稻种子对于重离子的辐照具有阈值效应。空间诱变效应与低剂量(小于10 Gy)重离子诱变效应相似,但也存在一定差异,主要表现为空间诱变显著降低了种子芽长。
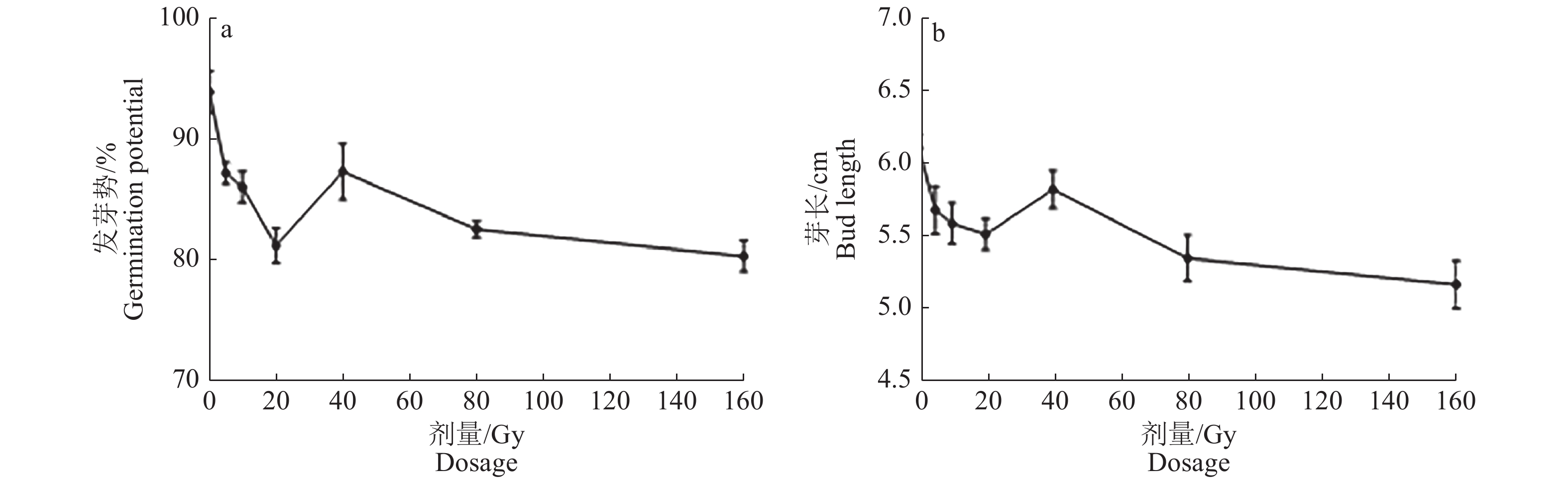
|
图 1 不同剂量重离子辐射的种子发芽势和芽长 Fig. 1 The germination potential and bud length of rice seeds treated by different doses of heavy ion radiation |
|
|
表 2 空间诱变及重离子诱变对种子活力的影响1) Table 2 Effects of space mutation and heavy ion mutation on seed vigor |
观察空间诱变与重离子诱变水稻种子M1代植株的田间表现,并没有发现明显的分离现象。考察各诱变处理当代植株的主要农艺性状,结果见表3。由表3可见,空间诱变处理的水稻种子M1代穗长和每穗粒数与对照有极显著差异(P<0.01),其他农艺性状与对照差异不显著;重离子诱变处理的水稻种子M1代穗长和每穗粒数显著低于对照,其中,每穗粒数与对照差异极显著,表明重离子诱变导致的生物学损伤从种子的发芽期延续到成熟期。
|
|
表 3 空间诱变和重离子诱变的水稻种子M1代植株主要农艺性状 1) Table 3 The main agronomic characters of contemporary plants of rice seeds treated by space mutation and heavy ion mutation |
有丝分裂指数反映了细胞的活跃程度,微核及畸变染色体均体现了染色体的严重损伤,表4为有丝分裂指数、微核千分率及染色体畸变率的统计结果。由表4可见,空间诱变和重离子辐射均诱发了水稻根尖细胞有丝分裂的异常,随着重离子辐射剂量的增加,水稻有丝分裂指数逐渐降低,而微核千分率及染色体畸变率逐渐增加,160 Gy处理的染色体畸变率是5 Gy处理的2.5倍。空间诱变导致有丝分裂指数降低、微核千分率及染色体畸变率增加,变异效应与中低剂量(5 Gy)重离子辐射相似。空间诱变或重离子诱变处理后,观察到单桥、双桥、断片、落后染色体或不均等分裂等不同畸变染色体类型,其中,断片是最常见的类型(图2)。
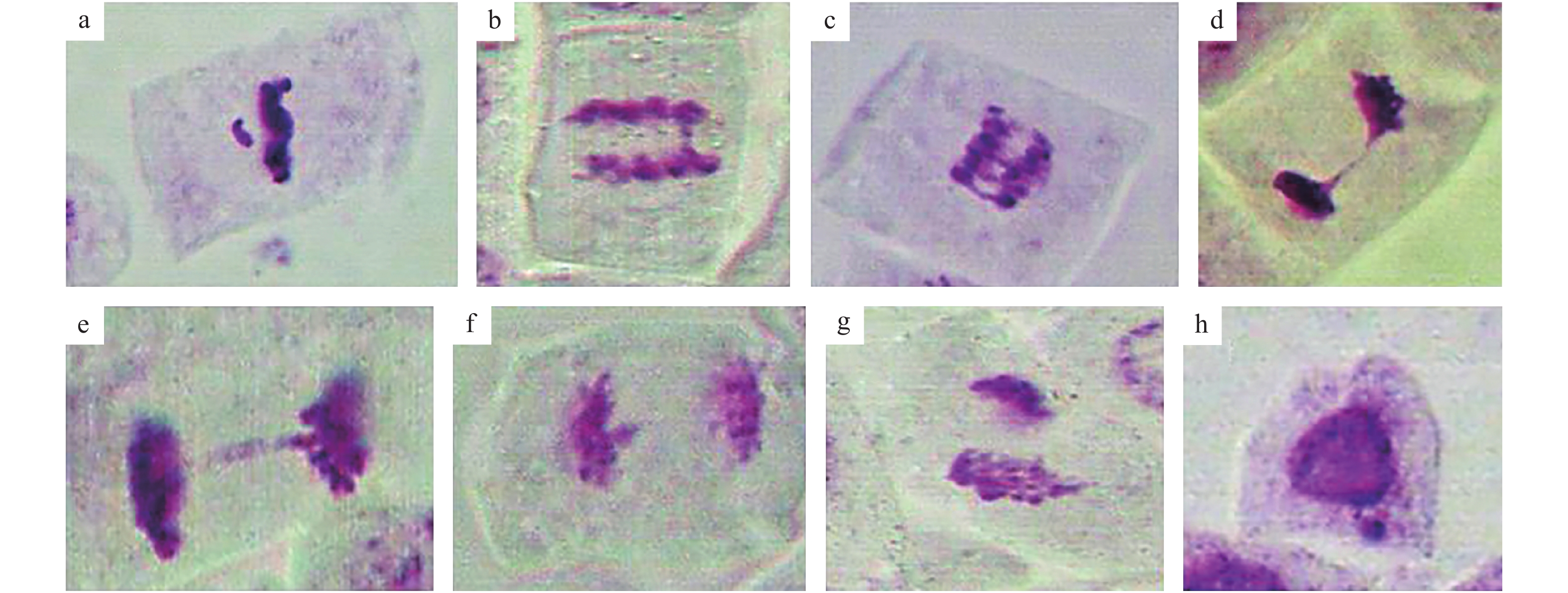
|
图 2 诱变处理后水稻M1代植株根尖细胞有丝分裂染色体异常 Fig. 2 Chromosomal abnormality of apical mitosis of root tip cells of contemporary rice plants after mutagenic treatment a:断片;b:单桥;c:多桥;d,e:后期单桥;f:染色体落后;g:不均等分裂;h:微核 a: Fragment; b: Single bridge; c: Polybridge; d,e: Single bridge at anaphase; f: Chromosome lag; g: Unequal cell division; h: Micronucleus |
|
|
表 4 空间诱变和重离子诱变对水稻M1代植株根尖细胞的影响1) Table 4 Effects of space mutation and heavy ion mutation on root tip cells of contemporary rice plants |
为筛选不同类型的粒型突变体,对‘华航31号’空间诱变及重离子(80 Gy剂量处理)诱变M2代单株籽粒的粒长、粒宽进行了测量,共测量14 754份材料,其中,空间诱变处理5 991份、重离子诱变处理8 733份、对照30份。对各粒型性状的统计分析结果如表5所示。从表5可以看出,空间诱变及重离子M2代的粒长、粒宽以及粒长宽比的平均值与对照差异不显著,但粒长的变异系数高于对照;M2代各粒型性状的变异幅度均明显大于对照,表明2种诱变处理的M2代均存在粒型差异明显的单株类型。参照
|
|
表 5 空间诱变及重离子诱变水稻M2代粒型变异 Table 5 Grain type variation in the second generation of rice seeds treated by space mutation and heavy ion mutation |
依据突变体筛选标准,空间诱变处理5 991份材料共筛选到248份突变材料,其中,粒长变长的80份、变短的140份,粒宽变宽的20份、变窄的8份,粒长宽比变大的4份、变小的36份;80 Gy重离子诱变处理8 733份材料共筛选到426份突变材料,其中,粒长变长的192份、变短的99份,粒宽变宽的51份、变窄的81份,粒长宽比变大的117份、变小的72份。空间诱变及重离子诱变的粒型变异频率分别为4.14%和4.88%;空间诱变处理的突变材料中具有2个及以上性状变异的占17.74%,而重离子诱变处理的占16.25%。可见,空间诱变粒型突变材料多为粒长变短、粒宽变宽、粒长宽比变小,而重离子诱变的粒型突变材料的粒长多为变长、粒宽变窄、粒长宽比变大;空间诱变与80 Gy重离子辐射对于粒型的诱变频率相近,但2种方法诱发变异的趋势不一致。
2.2.2 M2代直链淀粉含量突变体对空间诱变及80 Gy重离子诱变M2代共7 549份材料的糙米采用近红外光谱技术测定直链淀粉含量,其中,空间诱变处理3 674份、重离子诱变处理3 875份。表6的结果表明,空间诱变及重离子诱变M2代的直链淀粉含量的平均值与对照差异不显著,但变异系数及变异幅度均明显大于对照,表明2种诱变处理后代存在较大变异。按照
|
|
表 6 空间诱变和重离子诱变水稻M2代直链淀粉含量变异 Table 6 Variation of amylose content in the second generation of rice seeds treated by space mutation and heavy ion mutation |
将Wxa和Wxb扩增产物按1∶1、3∶1、5∶1、7∶1、9∶1、11∶1的比例混合构建不同倍率DNA混合池用于HRM检测分析,结果如图3所示。在差异曲线中,将|ΔF|>0.05看作是差异显著,表明存在疑似突变[16]。综合各比例DNA混合池的检测结果,混合池比例在9∶1(10倍池)时差异曲线的|ΔF|都在0.05以上。考虑到实际检测中可能存在杂合体的情况,为保证突变检测的灵敏度,最终选用4倍池作为群体检测的倍率。另外,检测单株时需保证样品的杂合型,因此需将单株DNA与对照1∶1混合构建2倍池进行检测。
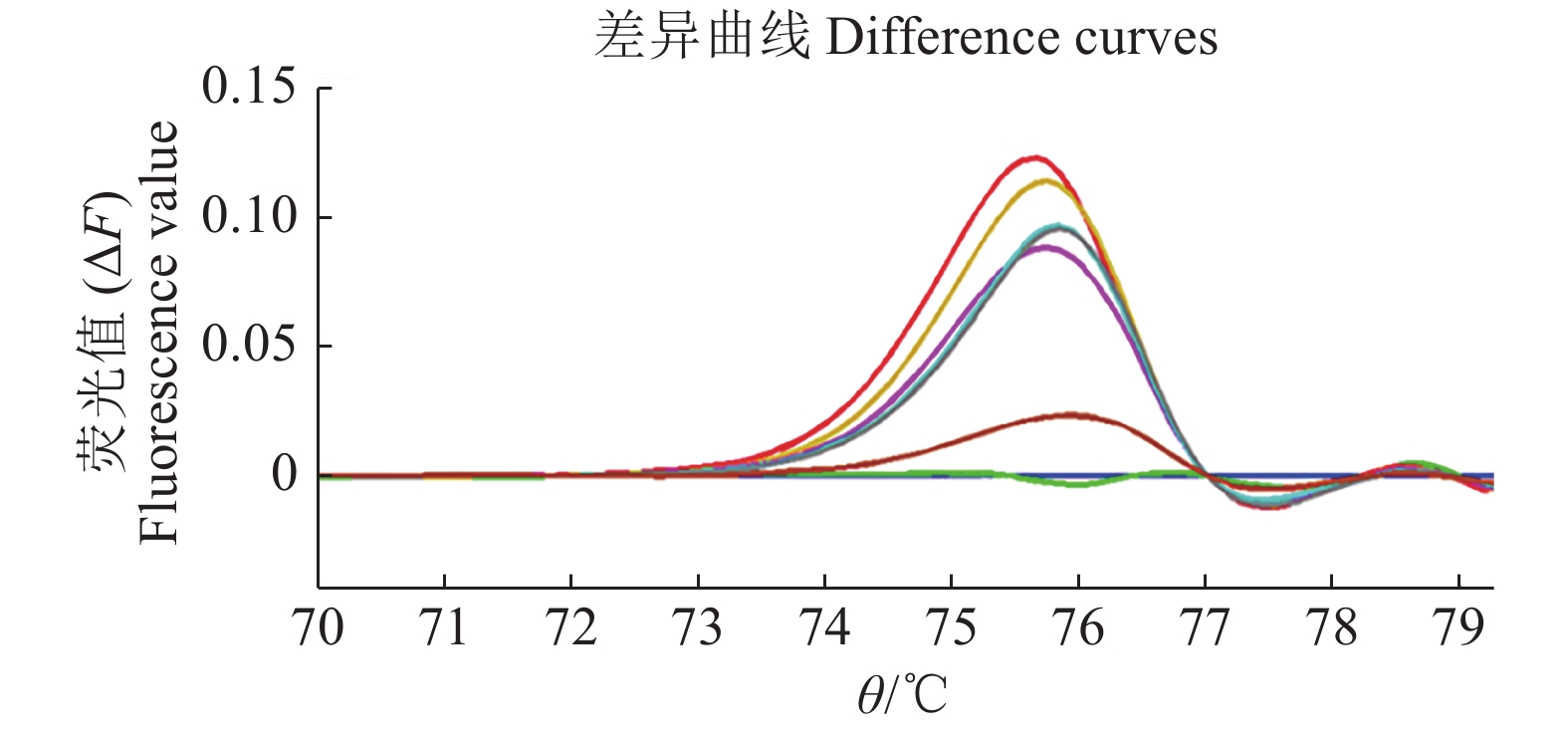
|
图 3 不同比例DNA混合池Wx基因的HRM检测结果 Fig. 3 HRM detection result of DNA mixed pool with different proportion 红色:1∶1混合池;橙色:3∶1混合池;松绿:7∶1混合池;灰色:9∶1混合池;粉色:5∶1混合池;深红:11∶1混合池;绿色:Wxb基因;蓝色:Wxa基因 Red: 1∶1; Orange: 1∶1;Turquoise: 7∶1; Grey: 9∶1; Pink: 5∶1; Dark red: 11∶1; Green: Wxb gene; Blue: Wxa gene |
4 736份水稻空间诱变M2代单株构建1 184个4倍DNA混合池,4 848份水稻重离子诱变M2代单株构建1 212个4倍DNA混合池。每个PCR96孔板放置93个DNA混合池和3个对照DNA,并统一稀释质量浓度至50 ng/µL后进行高分辨率溶解曲线(High resolution melting curve,HRM)检测分析。图4所示的是其中一个96孔板DNA混合池的4对巢式PCR引物扩增产物的HRM检测结果。图4可以看出,在Wxab-O和Wxab-I引物扩增产物、EX9-O和EX9-I引物扩增产物以及EX10-O和EX10-I引物扩增产物的检测中分别有2、4和1个|ΔF|>0.05的红色差异曲线,视为疑似突变池(图4a、4c、4d)。EX4-O和EX4-I引物扩增产物并无检测到差异曲线(图4b)。空间诱变共筛选到9个疑似突变池,其中Wxa与Wxb差异位点检测区域3个、exon 4检测区域3个、exon 9检测区域2个、exon 10检测区域1个;重离子诱变共筛选到14个疑似突变池,其中Wxa与Wxb差异位点检测区域5个、exon 4检测区域3个、exon 9检测区域2个、exon 10检测区域4个。
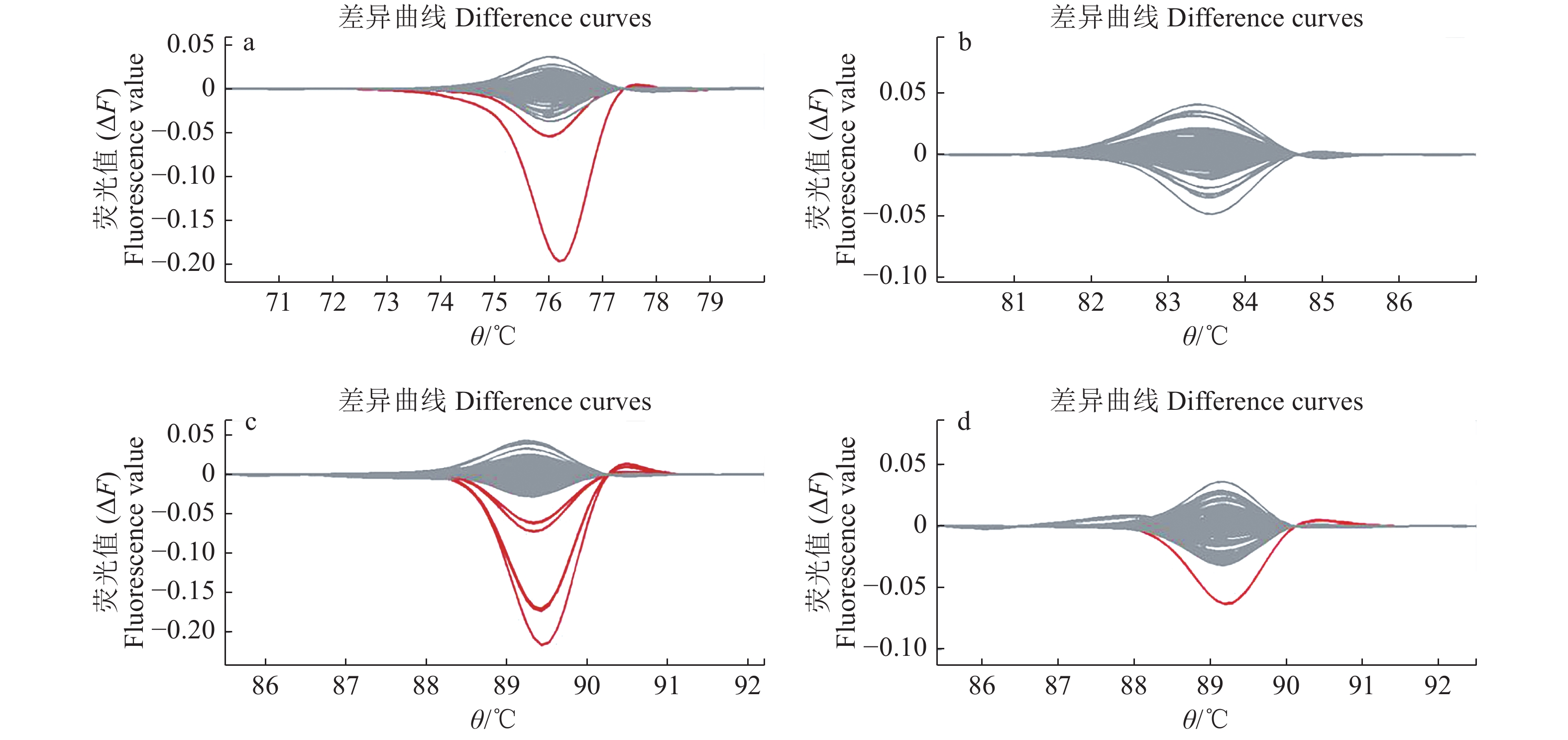
|
图 4 DNA混合池的4对巢式PCR引物扩增产物的HRM检测结果 Fig. 4 HRM detections of four pairs of nested PCR primer amplification products in DNA mixing cell a:Wxab-O和Wxab-I引物扩增产物检测;b:EX4-O和EX4-I引物扩增产物检测;c:EX9-O和EX9-I引物扩增产物检测;d:EX10-O和EX10-I引物扩增产物检测 a: Detecting amplifications of primers Wxab-O and Wxab-I; b: Detecting amplifications of primers EX4-O and EX4-I; c: Detecting amplifications of primers EX9-O and EX9-I; d: Detecting amplifications of primers EX10-O and EX10-I |
将23个突变池对应的92个单株以及对照分别提取DNA,利用巢式PCR的外引物进行扩增,回收PCR片段进行测序。空间诱变后代共鉴定到3个Wx基因突变体,全部位于Wxa与Wxb差异位点,均为Wxa型;重离子诱变后代共鉴定到4个Wx基因突变体,其中,Wxa与Wxb差异位点检测区域2个、exon 10检测区域2个。图5是重离子诱变exon 10突变体的测序结果。测序显示该突变单株在第10外显子的第115位点产生了C

|
图 5 重离子诱变exon 10突变体序列分析结果 Fig. 5 The results of sequence analysis of exon 10 mutant induced by heavy ion a:检测区域的序列分析,外显子区域由绿色标注,差异位点由红色标注;b:exon 10翻译的蛋白序列分析;c:对照Sanger测序峰图;d:突变体Sanger测序峰图 a: Sequence analysis, green for exon and red for mutation site; b: Protein sequence of exon 10; c: Sanger sequencing results of CK; d: Sanger sequencing results of the mutant |
诱变育种的诱变M1代往往以生理损伤为主,在诱变M2代时才开始发生大量的性状分离,出现各种变异性状。空间诱变M1代生理损伤低,在生物学效应、突变频率和突变方向等方面呈现出与地面其他传统诱变方式不同的性状变异特点[5]。马良勇等[17]比较了不同的航天搭载对10份籼稻材料的诱变效果,研究表明各航天器搭载材料的诱变M1代发芽率与成苗率相较对照都有所降低,其中“神州4号”搭载材料最低。诱变M2代出现株高、生育期及其他类型的变异,其中“实践8号”搭载材料的变异频率介于0.24%~7.23%,5个材料的平均变异频率为3.38%;返回式卫星搭载材料的变异频率介于1.06%~1.37%,平均为1.24%;而“神州4号”搭载材料的变异频率为2.79%。可见不同的空间搭载以及不同的材料,其诱变效应具有明显差异,刘永柱等[18]和俞法明等[19]的研究也证实了这一点。此外,空间诱变M2代大部分性状变异还表现出一定的倾向性。严文潮等[13]和黄永相等[20]发现空间处理后水稻株高、抽穗期、粒型、直链淀粉含量等突变的方向、频率与基因型有关,突变具有一定的倾向性。
重离子辐射具有生物学效应高的特点,在诱变育种中具有重要价值。Xu等[21]利用2种不同剂量的重离子辐照3个品种水稻种子,发现在低剂量下种子发芽率、存活率(除‘日本晴’)、秧苗高度都没有显著变化,中剂量下种子发芽率和存活率影响显著,低剂量突变率4.71%、中剂量突变率5.22%。卢明[22]研究表明14C离子和7Li离子辐照的水稻种子发芽势和发芽率均低于对照,且随着剂量的增加先增加后降低,发芽势、发芽率与剂量之间呈明显的“马鞍型”剂量效应曲线。Wei等[11]比较空间诱变和C离子、Ne离子及Fe离子辐照,发现空间诱变导致的有丝分裂指数和染色体畸变率最高。梅曼彤等[23]研究表明,高LET的重离子能更有效地抑制水稻种子萌发、幼苗生长,诱导根尖细胞和花粉母细胞的染色体畸变,降低当代植株的结实率并诱发后代出现形态性状及农艺性状的变异;程维民等[24]和杨瑰丽等[25]的研究也证实了这一点。本研究发现,重离子辐射水稻种子后M1代的发芽势、芽长、发芽指数及活力指数均随着剂量的增加呈先下降后上升而后再下降的“马鞍”型曲线,与前人的研究[23-25]一致;当辐照剂量为80和160 Gy时,M1代植株结实率显著低于对照,而5~40 Gy辐照剂量下结实率与对照没有显著差异,表明重离子诱变对结实率的影响存在剂量阈值。在细胞学方面,本研究发现重离子诱变对水稻根尖分生组织细胞有丝分裂产生影响,随着剂量的增加,水稻根尖有丝分裂指数降低,染色体的畸变率增加;细胞染色体畸变有染色体断片、染色体桥、染色体落后、染色体不均等分裂等异常,且伴有微核的产生,这与前人的结果[26]是一致的。
本研究对空间诱变及重离子诱变M1代的种子活力、主要农艺性状以及诱变M2代的主要农艺性状进行了调查。结果表明,空间诱变对诱变M1代的影响,以轻微的生理损伤为主;重离子诱变的生理损伤要明显高于空间诱变,重离子诱变M1代的生理损伤为37.74%,而空间诱变M1代的生理损伤为6.55%。2种诱变处理产生的性状变异及变异频率存在差异。对9 665株空间诱变M2代的粒型、直链淀粉含量进行表型和基因型突变筛选,共发现各种类型突变体310份,突变频率为3.21%;对12 608株重离子(80 Gy)诱变M2代单株进行了同样性状筛选,共发现各种类型突变体490份,突变频率3.89%。在变异的方向上,空间诱变粒型突变材料多以粒长变短、粒宽变宽、粒长宽比变小、直链淀粉含量升高为主;重离子诱变多以粒长变长、粒宽变窄、粒长宽比变大为主,直链淀粉含量变异无规律。综合而言,空间诱变的生理损伤类似于低剂量重离子辐射,变异频率与高剂量重离子辐射相近。易继财等[27]对返回式卫星诱导水稻突变的研究表明,空间诱变的辐射剂量约为3 mGy,相比较地面重离子辐射而言是比较低的辐射剂量。虽然空间诱变与重离子辐射诱变的方式不一样,但本研究发现空间诱变诱发表型变异频率与80 Gy重离子辐射相近,这表明低剂量辐射也可以诱发变异,骆艺等[28]报道低剂量空间重离子辐射可以诱发水稻产生遗传变异,与本研究结果一致。此外,低剂量空间辐射诱变的变异机制也可能与高真空、微重力的空间复杂环境协作效应有关。
3.2 诱变后代的定向选择方法比较对于诱变育种,如何高效、精确地筛选符合要求的突变体是育种工作者关注的重点。目前,育种工作者多是从诱变后代中筛选表型明显变异的、符合育种目标的突变单株,但局限于肉眼或简单测量可以获得的表型,对于一些需要大量分析的性状(如化学物质含量)则难以鉴定。与传统诱变育种的表型筛选相比,分子标记能够有针对性地对目的基因进行突变筛选,排除了环境的干扰,目的性更强。将表型选择与基因型选择有机结合,是提高诱变后代筛选效率的有效途径。
本研究利用高通量扫描系统获取粒型信息、利用近红外无损分析获得直链淀粉含量变异信息,提升了表型检测效率;将HRM引入到基因型鉴定,为诱变后代基因型的定向筛选提供了有益参考。HRM技术是通过检测与饱和荧光染料结合的DNA双链在解链过程中的荧光强度变化趋势进而绘制成溶解曲线,并通过分析曲线的差异实现对DNA双链差异的检测和分类[28],目前已普遍应用于基因分型、突变筛选和DNA甲基化研究等方面[29]。该技术具有高通量、高分辨率、灵敏度和特异性高的特点;操作简单,成本低,无须酶切系统,只需要在PCR过程中加入荧光染料即可检测;闭管操作,产物无污染,可用于后续试验等诸多优点。本研究针对HRM检测方法的要求,对直链淀粉含量Wx基因设计了多个目的位点,利用DNA混合样品、巢式PCR及突变测序提高鉴定的效率和准确性。Bush等[15]提出的ITILLING是对传统的TILLING的方法进行改进和简化,利用来自Bio-Rad实验室的CFX96 PCR检测系统,分辨率比Light Scanner系统低,检测的目的片段大小为95~125 bp。本研究利用的Light Scanner系统与之相比更灵敏,检测的目的片段更大,提高了检测效率。
本研究利用HRM技术在空间诱变及重离子诱变后代中共鉴定出7个Wx基因突变体。其中,筛选到的一个突变单株在Wx基因的第10外显子的第115位点产生了C/T的错义突变,密码子由CCU变成UCU,由编码脯氨酸变成了编码丝氨酸,说明HRM技术可以应用于突变筛选。
3.3 空间诱变与重离子诱变的分子突变频率分析突变密度的大小决定着突变获得的难易程度,突变密度与诱变材料、诱变手段以及检测手段密切相关[30]。表型变异的鉴别容易受到筛选规模和环境的影响,基因组层面的筛选可以更准确地反映突变率。全基因组测序是分析辐射诱发变异的理想手段,但受限于测序样本的数量和成本,难以大规模进行突变调查。利用TILLING技术对目的DNA片段进行诱变群体的大量调查,进而分析分子突变频率是一个可行的解决办法。Landau等[31]利用X射线和NaN3组合诱变二倍体大麦,利用TILLING筛选33个质体基因,至少发现61个独立突变,突变密度约1/211.6 kb(即每211.6 kb有1个突变)。Botticella等[32]利用EMS诱变六倍体小麦,利用TILLING技术结合HRM检测手段筛选出3个编码淀粉分支酶的同源等位基因,突变密度为1/40 kb。Kim等[33]分别用NaN3、EMS和MNU组合诱变水稻,经过测序检测控制植酸6个基因家族的基因,获得293个突变,突变密度为1/277 kb。王彩芬等[34]利用TILLING技术筛选水稻耐盐基因SKC1突变体,共获得4个突变,突变密度为1/526.3 kb。Hwang等[35]分别用200和300 Gy的γ射线诱变水稻,利用TILLING筛选9个跨膜转运基因,共鉴定出41个突变,突变密度为1/744.6 kb。上述结果表明,通过扫描特定DNA片段并分析序列变异,可以计算分子突变频率。
本研究利用HRM技术扫描了水稻直链淀粉Wx基因的4个位点共673 bp序列,空间诱变4 736份样本中发现3个SNP变异,突变密度为1/1063.83 kb;重离子诱变4848份样本中发现4个SNP变异,突变密度为1/815.68 kb。本研究中,空间诱变和重离子诱变的分子突变频率与Hwang等[35]的结果类似,但显著低于已报道的化学诱变或化学物理组合诱变的分子突变频率。这可能与本研究中HRM检测特性有关,HRM可有效检测SNP变异,但对小片段DNA插入或缺失突变的检测效率不高。重离子辐射可以诱发SNP和插入缺失突变[35-36],本研究中可能对于插入缺失突变的检测效率较低,导致检测到的分子突变频率偏低;与重离子辐射不同的是,化学诱变剂诱发以SNP为主的序列变异,在TILLING 检测中更容易被鉴定,导致分子突变频率较高。本研究下一步拟利用混合样品靶向测序技术开展基因组突变检测,以便准确地比较不同诱变方式的分子突变频率。
3.4 结论本研究发现空间诱变与重离子辐射对于水稻诱变M1代具有一定的抑制效应,并且空间诱变与低剂量重离子辐射的生物学效应相近。空间诱变M2代的突变频率为3.21%,80 Gy重离子辐射诱变M2代的突变频率为3.89%。在变异的方向上,空间诱变突变多以粒长变短、粒宽变宽、粒长宽比变小、直链淀粉含量升高为主;重离子诱变以粒长变长、粒宽变窄、粒长宽比变大为主,而直链淀粉含量变异无明显规律。可见,空间诱变的生理损伤类似于低剂量重离子辐射,而诱发变异的频率与高剂量重离子辐射相近。
| [1] |
ZHAO K, TUNG C W, EIZENGA G C, et al. Genome-wide association mapping reveals a rich genetic architecture of complex traits in Oryza sativa
[J]. Nature Communications, 2011, 2(1): 467. DOI:10.1038/ncomms1467 (  0) 0) |
| [2] |
GLASZMANN J C, KILIAN B, UPADHYAYVA H D, et al. Accessing genetic diversity for crop improvement[J]. Current Opinion in Plant Biology, 2010, 13(2): 167-173. DOI:10.1016/j.pbi.2010.01.004 (  0) 0) |
| [3] |
刘录祥, 王晶, 赵林姝, 等. 作物空间诱变效应及其地面模拟研究进展[J]. 核农学报, 2004, 18(4): 247-251. DOI:10.3969/j.issn.1000-8551.2004.04.002 (  0) 0) |
| [4] |
周利斌, 李文建, 曲颖, 等. 重离子束辐照育种研究进展及发展趋势[J]. 原子核物理评论, 2008(2): 71-76. (  0) 0) |
| [5] |
陈志强, 郭涛, 刘永柱, 等. 水稻航天育种研究进展与展望[J]. 华南农业大学学报, 2009, 30(1): 7-11. (  0) 0) |
| [6] |
李东芳, 倪丕冲, 沈桂芳. 水稻航天诱变育种及其机理研究的进展与展望[J]. 生物技术通报, 2004(3): 23-25. DOI:10.3969/j.issn.1002-5464.2004.03.006 (  0) 0) |
| [7] |
樊秋玲, 刘敏. 空间育种研究进展[J]. 航天医学与医学工程, 2002, 15(3): 231-234. DOI:10.3969/j.issn.1002-0837.2002.03.020 (  0) 0) |
| [8] |
史金铭. 空间和重离子辐射环境的诱变效应与DNA甲基化变化的关联[D]. 哈尔滨: 哈尔滨工业大学, 2010.
(  0) 0) |
| [9] |
OGATA T, TESHIMA T, KAGAWA K, et al. Particle irradiation suppresses metastatic potential of cancer cells[J]. Cancer Research, 2005, 65(1): 113-120. (  0) 0) |
| [10] |
SHI J M, LU W H, SUN Y Q. Comparison of space flight and heavy ion radiation induced genomic/epigenomic mutations in rice (Oryza sativa)
[J]. Life Sciences in Space Research, 2014(1): 74-79. (  0) 0) |
| [11] |
WEI L, YANG Q, XIA H, et al. Analysis of cytogenetic damage in rice seeds induced by energetic heavy ions on-ground and after spaceflight[J]. Journal of Radiation Research, 2006, 47(3/4): 273-278. DOI:10.1269/jrr.0613 (  0) 0) |
| [12] |
王巍. 空间诱导水稻蛋白变化特征及空间辐射地基模拟诱因分析[D]. 哈尔滨: 哈尔滨工业大学, 2011.
(  0) 0) |
| [13] |
严文潮, 徐建龙, 俞法明, 等. 不同早籼基因型水稻的空间诱变效应研究[J]. 核农学报, 2004, 18(3): 174-178. DOI:10.3969/j.issn.1000-8551.2004.03.005 (  0) 0) |
| [14] |
刘向东, 卢永根. 整体荧光原位杂交用于检测水稻特异DNA程序的研究[J]. 华南农业大学学报, 1998, 19(3): 1-4. (  0) 0) |
| [15] |
BUSH S M, KRYSAN P J. ITILLING: A personalized approach to the identification of induced mutations in Arabidopsis
[J]. Plant Physiology, 2010, 154(1): 25-35. DOI:10.1104/pp.110.159897 (  0) 0) |
| [16] |
SIMKO I. High-resolution DNA melting analysis in plant research[J]. Trends in Plant Science, 2016, 21(6): 528-537. DOI:10.1016/j.tplants.2016.01.004 (  0) 0) |
| [17] |
马良勇, 季芝娟, 曾宇翔, 等. 不同航天器搭载对籼稻诱变效果的比较[J]. 核农学报, 2011, 25(1): 7-11. (  0) 0) |
| [18] |
刘永柱, 许立超, 郭涛, 等. 2个三系杂交稻保持系航天诱变效应的研究[J]. 华南农业大学学报, 2013, 34(3): 292-299. DOI:10.7671/j.issn.1001-411X.2013.03.003 (  0) 0) |
| [19] |
俞法明, 严文潮, 毛雪琴, 等. 利用空间诱变技术进行早籼稻新品种的改良[J]. 核农学报, 2014, 28(6): 949-954. DOI:10.11869/j.issn.100-8551.2014.06.0949 (  0) 0) |
| [20] |
黄永相, 郭涛, 蔡金洋. 空间环境和60Co-γ辐照对水稻稻米品质的诱变效应
[J]. 核农学报, 2013, 27(6): 709-714. DOI:10.11869/hnxb.2013.06.0709 (  0) 0) |
| [21] |
XU X, LIU B, ZHANG L, et al. Mutagenic effects of heavy ion irradiation on rice seeds[J]. Nuclear Instruments & Methods in Physics Research, 2012, 290(1): 19-25. (  0) 0) |
| [22] |
卢明. 低能重离子C和Li及Co-γ射线对水稻的生物学效应研究[D]. 长沙: 湖南农业大学, 2005.
(  0) 0) |
| [23] |
梅曼彤, 邓红, 卢永根. 高能重离子辐射对水稻的生物学效应[J]. 作物学报, 1995, 21(3): 307-314. DOI:10.3321/j.issn:0496-3490.1995.03.008 (  0) 0) |
| [24] |
程维民, 刘斌美, 叶亚峰. 重离子辐照创建水稻直链淀粉、蛋白质突变系的研究[J]. 中国农学通报, 2016, 6(32): 86-90. (  0) 0) |
| [25] |
杨瑰丽, 陈莹, 郭涛, 等. 碳离子束辐照水稻诱变效应及突变体的筛选[J]. 华南农业大学学报, 2018, 39(2): 29-33. DOI:10.7671/j.issn.1001-411X.2018.02.005 (  0) 0) |
| [26] |
MANI S, TABIL L G, SOKHANSANJ S. Mechanical properties of corn stover grind[J]. Transactions of the ASAE, 2004, 47(6): 1983-1990. DOI:10.13031/2013.17786 (  0) 0) |
| [27] |
易继财, 庄楚雄, 姚涓, 等. 空间搭载诱导水稻种子突变的分子标记多态性分析[J]. 生物物理学报, 2002, 18(4): 478-483. DOI:10.3321/j.issn:1000-6737.2002.04.019 (  0) 0) |
| [28] |
骆艺, 王旭杰, 梅曼彤, 等. 空间搭载水稻种子后代基因组多态性及其与空间重离子辐射关系的探讨[J]. 生物物理学报, 2006, 22(2): 131-138. DOI:10.3321/j.issn:1000-6737.2006.02.010 (  0) 0) |
| [29] |
刘自增, 吴周良, 阎萍, 等. 高分辨率熔解曲线分析应用的研究进展[J]. 中国畜牧兽医, 2013, 40(8): 105-111. DOI:10.3969/j.issn.1671-7236.2013.08.024 (  0) 0) |
| [30] |
李贵成, 王林辉, 罗红兵. 重离子辐射玉米种子的细胞学观察[J]. 湖南农业大学学报(自然科学版), 2007, 33(5): 48-50. (  0) 0) |
| [31] |
LANDAU A, LENCINA F, PACHECO M G, et al. Plastome mutations and recombination events in barley chloroplast mutator seedlings[J]. Journal of Heredity, 2016, 107(3): 266-273. DOI:10.1093/jhered/esw003 (  0) 0) |
| [32] |
BOTTICELLA E, SESTILI F, HEMANDEZ-LOPEZ A, et al. High resolution melting analysis for the detection of EMS induced mutations in wheat SbeIIa genes
[J]. BMC Plant Biology, 2011, 11(1): 1-14. DOI:10.1186/1471-2229-11-1 (  0) 0) |
| [33] |
KIM S I, TAI T H. Identification of novel rice low phytic acid mutations via TILLING by sequencing[J]. Molecular Breeding, 2014, 34(4): 1731-1732. DOI:10.1007/s11032-014-0187-z (  0) 0) |
| [34] |
王彩芬, 马晓玲, 安永平, 等. TILLING术在水稻耐盐基因SKC1突变体筛选中的应用[J]. 作物杂志, 2013(5): 66-70. DOI:10.3969/j.issn.1001-7283.2013.05.019 (  0) 0) |
| [35] |
HWANG J E, JANG D S, LEE K J, et al. Identification of gamma ray irradiation-induced mutations in membrane transport genes in a rice population by TILLING[J]. Genes & Genetic Systems, 2016, 91(5): 245-256. (  0) 0) |
| [36] |
DU Y, LI W, YU L, et al. Mutagenic effects of carbon-ion irradiation on dry Arabidopsis thaliana seeds
[J]. Mutation Research, 2014, 759: 28-36. DOI:10.1016/j.mrgentox.2013.07.018 (  0) 0) |
 2021, Vol. 42
2021, Vol. 42


