细胞自噬(Autophagy)是真核生物中普遍存在并高度保守的生理过程。自噬通过形成具有双层膜的自噬体,将细胞中错误折叠的蛋白质、受损的细胞器运送到溶酶体降解后进行循环利用[1]。越来越多的研究表明,自噬是一个正常的细胞所必须的,是细胞主动的、受调控的生理过程[2]。自噬相关基因(Autophagy-related gene,Atg)所编码的蛋白(ATG)参与自噬体的形成和选择性自噬的调控[3]。
自1997年第1个自噬相关基因Atg1从酵母中被克隆以来[4],酵母中Atg5、Atg6和Atg13等自噬相关基因相继被克隆[5],后来Atg基因在果蝇Drosophila melanogaster、线虫Caenorhabditis elegans、小鼠Mus musculus、人类Homo sapiens等物种均被鉴定到。到2019年为止,真核生物中已经发现和鉴定了42个Atg基因[3],其中包括18个参与自噬体膜形成的核心Atg基因[6]。正常条件下,细胞会发生低水平的自噬,参与维持细胞内环境的动态平衡;当受到饥饿、温度变化、低氧等外界环境的刺激,细胞通过启动一系列的级联反应,触发自噬相关基因的表达而激活自噬,从而帮助细胞度过不良环境[7]。细菌和病毒等病原物的感染也能引发宿主的自噬响应,研究表明自噬参与病原物的清除[8-9],这种清除病原物的自噬作用被称为异体自噬(Xenophagy)[7]。
作为一种入侵的鳞翅目害虫,草地贪夜蛾Spodoptera frugiperda已经对我国玉米Zea mays、高粱Sorghum bicolor、甘蔗Saccharum officinarum等农作物的生产造成严重危害。草地贪夜蛾卵巢细胞系Sf9是传统上用于杆状病毒表达的细胞系,同时也是基础研究的常用细胞系。苜蓿丫纹夜蛾核型多角体病毒(Autographa californica multiple nucleopolyhedrovirus,AcMNPV)是杆状病毒的模式种,与Sf9细胞是一对研究病毒与宿主相互作用的模式代表,但鲜见AcMNPV与Sf9细胞在自噬应答方面相互作用的研究报道。本研究通过序列相似性和保守结构域分析,鉴定草地贪夜蛾自噬的相关基因及其对AcMNPV感染的自噬应答,以期研究草地贪夜蛾的自噬调控机制,为寻找调控防治草地贪夜蛾的dsRNA药物筛选靶点;另一方面,研究AcMNPV引起Sf9细胞的自噬应答及分子机制,以期为病毒杀虫剂在农业害虫防治上的应用提供理论依据。
1 材料与方法 1.1 材料草地贪夜蛾Sf9细胞、重组转移载体pFastBac HTb-EGFP由华南农业大学动物科学学院昆虫分子生物学与生物技术实验室保存。草地贪夜蛾Sf9细胞采用SFX昆虫培养基添加10%(φ)胎牛血清(Gibco)于28 ℃恒温培养箱培养。
PrimeScript™ RT reagent Kit (Perfect Real Time)和PrimeScript™ RT reagent Kit with gDNA Eraser购自Takara公司;Hieff SYBR Green Master Mix购自上海Yeasen公司;Bac-to-Bac表达系统试剂盒购自Invitrogen公司;转染试剂FuGENE HD Transfection Reagent购自Promega公司。
1.2 方法 1.2.1 草地贪夜蛾ATG序列的生物信息学分析以斜纹夜蛾Spodoptera litura、人类Homo sapiens、果蝇Drosophila melanogaster和家蚕Bombyx mori等物种中已经报道的ATG的氨基酸序列为基础,利用在线blast工具(
采用Bac-to-Bac系统构建带有绿色荧光的AcMNPV重组病毒[11-12]。将重组转移载体pFastBacHTb-EGFP转化含AcMNPV基因组的Escherichia coliDH10Bac感受态细胞,经抗性筛选和PCR鉴定获得重组杆粒Bacmid-EGFP。当Sf9细胞培养生长至六孔板的40%~50%时(对数生长期),将重组杆粒Bacmid-EGFP转染Sf9细胞,转染操作参考FuGENE HD Transfection Reagent说明书进行,转染72 h之后收集的上清液即为P1病毒。
1.2.3 病毒滴度测定采用TCID50法[13]测定重组病毒EGFP-AcMNPV的滴度,具体操作方法如下:Sf9细胞在96孔板中培养至生长密度为80%~90%时,遗弃培养基,依次加入经SFX 10倍系列稀释(10−1~10−10)的重组病毒EGFP-AcMNPV稀释液各100 μL,每个稀释度设8个重复;感染72 h后,使用倒置荧光显微镜进行观察,记录各稀释度病毒感染的细胞培养孔中出现和未出现病毒的孔数,以大约50%感染“临界值”的稀释度计算TCID50。
1.2.4 病毒感染Sf9细胞采用六孔板培养Sf9细胞,当细胞生长密度达到80%~90%时,加入重组病毒EGFP-AcMNPV,感染复数(MOI)为8。在感染6、12、24、36和48 h后,收集Sf9细胞,并同时取正常培养的Sf9细胞作为对照。
1.2.5 qRT-PCR检测Atg基因的转录活性收集Sf9细胞,采用Trizol法提取总RNA,经NanoDrop One微量分光光度计检测,D260 nm/D280 nm为1.8~2.0即合格,取1μg总RNA用于合成cDNA。
根据草地贪夜蛾Atg基因序列,利用Premier Primer 5.0设计荧光实时定量PCR引物,序列见表1。采用SYBR Green荧光定量PCR试剂盒,反应体系为SYBR Green混合液 (2×) 10 μL,引物(10 μmol/L)各0.2 μL,cDNA 0.1μL(相当于10 ng总RNA),加ddH2O至总体积20 μL。反应程序为:95 ℃预变性5 min; (95 ℃ 10 s,60 ℃ 20 s,72 ℃ 20 s)循环40次;溶解曲线在65~95 ℃每隔0.5 ℃采集1次,每次采集5 s,在CFX 96仪器(Bio-Rad)上进行反应。以草地贪夜蛾Ecdysoneless(ECD)基因作为内参基因[14],采用2−∆∆ct法[15]计算基因相对表达量,每个基因设置3个重复,进行3次生物学重复。
|
|
表 1 qRT-PCR引物序列 Table 1 Primer sequence for qRT-PCR |
使用GraphPad Prism 5.0软件t-检验方法对数据进行统计分析。
2 结果与分析 2.1 草地贪夜蛾自噬相关蛋白的序列分析根据已经报道的昆虫和哺乳动物等多个物种中的ATG序列,在草地贪夜蛾网站 (
|
|
表 2 草地贪夜蛾自噬相关蛋白的序列与相似性分析 Table 2 Sequence and similarity analysis of Spodoptera frugiperda autophagy related proteins |
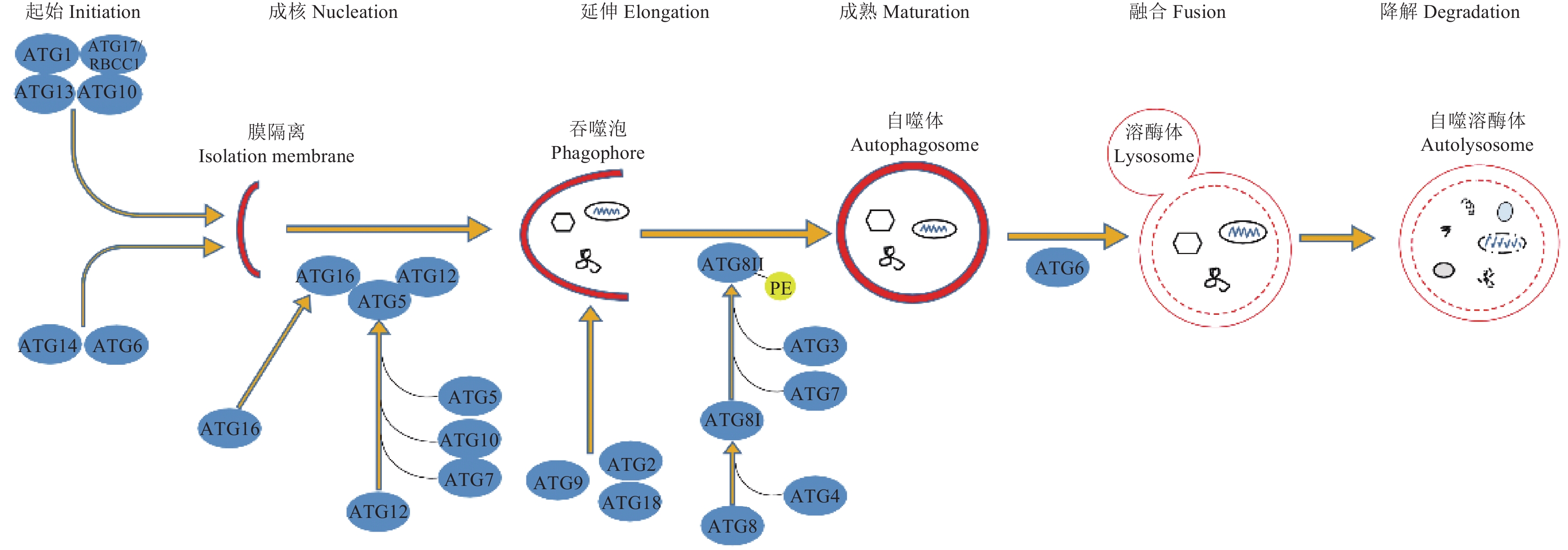
利用NCBI CD(Conserved domain)在线搜索工具对所获得的候选ATG蛋白序列进行保守结构域分析,表明多数草地贪夜蛾ATG蛋白具有该蛋白家族的保守结构域(图1),ATG1具有激酶活性,是自噬过程中的一个重要蛋白激酶;ATG4具有肽酶活性,可以切除ATG8的C端使甘氨酸(Gly)暴露出来;ATG8和ATG12具有类泛素的结构,ATG8可结合脂分子磷脂酰乙醇胺(PE),ATG12可与ATG5共价结合;而ATG16和ATG18具有WD40结构域。根据草地贪夜蛾ATG蛋白在序列上与果蝇、人类ATG的高度相似性及这些蛋白的功能结构域,推测这些自噬相关蛋白具有参与自噬体形成及分子机制的调控功能,草地贪夜蛾中的自噬通路也是真核生物高度保守的(图2)。这些ATG蛋白通过形成多个不同功能的复合物参与自噬的各个阶段,包括负责自噬起始的ATG1/ULK复合物(包括ATG1、ATG17/RB1CC1、ATG13和ATG101)、主要参与成核的Ⅲ型磷脂酰肌醇3激酶(PI3KC3)复合物(由ATG6/Beclin1和ATG14等组成)、参与延伸和成熟的2个泛素样蛋白系统:ATG5-ATG12系统和ATG8-PE系统。ATG8作为类泛素分子,羧基端被蛋白水解酶ATG4切割,暴露出的甘氨酸在E1-like酶ATG7、E2-like酶ATG3和具有E3连接酶活性的ATG12/ATG5/ATG16复合物的作用下结合PE,ATG8-PE定位于自噬体膜。此外,ATG9、ATG2和ATG18参与了膜延伸的过程。

|
图 1 草地贪夜蛾候选自噬相关蛋白的保守结构域预测 Fig. 1 Prediction of the conserved domains in the candidate autophagy-related proteins of Spodoptera frugiperda |
|
图 2 草地贪夜蛾自噬相关蛋白参与的自噬途径 Fig. 2 The autophagy pathway involving autophagy related proteins in Spodoptera frugiperda |
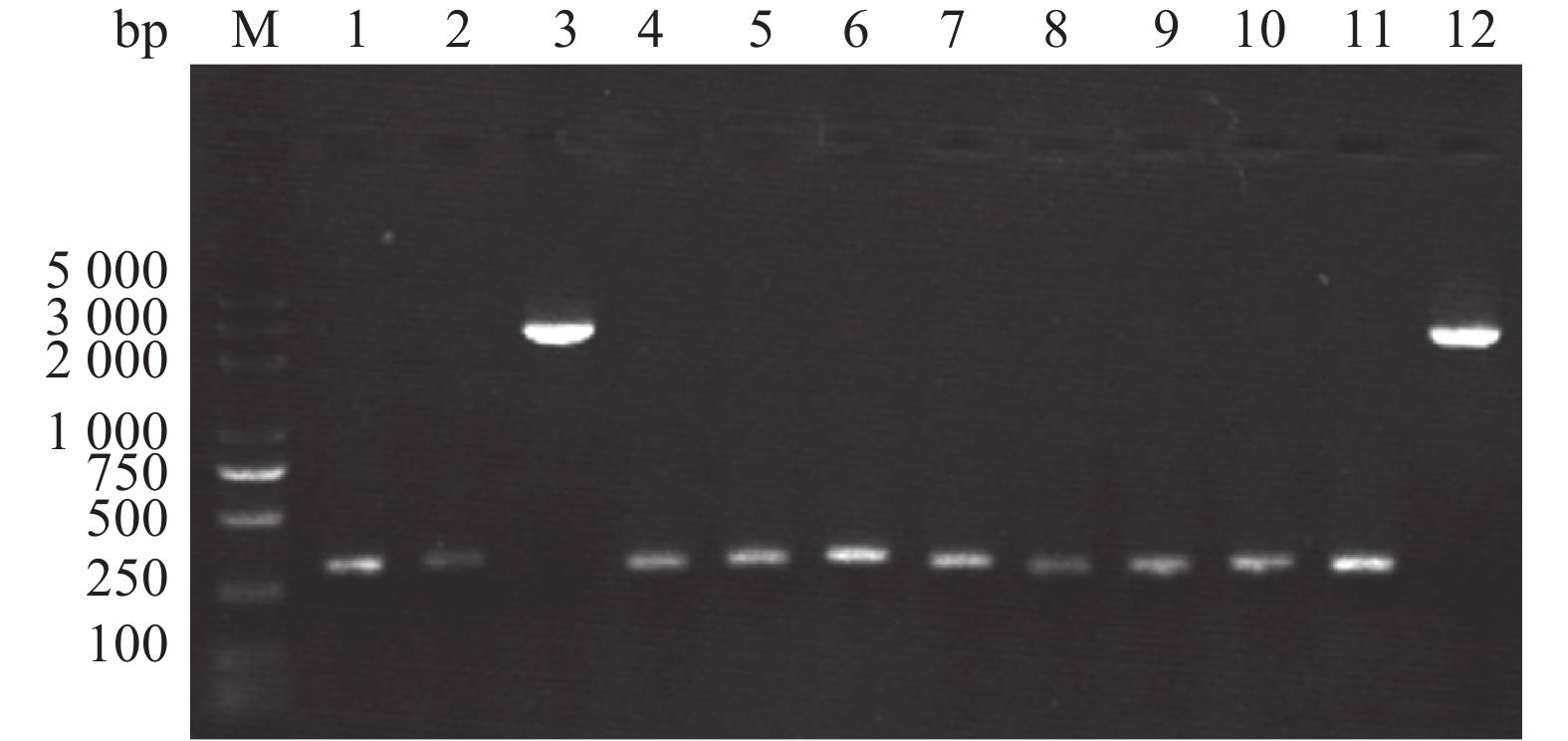
将pFast HTb-EGFP重组载体转化至含AcMNPV基因组的大肠埃希菌Escherichia coli感受态细胞DH10Bac中,经过抗性筛选获得的单菌落,通过M13引物进行PCR鉴定,获得约3000 bp的单一条带,表明重组杆粒Bacmid-HTb-EGFP已成功构建(图3)。经测序验证后将重组杆粒转染Sf9细胞,获得P1代重组病毒EGFP-AcMNPV。以P3代重组病毒EGFP-AcMNPV感染Sf9细胞,在感染6、12、24、36和48 h后观察Sf9细胞的绿色荧光强弱来判断重组病毒的增殖情况,结果(图4)表明:病毒感染6和12 h后没有观察到绿色荧光;24 h后可见少量的绿色荧光,表明子代病毒已经复制和繁殖;在36和48 h后可见大量的绿色荧光,表明制备的重组病毒能够有效感染Sf9细胞。
|
图 3 重组杆粒Bacmid-EGFP的PCR鉴定 Fig. 3 PCR identification of recombinant Bacmid-EGFP M:DL5000 DNA marker;1~12为挑取的12个单菌落的PCR结果,3和12菌落含3000 bp的目的条带 M:DL5000 DNA marker; 1−12 were the clones for PCR;the specific bands about 3 000 bp were amplified from clones numbered 3 and 12 |

|
图 4 EGFP-AcMNPV感染Sf9细胞不同时长后的荧光显微镜观察结果 Fig. 4 Fluorescence microscopy of Sf9 cells at different time after infection with EGFP-AcMNPV |
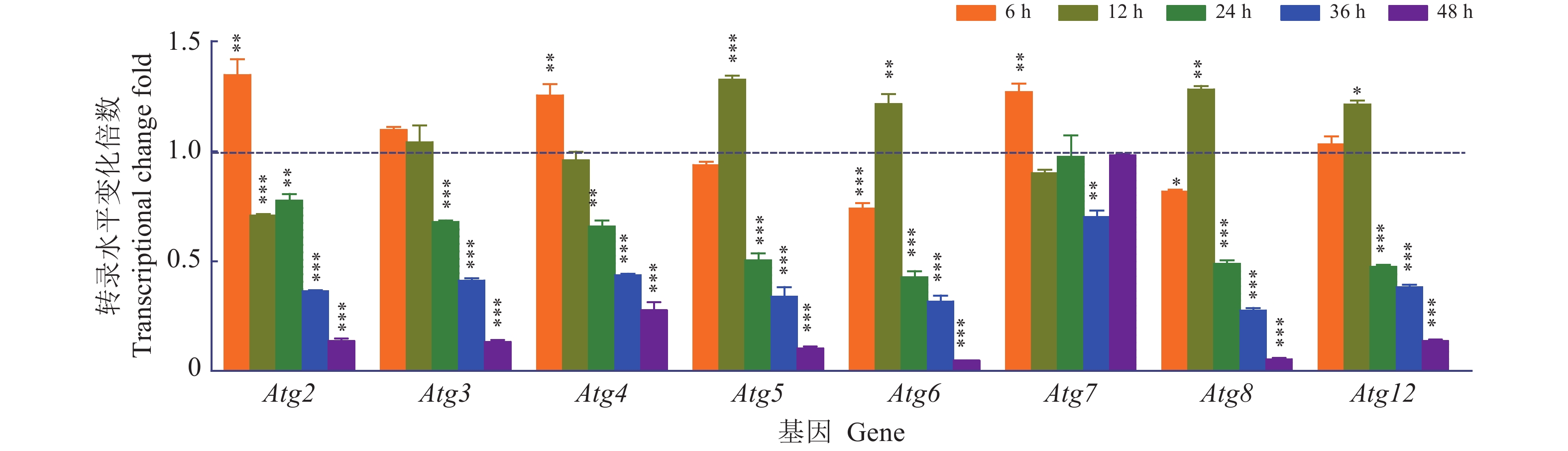
收集EGFP-AcMNPV感染不同时间的Sf9细胞,抽提总RNA,去除基因组后进行反转录,通过qRT-PCR对自噬相关基因的转录水平进行分析,定量结果(图5)显示:多数自噬相关基因的转录水平在病毒感染后表达上调,Atg2、Atg4和Atg7在感染6 h后基因表达量显著增加;Atg5、Atg6、Atg8和Atg12在病毒感染12 h后表达显著上调;之后随着病毒感染时间的延长,多数自噬相关基因(除Atg7)的表达持续下调。可能的原因是子代病毒的大量复制导致宿主细胞自噬相关基因的表达量减少,或是随着感染时间的延长,自噬无法实现细胞“自救”而走向不可逆的死亡。
|
图 5 AcMNPV对Sf9细胞对自噬相关基因转录水平的影响 Fig. 5 Effects of AcMNPV on transcriptional levels of autophagy-related genes in Sf9 cells 图中数据为平均数±标准差,“*”、“**”、“***”分别表示相同基因在病毒感染后不同时间表达量在0.05、0.01和0.001水平差异显著(t检验) Datum in the figure is mean ± standard deviation;“*”, “**” and “***” indicates significant differences at the levels of 0.05, 0.01 and 0.001 respectively (t test) |
自噬是真核生物中保守的生理过程,早期认为自噬的主要作用是实现营养物质的循环利用。近年来,随着对自噬研究的不断深入,发现自噬还参与细胞发育和分化、维持内环境的稳定,也与肿瘤形成、神经退行性疾病和免疫疾病有密切关系,自噬已成为国内外研究的热点。通过对酵母、线虫、果蝇、小鼠和人类等多种模式生物的研究,发现尽管有些物种中存在特有的自噬相关基因,但多数自噬基因是高度保守的。通过相似性比对分析,本研究从草地贪夜蛾基因组数据库中获得了自噬相关基因及对应自噬相关蛋白的序列。在参与自噬体膜形成的18个核心自噬相关蛋白中,除ATG29和ATG31外,获得了ATG1~10、ATG12~14、ATG16~18共16个草地贪夜蛾的ATG序列,其中ATG3、ATG5、ATG6、ATG7、ATG8、ATG10、ATG12和ATG13的序列是完整的。候选自噬相关蛋白保守结构域的分析结果表明,除ATG2外,其他自噬相关蛋白中均存在保守的结构域,暗示了在草地贪夜蛾中ATG功能的保守性,并且自噬过程也是保守的,猜测同酵母、果蝇和哺乳动物相似,草地贪夜蛾中的自噬也经过了起始、成核、延伸、成熟、融合和降解等基本过程,自噬相关蛋白参与了上述自噬体形成的各个过程和自噬过程中的分子调控。
Sf9细胞的自噬现象已有报道,饥饿条件和神经毒剂类杀虫剂高效氯氰菊酯都能诱导Sf9细胞发生自噬[16-17]。最新的研究表明具有杀虫活性的姜黄素、β-咔啉类生物碱是通过阻断信号通路PI3K/Akt/TOR诱导Sf9细胞发生自噬的[18-19]。为探讨杆状病毒模式代表AcMNPV与宿主Sf9细胞在自噬途径中的相互关系,本研究检测了AcMNPV病毒感染Sf9细胞后中Atg基因的表达水平,结果显示在感染6~12 h后多数Atg基因的表达上调,暗示了AcMNPV的感染激活了Sf9细胞中的自噬应答。后续研究进一步通过Western blot和免疫荧光显微镜观察等方法验证了自噬的发生(结果未发表)。在果蝇中的研究结果显示不同的病原菌,如李斯特菌Listeria monocytogenes[8]、大肠埃希菌[20]、沃尔巴克氏体Wolbachia[21]和水疱性口炎病毒(Vesicular stomatitis virus, VSV)[22-23]的感染都能引发细胞自噬应答,但这些不同的病原菌激活自噬的分子机制不同[1]。可见,病原菌引发自噬响应的分子机制复杂,AcMNPV引发Sf9细胞自噬响应的分子机制还有待进一步研究。
利用草地贪夜蛾基因组序列,通过相似性比对分析鉴定自噬相关基因及编码的蛋白质序列,结合候选自噬相关蛋白的保守结构域,我们推测了所鉴定的自噬相关蛋白在自噬中的功能。已有研究揭示:利用RNAi技术干扰棉铃虫Atg6、Atg8基因的表达引起产卵量和卵的孵化率降低[24-25];干扰褐飞虱Atg1的表达,抑制自噬和糖原代谢,降低褐飞虱的生存率[26]。草地贪夜蛾自噬相关基因与自噬通路的研究可能为未来筛选新型的dsRNA药物提供候选靶标。同时,本研究证实了自噬基因在AcMNPV感染的Sf9细胞中表达上调,暗示了病毒引发Sf9细胞的自噬应答,为进一步探究病毒引发草地贪夜蛾自噬响应的分子机制奠定了基础,为探索草地贪夜蛾的生物防治提供了理论依据。
致谢:衷心感谢中山大学生命科学学院杨凯教授在制备重组病毒EGFP-AcMNPV过程中提供的支持与帮助!
| [1] |
KUO C, HANSEN M, TROEMEL E. Autophagy and innate immunity: Insights from invertebrate model organisms[J]. Autophagy, 2018, 14(2): 233-242. DOI:10.1080/15548627.2017.1389824 (  0) 0) |
| [2] |
YIN Z, PASCUAL C, KLIONSKY D J. Autophagy: Machinery and regulation[J]. Microbial Cell, 2016, 3(12): 588-596. DOI:10.15698/mic2016.12.546 (  0) 0) |
| [3] |
SHENG R, QIN Z H. History and current status of autophagy research[J]. Advances in Experimental Medicine and Biology, 2019, 1206: 3-37. (  0) 0) |
| [4] |
MATSUURA A, TSUKADA M, WADA Y, et al. Apg1p, a novel protein kinase required for the autophagic process in Saccharomyces cerevisiae
[J]. Gene, 1997, 192(2): 245-250. DOI:10.1016/S0378-1119(97)00084-X (  0) 0) |
| [5] |
OHSUMI Y. Protein turnover[J]. International Union of Biochemistry and Moleular Biology: Life, 2006, 58(5/6): 363-369. (  0) 0) |
| [6] |
SUZUKI H, OSAWA T, FUJIOKA Y, et al. Structural biology of the core autophagy machinery[J]. Current Opinion in Structural Biology, 2017, 43: 10-17. DOI:10.1016/j.sbi.2016.09.010 (  0) 0) |
| [7] |
PALMISANO N J, MELÉNDEZ A. Autophagy in C. elegans development
[J]. Developmental Biology, 2019, 447(1): 103-125. DOI:10.1016/j.ydbio.2018.04.009 (  0) 0) |
| [8] |
YANO T, MITA S, OHMORI H, et al. Autophagic control of listeria through intracellular innate immune recognition in drosophila[J]. Nature Immunology, 2008, 9(8): 908-916. DOI:10.1038/ni.1634 (  0) 0) |
| [9] |
TALLOCZY Z, VIRGIN H T, LEVINE B. PKR-dependent autophagic degradation of herpes simplex virus type 1[J]. Autophagy, 2006, 2(1): 24-29. DOI:10.4161/auto.2176 (  0) 0) |
| [10] |
MARCHLER-BAUER A, BO Y, HAN L, et al. CDD/SPARCLE: Functional classification of proteins via subfamily domain architectures[J]. Nucleic Acids Research, 2017, 45(D1): D200-D203. DOI:10.1093/nar/gkw1129 (  0) 0) |
| [11] |
LUCKOW V A, LEE S C, BARRY G F, et al. Efficient generation of infectious recombinant baculoviruses by site-specific transposon-mediated insertion of foreign genes into a baculovirus genome propagated in Escherichia coli
[J]. Journal of Virology, 1993, 67(8): 4566-4579. DOI:10.1128/JVI.67.8.4566-4579.1993 (  0) 0) |
| [12] |
SHANG H, GARRETSON T A, KUMAR C M S, et al. Improved pFastBacTM donor plasmid vectors for higher protein production using the Bac-to-Bac® baculovirus expression vector system
[J]. Journal of Biotechnology, 2017, 255: 37-46. DOI:10.1016/j.jbiotec.2017.06.397 (  0) 0) |
| [13] |
余倩. 斜纹夜蛾核多角体病毒诱导细胞凋亡的研究[D]. 广州: 中山大学, 2008.
(  0) 0) |
| [14] |
SALEM T Z, ALLAM W R, THIEM S M. Verifying the stability of selected genes for normalization in q-PCR experiments of Spodoptera frugiperda cells during AcMNPV infection
[J]. PLoS One, 2014, 9(10): e108516. DOI:10.1371/journal.pone.0108516 (  0) 0) |
| [15] |
LIVAK K J, SCHMITTGEN T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2−ΔΔCT method
[J]. Methods, 2001, 25(4): 402-408. DOI:10.1006/meth.2001.1262 (  0) 0) |
| [16] |
谢昆, 王丽仙, 王靖, 等. 草地贪夜蛾Sf9细胞对饥饿诱导自噬的响应[J]. 华北农学报, 2017, 32(3): 91-95. DOI:10.7668/hbnxb.2017.03.014 (  0) 0) |
| [17] |
杨韵, 卢淼青, 张阳, 等. 高效氯氰菊酯对草地贪夜蛾Sf9细胞自噬的诱导作用[J]. 农药学学报, 2017, 19(2): 176-181. (  0) 0) |
| [18] |
VEERAN S, CUI G, SHU B, et al. Curcumin-induced autophagy and nucleophagy inSpodoptera frugiperda Sf9 insect cells occur via PI3K/AKT/TOR pathways
[J]. Journal of Cell Biochemistry, 2018, 120(2): 2119-2137. (  0) 0) |
| [19] |
CUI G, SHU B, VEERAN S, et al. Natural beta-carboline alkaloids regulate the PI3K/Akt/mTOR pathway and induce autophagy in insect Sf9 cells[J]. Pesticide Biochemistry and Physiology, 2019, 154: 67-77. DOI:10.1016/j.pestbp.2018.12.005 (  0) 0) |
| [20] |
REN C, FINKEL S E, TOWER J. Conditional inhibition of autophagy genes in adult Drosophila impairs immunity without compromising longevity
[J]. Experimental Gerontology, 2009, 44(3): 228-235. DOI:10.1016/j.exger.2008.10.002 (  0) 0) |
| [21] |
VORONIN D, COOK D A, STEVEN A, et al. Autophagy regulates Wolbachia populations across diverse symbiotic associations
[J]. Proceedings of the National Academy of Sciences, 2012, 109(25): E1638-E1646. DOI:10.1073/pnas.1203519109 (  0) 0) |
| [22] |
SHELLY S, LUKINOVA N, BAMBINA S, et al. Autophagy is an essential component of drosophila immunity against vesicular stomatitis virus[J]. Immunity, 2009, 30(4): 588-598. DOI:10.1016/j.immuni.2009.02.009 (  0) 0) |
| [23] |
NAKAMOTO M, MOY R H, XU J, et al. Virus recognition by toll-7 activates antiviral autophagy in Drosophila
[J]. Immunity, 2012, 36(4): 658-667. DOI:10.1016/j.immuni.2012.03.003 (  0) 0) |
| [24] |
张晓娟. 棉铃虫细胞自噬相关基因Atg8的分子特征以及对昆虫生长发育的影响[D]. 武汉: 华中师范大学, 2014.
(  0) 0) |
| [25] |
王霞. Atg6对棉铃虫繁殖的影响及其在昆虫细胞自噬中的作用[D]. 武汉: 华中师范大学, 2014.
(  0) 0) |
| [26] |
YU F, HAO P, YE C, et al. NlATG1 gene participates in regulating autophagy and fission of mitochondria in the brown planthopper, Nilaparvata lugens
[J]. Frontiers in Physiology, 2020, 10: 1622. DOI:10.3389/fphys.2019.01622 (  0) 0) |
 2021, Vol. 42
2021, Vol. 42


