2. 岭南现代农业科学与技术广东省实验室,广东 广州 510642;
3. 华南农业大学 工程学院,广东 广州 510642;
4. 中国农业科学院 植物保护研究所,北京 100193
2. Guangdong Provincial Laboratory of Lingnan Modern Agricultural Science and Technology, Guangzhou 510642, China;
3. College of Engineering, South China Agricultural University, Guangzhou 510642, China;
4. Institute of Plant Protection, Chinese Academy of Agricultural Sciences, Beijing 100193, China
小麦白粉病是由白粉菌Blumeria graminis f.sp. tritici引起的气传性真菌病害,在世界各小麦种植区均有发生,20世纪70年代以前国内主要在西南以及山东沿海局部小麦种植地区发病严重,随后发生范围不断扩大,危害程度加重[1]。在田间,最早能够看到苗期染病叶片出现非常小的白点,之后染病部位短期内快速扩大,形成大的白色霉层,最后各个病斑相互融合,形成圆形和不规则的大霉斑。霉层上面有一层白色粉状物(分生孢子),稍有外力作用,就会发散,成为再次侵染的来源。感染后期,霉层颜色逐步加深,由白色转变为灰白色、灰色和浅褐色等,病斑上分散着针头大小的黑色小颗粒(闭囊壳);霉层下面的叶片及其周围颜色变浅,最终导致叶片退绿发黄、卷曲、枯死;叶绿素含量降低,严重影响小麦的光合作用[2]。因此,对小麦植株进行实时监测,及早发现病害并喷洒农药对控制病害扩散具有重要的意义。
田间监测目前主要依靠植保人员田间调查、田间取样等传统方式,并通过“网格法”计算感染区域的占比确定单片小麦叶片的感染程度,分为少数病斑(0~25%):叶片上有少数病斑,白点随机分布;轻度发病(25%~50%):白点联结成一块;中度发病(50%~75%):叶片局部变黄;严重发病(75%~100%):叶片大面积黄化。结合5片小麦叶片的感染程度确定植株的发病情况[3],不仅耗时、费力,而且存在代表性差、主观性强、时效性差等问题[4],难以满足大范围病虫害实时监测的需求。
发展快速、无损和实时监测技术对于精确防控病害具有重要意义。高光谱技术能够获得从可见光至红外波段范围内的许多连续窄波段(<10 nm)数据[5-6],广泛应用于小麦病害监测。在小麦条锈病监测方面,黄木易等[7]研究表明遥感监测条锈病的敏感波段为630~687、740~890和976~1350 nm。在小麦蚜虫监测方面,Riedell等[8]明确了蚜虫敏感的光谱波段范围为625~635和680~695 nm。在小麦白粉病的光谱监测方面,由于叶片被白粉病病菌覆盖使叶片细胞光合作用降低、叶绿素含量降低[9],因此学者们逐步明确了小麦病虫害光谱识别的敏感波段主要位于可见光和近红外波段[10-12]。沈文颖等[3]研究认为415、485~495和620~640 nm为小麦白粉病的敏感波段,并且能通过敏感波段反演小麦叶片白粉病。梁栋等[13]利用成像高光谱提取病斑区域并筛选出小麦白粉病和条锈病的敏感波段,以此建立白粉病和条锈病的判别模型,分类精度可以达到92%。研究在冠层和叶片尺度上确立了小麦白粉病敏感波段分别为580~710 nm[4]以及400~500和610~690 nm[14]。姚志凤等[11]在平滑和降维后对患小麦白粉病、条锈病植株和健康植株进行分类,最终得出主成分分析(Principal component analysis, PCA)结合极限学习机ELM的校正集和测试集正确率分别达到99.18%和100%。总的来说,基于小麦冠层的高光谱监测模型研究较为深入,但感染白粉病后,植株是下部最先出现症状[15],检测冠层的时效性相对较差。因此,采用地面光谱检测方法对白粉病及早发现并干预更有优势。但地面光谱检测受采样量和光谱判别方法的限制,不仅费时费力,而且精准度有限。为解决上述问题,本文借鉴网格法的检测思想,使用“区域法”代替“网格法”,建立SF-SPAD值结合光谱PCA-SVM的智能二分类模型,在保障检测精确度的前提下,减少采样数量,实现小麦白粉病感染与否以及感染等级的判别,为快速确定小麦白粉病感染等级提供一种新的统计学方法。
1 材料与方法 1.1 材料试验选用‘京双16号’小麦,人工接种小麦白粉菌,试验设对照组(0级)、少数病斑(Ⅰ级)、轻度发病(Ⅱ级)、中度发病(Ⅲ级)、严重发病(Ⅳ级)共5个区域。
试验在中国农业科学院植物保护研究所综合试验基地(河南新乡,东经119.19°、北纬31.61°)小麦试验田中开展。
1.2 数据获取方法小麦叶片光谱测定时,光源采用海洋光学公司生产的海洋光学辐射定标光源(海洋光学,HL-2000-CAL,光谱范围300~1050 nm),光纤光谱仪采用海洋光学微型光纤光谱仪(海洋光学,FLAME-S,光谱范围200~1000 nm,700 nm的光谱分辨率0.335 nm),探测器采用线阵硅基检测器(索尼,ILX511B)。
小麦光谱采集系统如图1所示。光源输出的光通过光纤从积分球顶部射入,积分球底部通过叶片夹固定叶片。被叶片反射的光携带有被测叶片的特征信息,经积分球多次漫反射,从侧方输出,经光纤传输至海洋光谱仪内,转化为电信号,以灰度值的数据形式存储于计算机中。设置采集参数为积分时间200 ms,平均次数5次,平滑度为5,包含2 048个波段。
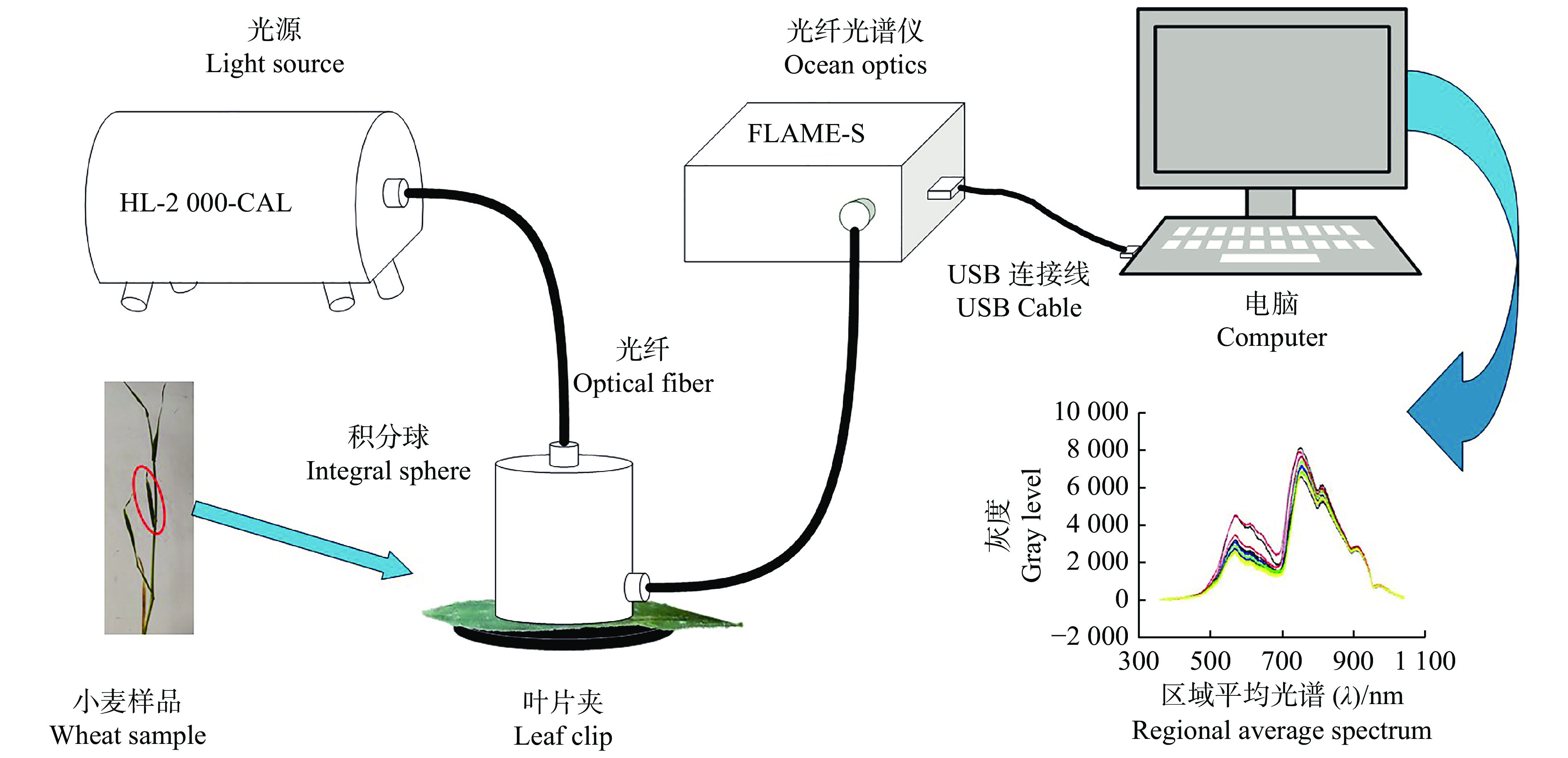
|
图 1 小麦光谱采集系统 Fig. 1 Wheat spectrum collection system |
本文将由光纤光谱仪采集的叶片中受白粉病侵染的点称为病点,未受侵染的点称为好点。采集对照组好点、病点光谱各50条,用于判断病点建模。确定是否感染和感染等级时,在小麦田中随机选取植株,测定每株植株的每片叶片叶尖、中部和基部3个部位的光谱,每株小麦共5片叶片、15条光谱数据。
1.3 SF-SPAD值以及临界值小麦感染白粉病会直接改变叶片中的叶绿素含量,而叶绿素含量与叶片SPAD值呈极显著正相关[16]。因此本文通过光谱获取的SF-SPAD值来初步判断植株是否被白粉病侵染,SF-SPAD值的计算公式如下:
| $ {\rm{SF}}{\text{-}} {\rm{SPAD}} = K{\lg }\frac{{{\rm{I}}{{\rm{R}}_{\rm{r}}}/{\rm{I}}{{\rm{R}}_0}}}{{{R_{\rm{r}}}/{R_0}}}, $ | (1) |
式中,
将SF-SPAD值由小到大排列,假设SF-SPAD值取
| $ t_1\left( i \right) = {\rm{sort}}\left( {{\rm{SF}} {\text{-}} {\rm{SPAD}}} \right),\left( {i = 1, \cdots ,n} \right), $ | (2) |
| $ T_1\left( {{\rm{SF}} {\text{-}} {\rm{SPAD}} = a} \right) = \frac{{\displaystyle\sum \limits_{i = 1}^n {x_i}}}{n},\left\{ {\begin{array}{*{20}{c}} {{x_i} = 0,{\text{病点}}}\\ {{x_i} = 1,{\text{好点}}} \end{array}} \right.{\text{。}} $ | (3) |
类似的,将SF-SPAD值由大到小排列,
| $ t_2\left( i \right) = {\rm{sort}}\left( {{\rm{SF}} {\text{-}} {\rm{SPAD}},{\rm{'descend'}}} \right),\left( {i = 1, \cdots ,n} \right), $ | (4) |
| $ T_2\left( {{\rm{SF}} {\text{-}} {\rm{SPAD}} = b} \right) = \frac{{\displaystyle\sum \limits_{i = 1}^m {y_i}}}{m},\left\{ {\begin{array}{*{20}{c}} {{y_i} = 0,{\text{病点}}}\\ {{y_i} = 1,{\text{好点}}} \end{array}} \right.{\text{。}} $ | (5) |
式(2)中
为消除响应度不高以及暗噪声太大的波段,计算反射率,去除反射率不符合实际的波段。根据公式(6)得到植株反射率光谱。
| $ I = \frac{{{R_{{\rm{raw}}}} - {R_{{\rm{black}}}}}}{{{R_{{\rm{white}}}} - {R_{{\rm{black}}}}}}, $ | (6) |
式中,
PROSPECT模型是一个基于“平板模型”的辐射传输模型。它通过模拟叶片在400~2500 nm的上行和下行辐射通量得到叶片的反射率和透射率,本研究采用PROSPECT-5拟合植物的反射率光谱,该模型定量描述了植物叶片反射率光谱、透过率光谱与结构参数(
敏感度可以描述某一变量以相同步长变化的过程中对模型输出结果的影响程度。本文通过PROSPECT模型参数的敏感性计算分析各种生化参数对叶片光谱的影响程度,同时结合模型参数参考范围确定光谱分类的波段范围。
LOPEX93 (Leaf optical properties experiment 93)是经典的植物叶片高光谱和生理生化参数数据集,包含了50多种植物的70多个叶片样本高光谱数据及对应的生化参数值,是研究高光谱反演生化参数的重要数据库。通过改变PROSPECT模型3个敏感度分析参数(
PCA降维将所有维度投影到低维空间内,使每个数据在这个空间的方差
| $ {{Z}}\left( {m*k} \right) = X\left( {m*n} \right) \times {{W}}\left( {n*k} \right), $ | (7) |
| $ {D_1} = \mathop \sum \limits_{m = 1}^{36} {{{{\omega}}}^T}{x_m}, $ | (8) |
式中,
SVM的基本思想是寻找一个分类的最优超平面,使得离最优超平面比较近的点与最优超平面能有更大的间距,进而能够很好地分开训练样本中的2类样本。核函数主要有线性核、多项式核、径向基核(Radial basis function,RBF)以及Sigmoid核。这4种核函数中,RBF核函数可以应用到低维、高维、小样本、大样本等情况[19]。本文选用径向基核函数,其核函数公式如下:
| $ K\left( {a,a'} \right) = {\rm{e}}^{\left( { - \frac{{{{\left| {a - a'} \right|}^2}}}{{{b^2}}}} \right)}, $ | (9) |
式中,
采用PCA对数据集进行降维处理,当方差贡献率大于95%时,得到
本文通过病点百分比进行感染等级确定。在不同感染等级试验地采集样品,在每株样本的5片叶片叶尖、中部和基部3个部位取点,采用SF-SPAD值粗选结合PCA-SVM二分类精选的方法判别病点,计算病点百分比。对于同一感染等级,随着检测点数量的增加病点占全部检测点的百分比先增加后逐步达到稳定。将该稳定的百分比作为感染等级的判别依据,所检测的株数即为模型适用的最少检测株数。本文分别从不同感染等级麦田中随机选取
| $ {\bf{MEAN}}\left( j \right) = {\rm{sort}}\Bigg( {\frac{{\displaystyle\sum \limits_{k = 1}^i {P_{{m_k}}}}}{i}} \Bigg),\left( {i = 1, \cdots ,n} \right), $ | (10) |
| $ j = \mathop \sum \limits_k^{i - 1} ({m_k} - k)C_{n - \left( {i - 2 + k} \right)}^{i - k} + \left( {{m_i} - 2 + q} \right)C_{n - \left( {2i - 2} \right)}^0, $ | (11) |
| $ q = {\rm{RoundDown}}\left( {\frac{j}{{n - 1}}} \right), $ | (12) |
本文随机在试验田中取
本文使用SF-SPAD值初步判断小麦白粉病感染等级。图2为随机选取的4个感染等级共20株具有代表性的感染程度逐渐增加的小麦的SF-SPAD值。从图2可以看出,相同植株的一叶、二叶的SF-SPAD值比其他叶片低;对不同植株的同一叶序,随感染程度的增加,SF-SPAD值降低。比较SF-SPAD值可以得出,小麦白粉病感染首先出现在叶序小的叶片上,感染程度越大、叶片序数越小,SF-SPAD值越低。
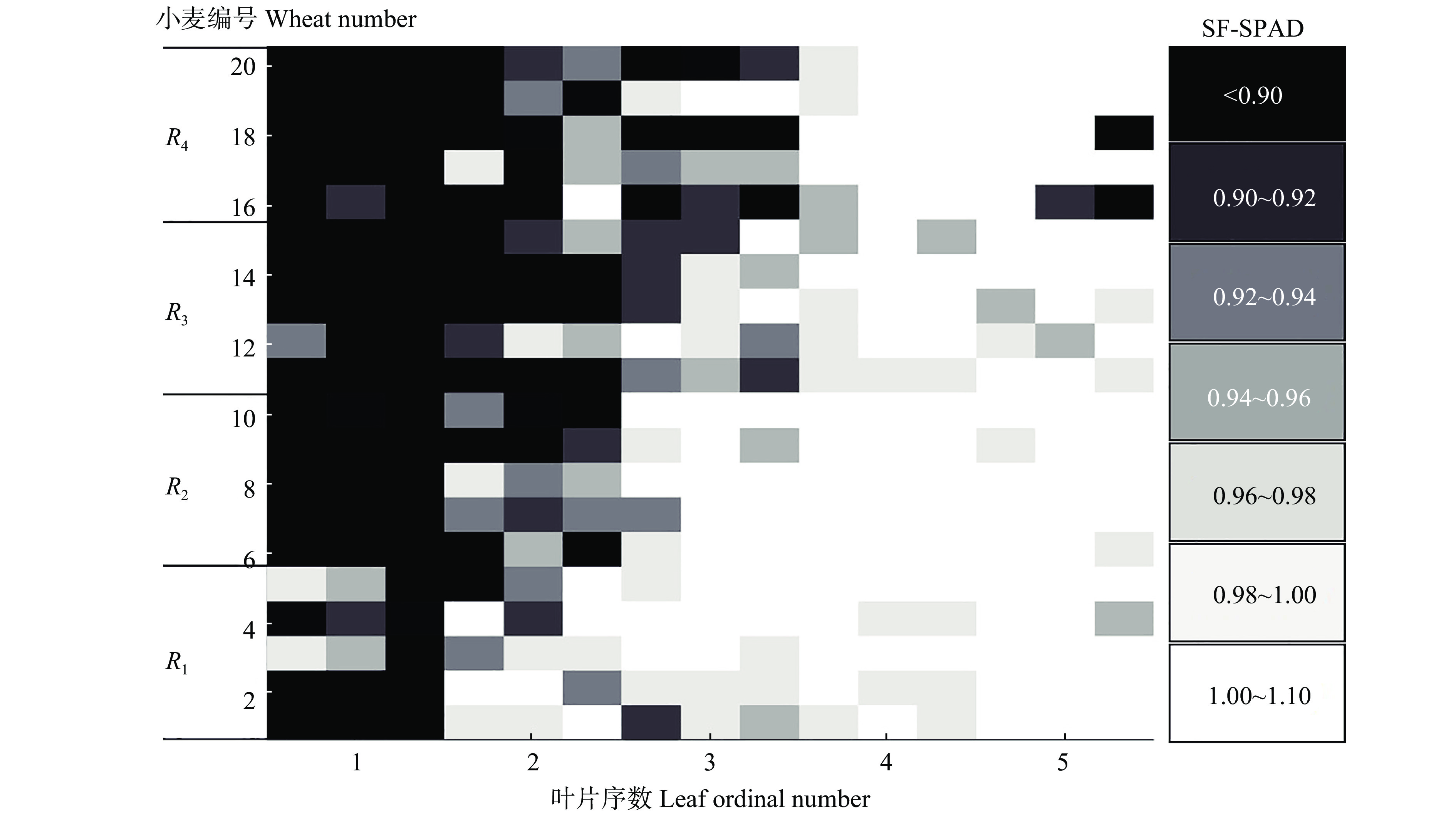
|
图 2 不同感染等级(R)不同叶序叶片的SF-SPAD值规律 Fig. 2 The law of SF-SPAD value in different ordinal leaves with different infection grades (R) |
通过对比不同感染级别、不同叶序小麦叶片的SF-SPAD值(图3),得到规律:SF-SPAD值随叶序的增大而逐渐上升。其原因主要是小麦叶面感染白粉病,叶绿素含量降低,导致叶片对红光的吸收减弱而形成“红谷”(600~680 nm),即公式(1)中的
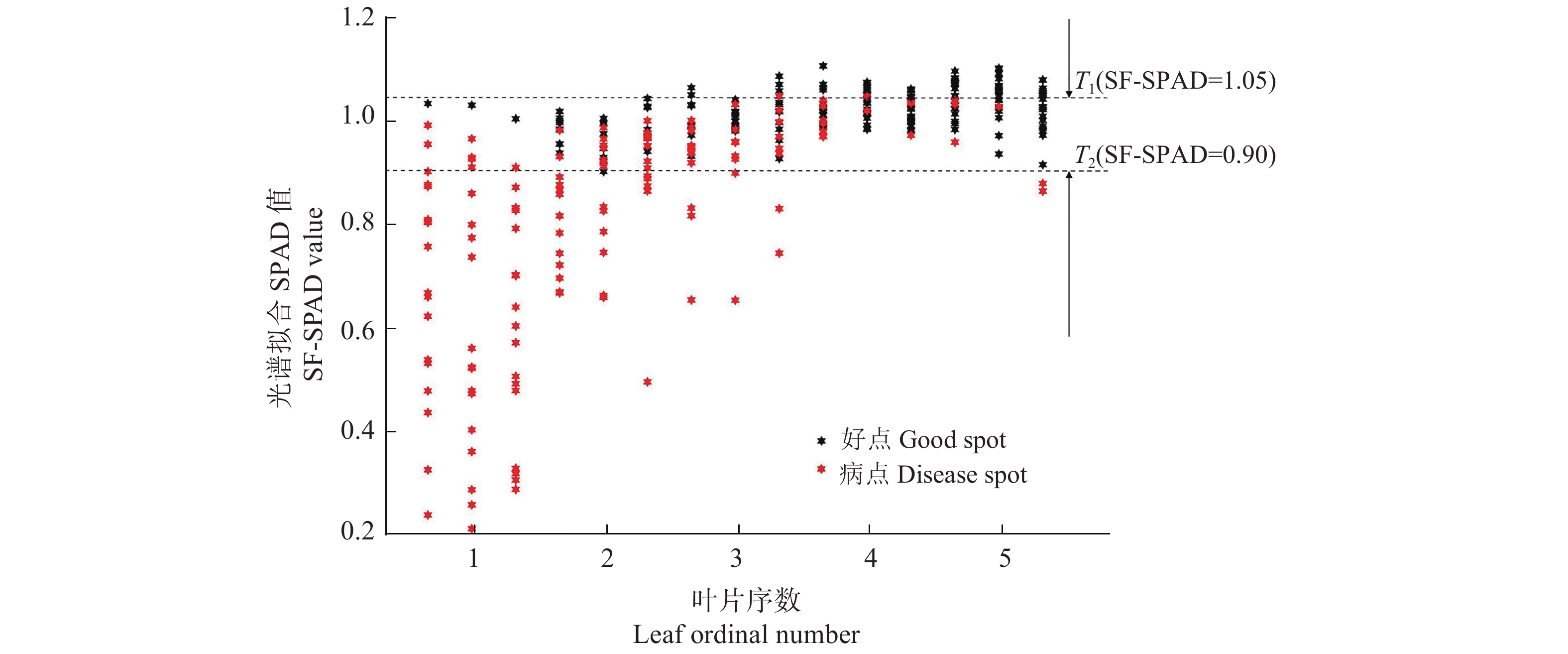
|
图 3 好点、病点SF-SPAD临界值判别 Fig. 3 Judgment of SF-SPAD critical value for good spots and disease spots |
图4a、4b分别为好点和病点百分比随SPAD值变大和变小时的规律。当SF-SPAD值≥1.05,好点百分率开始逐渐下降,当SF-SPAD≤0.90,病点百分率开始逐渐下降,即:
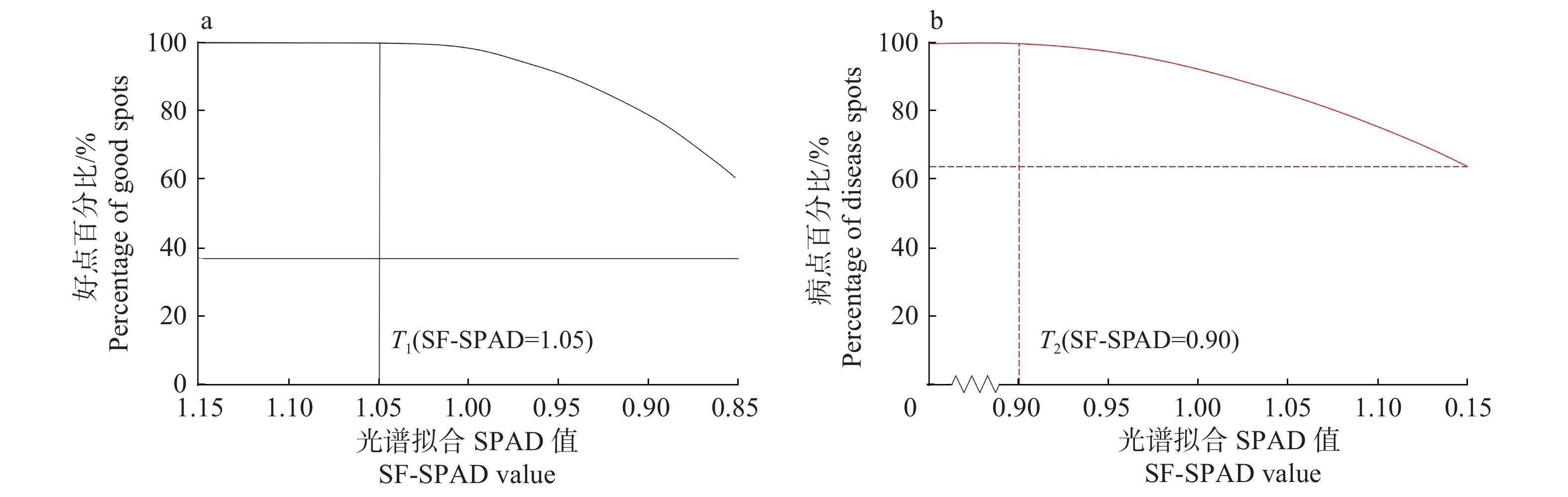
|
图 4 好/病点百分比变化规律 Fig. 4 Change law of good and disease spot percentage |
| $\begin{split}& T_1({\rm{SF}} {\text{-}} {\rm{SPAD}} \geqslant 1.05) = 100{\text{%}}, \\& T_2({\rm{SF}} {\text{-}} {\rm{SPAD}} \leqslant 0.90) = 100{\text{%}}{\text{。}} \end{split}$ |
因此,本文将0.90和1.05分别作为判断病点与好点的临界值。
由图3、4可以看出,将SF-SPAD值用于小麦白粉病初步判断,具有迅速、准确率高、工作量小的优势,能够根据650和940 nm的反射率数据初步判定植株感染与否。
2.2 光谱预处理以及敏感度分析为了确定小麦白粉病光谱响应的敏感波段,本文对LOPEX93数据集中的小麦光谱进行了敏感度分析,该数据集提供了小麦结构参数、叶绿素含量、胡萝卜素含量等不同参数的400~1000 nm的高光谱数据。通过改变小麦植株的各种生化参数,分析生化参数对叶片光谱的影响程度,同时结合模型参数范围确定光谱分类的波段范围,结果如图5所示。在敏感度分析中,结构参数、叶绿素含量对可见光波段(400 ~ 780 nm)光谱的影响较大,而对胡萝卜素和干物质含量的影响较小。这是由于叶绿素对红光的强烈吸收而形成“绿峰”和“红谷”(450、680 nm),以及由植被红光波段叶绿素的强烈吸收和近红外波段光在叶片内多次散射形成的强反射所构成的“红边”(680 ~780 nm),这2个区域内蕴含了丰富的植被光谱信息,均被广泛用于叶绿素含量反演[20-21]。而植株结构参数包括了植株平均密度、平均高度、叶冠平均半径等,对植株叶绿素含量、干物质含量影响较大,而植株叶绿素含量影响叶片400~780 nm的光谱。因此,本文敏感波段提取了对叶绿素含量以及SPAD值贡献率大的可见光波段(400~780 nm)。
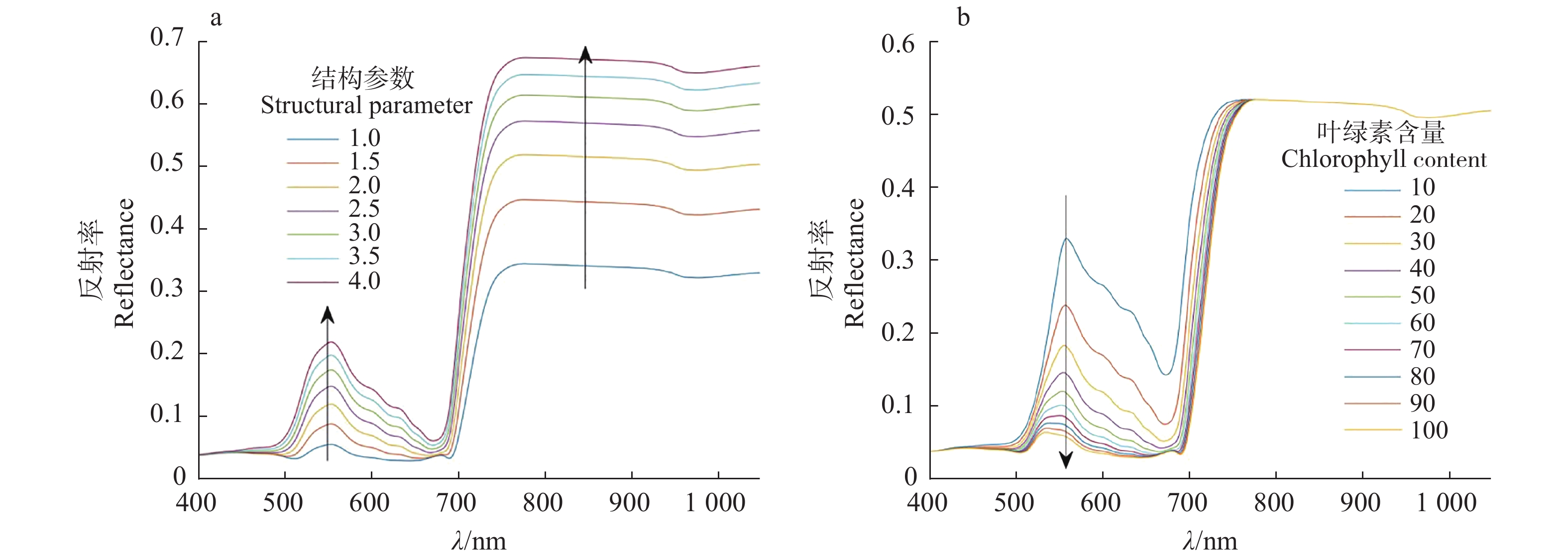
|
图 5 植株生化参数的敏感度分析 Fig. 5 Sensitivity analysis of plant biochemical parameters |
在此基础上,对400~780 nm波段进行平滑,将平滑后波动范围大于此平滑值10%的波段作为噪声去除,最终确定440~780 nm波段为建模数据集,如图6所示。
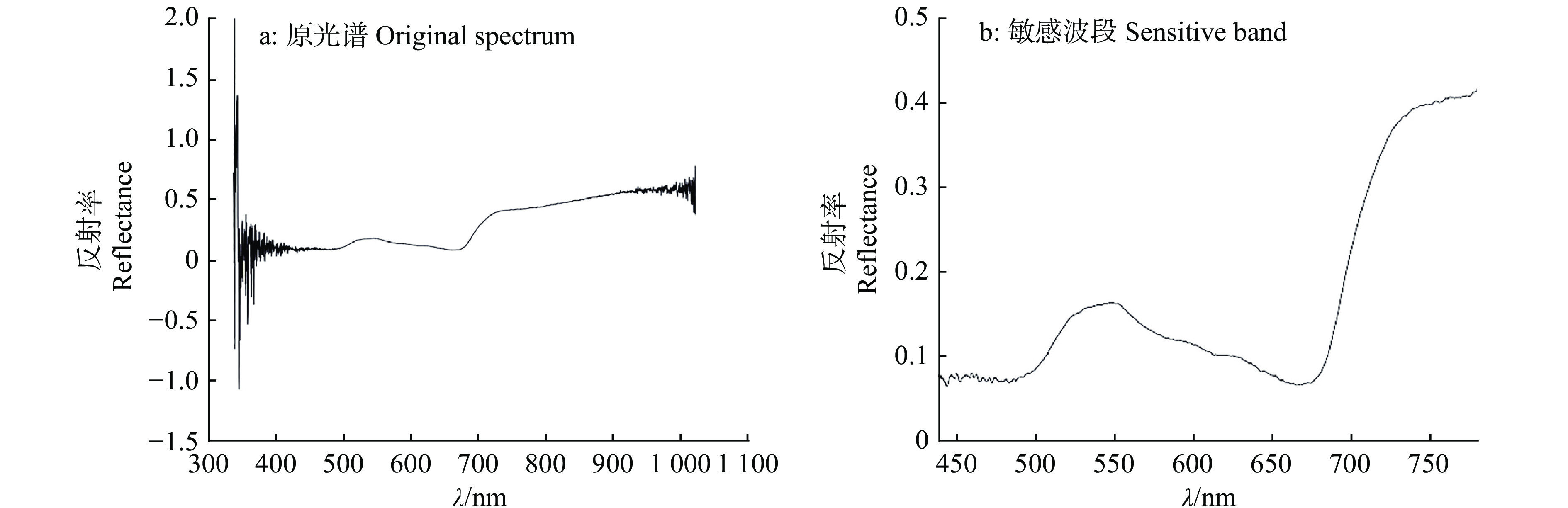
|
图 6 敏感波段确定结果 Fig. 6 Determination results of sensitive band |
本文使用PCA结合SVM算法,对反射率数据训练分类网络。图7是PCA降维后取前3维得到的好点与病点的分类情况,其中,红点代表病点,黑点代表好点。从图7可以看出,仅使用PCA第一至第三个主成分已能初步取得较好的效果,再使用SVM构建非线性超平面,就可以达到理想的分类效果,当PCA降维至10维时,特征贡献率大于99%,且SVM二分类的结果趋于稳定,因此确定使用10维数据进行建模。除此之外,图7中显示好点相对病点更加集中,这种情况的原因可能是未感染病害的小麦光谱差异较小,而感染病虫害的植株因在各个感染时期的生理状态和病菌的形态不同导致光谱的差异较大。
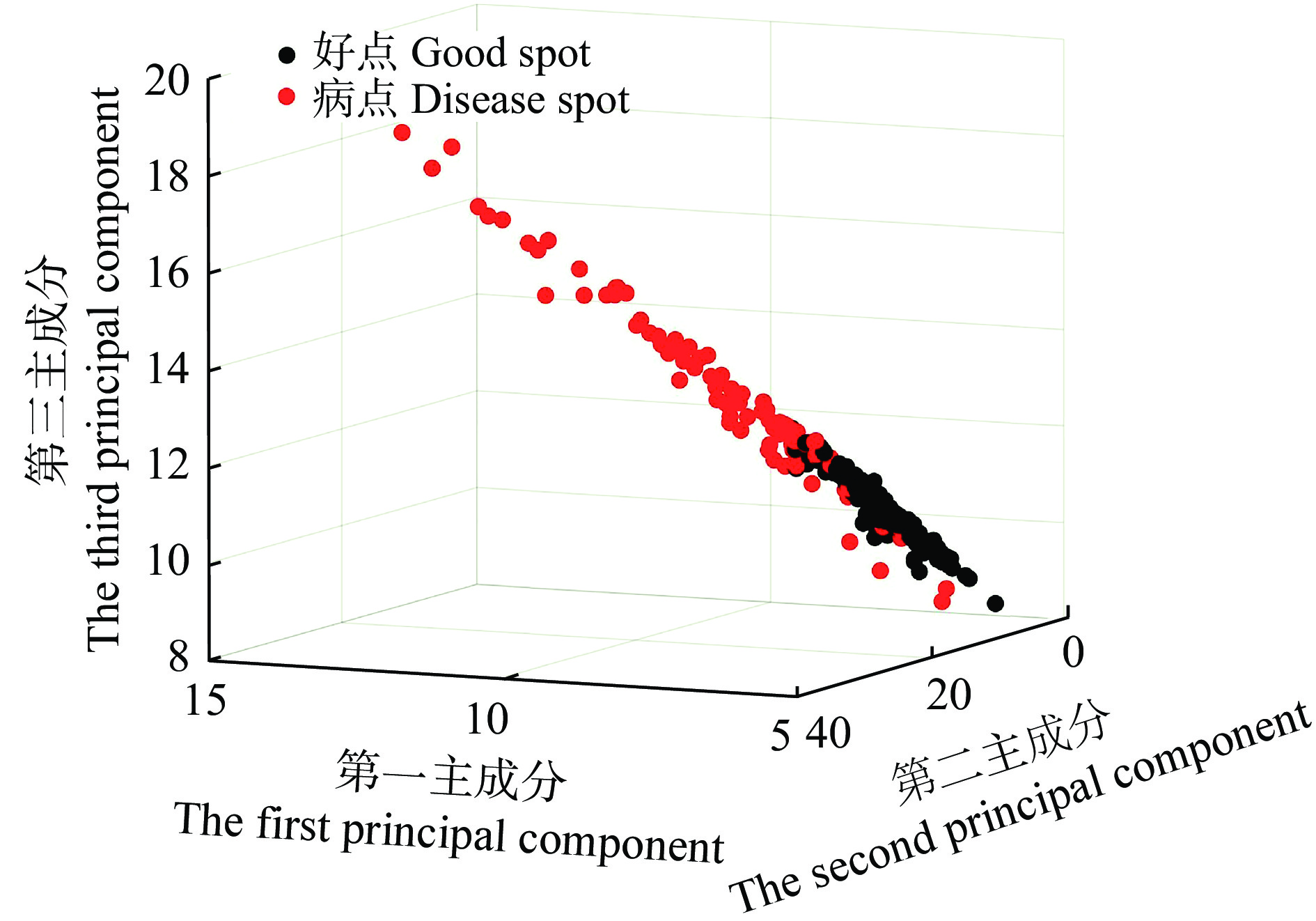
|
图 7 光谱分类结果 Fig. 7 Spectral classification results |
图8为PCA-SVM光谱分类模型判别的病点百分比分布与感染等级(R)的关系。从各感染等级内随机选取
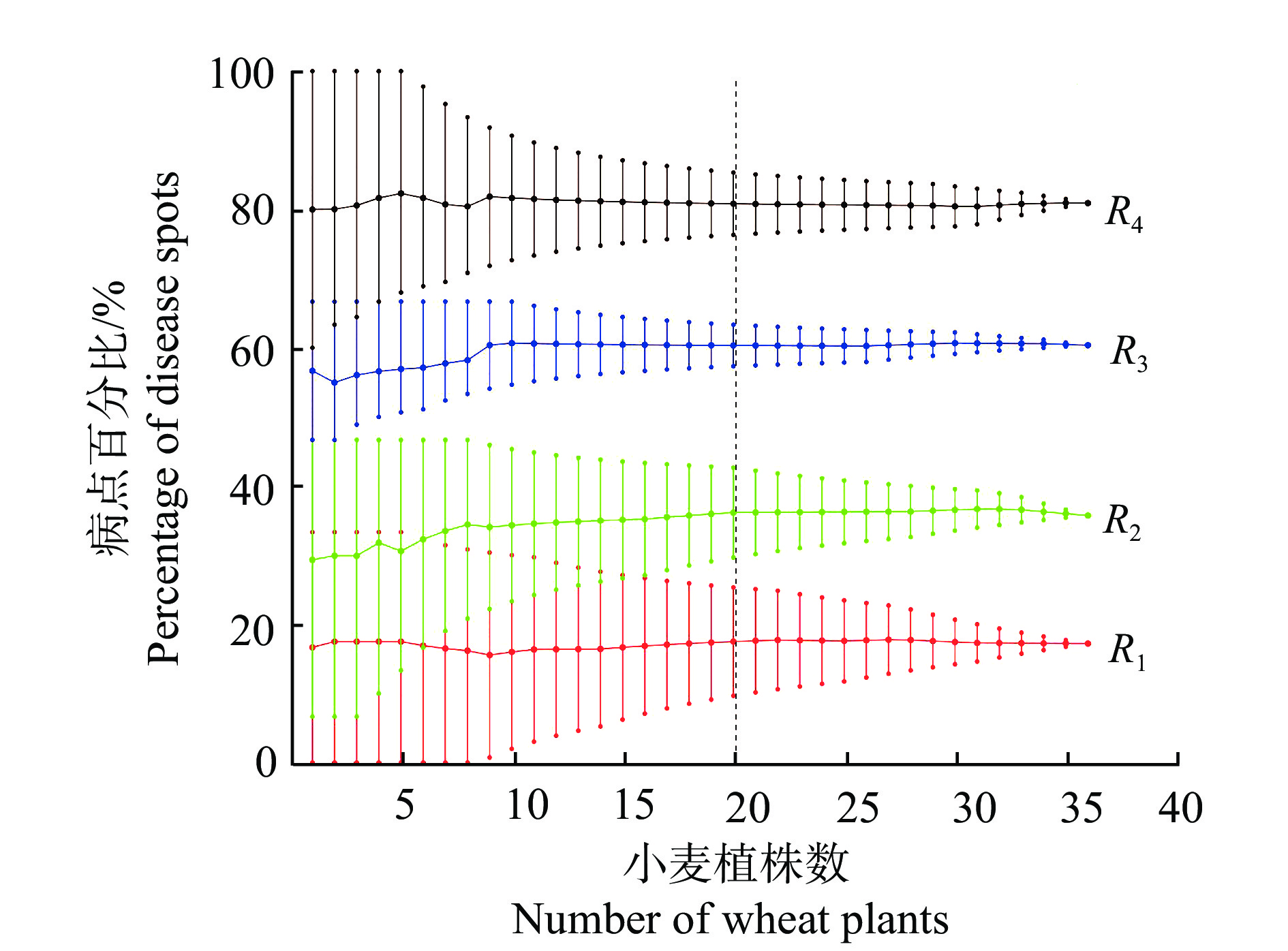
|
图 8 小麦植株病点百分比分布与感染等级(R) Fig. 8 Percentage distribution of disease spots in wheat plants and infection grade (R) |
本文通过SF-SPAD值结合PCA-SVM模型对小麦植株上的光谱数据进行二分类,实现小麦白粉病的判断,通过确定病点百分比来确定小麦白粉病的感染等级。结果表明SF-SPAD值随叶片序数的增加逐渐上升,病点和好点的SF-SPAD临界值分别为0.90和1.05。使用PROSPECT模型进行光谱敏感度分析,确定叶绿素的敏感波段在可见光波段440~500和540~780 nm,将光谱范围缩小为440~780 nm。结合PCA降维和SVM建模,当总贡献率大于99%时,确定维度降至10维,能实现对光谱数据精确地二分类。根据二分类模型结果判断病点和好点,计算出单株小麦的病点百分比,根据病点百分比的分布情况以及收敛关系,最终确定感染等级以及病点百分比关系为
| [1] |
冯伟, 王晓宇, 宋晓, 等. 白粉病胁迫下小麦冠层叶绿素密度的高光谱估测[J]. 农业工程学报, 2013, 29(13): 114-123. DOI:10.3969/j.issn.1002-6819.2013.13.016 (  0) 0) |
| [2] |
杜世州. 基于多源数据小麦白粉病遥感监测研究[D]. 合肥: 安徽农业大学, 2013.
(  0) 0) |
| [3] |
沈文颖, 李映雪, 冯伟, 等. 基于因子分析-BP神经网络的小麦叶片白粉病反演模型[J]. 农业工程学报, 2015, 31(22): 183-190. DOI:10.11975/j.issn.1002-6819.2015.22.025 (  0) 0) |
| [4] |
张竞成, 袁琳, 王纪华, 等. 作物病虫害遥感监测研究进展[J]. 农业工程学报, 2012, 28(20): 1-11. (  0) 0) |
| [5] |
冯伟, 王晓宇, 宋晓, 等. 基于冠层反射光谱的小麦白粉病严重度估测[J]. 作物学报, 2013, 39(8): 1469-1477. (  0) 0) |
| [6] |
刘鹏. 基于高光谱技术的植物分类及状态监测方法研究[D]. 杭州: 杭州电子科技大学, 2019.
(  0) 0) |
| [7] |
黄木易, 王纪华, 黄文江, 等. 冬小麦条锈病的光谱特征及遥感监测[J]. 农业工程学报, 2003, 19(6): 154-158. DOI:10.3321/j.issn:1002-6819.2003.06.037 (  0) 0) |
| [8] |
RIEDELL W E, BLACKMER T M. Leaf reflectance spectra of cereal aphid-damaged wheat[J]. Crop Science, 1999, 39(6): 1835-1840. DOI:10.2135/cropsci1999.3961835x (  0) 0) |
| [9] |
GRAEFF S, LINK J, CLAUPEIN W. Identification of powdery mildew (Erysiphe graminis sp. tritici) and take-all disease (Gaeumannomyces graminis sp. tritici) in wheat (Triticum aestivum L.) by means of leaf reflectance measurements
[J]. Central European Journal of Biology, 2006, 1(2): 275-288. DOI:10.2478/s11535-006-0020-8 (  0) 0) |
| [10] |
FRANKE J, MENZ G. Multi-temporal wheat disease detection by multi-spectral remote sensing[J]. Precision Agriculture, 2007, 8(3): 161-172. DOI:10.1007/s11119-007-9036-y (  0) 0) |
| [11] |
姚志凤, 雷雨, 何东健. 基于高光谱成像的小麦白粉病与条锈病识别[J]. 光谱学与光谱分析, 2019, 39(3): 969-976. (  0) 0) |
| [12] |
袁琳, 张竞成, 赵晋陵, 等. 基于叶片光谱分析的小麦白粉病与条锈病区分及病情反演研究[J]. 光谱学与光谱分析, 2013, 33(6): 1608-1614. DOI:10.3964/j.issn.1000-0593(2013)06-1608-07 (  0) 0) |
| [13] |
梁栋, 刘娜, 张东彦, 等. 利用成像高光谱区分冬小麦白粉病与条锈病[J]. 红外与激光工程, 2017, 46(1): 50-58. (  0) 0) |
| [14] |
沈文颖, 冯伟, 李晓, 等. 基于叶片高光谱特征的小麦白粉病严重度估算模式[J]. 麦类作物学报, 2015, 35(1): 129-137. DOI:10.7606/j.issn.1009-1041.2015.01.020 (  0) 0) |
| [15] |
王晓宇, 冯伟, 王永华, 等. 小麦白粉病严重度与植株生理性状及产量损失的关系[J]. 麦类作物学报, 2012, 32(6): 1192-1198. DOI:10.7606/j.issn.1009-1041.2012.06.032 (  0) 0) |
| [16] |
雷祥祥, 赵静, 刘厚诚, 等. 基于PROSPECT模型的蔬菜叶片叶绿素含量和SPAD值反演[J]. 光谱学与光谱分析, 2019, 39(10): 3256-3260. (  0) 0) |
| [17] |
吴伶, 刘湘南, 周博天, 等. 利用PROSPECT+SAIL模型反演植物生化参数的植被指数优化模拟[J]. 应用生态学报, 2012, 23(12): 3250-3256. (  0) 0) |
| [18] |
王洋, 肖文, 邹焕成, 等. 基于PROSPECT模型的植物叶片干物质估测建模研究[J]. 沈阳农业大学学报, 2018, 49(1): 121-127. (  0) 0) |
| [19] |
王鑫, 张鑫, 宁晨. 基于多特征降维和迁移学习的红外人体目标识别方法[J]. 计算机应用, 2019, 39(12): 3490-3495. (  0) 0) |
| [20] |
程术希, 邵咏妮, 吴迪, 等. 稻叶瘟染病程度的可见-近红外光谱检测方法[J]. 浙江大学学报(农业与生命科学版), 2011, 37(3): 307-311. (  0) 0) |
| [21] |
竞霞, 黄文江, 王纪华, 等. 棉花单叶黄萎病病情严重度高光谱反演模型研究[J]. 光谱学与光谱分析, 2009, 29(12): 3348-3352. DOI:10.3964/j.issn.1000-0593(2009)12-3348-05 (  0) 0) |
 2021, Vol. 42
2021, Vol. 42


