藏猪是少有的高原型地方猪种,是我国宝贵的地方品种资源[1]。据调查,藏猪产仔数并不低,母猪的营养水平低下和乳腺发育不佳以及生存条件较恶劣可能是导致仔猪死亡率高的主要原因[2]。乳腺的良好发育是正常泌乳的前提,仔猪的存活率与母猪的乳腺发育密不可分。因此,研究藏猪妊娠期乳腺发育状况对于判断乳腺是否正常发育以及提高藏猪繁殖能力具有重要意义。
妊娠期是母猪乳腺发育的关键时期,特别是妊娠后1/3阶段,即妊娠75 d后,乳腺快速发育,其质量快速增加,乳腺结构由怀孕初期的以脂肪细胞为主转化为怀孕后期以导管和腺泡结构为主[3];妊娠期乳腺发育受到雌二醇(Estradiol,E2)、孕酮(Progesterone,P)、催乳素(Prolactin,PRL)[4]等激素的调控。E2对于乳腺导管的伸长和分支具有重要作用[5];P与E2相似,由卵巢分泌,调控乳腺组织的导管分枝、腺泡形成[6];PRL促进乳腺腺泡的发育及乳汁的分泌[7-8]。此外,在信号通路方面,PI3K/Akt是细胞内重要的信号转导通路,在乳腺细胞的增殖、分化、凋亡等活动中发挥重要的生物学功能[9-11]。Jak2/STAT5信号通路对乳腺腺泡的生成和多种乳汁蛋白基因的转录有着重要的调控作用[12-13]。但是,目前对于藏猪妊娠期乳腺的发育情况及激素和信号通路调控尚不清楚。
本试验以藏猪为对象,选取妊娠期不同时间点,在研究乳腺发育形态的基础上,进一步探索不同时间点血清中E2、P、PRL的水平,乳腺中激素受体的表达及乳腺发育关键信号通路PI3K/Akt和Jak2/STAT5的变化。研究旨在初步探究妊娠期藏猪乳腺发育过程及其潜在调控机制,为日后藏猪乳腺发育规律的揭示和地方品种的保护提供科学依据。
1 材料与方法 1.1 试验动物妊娠藏猪选取4个时间点(妊娠33、50、75和90 d)进行屠宰采样,采集血后离心取血清,采集第3、4对乳腺组织提取蛋白质,取第4对靠近乳头部乳腺进行石蜡切片染色。
1.2 试验材料雌二醇、孕酮和催乳素ELISA试剂盒购于南京建成生物工程有限公司;催乳素受体(Prolactin receptor,PRLR)(货号:382057)、雌激素受体(Estrogen receptor,ER)(货号:220467)、孕酮受体(Progesterone receptor, PR)(货号:220124)抗体购于正能生物有限公司,蛋白酪氨酸激酶2(Janus kinase 2, Jak2)(货号:3230)、磷酸化蛋白酪氨酸激酶2 (p-Jak2)(货号:3771)、信号转导及转录激活因子5 (Signal transducers and activators of transduction 5, STAT5)(货号:9359)、磷酸化信号转导及转录激活因子5 (p-STAT5)(货号:4322)、磷脂酰肌醇三激酶(Phosphatidylinositol 3-kinase, PI3K)(货号:4249)、磷酸化磷脂酰肌醇三激酶(p-PI3K)(货号:4228)、蛋白激酶B (Protein kinase B, AKT)(货号:9272)和磷酸化蛋白激酶B (p-AKT)(货号:4060)抗体购于Cell Signaling Technology公司;苏木素染液、伊红染液、苏木素分化液和苏木素返蓝液购于塞维尔生物公司;BCA蛋白定量试剂盒购自白泰克生物技术有限公司(北京);ECL化学发光液购自上海雅酶生物医药科技有限公司。
1.3 测定指标及方法乳腺采集和HE染色:切下右侧乳腺腹腺体(第4对乳腺),体积分数为4%的多聚甲醛溶液固定24 h,石蜡包埋,切片,进行HE染色,显微镜下观察并拍照。
蛋白质免疫印迹(Western blot):按照每10 μg乳腺组织加入100 μL裂解液进行匀浆,试剂盒抽提法提取蛋白质,按照BCA蛋白定量试剂盒进行蛋白浓度测定,调整蛋白浓度并用5×loading buffer制样,按照每孔20 μg总蛋白上样电泳,经电转至聚偏二氟乙烯(PVDF) 膜上后封闭,孵育一抗过夜,并用TBST缓冲液洗净孵育二抗,TBST缓冲液洗净后按照ECL化学发光底物说明书1∶1配置工作液,使PVDF膜与其充分反应30 s,置于曝光仪中曝光显色并拍照。
血清激素检测:按照南京建成ELISA试剂盒说明书进行检测;加入准备好的样品、标准品和生物素抗原,37 ℃条件下反应30 min;洗板5次,加入亲和素−HRP,37 ℃条件下反应30 min;洗板5次,加入显色液A、B,37 ℃条件下显色10 min;加入终止液;10 min之内读取D450 nm,计算浓度。
1.4 统计分析数据结果用平均值±标准误表示,统计分析采用SigmaPlot 12.5软件分析,采用单因素方差分析,并用Duncan’s法对各组进行多重比较分析。
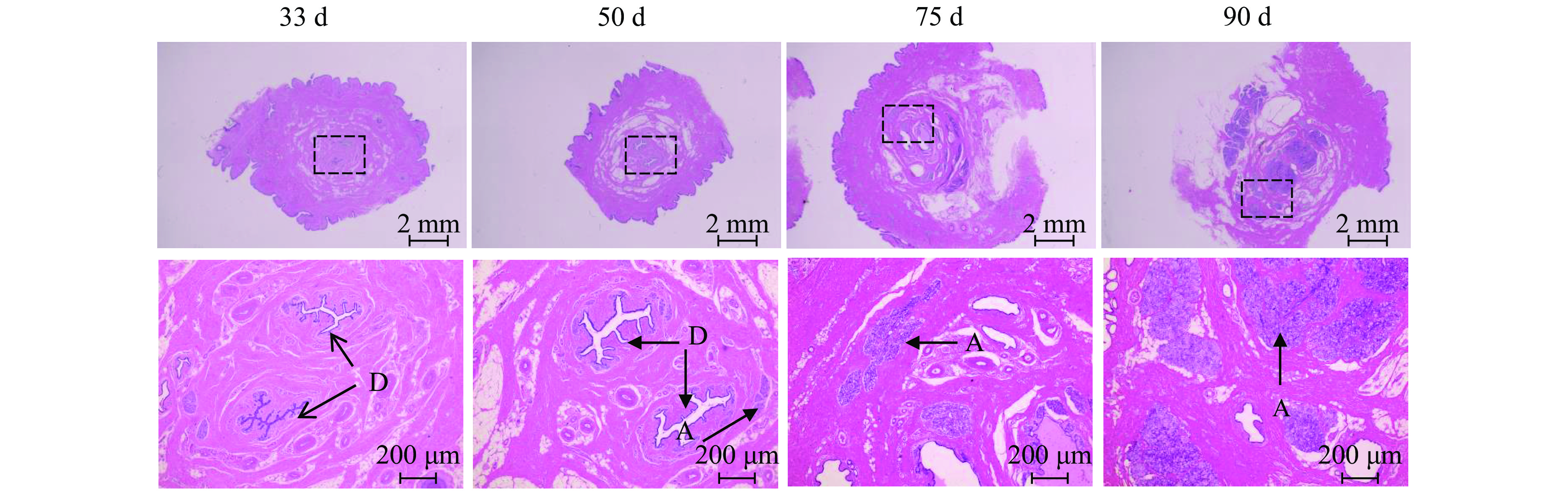
2 结果与分析 2.1 藏猪妊娠期乳腺形态变化乳腺HE染色结果如图1所示,妊娠33 d时,藏猪乳腺中主要是导管结构;50 d时,乳腺中出现少量腺泡结构;75 d时,乳腺中腺泡结构快速增多;至90 d时,乳腺中主要是腺泡结构。
|
图 1 藏猪妊娠期不同时间点乳腺形态 Fig. 1 Mammary gland morphology in Tibetan pigs at different time points during gestation D:乳腺导管;A:乳腺腺泡 D: Mammary ducts; A: Mammary alveolus |
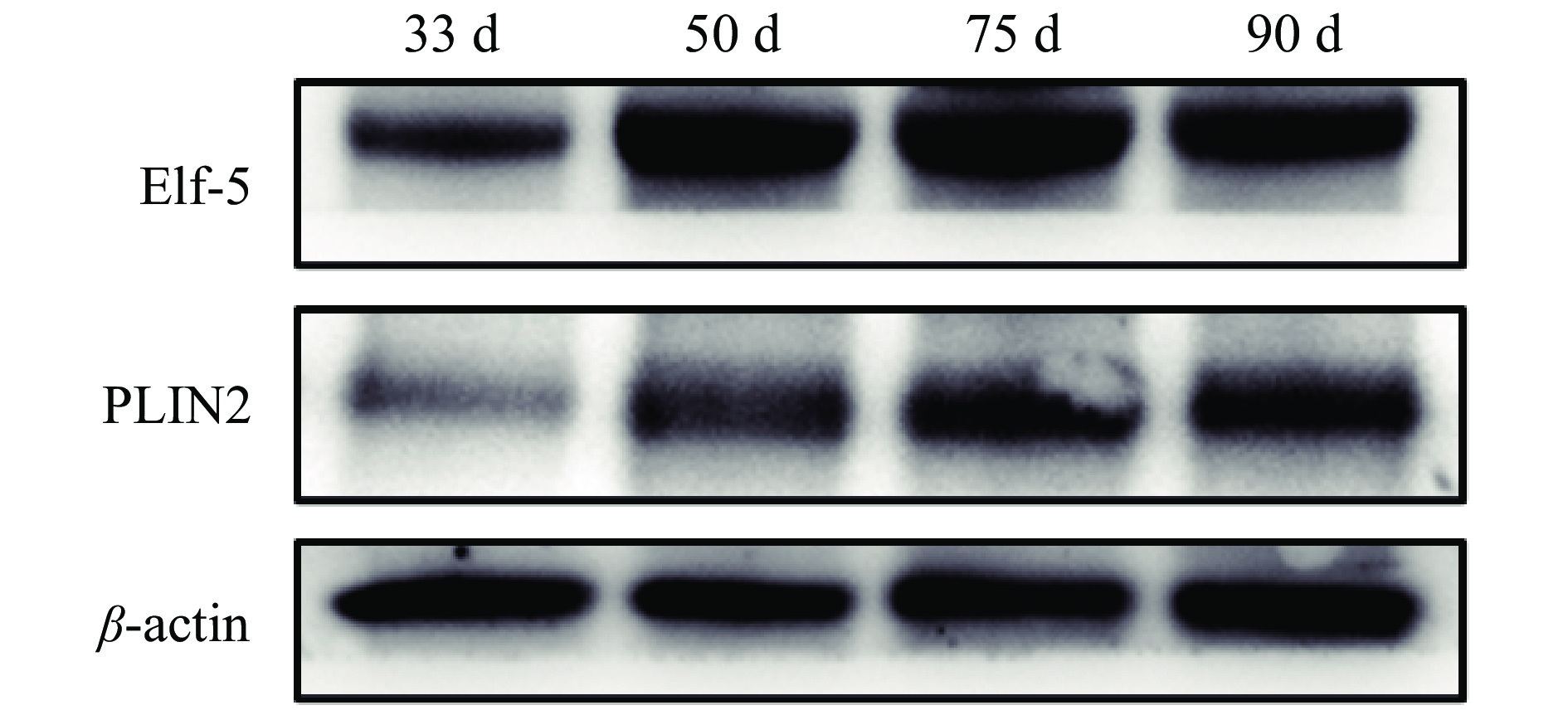
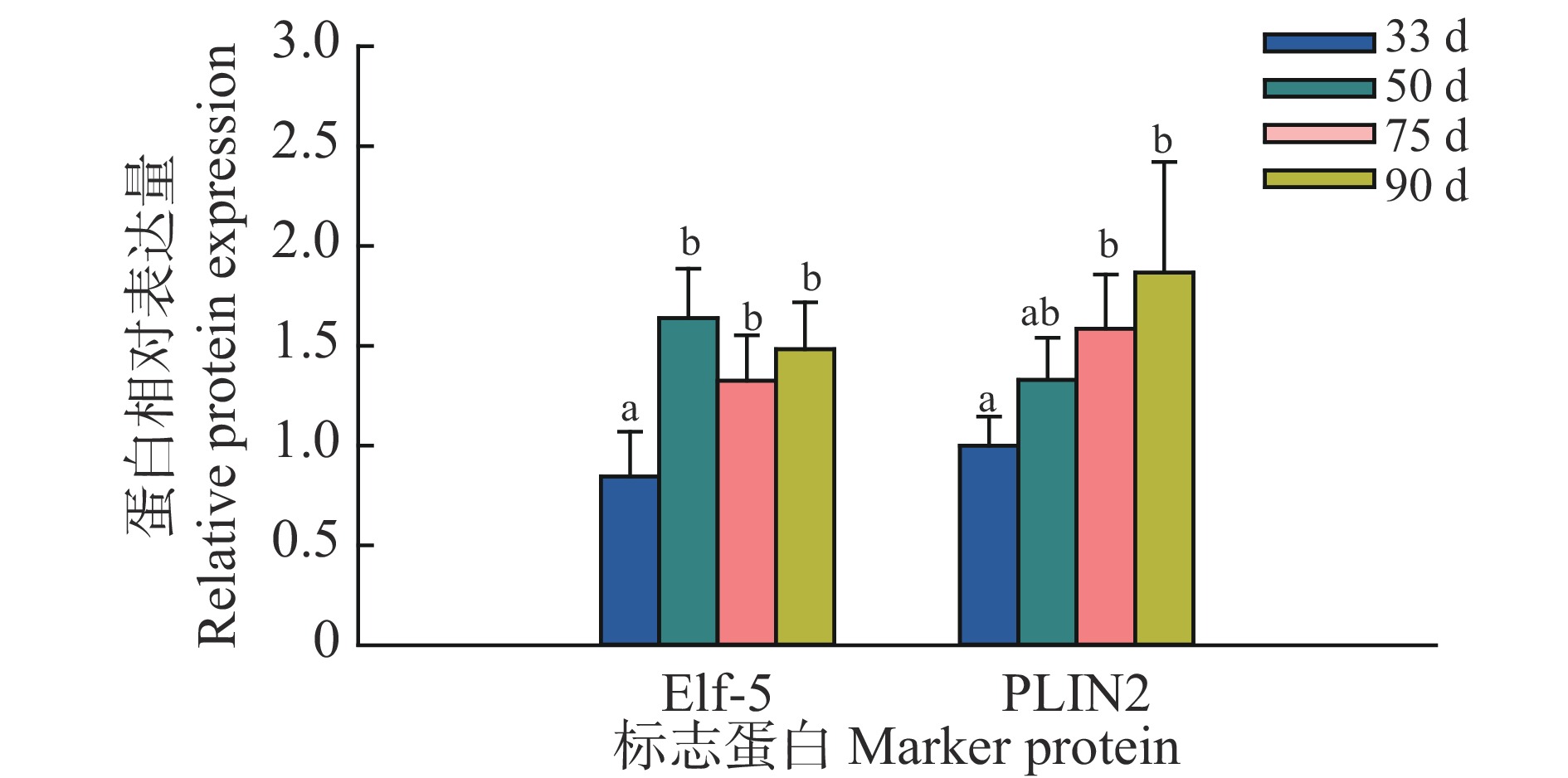
利用Western blot方法检测了藏猪妊娠期不同时间点乳腺发育标志蛋白Elf-5和PLIN2的表达,结果发现,在妊娠50、75和90 d时,Elf-5蛋白表达水平显著高于33 d;PLIN2的蛋白水平在75和90 d时显著高于33 d (图2、图3)。
|
图 2 藏猪妊娠期不同时间点乳腺发育标志蛋白的电泳图 Fig. 2 Electropherograms of marker protein for mammary gland development at different time points during gestation in Tibetan pigs |
|
图 3 藏猪妊娠期不同时间点乳腺发育标志蛋白相对表达量 Fig. 3 Relative expressions of marker proteins for mammary gland development at different time points during gestation in Tibetan pigs 相同标志蛋白柱子上方的不同小写字母表示差异显著(P<0.05,Duncan’s法) Different lowercase letters on bars of the same marker protein indicate significant differences (P<0.05,Duncan’s method) |
如表1所示,妊娠期不同时间点藏猪血清中E2、P和PRL的水平随着妊娠的进行呈升高趋势。其中E2水平逐渐升高,到妊娠90 d达到最高水平,为42.82 ng/L;P水平在75和90 d显著高于33和50 d,90 d P水平达到36.76 μg/L;PRL水平在50 d升高,75 d显著高于33 d但与50 d无显著差异,90 d时达到最高,为66.53 μg/L,显著高于其他时间点。
|
|
表 1 藏猪妊娠期不同时间点的血清激素水平1) Table 1 Serum hormone levels at different time points during gestation in Tibetan pigs |
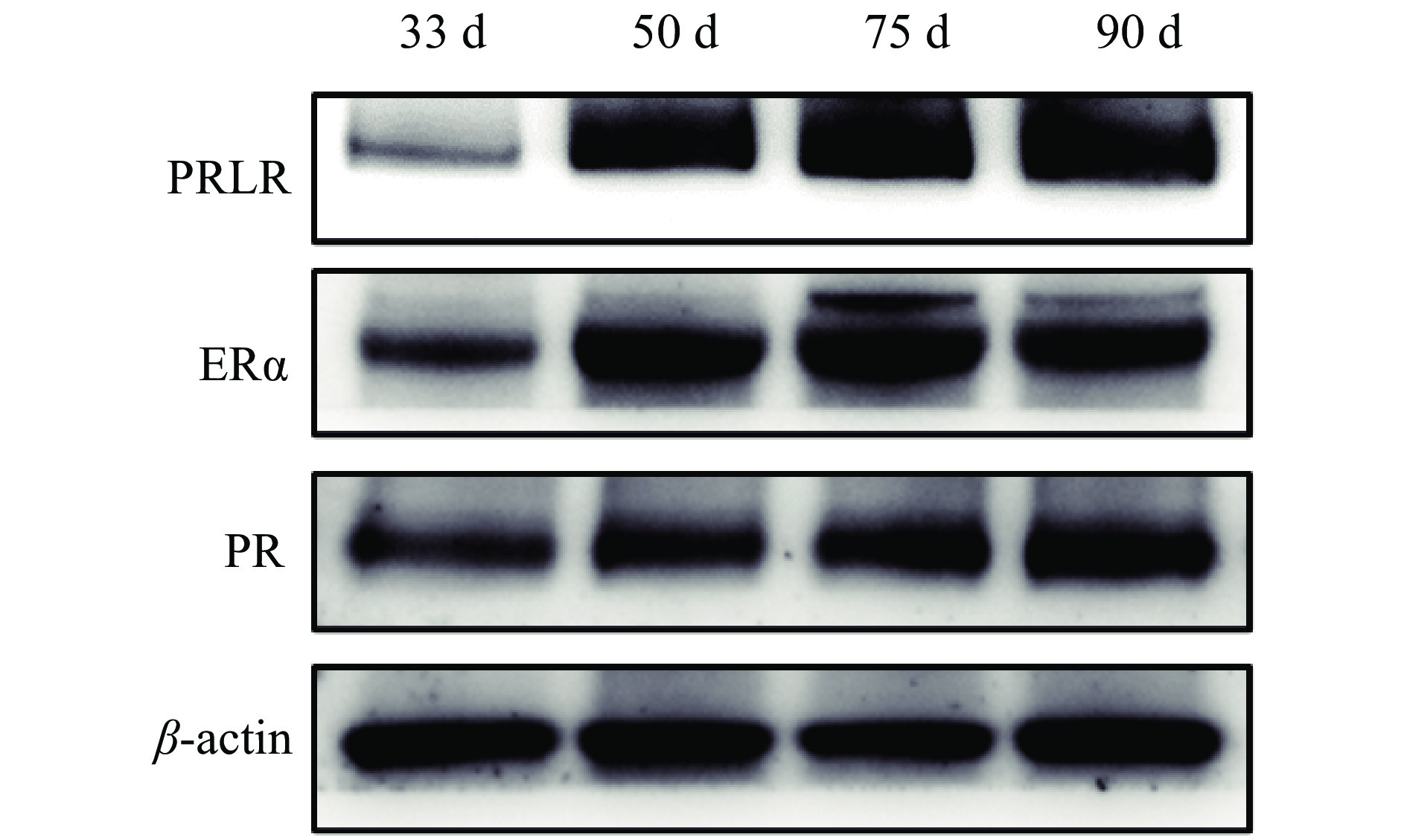
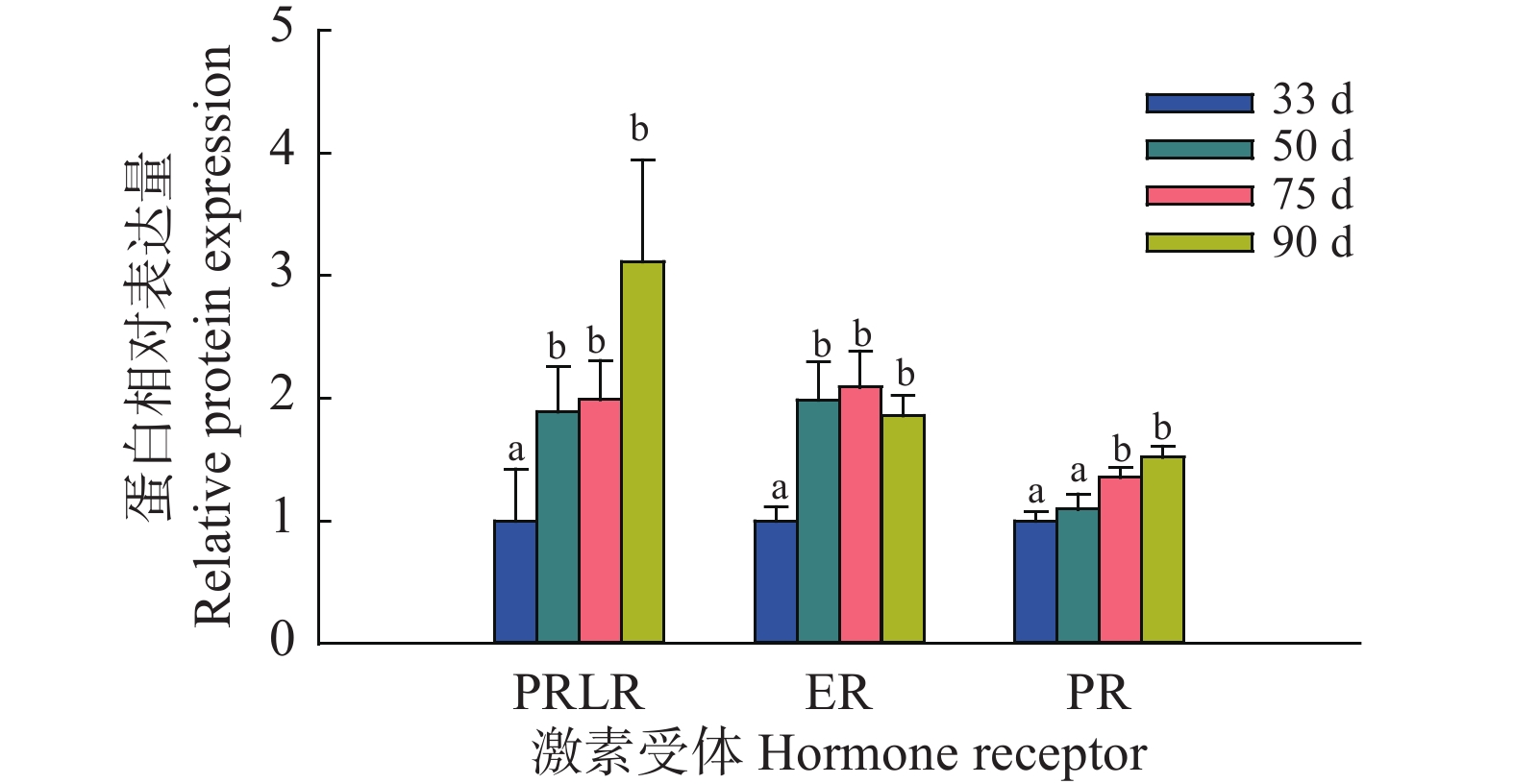
利用Western blot方法检测了藏猪妊娠期不同时间点乳腺中激素受体的蛋白表达。结果显示,妊娠50 d时PRLR表达水平显著高于33 d,在90 d时达到最高;ER表达水平在50 d时显著增加,在50、75和90 d时水平相当;在75 d时PR表达水平显著高于33和50 d,在90 d时达到更高(图4、图5)。
|
图 4 藏猪妊娠期不同时间点乳腺中激素受体电泳图 Fig. 4 Electropherograms of the hormone receptors at different time points during gestation in mammary glands of Tibetan pigs |
|
图 5 藏猪妊娠期不同时间点乳腺中激素受体蛋白相对表达量 Fig. 5 Relative expressions of the hormone receptors at different time points during gestation in mammary glands of Tibetan pigs 相同激素受体柱子上方的不同小写字母表示差异显著(P<0.05,Duncan’s法) Different lowercase letters on bars of the same hormone receptor indicate significant differences (P<0.05,Duncan’s method) |
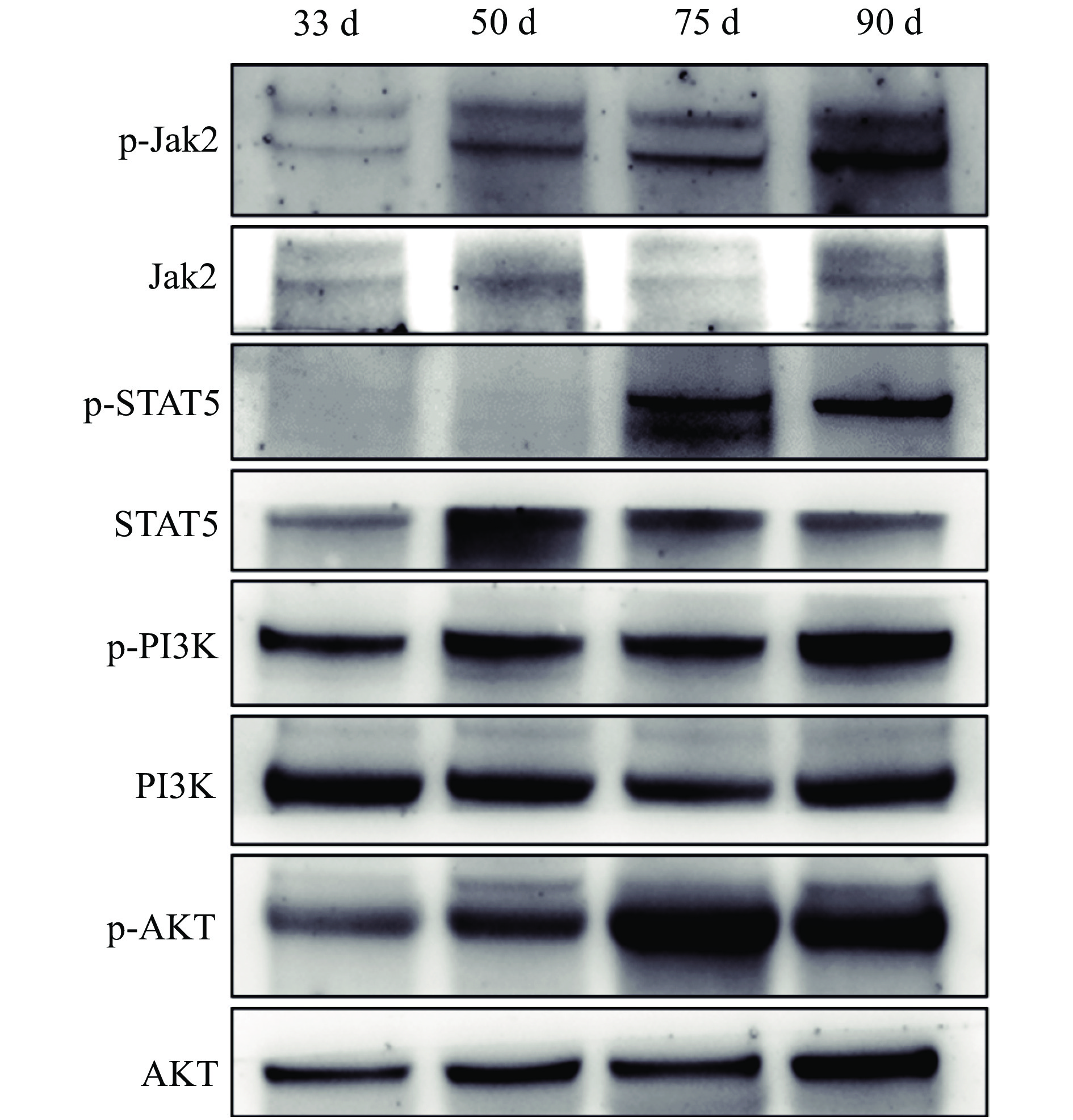
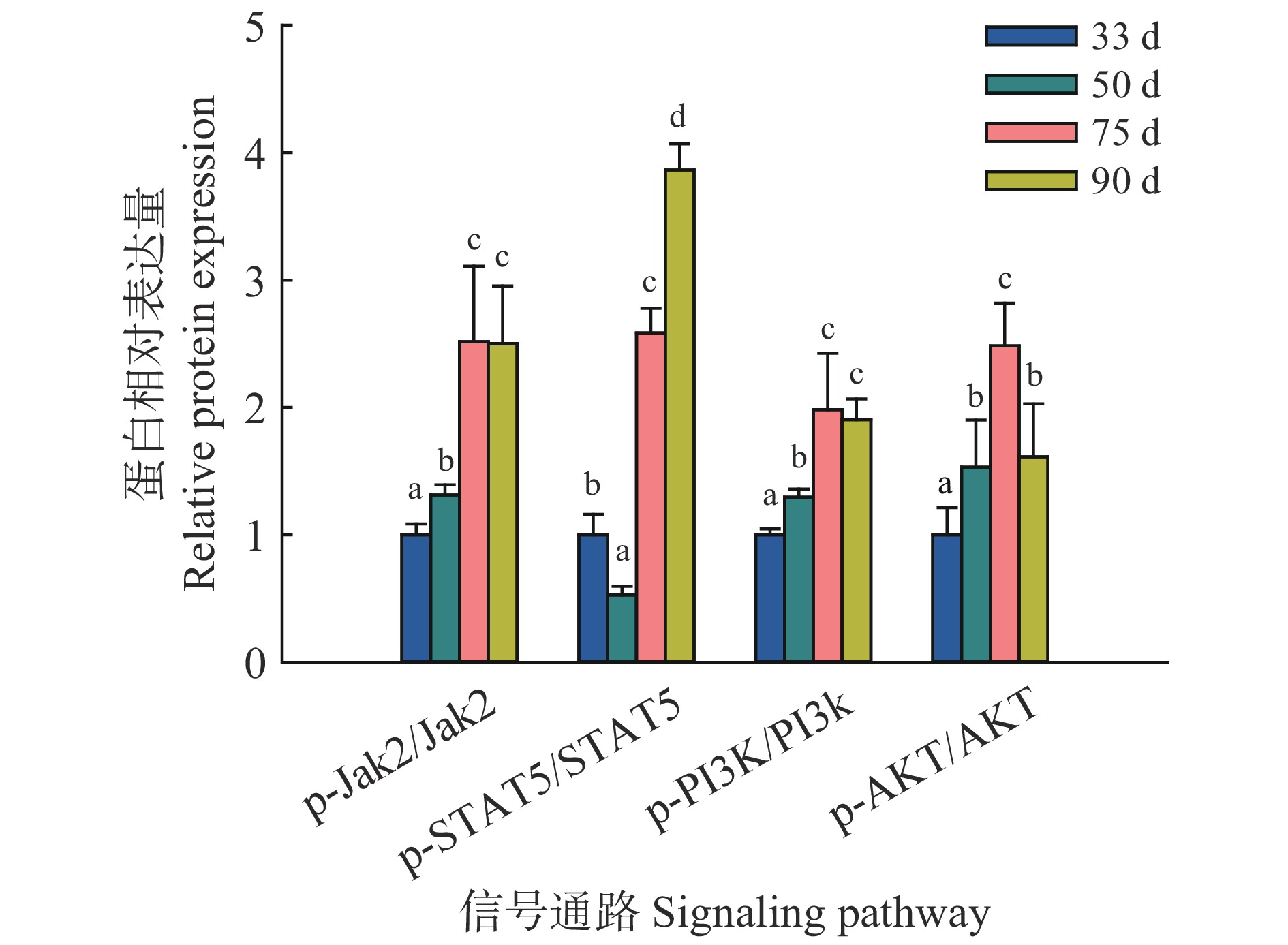
利用Western blot方法检测藏猪妊娠期不同时间点乳腺发育相关信号通路Jak2/STAT5和PI3K/AKT的激活情况。由图6、图7可知,妊娠75 d时,Jak2、STAT5、PI3k和AKT的磷酸化水平显著升高,90 d时,Jak2、STAT5和PI3k的磷酸化水平显著升高,提示Jak2/STAT5和PI3K/AKT信号通路被显著激活。
|
图 6 藏猪妊娠期不同时间点乳腺中Jak2/STAT5和PI3K/AKT信号通路蛋白的电泳图 Fig. 6 Electropherograms of proteins from Jak2/STAT5 and PI3K/AKT signaling pathways at different time points during gestation in mammary glands of Tibetan pigs |
|
图 7 藏猪妊娠期不同时间点乳腺中Jak2/STAT5和PI3K/AKT信号通路的蛋白相对表达量 Fig. 7 Relative expressions of proteins from Jak2/STAT5 and PI3K/AKT signaling pathways at different time points during gestation in mammary glands of Tibetan pigs 相同信号通路柱子上方的不同小写字母表示差异显著(P<0.05,Duncan’s法) Different lowercase letters on bars of the same signaling pathway indicate significant differences (P<0.05,Duncan’s method) |
妊娠期是母猪乳腺发育的重要时期。我们的研究发现,妊娠33 d时,藏猪乳腺中主要是导管结构,50 d时出现少量腺泡结构,75 d时腺泡快速增多,90 d时乳腺中主要是腺泡结构。与我们的研究结果类似的是,Ji等[14]研究发现,母猪乳腺在妊娠45 d仅316 g,75 d乳腺质量达1606 g,90 d达到2357 g;此外,Kensinger等[15]研究表明,母猪乳腺在90 d时,腺泡数量达到最大,在90~105 d,乳腺腺泡开始分泌并蓄积大量乳汁,泌乳活动即将开始等。高慧杰等[16]在奶山羊的妊娠前期也发现乳腺并没有进入快速增殖分化阶段,而是代谢和呼吸作用增强,妊娠中期有大量细胞增殖分化。
Elf-5在妊娠期和哺乳期对乳腺腺泡的增殖和分化有重要作用,是调节乳腺发育中必不可少的调控因子[17-18]。PLIN2是调控乳脂生成的关键分子[19]。我们的研究结果显示,Elf-5和PLIN2在妊娠50 d后表达量显著升高,结合乳腺的形态和Elf-5、PLIN2蛋白水平,说明50 d乳腺开始发育出腺泡,75 d乳腺进入快速发育的阶段,90 d达到更高的发育程度,其中主要是腺泡结构。
3.2 藏猪妊娠期血清激素水平、乳腺激素受体及关键信号通路的蛋白表达模式妊娠期乳腺发育受到多种激素的调节,其中,E2、P是调节妊娠期乳腺发育的主要激素,PRL是调节泌乳期乳腺发育及泌乳的的主要激素[5-6]。激素通过与其受体结合发挥作用,若敲除其受体,则乳腺无法正常发育[20]。方莉莉等[21]研究发现,在牦牛的妊娠早中期,PR在乳腺组织中表达量较少,与本文藏猪妊娠早中期PR蛋白表达较少一致。本文研究结果显示,E2、P和PRL等激素及其受体在妊娠期呈升高趋势,与乳腺的发育程度相吻合。类似地,Horigan等[22]通过体外给卵巢切除并抑制PRL分泌的猪注射E2、P、E2+PRL、E2+PRL+P,结果表明,注射E2+PRL+P这3种激素的组合方式才能最大程度地促进乳腺导管和腺泡产生,说明E2、P和PRL之间的相互作用对母猪乳腺发育起着关键作用。
PI3K/Akt和Jak2/STAT5信号通路在乳腺发育中起着重要调控作用。其中,PI3K/Akt是细胞内参与细胞信号转导的重要通路,参与细胞生长、增殖及分化等细胞过程[9, 23]。Meng等[10-11]研究表明,PI3K/Akt信号通路对乳腺发育和乳腺细胞的增殖具有重要作用。此外,JAK2/STAT5信号通路对乳腺腺泡的生成和多种乳汁蛋白基因的转录有着重要的调控作用[12-13]。我们的研究结果表明,PI3K/Akt和Jak2/STAT5信号通路在妊娠75 d后被显著激活,这与乳腺的高度发育及泌乳活动的开始有关。Palin等[24]的研究表明,梅山猪与大白猪乳腺组织实质中STAT5A和STAT5B的表达水平存在差异,STAT5发生磷酸化后易位至细胞核,与产乳靶基因启动子结合,激活并维持泌乳,梅山猪妊娠期乳腺组织中STAT5A和STAT5B的表达水平更高,能够生成更多的磷酸二聚体易位至核,同时梅山猪乳腺发育情况更好,具有更高的泌乳力。
综上所述,本文研究了藏猪妊娠期乳腺形态和乳腺发育标志蛋白、相关激素及信号通路的变化。结果发现,在藏猪妊娠过程中,其乳腺在妊娠50 d开始腺泡发育,75 d乳腺进入腺泡快速发育期,90 d发育程度更高,同时伴随着血清中乳腺发育相关激素(E2、P和PRL)和乳腺中激素受体表达的显著升高,以及乳腺发育相关通路PI3K/AKT和Jak2/STAT5的激活。研究结果为认识藏猪的乳腺发育和繁殖功能奠定了科学依据,为保护藏猪资源奠定了理论基础。
| [1] |
唐建华, 冯静, 陈晓英, 等. 藏猪种质资源保护与利用研究[J]. 养猪, 2016(1): 68-70. DOI:10.3969/j.issn.1002-1957.2016.01.033 (  0) 0) |
| [2] |
张浩, 吴常信, 强巴央宗, 等. 藏猪3个繁殖性状主效基因多态性研究[J]. 遗传, 2007(8): 939-944. DOI:10.3321/j.issn:0253-9772.2007.08.007 (  0) 0) |
| [3] |
JI F, HURLEY W L, KIM S W. Characterization of mammary gland development in pregnant gilts[J]. Journal of Animal Science, 2006, 84(3): 579-587. DOI:10.2527/2006.843579x (  0) 0) |
| [4] |
MACIAS H, HINCK L. Mammary gland development[J]. Wiley Interdisciplinary Reviews Developmental Biology, 2012, 1(4): 533-557. DOI:10.1002/wdev.35 (  0) 0) |
| [5] |
HILTON H N, CLARKE C L, GRAHAM J D. Estrogen and progesterone signalling in the normal breast and its implications for cancer development[J]. Molecular and Cellular Endocrinology, 2018, 466: 2-14. DOI:10.1016/j.mce.2017.08.011 (  0) 0) |
| [6] |
ZIELNIOK K, SOBOLEWSKA A, GAJEWSKA M. Mechanisms of autophagy induction by sex steroids in bovine mammary epithelial cells[J]. Journal of Molecular Endocrinology, 2017, 59(1): 29. DOI:10.1530/JME-16-0247 (  0) 0) |
| [7] |
TIAN L, ZHANG L, CUI Y, et al. miR-142-3p regulates milk synthesis and structure of murine mammary glands via PRLR-mediated multiple signaling pathways[J]. Journal of Agricultural and Food Chemistry, 2019, 67(34): 9532-9542. DOI:10.1021/acs.jafc.9b03734 (  0) 0) |
| [8] |
O’LEARY K A, SHEA M P, SALITURO S, et al. Prolactin alters the mammary epithelial hierarchy, increasing progenitors and facilitating ovarian steroid action[J]. Stem Cell Reports, 2017, 9(4): 1167-1179. DOI:10.1016/j.stemcr.2017.08.011 (  0) 0) |
| [9] |
RÄDLER P D, WEHDE B L, WAGNER K U. Crosstalk between STAT5 activation and PI3K/AKT functions in normal and transformed mammary epithelial cells[J]. Molecular and Cellular Endocrinology, 2017, 451: 31-39. DOI:10.1016/j.mce.2017.04.025 (  0) 0) |
| [10] |
MENG Y, YUAN C, ZHANG J, et al. Stearic acid suppresses mammary gland development by inhibiting PI3K/Akt signaling pathway through GPR120 in pubertal mice[J]. Biochemical And Biophysical Research Communications, 2017, 491(1): 192-197. DOI:10.1016/j.bbrc.2017.07.075 (  0) 0) |
| [11] |
MENG Y, ZHANG J, ZHANG F, et al. Lauric acid stimulates mammary gland development of pubertal mice through activation of GPR84 and PI3K/Akt signaling pathway[J]. Journal of Agricultural and Food Chemistry, 2017, 65(1): 95-103. DOI:10.1021/acs.jafc.6b04878 (  0) 0) |
| [12] |
VOLKER S E, HEDRICK S E, FEENEY Y B, et al. Cyclophilin a function in mammary epithelium impacts Jak2/Stat5 signaling, morphogenesis, differentiation, and tumorigenesis in the mammary gland[J]. Cancer Research, 2018, 78(14): 3877-3887. DOI:10.1158/0008-5472.CAN-17-2892 (  0) 0) |
| [13] |
ZHANG M C, ZHAO S G, WANG S S, et al. d-Glucose and amino acid deficiency inhibits casein synthesis through JAK2/STAT5 and AMPK/mTOR signaling pathways in mammary epithelial cells of dairy cows[J]. Journal of Dairy Science, 2018, 101(2): 1737-1746. DOI:10.3168/jds.2017-12926 (  0) 0) |
| [14] |
JI F, WU G, BLANTON J R, et al. Changes in weight and composition in various tissues of pregnant gilts and their nutritional implications1[J]. Journal of Animal Science, 2005, 83(2): 366-375. DOI:10.2527/2005.832366x (  0) 0) |
| [15] |
KENSINGER R S, COLLIER R J, BAZER F W, et al. Nucleic acid, metabolic and histological changes in gilt mammary tissue during pregnancy and lactogenesis[J]. Journal of Animal Science, 1982, 54(6): 1297-1308. DOI:10.2527/jas1982.5461297x (  0) 0) |
| [16] |
高慧杰, 郑惠玲. WGCNA鉴定奶山羊妊娠至泌乳期乳腺发育关键基因[J]. 畜牧兽医学报, 2020, 51(11): 2679-2688. DOI:10.11843/j.issn.0366-6964.2020.11.007 (  0) 0) |
| [17] |
苏启明, 曲鑫建, 伍会健. ELF5在正常乳腺发育和乳腺肿瘤发生中的作用[J]. 生命科学研究, 2017, 21(3): 262-267. (  0) 0) |
| [18] |
OAKES S R, NAYLOR M J, ASSELIN-LABAT M-L, et al. The Ets transcription factor Elf5 specifies mammary alveolar cell fate[J]. Genes & Development, 2008, 22(5): 581-586. (  0) 0) |
| [19] |
SHI H B, YU K, LUO J, et al. Adipocyte differentiation-related protein promotes lipid accumulation in goat mammary epithelial cells[J]. Journal of Dairy Science, 2015, 98(10): 6954-6964. DOI:10.3168/jds.2015-9452 (  0) 0) |
| [20] |
KELLY P A, BACHELOT A, KEDZIA C, et al. The role of prolactin and growth hormone in mammary gland development[J]. Molecular and Cellular Endocrinology, 2002, 197(1): 127-131. (  0) 0) |
| [21] |
方莉莉, 安玲, 荆海霞, 等. 孕激素受体在不同发育期牦牛乳腺组织内的分布及表达[J]. 黑龙江畜牧兽医, 2019(11): 141-146. (  0) 0) |
| [22] |
HORIGAN K C, TROTT J F, BARNDOLLAR A S, et al. Hormone interactions confer specific proliferative and histomorphogenic responses in the porcine mammary gland[J]. Domestic Animal Endocrinology, 2009, 37(2): 124-138. DOI:10.1016/j.domaniend.2009.04.002 (  0) 0) |
| [23] |
CHAI X, SUN D, HAN Q, et al. Hypoxia induces pulmonary arterial fibroblast proliferation, migration, differentiation and vascular remodeling via the PI3K/Akt/p70S6K signaling pathway[J]. International Journal of Molecular Medicine, 2018, 41(5): 2461-2472. (  0) 0) |
| [24] |
PALIN M F, BEAUDRY D, ROBERGE C, et al. Expression levels of STAT5A and STAT5B in mammary parenchymal tissue from Upton-Meishan and Large White gilts[J]. Canadian Journal of Animal Science, 2002, 82(4): 507-518. DOI:10.4141/A01-091 (  0) 0) |
 2021, Vol. 42
2021, Vol. 42


