2. 华南农业大学 植物保护学院/广东省微生物信号与作物病害防控重点实验室,广东 广州 510642
2. College of Plant Protection, South China Agricultural University/Guangdong Provincial Key Laboratory of Microbial Signals and Disease Control, Guangzhou 510642, China
美丽崖豆藤Millettia speciosa Champ.,又名牛大力、大力薯、山莲藕,为豆科崖豆藤属植物,主要分布在广东、福建、湖南、广西、海南、云南、贵州等省区的山谷、路旁、灌木林丛或疏林中[1]。其根部可以入药,用来治疗腰肌劳损、风湿性关节炎、肺结核等疾病,是多种中成药的主要原料;在美丽崖豆藤生产地,其根部常用于制作药膳、药酒,其茎、芽、叶片被开发成茶包或饲料添加剂,产品附加值大大提升[2]。目前美丽崖豆藤野生资源已濒临枯竭,规模化的人工种植基地面积正逐渐扩大。但是,鲜见关于美丽崖豆藤的病害研究[3]。
炭疽病是世界范围内的一种重要病害,炭疽病菌Colletotrichum spp.能够侵染为害3200余种单子叶和双子叶植物,包括园艺观赏植物、水果、蔬菜、中药材等[4]。在我国的豆科植物上已报道了多种炭疽病菌,如C. spaethianum引起的菜豆炭疽病[5]、C. gloeosporioides引起的葛藤和大豆炭疽病[6]、C. capsici引起的豇豆炭疽病[6]、C. chlorophyti 引起的大豆炭疽病[7]、C. siamense引起的紫荆炭疽病[8],但其鉴定所采用的标准不尽一致。即使是形态学特征和分子系统发育分析相结合,也有单个内转录间隔区(Internal transcribed spacer,ITS)片段、肌动蛋白(Actin,ACT)、3−磷酸甘油醛脱氢酶(Glyceraldehyde-3- phosphate dehydrogenase,GAPDH)、几丁质合成酶基因(Chitin synthase,CHS-1)、β−微管蛋白(β-tubulin,TUB2)和钙调蛋白(Calmodulin,CAL)等多个基因联合分析的区别,后者已成为炭疽病菌精准鉴定的重要手段[9-10]。美丽崖豆藤炭疽病菌主要侵染叶片,在叶尖或叶缘形成大量病斑,发病后期引起大量叶片脱落,田间发病植株叶片黄化,长势衰退。为明确广东省德庆县美丽崖豆藤叶片炭疽病的病原菌种类及筛选有效杀菌剂,本研究采集了发病的美丽崖豆藤植株样品,采用组织分离法获得分离物,单孢纯化后通过柯赫氏法则验证其致病性;结合病原菌形态学特征和多基因系统学分析确定病原菌分类地位;同时,采用菌丝生长速率法测定病原菌对4种常用杀菌剂的敏感性,旨在为美丽崖豆藤炭疽病的诊断和有效防控提供理论依据。
1 材料与方法 1.1 症状观察及样本采集2018年11月在广东省肇庆市德庆县药材种植示范基地发现感染炭疽病的美丽崖豆藤,观察并记录病害症状;采集具有典型症状的叶片。
1.2 病原菌的分离和纯化在采集的具有典型症状的美丽崖豆藤叶片的病健交界处切取5 mm×5 mm的叶片组织块,于φ为75%的乙醇溶液中浸润10 s进行表面消毒,随后用φ为2%的次氯酸钠消毒2~3 min,再用无菌蒸馏水冲洗3次,最后于无菌滤纸上自然晾干水分。用无菌镊子将消毒后的叶片组织块移至倒好的PDA培养基上,于25 ℃黑暗条件下培养至组织块周围长出菌丝。挑取新鲜的菌丝至新PDA平板中央进行疑似病原菌的培养。待新转移的菌落产生橘红色黏孢团后,挑取分生孢子配制孢子悬浮液,涂布于琼脂培养基上,于显微镜下切取单孢子的琼脂块转移至PDA平板上,获得单孢纯化菌株。观察各纯化菌株的菌落形态,并将各菌株接种至PDA斜面试管中在4 ℃条件下保存备用。
1.3 病原菌致病性的测定采用菌饼接种法进行菌株致病性测定。待培养菌株于PDA培养基上培养7 d后,在菌落边缘打取直径为5 mm的菌饼。选取美丽崖豆藤嫩叶,用无菌接种针刺伤后接种菌饼,以接种纯PDA培养基饼作为对照,每个菌株共计接种15张叶片。接种后的叶片置于保鲜盒中喷雾保湿,定期观察叶片的发病情况,方法参照文献[7];随机选取发病的叶片进行病原菌的再分离,并与原接种菌株进行形态及分子序列比较,若与原接种菌株相同,则原接种菌株即为致病菌。
1.4 病原菌的形态学鉴定观察病原菌在PDA培养基上于25 ℃条件下的培养性状;待产生橘红色的黏孢团后,用无菌牙签挑取黏孢团制备玻片,用Olympus BX41显微镜观察各菌株形态、测定分生孢子大小。
1.5 病原菌的分子鉴定将病原菌于PDA培养基上培养5 d,刮取菌丝置于液氮下充分研磨,采用真菌基因组DNA提取试剂盒(Omega生物工程有限公司)提取菌丝DNA。采用引物ITS1/ITS4[11]、CHS-79F/CHS-345R[12]、GDF/GDR[13]、ACT-512F/ACT-783R[12]和Bt2a/Bt2b[14]进行PCR扩增,各序列扩增引物信息见表1。PCR反应体系总体积为25 μL:DNA模板1 μL,正、反向引物各1 μL(10 μmol/L),2×MasterMix 12.5 μL,加ddH2O补足至25 μL。反应条件为:94 ℃预变性5 min;94 ℃变性30 s (CHS、ACT,58 ℃;GAPDH,60 ℃;ITS、TUB2,55 ℃)退火30 s,72 ℃延伸45 s,共35个循环;最后72 ℃延伸7 min。表2为本研究所用的刺盘孢菌株的序列信息。
|
|
表 1 病原菌鉴定所用引物 Table 1 Primers used for pathogen identification |
取5 μL PCR扩增产物用10 g/L琼脂糖凝胶电泳进行检测,然后将PCR产物送至北京六合华大基因科技有限公司广州分公司测序。将测得的基因序列与GenBank中的序列进行比对。下载相似性高的序列及其对应复合种的常见模式菌株序列(各菌株均为狭义的生物学种,具体信息见表2),使用MEGA软件剪切后按照ITS-CHS-GAPDH-ACT-TUB2的顺序首尾拼接,然后分析系统发育关系,采用最大似然法(Maximum likelihood,ML)构建系统发育树,以自展法(Bootstrap)进行检测,共循环1000次。
|
|
表 2 刺盘孢菌株的序列信息 Table 2 Sequence information of the Colletotrichum isolates |
以经致病性测定的菌株NDL13为材料,供试药剂为苯醚甲环唑(φ为96.3%)、咪鲜胺(φ为97.0%)、吡唑醚菌酯(φ为98.0%)和甲基硫菌灵(φ为97.0%)原药,采用菌丝生长速率法测定供试药剂对病原菌的抑制活性。首先将各药剂溶解于甲醇中得到原液,然后加水稀释得到工作液,取各工作液加入至PDA培养基中充分混匀,配制得到不同终浓度的含药平板,以不加药剂加入等量甲醇的PDA平板作为对照,每个药剂浓度处理设置4个重复。用孔径为5 mm的打孔器在培养7 d的菌落边缘打取菌饼,接种至PDA含药平板上,置于25 ℃条件下黑暗培养7 d,然后用十字交叉法测量各处理的菌落半径,计算各杀菌剂菌丝生长抑制率和抑制中浓度(EC50),绘制毒力回归方程。
1.7 数据分析用SPSS 26软件统计分析试验数据,求得毒力回归方程、EC50和相关系数,并采用Duncan’s新复极差法进行各处理间的差异显著性检验。
2 结果与分析 2.1 美丽崖豆藤炭疽病的田间症状美丽崖豆藤炭疽病发生于叶片,在叶尖或叶缘形成褐色的不规则形病斑,发病后期病斑变为灰白色或灰褐色(图1A、1B),边缘具有一条明显的褐色坏死交界线(图1C、1D),病斑外具黄色晕圈,病斑正面有明显的黑色小颗粒,为病原菌的分生孢子盘(图1C)。

|
图 1 美丽崖豆藤的田间发病症状 Fig. 1 Symptoms of the diseased Millettia speciose in the field A 和B: 田间发病症状;C 和D:发病叶片的正、反面 A and B: Typical symptoms in the field; C and D: The adaxial side and abaxial side of diseased leaves, respectively |
经过病组织分离、单孢纯化及单孢菌株的菌落性状比较,保存6个菌株,分别编号为NDL09、NDL13、NDL18、NDL19、NDL23和NDL35。6个菌株的致病性测定结果表明,只有菌株NDL13和NDL19可引起接种叶片发病,接种3 d后叶片开始出现水渍状病斑,接种8 d后病斑呈现为明显的褐色坏死,中央灰白色,边缘有黄色晕圈(图2A~2C),该症状与植株自然发病症状相似;对发病组织进行病原菌的再分离,得到的菌株的菌丝生长特征、菌落颜色、产孢表现、分生孢子显微特征等均与接种菌株表现一致。PDA对照、空白对照及另外4个菌株接种的叶片均不发病,仅在伤口刺伤处有一褐色坏死点(图2D~2H)。

|
图 2 美丽崖豆藤叶片接种8 d后的发病症状 Fig. 2 Disease symptoms on Millettia speciosa leaves eight days after inoculation A~C:NDL13接种;D~E: 刺伤后接PDA饼;F: 空白对照;G~H:NDL18接种接种 A−C indicate the anthracnose symptom of leaves inoculated with NDL13; D−E indicate leaves were wounded and inoculated with pure PDA plug; F indicate leaves were only wounded; G−H indicate leaves were inoculated with NDL18 |
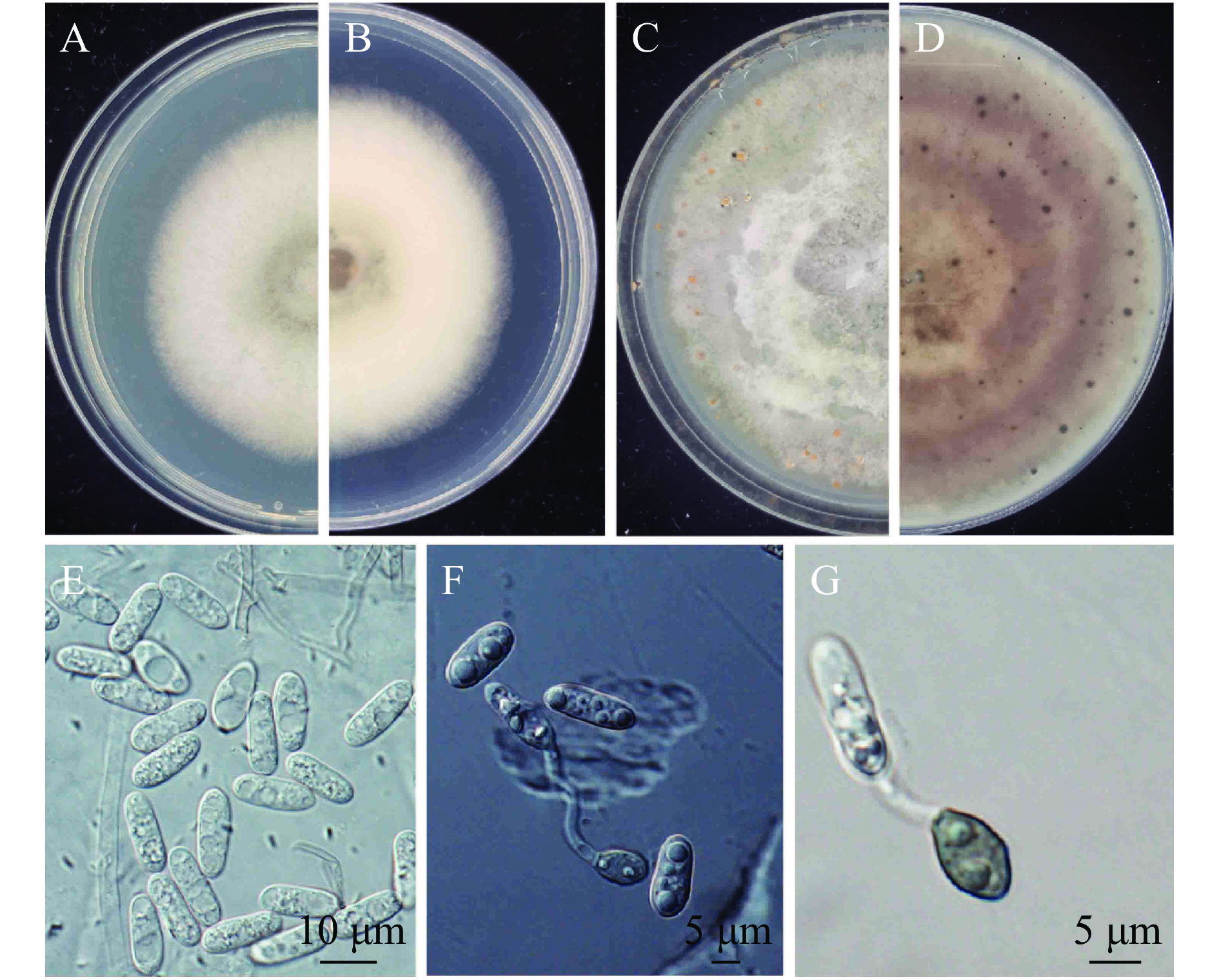
致病菌株NDL13和NDL19的形态学特征基本一致。在PDA培养基上,菌丝初期为白色,气生菌丝茂盛,呈绒毛状,菌落边缘整齐(图3A、3B);培养15 d后菌落上出现橘红色的黏孢团(图3C、3D),为病原菌的分生孢子。分生孢子无色,单孢,长椭圆形,两端钝圆,具1~2个油球,13.46~15.45 μm×4.77~5.91 μm (图3E)。分生孢子萌发形成的附着孢浅棕色至黑褐色,近球形、棒形或不规则形,8.22~9.95 μm×5.46~6.29 μm(图3F、3G)。根据病原菌的形态特征,结合Weir等[10]的描述,初步确定该菌株属于胶孢刺盘孢C. gloeosporioides 复合种。
|
图 3 炭疽病菌株的菌落形态和显微形态 Fig. 3 Colony morphology and microscopic characters of Colletotrichum isolates A和B:培养8 d后正、反面菌落;C和D:培养15 d后正、反面菌落;E: 孢子;F和G:附着孢 A and B indicate upper and reverse of cultures 4 days after inoculation; C and D indicate upper and reverse of cultures 15 days after inoculation; E: conidia; F and G indicate appressoria |
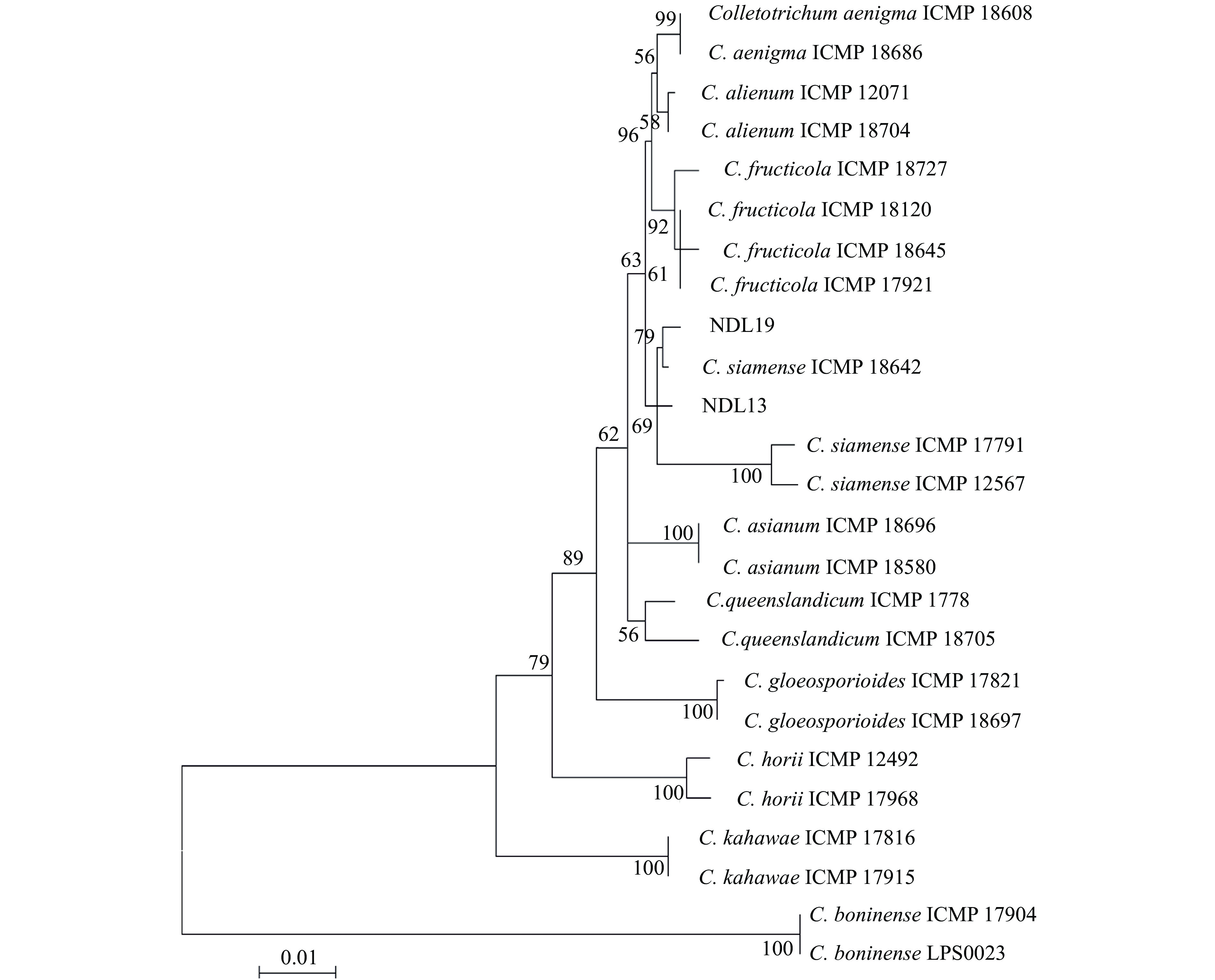
将菌株NDL13和NDL19的ITS、CHS、GAPDH、ACT和TUB2这5个基因的序列与从GenBank中下载得到的21个模式菌株或公认菌株相应的序列进行比对,以C. boninense为外类群构建的系统发育树如图4所示,病原菌NDL13和NDL19均与暹罗刺盘孢C. siamense聚在一起,形成一个明显的分支,且各分支间均有较高的支持率,因此确定美丽崖豆藤炭疽病的病原菌为暹罗刺盘孢C. siamense。
|
图 4 基于最大似然法构建的多基因系统发育树 Fig. 4 Multigene phylogenetic tree based on maximum likelihood analysis NDL19和NDL13为供试菌株 NDL19 and NDL13 indicate the present study isolates |
由表3可知,4种杀菌剂对美丽崖豆藤炭疽病菌均表现出显著的抑制效果,EC50为0.015~0.066 mg/L。其中,咪鲜胺的抑菌效果最佳,EC50最低,为0.015 mg/L,其次为吡唑醚菌酯、苯醚甲环唑和甲基硫菌灵,其EC50分别为0.055、0.060和0.066 mg/L,结果表明这4种测试药剂均可作为防治美丽崖豆藤炭疽病的首选药剂。
|
|
表 3 4种杀菌剂对美丽崖豆藤炭疽病菌的室内毒力测定结果 Table 3 In vitro toxicity test of four fungicides against Colletotrichum siamense |
美丽崖豆藤具有重要的药用和经济价值,炭疽病的发生极大地影响了其产量和价值,本研究报道了在广东省德庆县药材种植基地发现的美丽崖豆藤炭疽病,并结合致病性接种、形态特征和多基因系统发育树,将病原菌鉴定为暹罗刺盘孢C. siamense。该发现为美丽崖豆藤炭疽病的诊断和防治提供了理论依据。
炭疽病是一种重要的植物病害,可侵染为害植物叶片[15]、花穗[16]、果实[17]等,多年来很多学者致力于炭疽病的病原菌分类鉴定和病害防控的研究[18-19]。暹罗刺盘孢C. siamense被归入胶孢刺盘孢C. gloeosporioides复合种,前期研究只用ITS序列对病原菌进行鉴定,而该序列不能很好地区分胶胞刺盘孢复合种里面的近缘种,在后期的胶胞刺盘孢C. gloeosporioides复合种的修订中,多基因(ITS、ACT、GAPDH、CHS-1、TUB和CAL等)联合应用至胶胞刺盘孢复合种的鉴定中,提升了生物种鉴定的准确性[10, 20]。暹罗刺盘孢C. siamense能够侵染多种宿主植物,如茜草科Rubiaceae的咖啡Coffea arabica[21]、天南星科Araceae的魔芋Amorphophallus konjac[22]、无患子科Sapindaceae的荔枝Litchi chinensis [23]、蔷薇科Rosaceae的苹果Malus domestica [24]、山龙眼科Proteaceae植物[25]、五加科Araliaceae的鹅掌柴Schefflera octophylla [26]、兰科Orchidaceae植物[27]等。美丽崖豆藤隶属于豆科Leguminosae崖豆藤属Millettia,目前鲜见刺盘孢属Colletotrichum病原菌在崖豆藤属植物上的相关报道。本研究结合形态特征并构建多基因(ITS、CHS、GAPDH、ACT和TUB2)系统发育树,鉴定出美丽崖豆藤炭疽病的病原菌为暹罗刺盘孢C. siamense。
化学防治虽具有造成环境污染和诱使病原菌产生抗药性等缺陷,但其具有高效、快速、不受地域限制、便于规模化农事操作等优点,依然是目前防治炭疽病的主要措施。药效试验结果表明,美丽崖豆藤炭疽病的病原菌NDL13对咪鲜胺和苯醚甲环唑敏感,该结果与Cao等[28]的试验结果基本一致。Hu等[29]对桃子Prunus persica和蓝莓Vaccinium spp.上分离得到的暹罗刺盘孢C. siamense进行研究,结果发现100 mg/L的甲基硫菌灵对其抑制率才能超过50%,远高于本研究中甲基硫菌灵对美丽崖豆藤炭疽病的病原菌暹罗刺盘孢C. siamense的EC50(0.066 mg/L),这或与该病害为新病害,尚无进行长期的药剂防控,病原菌对供试药剂敏感有关,因此实际生产中应多种药剂轮换使用以降低病原菌的抗药性。本研究为美丽崖豆藤炭疽病的准确识别和科学防治奠定了理论基础、提供了科学的指导建议。
| [1] |
方利娟, 宁珊. 药用植物牛大力研究概况[J]. 安徽农学通报, 2017, 23(23): 18-20. DOI:10.3969/j.issn.1007-7731.2017.23.008 (  0) 0) |
| [2] |
刘丹丹, 唐立海, 王艳, 等. 牛大力祛痰、镇咳和平喘作用的实验研究[J]. 广州中医药大学学报, 2009, 26(3): 266-269. DOI:10.3969/j.issn.1007-3213.2009.03.018 (  0) 0) |
| [3] |
ZENG Q Q, XU D D, HUANG Y C, et al. First report of powdery mildew of beautiful millettia (Millettia speciosa) caused by Erysiphe quercicola in China
[J]. Plant Disease, 2019, 103(7): 1791. (  0) 0) |
| [4] |
O'CONNELL R J, THON M R, HACQUARD S, et al. Lifestyle transitions in plant pathogenic Colletotrichum fungi deciphered by genome and transcriptome analyses
[J]. Nature Genetics, 2012, 44(9): 1060-1065. DOI:10.1038/ng.2372 (  0) 0) |
| [5] |
YANG L, LU X, LI S, et al. First report of common bean (Phaseolus vulgaris) stem rot caused by Colletotrichum spaethianum in China
[J]. Plant Disease, 2019, 103(1): 151. (  0) 0) |
| [6] |
孙劲, 徐彪, 周长彬. 西昌地区豆科植物炭疽病的鉴定[J]. 西昌学院学报(自然科学版), 2004, 18(4): 83-84. (  0) 0) |
| [7] |
李海云, 靳帅, 张学勤, 等. 大豆炭疽病菌Colletotrichum chlorophyti 的鉴定
[J]. 植物保护, 2017, 43(2): 163-166. DOI:10.3969/j.issn.0529-1542.2017.02.028 (  0) 0) |
| [8] |
JI J, WANG T, XU X, et al. First report of Colletotrichum siamense causing leaf spot on redbud in China
[J]. Plant Disease, 2018, 103(3): 585. (  0) 0) |
| [9] |
SILVA D N, TALHINHAS P, VÁRZEA V, et al. Application of the Apn2/MAT locus to improve the systematics of the Colletotrichum gloeosporioides complex: An example from coffee (Coffea spp.) hosts
[J]. Mycologia, 2012, 104(2): 396-409. DOI:10.3852/11-145 (  0) 0) |
| [10] |
WEIR B S, JOHNSTON P R, DAMM U. The Colletotrichum gloeosporioides species complex
[J]. Studies in Mycology, 2012, 73: 115-180. DOI:10.3114/sim0011 (  0) 0) |
| [11] |
WHITE T J, BRUNS T, LEE S, et al. Amplification and direct sequencing of fungal ribosomal RNA genes for phylogenetics[M]//INNIS M A, GELFAND D H, SNINSKY J J, et al. PCR protocols: A guide to methods and applications. San Diego: Academic Press, 1990: 315-322.
(  0) 0) |
| [12] |
CARBONE I, KOHN L M. A method for designing primer sets for speciation studies in filamentous ascomycetes[J]. Mycologia, 1999, 91(3): 553-556. DOI:10.1080/00275514.1999.12061051 (  0) 0) |
| [13] |
TEMPLETON M D, RIKKERINK E H A, SOLON S L, et al. Cloning and molecular characterization of the glyceraldehyde-3-phosphate dehydrogenase-encoding gene and cDNA from the plant pathogenic fungus Glomerella cingulata
[J]. Gene, 1992, 122(1): 225-230. DOI:10.1016/0378-1119(92)90055-T (  0) 0) |
| [14] |
GLASS N L, DONALDSON G C. Development of primer sets designed for use with the PCR to amplify conserved genes from filamentous ascomycetes[J]. Applied and Environmental Microbiology, 1995, 61(4): 1323-1330. DOI:10.1128/AEM.61.4.1323-1330.1995 (  0) 0) |
| [15] |
李沛利, 刘丹, 陈诗瑶, 等. 四川省成都市狭叶十大功劳炭疽病病原菌的鉴定与生物学特性研究[J]. 植物保护, 2018, 44(3): 61-66. (  0) 0) |
| [16] |
张荣, 邓振权, 刘爱媛, 等. 荔枝叶面、花穗和果实上真菌消长动态[J]. 华南农业大学学报, 2012, 33(2): 159-162. DOI:10.3969/j.issn.1001-411X.2012.02.008 (  0) 0) |
| [17] |
刘梅, JAYAWARDENA R S, 刘阳, 等. 北京市葡萄炭疽病病原菌的分子鉴定[J]. 植物保护学报, 2018, 45(2): 393-394. (  0) 0) |
| [18] |
WIKEE S, WIKEE S, CAI L, et al. Colletotrichum species from jasmine (Jasminum sambac)
[J]. Fungal Diversity, 2011, 46(1): 171-182. DOI:10.1007/s13225-010-0049-x (  0) 0) |
| [19] |
YANG Y L, LIU Z Y, CAI L L, et al. Colletotrichum anthracnose of Amaryllidaceae
[J]. Fungal Diversity, 2009, 39(2): 123-146. (  0) 0) |
| [20] |
SHARMA G, PINNAKA A K, SHENOY B D. Resolving the Colletotrichum siamense species complex using ApMat marker
[J]. Fungal Diversity, 2015, 71(1): 247-264. DOI:10.1007/s13225-014-0312-7 (  0) 0) |
| [21] |
PRIHASTUTI H, CAI L, CHEN H, et al. Characterization of Colletotrichum species associated with coffee berries in northern Thailand
[J]. Fungal Diversity, 2009, 39: 89-109. (  0) 0) |
| [22] |
WU J P, ZHOU J, JIAO Z B, et al. Amorphophallus konjac anthracnose caused by Colletotrichum siamense in China
[J]. Journal of Applied Microbiology, 2019, 128(1): 225-231. (  0) 0) |
| [23] |
LING J F, SONG X B, XI P G, et al. Identification of Colletotrichum siamense causing litchi pepper spot disease in mainland China
[J]. Plant Pathology, 2019, 68(8): 1533-1542. DOI:10.1111/ppa.13075 (  0) 0) |
| [24] |
CHECHI A, STAHLECKER J, DOWLING M E, et al. Diversity in species composition and fungicide resistance profiles in Colletotrichum isolates from apples
[J]. Pesticide Biochemistry and Physiology, 2019, 158: 18-24. DOI:10.1016/j.pestbp.2019.04.002 (  0) 0) |
| [25] |
LIU F, DAMM U, CAI L, et al. Species of the Colletotrichum gloeosporioides complex associated with anthracnose diseases of Proteaceae
[J]. Fungal Diversity, 2013, 61(1): 89-105. DOI:10.1007/s13225-013-0249-2 (  0) 0) |
| [26] |
李沛利, 李娟, 龚国淑, 等. 四川省鹅掌柴炭疽病病原菌的初步鉴定[J]. 植物病理学报, 2017, 47(3): 296-304. (  0) 0) |
| [27] |
YANG Y, CAI L, YU Z, et al. Colletotrichum species on Orchidaceae in Southwest China
[J]. Cryptogamie Mycologie, 2011, 32(3): 229-253. DOI:10.7872/crym.v32.iss3.2011.229 (  0) 0) |
| [28] |
CAO X R, XU X M, CHE H Y, et al. Characteristics and distribution of Colletotrichum species in coffee plantations in Hainan, China
[J]. Plant Pathology, 2019, 68(6): 1146-1156. DOI:10.1111/ppa.13028 (  0) 0) |
| [29] |
HU M, GRABKE A, DOWLING M E, et al. Resistance in Colletotrichum siamense from peach and blueberry to thiophanate-methyl and azoxystrobin
[J]. Plant Disease, 2015, 99(6): 806-814. DOI:10.1094/PDIS-10-14-1077-RE (  0) 0) |
 2021, Vol. 42
2021, Vol. 42


