人类基因组约70%~90%可以转录成RNA,然而仅有不足2%的基因具备编码能力[1]。众多不具备编码能力的RNA都被归作转录噪音或者剪接副产品。尽管早期研究明确显示非编码RNA(Non-coding RNA,ncRNA)在自然界真实存在,它们的潜在作用仍没有被充分证实[2]。随着20世纪以来计算机技术的迅猛发展,人们发现这些非编码RNA在不同的生理或者病理过程中发挥着重要的调控作用[3]。环状RNA(Circular RNA,circRNA)是内源性非编码RNA家族的一员,大概40年前,研究人员逐渐关注这种具有共价闭环结构的新兴RNA分子。研究表明,circRNA在细胞中广泛分布,和线性RNA相比,不易受RNA外切酶影响,具有更高的稳定性[4]。近年来有关circRNA的生物学功能研究受到广泛关注,其作用方式多种多样,包括作为miRNA海绵、调控亲本基因转录、和蛋白质相互作用、甚至翻译小肽等方式发挥功能[5-8]。目前对circRNA生物学功能的理解仍处于早期,除了对衰老、癌症等疾病具有重要调控作用外,circRNA在肌肉发育过程中也具有重要作用。通过对不同动物的骨骼肌和成肌细胞进行circRNA测序,发现在肌肉中高表达且具有调控作用的多个circRNA,例如circFUT10、circLMO7、circRBFOX2、circFGFR4等,它们通过结合miRNA参与成肌细胞的增殖分化进程[9-12];另外也有研究发现circZNF609可以翻译微肽,且调控成肌细胞的增殖过程[8]。
RIPK2是RIP家族的一员,RIPK2的N端包含1个丝氨酸/苏氨酸结构域,C端为半胱氨酸蛋白水解酶募集域[13],研究表明,RIPK2在维持免疫系统稳态或者调节脂肪代谢等方面发挥重要作用[14-15]。Ouyang等[11]前期对不同发育时期鸡的骨骼肌进行circRNA测序,通过对测序结果的分析筛选,发现circRIPK2在3个时期差异表达,因此推测circRIPK2可能在鸡肌肉发育过程中具有重要作用。本研究利用PCR扩增、Sanger测序验证circRIPK2的存在,同时利用定量PCR、EdU试验、流式细胞术等探究circRIPK2对鸡原代成肌细胞的影响。
1 材料与方法 1.1 材料鸡胚来源于珠海市裕禾农牧有限公司。
主要试剂:DNA抽提试剂盒购自OMEGA公司;RNA反转录试剂盒购自莫纳生物科技有限公司;荧光定量PCR酶购自南京诺唯赞生物科技有限公司;环状RNA过表达载体pCD2.5-ciR购自吉赛生物科技有限公司;核质分离试剂盒、FastDigestBamHI、FastDigestEcoRI购自Thermo公司;RNAiso Plus购自TAKARA公司;凝胶DNA小量回收试剂盒、低内毒素质粒抽提试剂盒均购自Magen公司;转染试剂Lipofectamine 3000购自Invitrogen公司;Opti-MEM无血清培养基、RPMI1640细胞培养基、胰蛋白酶、胎牛血清、马血清均购自Gibco公司;EdU细胞增殖检测试剂盒购自广州锐博生物科技有限公司。
1.2 方法 1.2.1 鸡原代成肌细胞的分离与培养采集11胚龄鸡胚的腿肌组织,用手术剪刀和镊子剔除可见的骨骼和皮肤组织,剩余肌肉组织剪至肉糜状,然后用胰蛋白酶在37 ℃培养箱内消化15~20 min,用完全培养基(体积分数为20%的胎牛血清+体积分数为79.5% 的RPMI+体积分数为0.5%的青霉素、链霉素)终止消化。使用70 μm过滤网过滤后,1 500 r/min离心5 min,用完全培养基对细胞进行重悬、并接种到无菌培养皿中、差速贴壁2次,获取纯化的成肌细胞,细胞在37 ℃、CO2体积分数为5%的培养箱内培养。
1.2.2 circRIPK2过表达载体构建根据circRNA的测序数据,通过Ensemble数据库下载circRIPK2的基因序列,应用DNASTAR软件设计全长序列的引物(表1)。通过PCR反应获得circRIPK2的全长序列。使用FastDigestBamHI、FastDigestEcoRI酶切PCR扩增产物及pCD2.5-ciR载体,酶切产物纯化后利用T4连接酶连接、22 ℃条件下放置1 h。取10 μL连接产物转化至DH5α感受态细胞中,转化完成后涂板,37 ℃培养箱培养12~14 h后挑取单克隆菌落培养,菌液鉴定后,送擎科生物技术有限公司测序,比对circRIPK2基因序列和测序序列,选取结果吻合的单克隆菌落留用。
|
|
表 1 引物信息 Table 1 Primers used in this study |
当原代成肌细胞密度(显微镜视野下的细胞占比)超90%时,将细胞接种于12孔板,RPMI1640完全培养基培养细胞。12孔板细胞密度为70%~80%时,使用转染试剂Lipofectamine 3000转染过表达载体pCD2.5-circRIPK2和对照空载质粒pCD2.5-ciR,转染6 h后更换培养基,待贴壁生长细胞密度为90%~100%时,使用分化培养基(体积分数为2%的马血清+体积分数为97.5%的RPMI+体积分数为0.5%的青霉素、链霉素)诱导成肌细胞分化。
1.2.4 RNA提取及实时荧光定量PCR检测分别取100 mg不同胚龄和日龄的肌肉组织样品,加入1 mL RNAiso Plus试剂后研磨匀浆。同时收集增殖分化不同时期的成肌细胞,用RNAiso Plus试剂吹打细胞,RNAiso Plus处理后进行总RNA抽提,然后取0.5 μg总RNA,依据Monad反转录试剂盒说明书将其反转录为cDNA,反转录程序为37 ℃ 2 min,55 ℃ 15 min,85 ℃ 5 min。以反转录生成的cDNA为模板进行实时荧光定量PCR(Quantitative real-time PCR,RT-PCR),PCR反应体系:上、下游引物各0.3 μL、SYBR Green qPCR Mix 5 μL、cDNA 1 μL、双蒸水3.5 μL。PCR反应条件为:95 ℃ 5 min;95 ℃ 15 s,60 ℃ 30 s,40个循环;溶解曲线程序为95 ℃ 15 s,60 ℃ 1 min,95 ℃ 1 s。以GAPDH作为内参基因,检测circRIPK2基因、细胞增殖相关标记基因及肌分化标志基因的表达。
1.2.5 EdU试验、流式细胞术检测细胞增殖转染过表达载体circRIPK2和pCD2.5-ciR,每组设置6个重复,24 h后收集细胞,用流式细胞仪检测并分析细胞周期变化;转染48 h后参考锐博EdU试剂盒说明书对细胞进行孵育、固定、通透等处理,染色完成后加PBS缓冲液避光保存待用,在荧光显微镜下观察。
1.2.6 核质定位分析分离原代成肌细胞后用完全培养基培养,待细胞密度达100% 时,使用核质分离试剂盒回收细胞核和细胞质RNA,然后利用RT-PCR技术检测circRIPK2在细胞质、细胞核中的表达量。
1.2.7 统计学分析试验分组中每组包含3个重复,采用GraphPad Prism8软件绘图和数据统计分析,2组数据比较采用t检验分析。
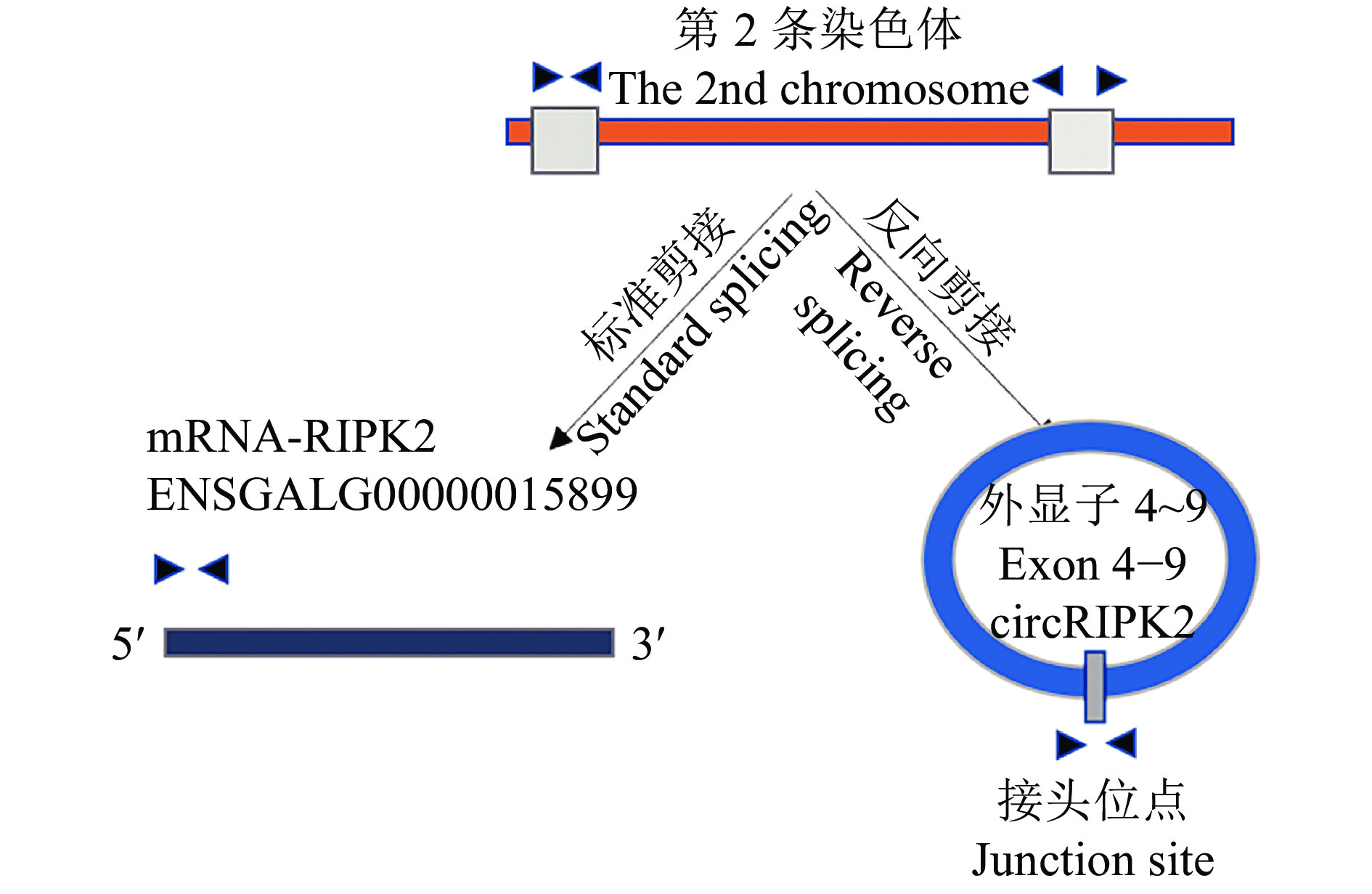
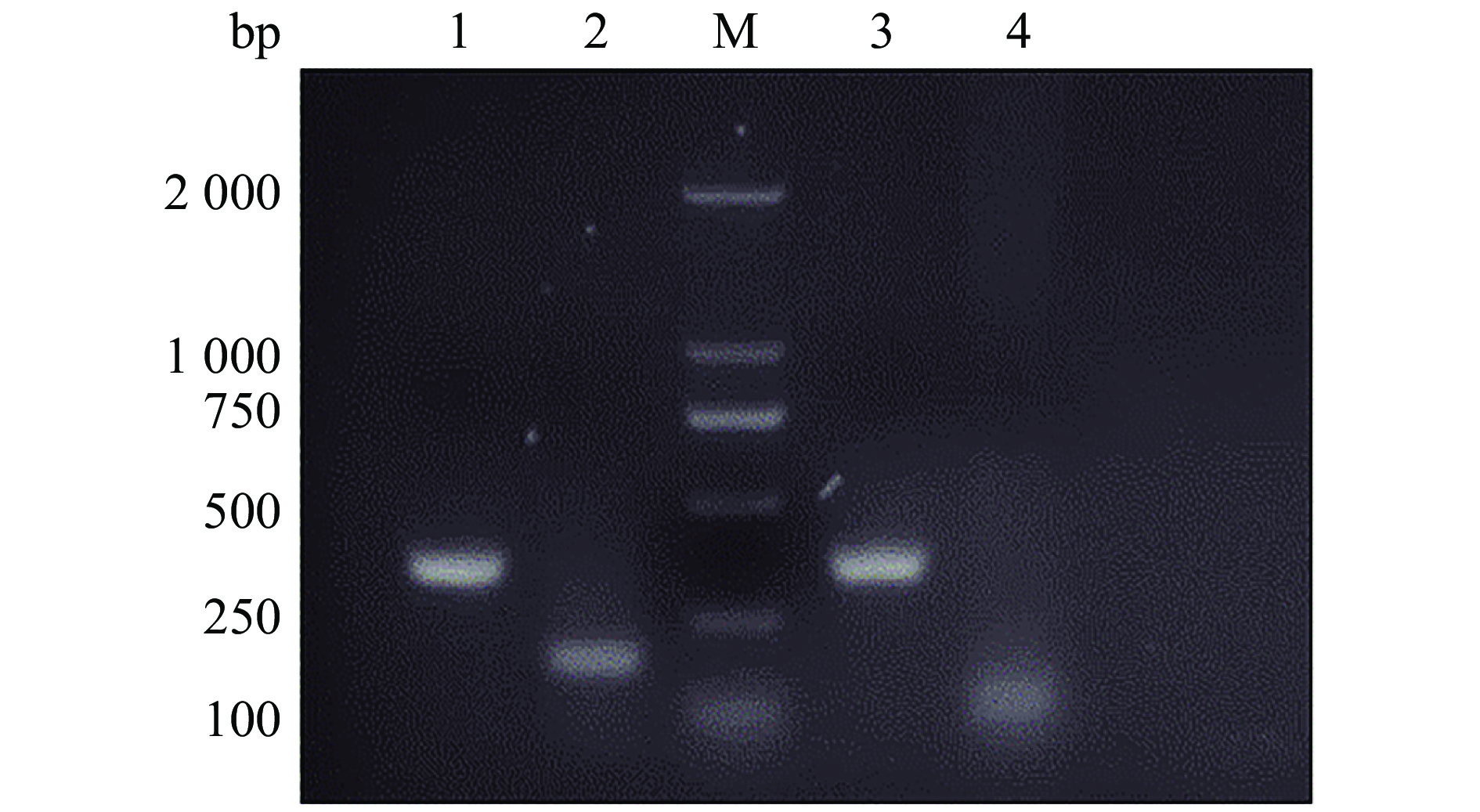
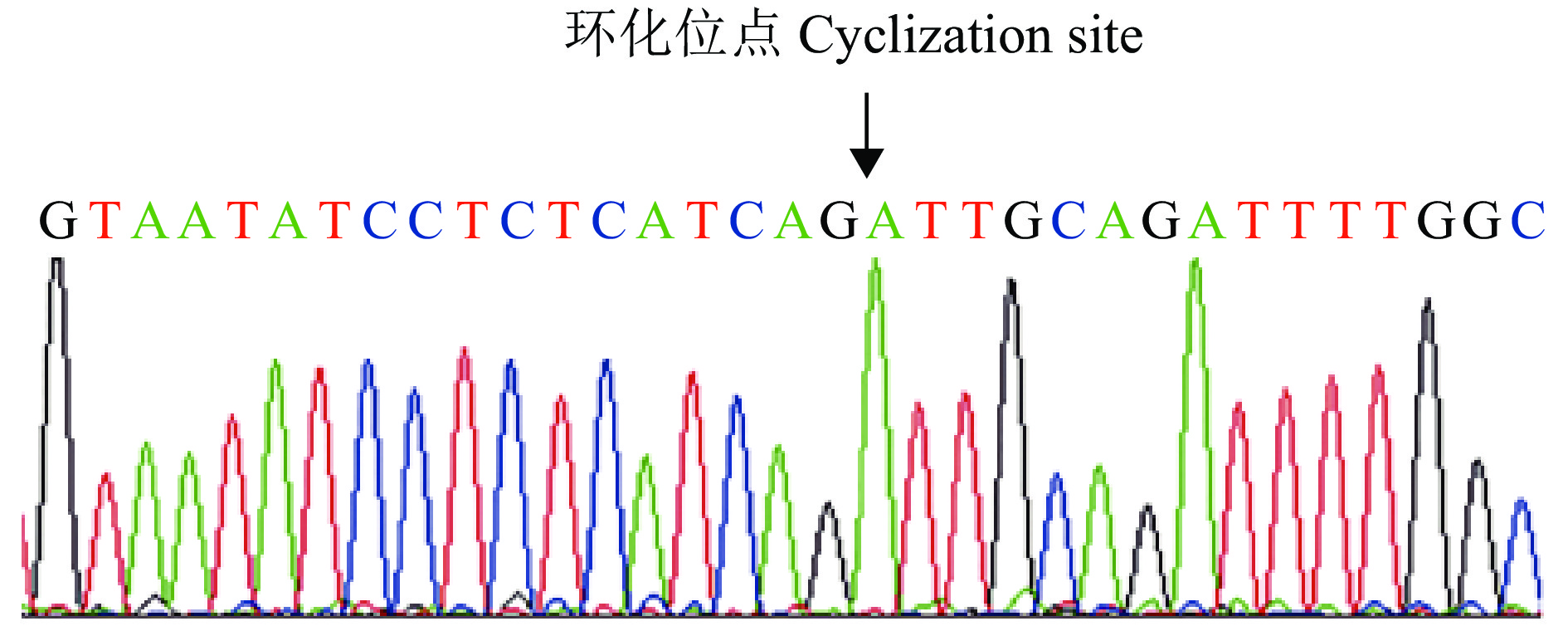
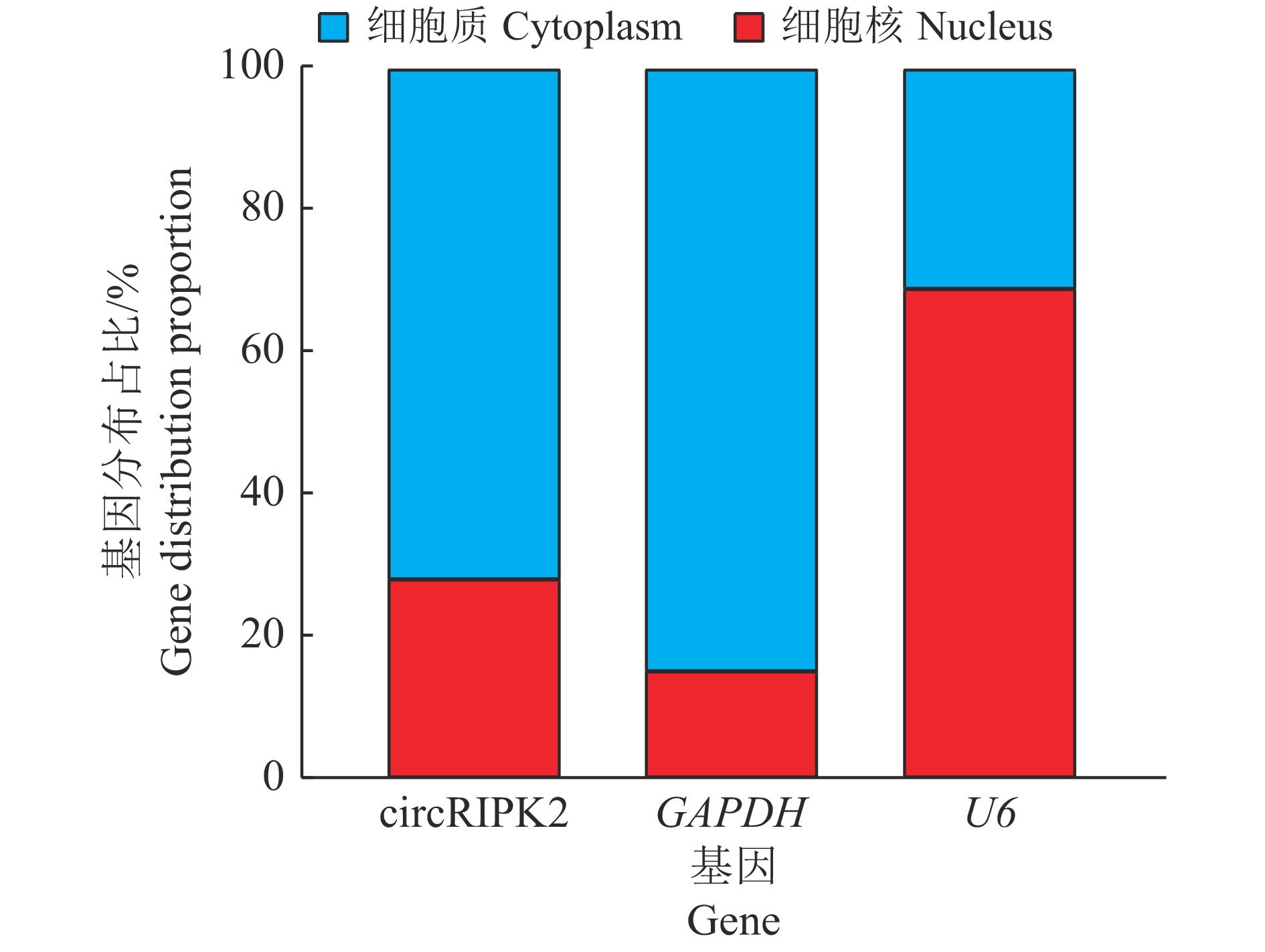
2 结果与分析 2.1 circRIPK2的鉴定及细胞定位用不同胚龄(11胚龄、16胚龄、1日龄)杏花鸡腿肌进行高通量测序,Ouyang等[11]鉴定发现了13 377个cricRNA,根据上述测序数据,本研究选取在3个时期差异表达的circRIPK2作为候选研究基因,描述了circRIPK2的成环来源示意图(图1)。针对RIPK2接头序列预测位点设计收敛引物、发散引物各1对(表1),利用反转录后的cDNA、gDNA为模板进行PCR扩增,结果显示只有以cDNA为模板时,发散引物才可以扩增出明亮的条带(图2)。同时Sanger测序结果显示circRIPK2的环化位点真实存在(图3)。使用核质分离试剂盒,分别回收细胞核和细胞质RNA,采用RT-PCR对circRIPK2进行细胞定位,结果(图4)表明circRIPK2在核质中均存在,其中细胞质占比为72%,细胞核占比为28%。
|
图 1 circRIPK2成环来源 Fig. 1 The biogenesis of circRIPK2 |
|
图 2 circRIPK2收敛引物和发散引物的PCR扩增 Fig. 2 PCR amplification of circHIPK2 by convergent primers and divergent primers 1和2使用cDNA模板,利用收敛引物和发散引物分别扩增;3和4使用gDNA模板, 利用收敛引物和发散引物分别扩增; M: DL2000 DNA marker 1 and 2 used cDNA template, and amplified by using convergent primers and divergent primers respectively; 3 and 4 used gDNA template, and amplified by using convergent primers and divergent primers respectively; M: DL2000 DNA marker |
|
图 3 circRIPK2发散引物扩增片段测序结果 Fig. 3 Sanger sequencing result of PCR product amplified by divergent primers for circRIPK2 |
|
图 4 circRIPK2在细胞核与细胞质中的分布 Fig. 4 Distribution of circRIPK2 in the nucleus and cytoplasm GAPDH、U6分别为细胞质与细胞核的标记基因 GAPDH and U6 are the marker genes of cytoplasm and nucleus respectively |
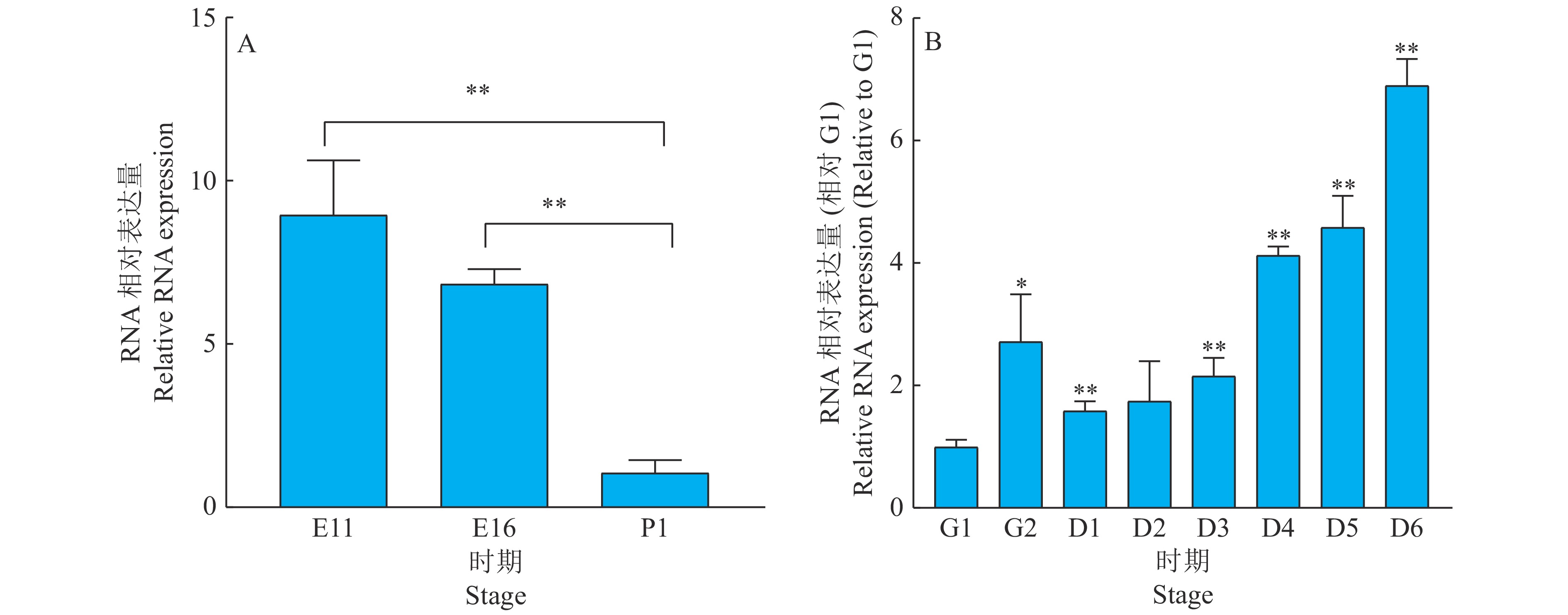
以11胚龄、16胚龄、1日龄小鸡腿肌的cDNA作模板,通过RT-PCR技术比较不同胚龄circRIPK2的表达水平变化,发现circRIPK2在不同时期表达存在差异(图5A)。同时,试验分析了circRIPK2在原代成肌细胞增殖分化不同时期的表达变化,发现与成肌细胞密度约为50%的增殖期相比,分化期第1天至第6天circRIPK2的表达均显著上调,在分化期第6天circRIPK2表达达到最高水平,这提示circRIPK2可能在细胞分化过程中起重要作用(图5B)。
|
图 5 circRIPK2的时空表达谱分析 Fig. 5 Analysis of the expression of circRIPK2 at different stages A图中,E11:11胚龄,E16:16胚龄,P1:1日龄;B图中,G1:成肌细胞密度约为50%的增殖期,G2:成肌细胞密度约为100%的增殖期,D1~D6:分化期第1天至第6天;“*”和“**”分别表示与P1(图A)或与G1(图B)差异达到0.05和0.01的显著水平(t检验) In graph A, E11:11 embryo age, E16:16 embryo age, P1: 1-day post-hatch;In graph B, G1: Myoblast proliferation stage and the cell density was about 50%, G2: Myoblast proliferation stage and the cell density was about 100%, D1−D6: The first day to sixth day of myoblast differentiation; “*”and“**”indicate significant difference from P1 (graph A) or G1 (graph B) at 0.05 and 0.01 levels respectively (t test) |
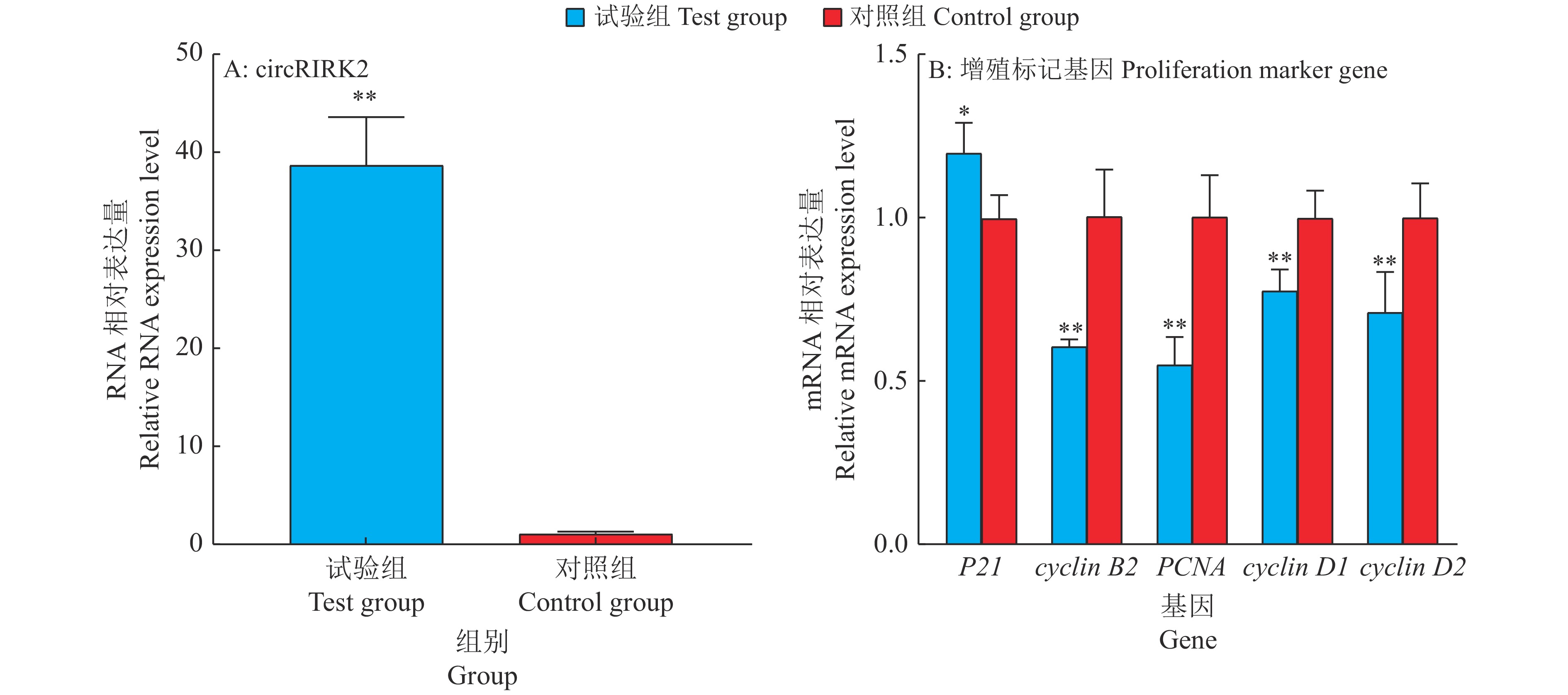
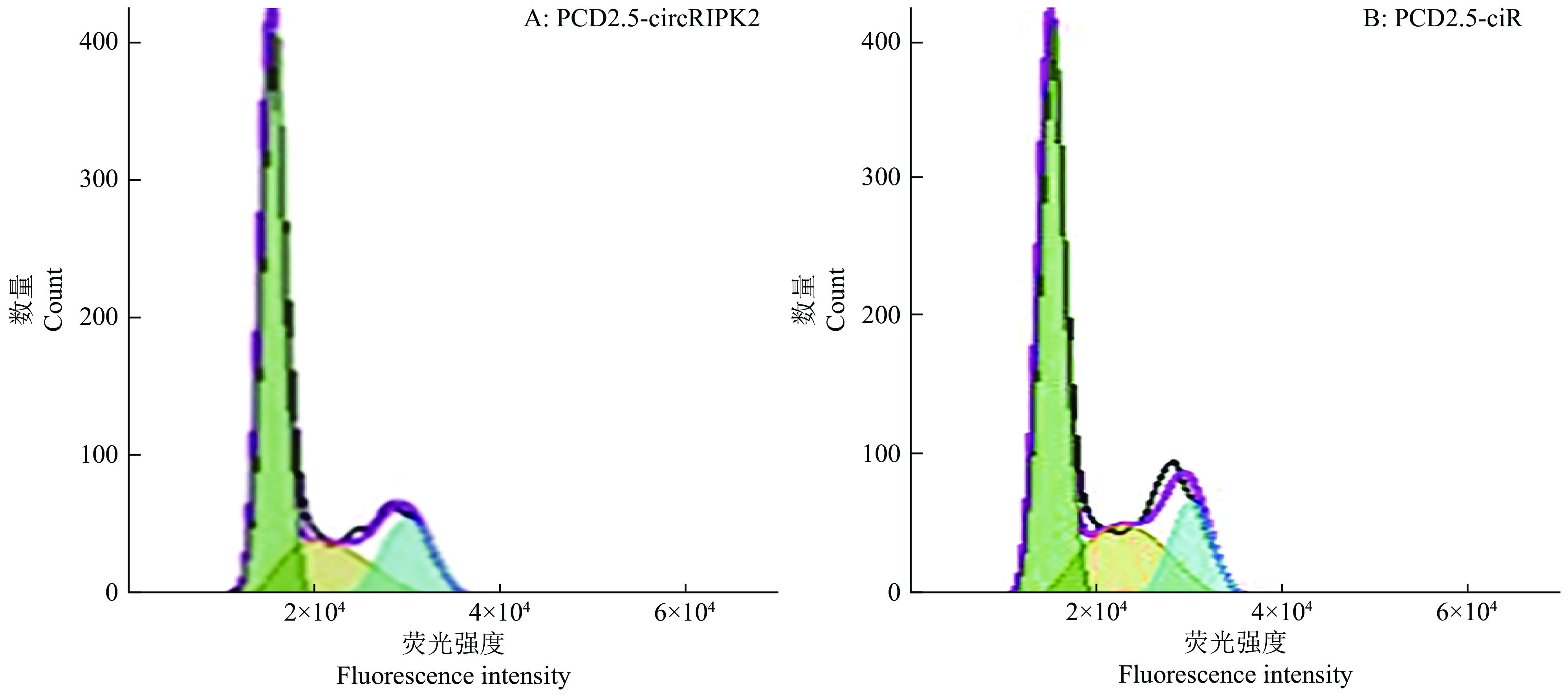
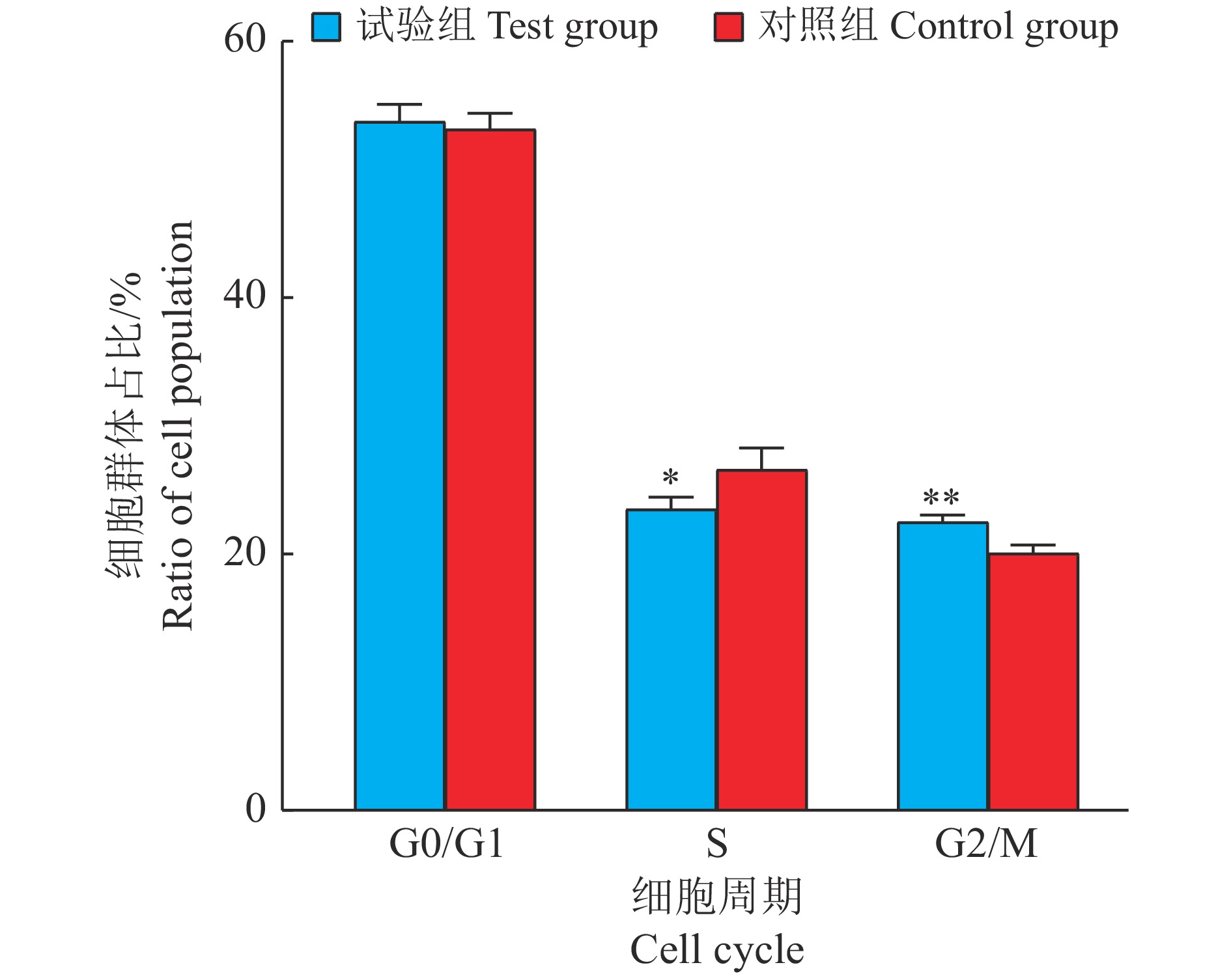
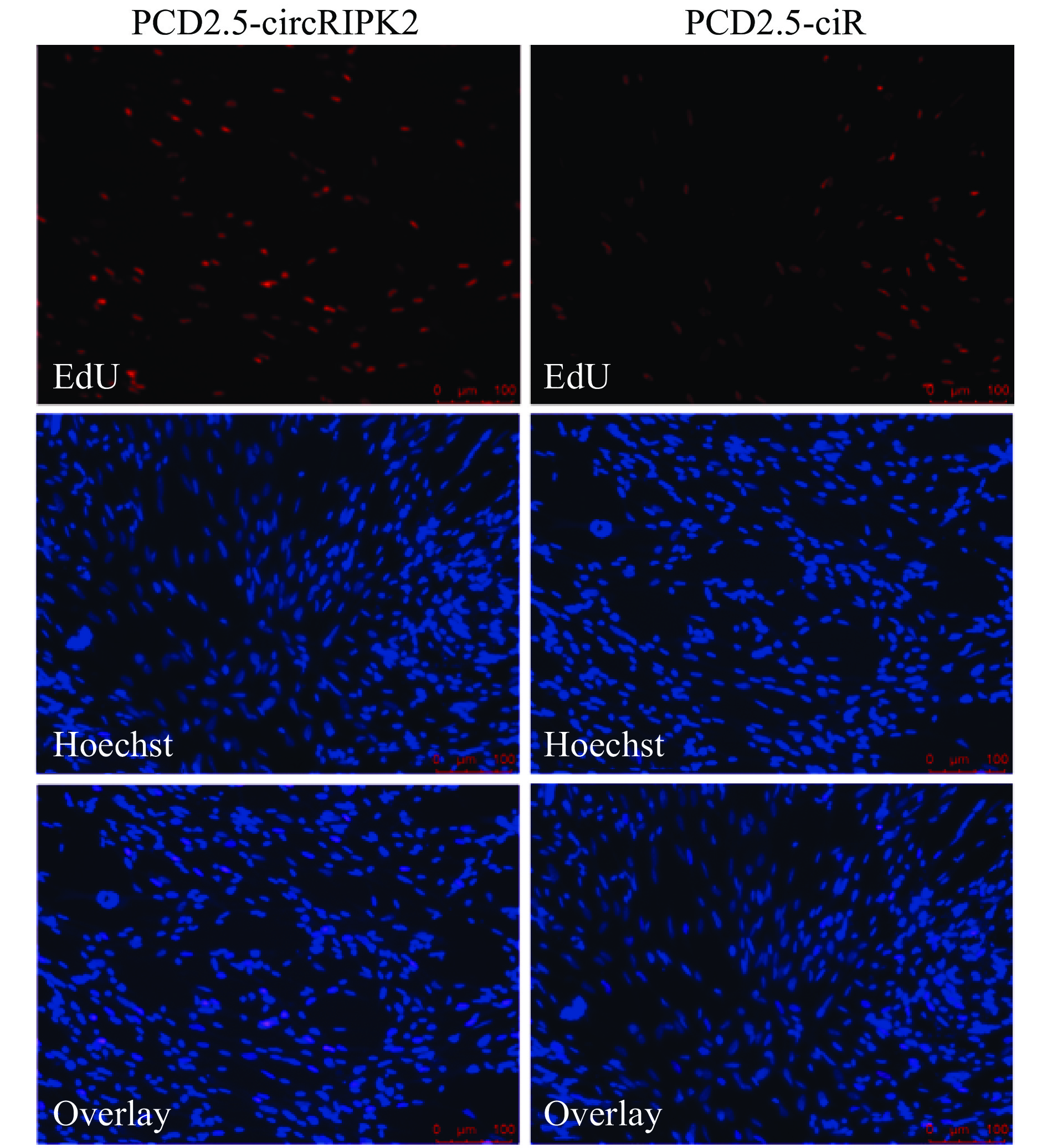
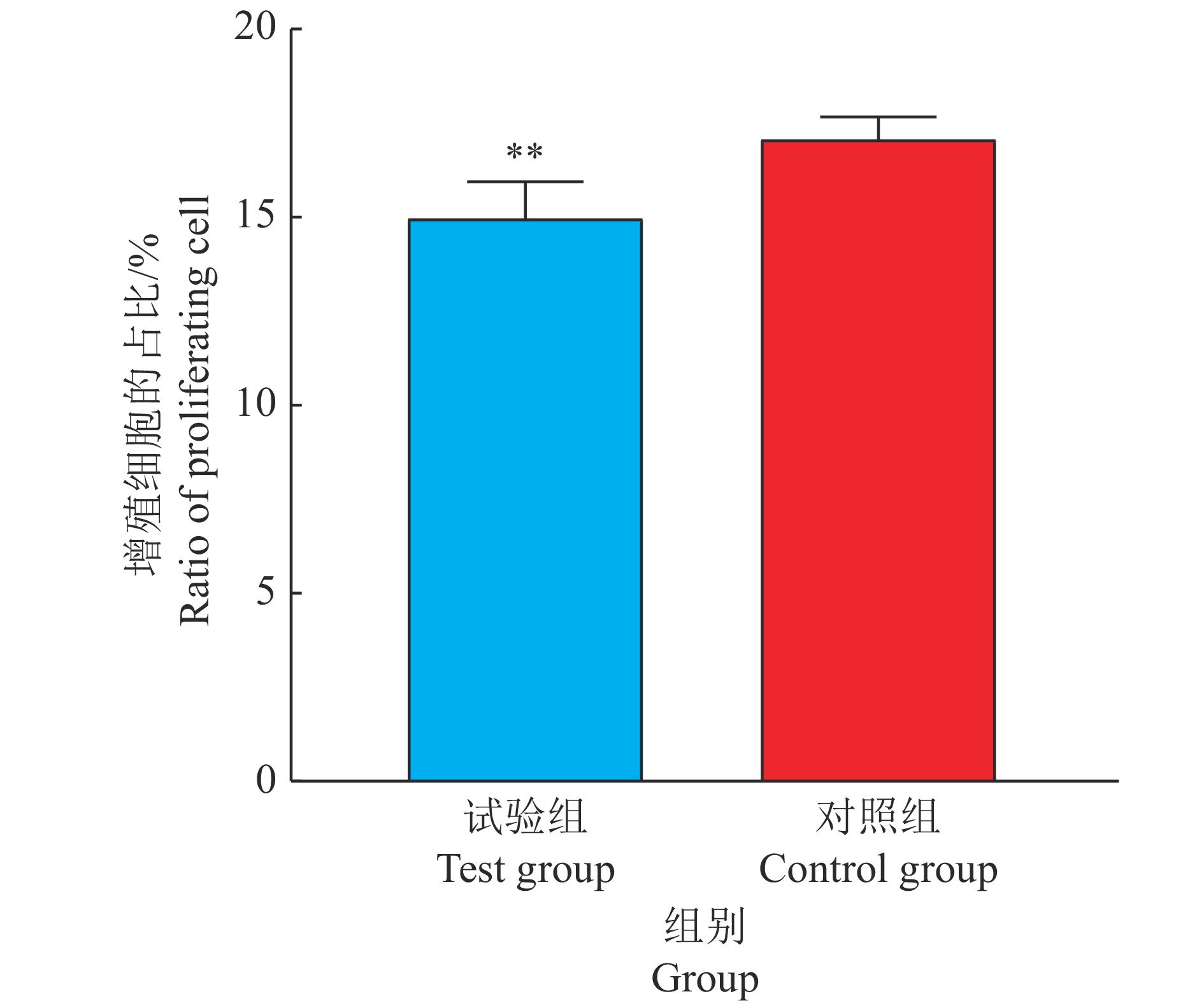
在原代成肌细胞中过表达circRIPK2,利用RT-PCR技术证实过表达效果显著(图6A),可进行下一步试验。转染48 h后,和对照组比较,过表达circRIPK2的原代成肌细胞中p21的mRNA表达水平上调20%,而Cyclin B2、Cyclin D1、Cyclin D2和PCNA的mRNA表达水平分别下调39%、22%、29%和45%(图6B)。此外,通过流式细胞术检测对细胞周期的影响(图7、图8),结果表明过表达circRIPK2后,处于S期细胞显著减少,处于G2/M期细胞显著增多(图8);采用EdU染色检测细胞增殖情况(图9、图10),对EdU渗入细胞数目进行统计、分析,结果发现过表达circRIPK2后,EdU渗入的细胞总数明显低于对照组,细胞增殖水平受到抑制(图10)。以上结果表明circRIPK2对成肌细胞的增殖过程具有显著抑制作用。
|
图 6 过表达circRIPK2后增殖相关标记基因表达量变化 Fig. 6 Expression change of proliferation marker gene after overexpression of circRIPK2 “*”和“**”分别表示与对照组差异达到0.05和0.01的显著水平(t检验) “*”and“**”indicate significant difference from control group at 0.05 and 0.01 levels respectively (t test) |
|
图 7 过表达circRIPK2对细胞周期的影响 Fig. 7 Effect of circRIPK2 overexpression on cell cycle progression of chicken primary myoblasts |
|
图 8 过表达circRIPK2后细胞周期的统计结果 Fig. 8 Statistical results of cell cycle after overexpression of circRIPK2 “*”和“**”分别表示与对照组差异达到0.05和0.01的显著水平(t检验) “*”and“**”indicate significant difference from control group at 0.05 and 0.01 levels respectively (t test) |
|
图 9 EdU试验检测过表达circRIPK2对鸡原代成肌细胞增殖能力的影响 Fig. 9 Effect of circRIPK2 overexpression on the proliferation rate of chicken primary myoblast detected by EdU assay |
|
图 10 过表达circRIPK2后EdU试验的统计结果 Fig. 10 Statistical results of EdU assays after overexpression of circRIPK2 “**”表示与对照组差异达到0.01的显著水平(t检验) “**” indicates significant difference from control group at 0.01 level (t test) |
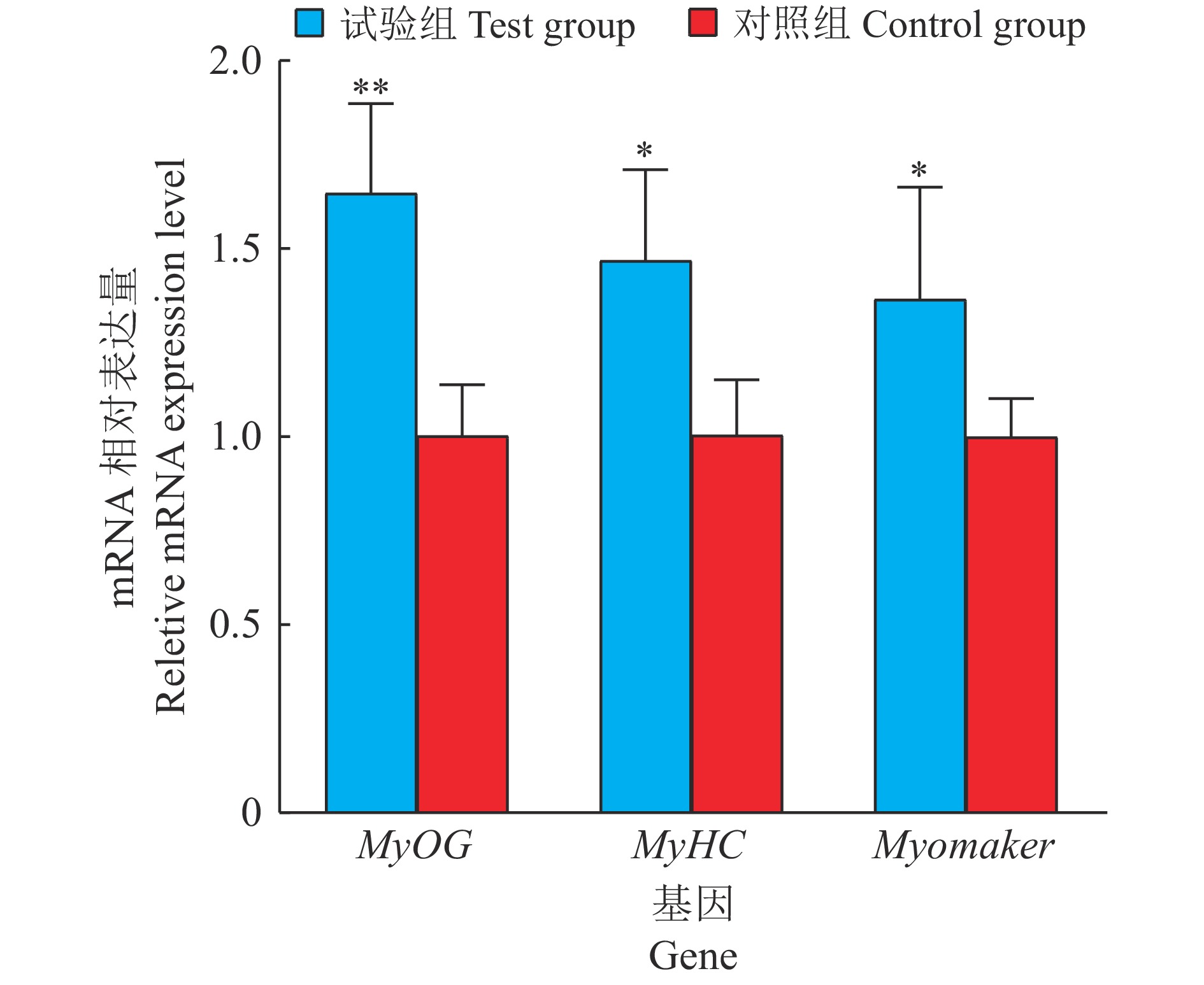
转染过表达载体pCD2.5-circRIPK2、pCD2.5-ciR至鸡原代成肌细胞中,待细胞密度为90%~100%时,将培养基更换为分化培养基以诱导成肌细胞分化。诱导分化第2天提取细胞总RNA并进行RT-PCR。试验结果显示过表达circRIPK2后肌分化标记基因MyHC、MYOG和Myomaker的mRNA表达水平显著上调39%、56%和25%(图11)。
|
图 11 过表达circRIPK2后肌分化标记基因表达量变化 Fig. 11 Expression changes of the myoblast differentiation marker genes after overexpression of circRIPK2 “*”和“**”分别表示与对照组差异达到0.05和0.01的显著水平(t检验) “*”and“**”indicate significant difference from control group at 0.05 and 0.01 levels respectively (t test) |
作为非编码RNA家族的重要成员,circRNA广泛参与基因表达调控和疾病发生过程[16-17]。有证据表明circRNA不但在动物骨骼肌中例如牛骨骼肌、家禽骨骼肌、小鼠骨骼肌、猪骨骼肌等大量存在,而且具有较高的表达水平[11, 18-21]。这表明除了生肌调控因子、成肌增强因子、PAX家族等调控骨骼肌发育过程之外,circRNA在调控肌肉发育过程中也扮演重要角色[22-24]。多项研究发现,骨骼肌中的circRNA可通过作为miRNA海绵来调控骨骼肌的生长发育[25]。根据前期测序,本研究筛选出在3个时期差异表达的候选环状RNA-circRIPK2,并且通过PCR和Sanger测序等技术验证circRIK2由RIPK2基因第4至第9外显子反向剪切形成。RT-PCR发现circRIPK2在3个时期中差异表达,这提示circRIPK2可能在鸡骨骼肌发育过程具有一定的调控作用。
有关circRNA对于成肌细胞的增殖已有多篇文献报道。在家禽骨骼肌中,RBFOX2基因的不同外显子能够环化形成circRBFOX2.2-3、circRBFOX2.2-4,两者均可以吸附miR-1a、miR-206来调控鸡成肌细胞增殖过程[11]。另外,在牛骨骼肌中发现,circLMO7可以充当miR-378a-3p海绵,通过作为竞争性内源RNA来促进成肌增殖[10]。在对circRIPK2研究中,我们发现过表达circRIPK2后,和对照组比较,对细胞增殖有促进作用的相关基因(Cyclin B2、Cyclin D1、Cyclin D2和PCNA)的mRNA表达水平显著降低,然而对细胞增殖有抑制作用的标记基因(p21)mRNA水平显著上调。同时通过流式细胞术、EdU试验检测其对细胞周期的影响,结果也表明circRIPK2抑制成肌细胞的增殖。
circRNA除了调控肌肉细胞增殖,它对于肌肉细胞的分化也具有重要的作用。Li等[12]研究发现,circFGFR4在牛肌肉中高表达,它可以通过作为miR-107的分子海绵调控WNT3A的表达,从而间接促进成肌细胞的分化。在小鼠中circZfp609可以吸附miR-125b解除对下游靶基因BCLAF1的抑制作用,并且通过影响Myf5和MYOG的表达间接抑制成肌细胞的分化[26]。此外,在羊骨骼肌中,circFOXO3对成肌细胞的分化过程也具有抑制作用[27]。本试验表明过表达circRIPK2后,肌分化标记基因MyHC、MYOG和Myomaker的mRNA表达水平上调,这证明过表达circRIPK2对成肌细胞的分化具有显著抑制作用。
以上结果表明circRIPK2在骨骼肌生长发育过程中具有调控作用,然而circRIPK2参与骨骼肌调控的具体机制尚未阐释,有待后续进一步探究。
研究表明circRIPK2在细胞核、细胞质中均有表达,其中在细胞质中的占比高于在细胞核中的占比,同时通过在鸡原代成肌细胞过表达circRIPK2检测相关标记基因表达,证实circRIPK2可能通过抑制成肌细胞的增殖,正向调控成肌细胞分化进程,从而参与骨骼肌调控过程。
| [1] |
LANDER E S, LINTON L M, BIRREN B, et al. Initial sequencing and analysis of the human genome[J]. Nature, 2011, 409(6822): 860-921. (  0) 0) |
| [2] |
WU Q, WANG Y, CAO M, et al. Homology-independent discovery of replicating pathogenic circular RNAs by deep sequencing and a new computational algorithm[J]. Proceedings of the National Academy of Sciences of the United States, 2012, 109(10): 3938-3943. DOI:10.1073/pnas.1117815109 (  0) 0) |
| [3] |
YANG D, YANG K, YANG M, et al. Circular RNA in aging and age-related diseases[J]. Advances in Experimental Medicine and Biology, 2018, 1086: 17-35. (  0) 0) |
| [4] |
CHEN L, YANG L. Regulation of circRNA biogenesis[J]. RNA Biology, 2015, 12(4): 381-388. DOI:10.1080/15476286.2015.1020271 (  0) 0) |
| [5] |
MEMCZAK S, JENS M, ELEFSINIOTI A, et al. Circular RNAs are a large class of animal RNAs with regulatory potency[J]. Nature, 2013, 495(7441): 333-338. DOI:10.1038/nature11928 (  0) 0) |
| [6] |
LI Z, HUANG C, BAO C, et al. Exon-intron circular RNAs regulate transcription in the nucleus[J]. Nature Structural & Molecular Biology, 2015, 22(3): 256-264. (  0) 0) |
| [7] |
HUANG A, ZHENG H, WU Z, et al. Circular RNA-protein interactions: Functions, mechanisms, and identification[J]. Theranostics, 2020, 10(8): 3503-3517. DOI:10.7150/thno.42174 (  0) 0) |
| [8] |
LEGNINI I, DI TIMOTEO G, ROSSI F, et al. Circ-ZNF609 is a circular RNA that can be translated and functions in myogenesis[J]. Molecular Cell, 2017, 66(1): 22-37. DOI:10.1016/j.molcel.2017.02.017 (  0) 0) |
| [9] |
LI H, YANG J, WEI X, et al. CircFUT10 reduces proliferation and facilitates differentiation of myoblasts by sponging miR-133a[J]. Journal of Cellular Physiology, 2018, 233: 4643-4651. DOI:10.1002/jcp.26230 (  0) 0) |
| [10] |
WEI X, LI H, YANG J, et al. Circular RNA profiling reveals an abundant circLMO7 that regulates myoblasts differentiation and survival by sponging miR-378a-3p[J]. Cell Death & Disease, 2017, 8(10): e3153. (  0) 0) |
| [11] |
OUYANG H, CHEN X, WANG Z, et al. Circular RNAs are abundant and dynamically expressed during embryonic muscle development in chickens[J]. DNA Research, 2018, 25(1): 71-86. DOI:10.1093/dnares/dsx039 (  0) 0) |
| [12] |
LI H, WEI X, YANG J, et al. circFGFR4 promotes differentiation of myoblasts via binding miR-107 to relieve its inhibition of Wnt3a[J]. Molecular Therapy Nucleic Acids, 2018, 11: 272-283. DOI:10.1016/j.omtn.2018.02.012 (  0) 0) |
| [13] |
GONG Q, LONG Z, ZHONG F, et al. Structural basis of RIP2 activation and signaling[J]. Nature Communications, 2018, 9(1): 4993. DOI:10.1038/s41467-018-07447-9 (  0) 0) |
| [14] |
MAGALHAES J G, LEE J, GEDDES K, et al. Essential role of RIP2 in the modulation of innate and adaptive immunity triggered by Nodl and Nod2 ligands[J]. European Journal of Immunology, 2011, 41(5): 1445-1455. DOI:10.1002/eji.201040827 (  0) 0) |
| [15] |
MINCHENKO D O, DAVYDOV V V, BUDREIKO O A, et al. The expression of CCN2, IQSEC, RSPO1, DNAJC15, RIPK2, IL13RA2, IRS1, and IRS2 genes in blood of obese boys with insulin resistance
[J]. Fiziolohichnyi Zhurnal, 2015, 61(1): 10-18. DOI:10.15407/fz61.01.010 (  0) 0) |
| [16] |
ZHOU W, CAI Z, LIU J, et al. Circular RNA: Metabolism, functions and interactions with proteins[J]. Molecular Cancer, 2020, 19(1): 172. DOI:10.1186/s12943-020-01286-3 (  0) 0) |
| [17] |
高永超, 王爽, 王静, 等. 环状RNA在神经系统疾病中的研究进展[J]. 中国医药导报, 2020, 17(29): 45-47. (  0) 0) |
| [18] |
宋成创, 岳炳霖, 杨兆鑫, 等. 非编码RNA在牛骨骼肌发育中的研究进展[J]. 中国牛业科学, 2018, 44(6): 75-77. DOI:10.3969/j.issn.1001-9111.2018.06.023 (  0) 0) |
| [19] |
钮广林. 小鼠骨骼肌发育相关环状RNA的鉴定和功能研究[D]. 北京: 中国农业科学院, 2017.
(  0) 0) |
| [20] |
曹海港. 猪骨骼肌纤维类型关键circRNAs的筛选及circMYLK4的功能研究[D]. 杨凌: 西北农林科技大学, 2019.
(  0) 0) |
| [21] |
MARTONE J, MARIANI D, DESIDERI F, et al. Noncoding RNAs shaping muscle[J]. Frontiers in Cell and Developmental Biology, 2019, 7: 394. (  0) 0) |
| [22] |
ZANOU N, GAILLY P. Skeletal muscle hypertrophy and regeneration: Interplay between the myogenic regulatory factors (MRFs) and insulin-like growth factors (IGFs) pathways[J]. Cellular and Molecular Life Sciences, 2013, 70(21): 4117-4130. DOI:10.1007/s00018-013-1330-4 (  0) 0) |
| [23] |
WANG D Z, VALDEZ M R, MCANALLY J, et al. The Mef2c gene is a direct transcriptional target of myogenic bHLH and MEF2 proteins during skeletal muscle development[J]. Development, 2001, 128(22): 4623-4633. DOI:10.1242/dev.128.22.4623 (  0) 0) |
| [24] |
BUCKINGHAM M, RELAIX F. The role of Pax genes in the development of tissues and organs: Pax3 and Pax7 regulate muscle progenitor cell functions[J]. Annual Review of Cell and Developmental Biology, 2007, 23(1): 645-673. DOI:10.1146/annurev.cellbio.23.090506.123438 (  0) 0) |
| [25] |
YUE B, WANG J, SONG C, et al. Biogenesis and ceRNA role of circular RNAs in skeletal muscle myogenesis[J]. The International Journal of Biochemistry & Cell Biology, 2019, 117: 105621. (  0) 0) |
| [26] |
WANG Y, LI M, WANG Y, et al. A Zfp609 circular RNA regulates myoblast differentiation by sponging miR-194-5p[J]. International Journal of Biological Macromolecules, 2019, 121: 1308-1313. DOI:10.1016/j.ijbiomac.2018.09.039 (  0) 0) |
| [27] |
LI X, LI C, LIU Z, et al. Circular RNA circ-FoxO3 Inhibits myoblast cells differentiation[J]. Cells, 2019, 8(6): 616. DOI:10.3390/cells8060616 (  0) 0) |
 2021, Vol. 42
2021, Vol. 42


