荔枝、龙眼是我国南方优势名贵水果,主要分布于广东、广西、福建、海南、四川及云南等省区,被誉为“南国四大果品”之首。2019年全国荔枝、龙眼栽培面积分别高达54.1万和27.6万hm2,在农业经济中占有重要地位[1]。荔枝蒂蛀虫Conopomorphasinensis Bradley (Lepidoptera: Gracillariidae)是荔枝、龙眼栽培中频发的暴发性鳞翅目害虫,也是荔枝、龙眼果树害虫防控中的难点。首先,荔枝蒂蛀虫的初孵幼虫咬破卵壳后,钻入果实、花穗、嫩梢或叶肉等组织内为害,整个幼虫期都潜伏于寄主植物组织内部,无法防治;其次,该虫在果园世代重叠,蛹期参差不齐,成虫期长且高峰期不明显,唯有反复大量施用化学药剂才能保证成虫防控效果[2-3]。近年来,由杀卵剂介导的害虫卵期防控成为了荔枝蒂蛀虫防控的有效突破口。
昆虫依靠发达灵敏的感觉系统识别外界环境中的各种信息,进而完成取食、交配、生殖、躲避天敌、产卵等行为反应。气味结合蛋白(Odorant binding proteins, OBPs)和化学感受蛋白(Chemosensory proteins, CSPs)在昆虫感知外界化学信息过程中发挥着重要作用,其大量存在于化学感受器的淋巴液中,是昆虫化学信息感知的2类关键载体蛋白[4-5]。其中,CSPs是一类可溶性的小分子球状蛋白,典型特征是含有4个保守的半胱氨酸,能两两配对形成2个二硫键,用以保持CSPs蛋白结构的稳定性。CSPs在昆虫体内的许多部位都有表达,例如触角、性腺、翅膀、足、精卵巢等[6-7]。CSPs以广泛的分布及高度保守性被认为在昆虫对化学刺激的行为反应及多种生理生化过程中扮演着重要的角色。
有关昆虫CSPs研究绝大多数集中于成虫期。国家荔枝龙眼产业体系—虫害防控岗位科学家研究团队前期在荔枝蒂蛀虫卵转录组数据中鉴定了5个CSPs基因,为深入解析其结合特征及功能,本研究对荔枝蒂蛀虫卵5个CsinCSPs基因进行克隆,对其序列特征进行生物信息学分析,通过分子对接模拟预测荔枝、龙眼果园常用的几种杀虫剂与5个CsinCSPs的结合特征,利用qRT-PCR技术测定了5个CsinCSPs基因在除虫脲处理后的表达变化,以期为阐明荔枝蒂蛀虫卵期CSPs功能研究提供线索。
1 材料与方法 1.1 供试昆虫荔枝蒂蛀虫成虫采集自广东省农业科学院白云基地荔枝园,在温度(25±1)℃,湿度为(75±1)%、光周期为14 h光∶10 h暗的养虫室中,以φ为10%的蜂蜜水作为营养补充饲养,每天定时收集并更换产有荔枝蒂蛀虫卵的白色卫生卷纸,于养虫室内存放备用,方法参照文献[8]。
1.2 总RNA的提取与反转录收集孵化1、2和3 d荔枝蒂蛀虫卵各200粒,分别用液氮研磨后,利用Trizol试剂提取总RNA,通过20 g/L琼脂糖凝胶电泳检测总RNA的完整性。采用PrimeScript RT Reagent试剂盒(Takara, Tokyo, Japan)以提取的总RNA为模板反转录得到cDNA第1链,−20 ℃保存备用。
1.3 序列克隆与分析以荔枝蒂蛀虫卵转录组(数据待发表)测序结果为基础,从成功注释的unigene中搜索CSPs基因序列,将其对应的蛋白序列与NCBI中的nr数据库进行BLASTP,验证是否属于化学感受蛋白。使用Primer Premier 3.0软件根据目的基因片段设计用于5个CsinCSPs基因全长序列扩增和表达分析的引物(表1)。分别以2对特异性嵌套引物进行5′和3′RACE扩增。5′RACE反应程序为:94 ℃ 3 min;94 ℃ 30 s,65 ℃ 30 s,72 ℃ 1 min,33个循环;72 ℃ 10 min;4 ℃保存。3′RACE反应程序为:94 ℃ 3 min;94 ℃ 30 s,58 ℃ 30 s,72 ℃ 1 min,33个循环;72 ℃ 10 min;4 ℃保存。最后用DNAstar软件将所得序列片段拼接为完整的序列。
|
|
表 1 CsinCSPs克隆及实时荧光定量PCR所需引物 Table 1 Primers for CsinCSPs cloning and qRT-PCR |
蛋白相对分子质量及等电点预测使用ExPASy平台中的Compute pI/Mw (
使用Phyre2软件构建蛋白三维结构(
前期以孵化后1 d的荔枝蒂蛀虫卵开展除虫脲毒力测定,其毒力方程为y=−0.49+1.32x,LC50 为2.37 mg/L[9]。处理组:将荔枝蒂蛀虫卵纸置于2.37 mg/L除虫脲(以丙酮为介质稀释)中浸泡处理10 s;对照组:将荔枝蒂蛀虫卵纸置于丙酮中浸泡处理10 s。然后分别于处理后6、24和48 h随机收集处理组和对照组虫卵各200粒,液氮处理后−80 ℃保存备用。样品总RNA的提取与反转录方法同“1.2”。
1.6 实时荧光定量PCR根据5个CsinCSPs基因序列,用Primer Premier 3.0软件设计qRT-PCR 特异性引物。利用GoTaq qPCR Master Mix试剂盒(Promega,麦迪逊,美国)进行qRT-PCR。反应体系包括:10 μL GoTaq qPCR Master Mix,1 μL cDNA模板,0.5 μL正向引物,0.5 μL反向引物,8 μL DEPC水。反应程序:95 ℃预变性2 min;95 ℃变性15 s;60 ℃退火60 s;40个循环。以β-actin (GenBank accession No. KF598848)基因为内参基因计算相对表达量,数据分析使用比较Ct值方法分析(Schmittgen and Livak, 2008)。每次qRT-PCR需要3次技术重复,并且每个样本进行3次生物学重复。
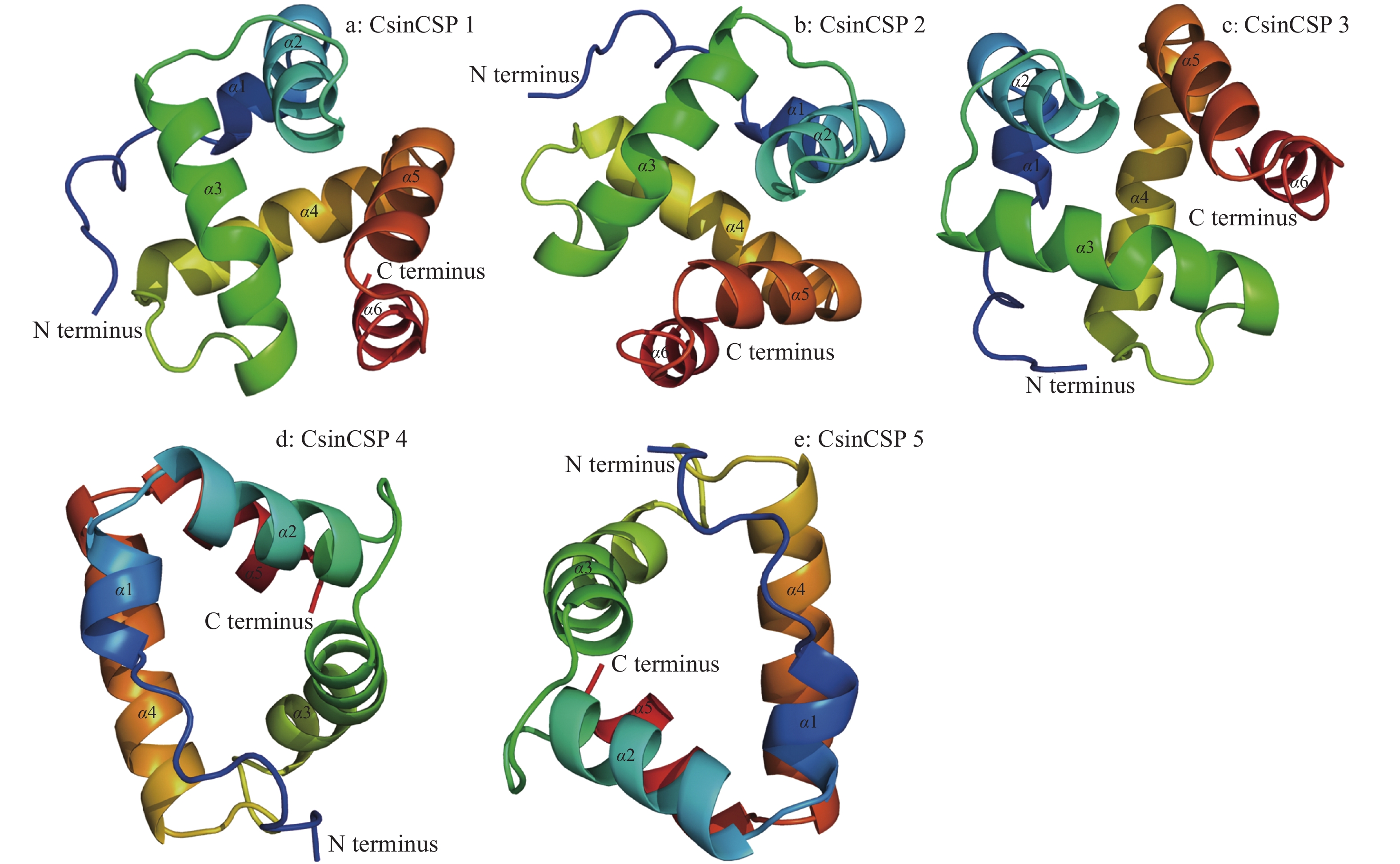
2 结果与分析 2.1 荔枝蒂蛀虫卵5个CsinCSPs基因的克隆与序列分析以荔枝蒂蛀虫卵cDNA为模板进行PCR扩增,得到CsinCSP1~5的基因开放阅读框(Open reading frame, ORF)长度分别为438、378、360、336和318 bp,分别编码145、125、119、111和105个氨基酸(表2)。CsinCSP1~5蛋白相对分子质量分别为16 400、14 100、13 200、12 600和11 900,其中,CsinCSP3等电点为5.04,偏酸性,其余4个CsinCSPs等电点均大于9,偏碱性。CsinCSP1~5的N端分别包含由起始位置开始的16~22个信号肽序列,无跨膜结构。蛋白二级结构预测表明,5个CsinCSPs的保守半胱氨酸位点排布模式均为C1-X6-C2-X18-C3-X2-C4。α−螺旋是所有CsinCSPs的主要二级结构,其中CsinCSP1、CsinCSP2和CsinCSP3均含有6个α−螺旋,而CsinCSP4和CsinCSP5仅含有5个α−螺旋(图1)。亚细胞定位分析表明CsinCSP1~5均为非膜蛋白。
|
|
表 2 荔枝蒂蛀虫卵的CsinCSPs蛋白信息 Table 2 Information of CsinCSPs in Conopomorpha sinensis eggs |

|
图 1 荔枝蒂蛀虫卵5个CsinCSPs的二级结构分析 Fig. 1 Secondary structure analysis of five CsinCSPs from Conopomorpha sinensis eggs |
通过与其他昆虫CSPs氨基酸序列进行比对,结果(图2)显示,与CsinCSP1~5相似性最高的同类蛋白分别为蚜科棉蚜Aphis gossypii CSP1、螟蛾科稻纵卷叶螟Cnaphalocrocis medinalis CSP1、螟蛾科二化螟Chilo suppressalis CSP2、凤蝶科柑橘凤蝶Papilio xuthus CSP2和枯叶蛾科云南松毛虫Dendrolimus houi CSP2。使用MEGA 4.1软件邻接法进行1000次重复计算后构建进化树(图2)。由图2可以看出,所有选中的昆虫CSPs形成2个明显的分支,CsinCSP1~3属于6个α−螺旋的类群,而CsinCSP4和CsinCSP5属于5个α−螺旋的类群。借助WebLogo软件对所有选中昆虫的保守区域进行motif可视化分析,结果表明4个半胱氨酸位点非常保守,其次第2个和第3个半胱氨酸位点中间的甘氨酸、脯氨酸和亮氨酸也有较高保守性(图3)。

|
图 2 CsinCSP1~5与其他昆虫CSPs的系统进化树分析 Fig. 2 Phylogenetic analysis of CsinCSP1−5 and CSPs in other insects |

|
图 3 CsinCSP1~5与其他昆虫CSPs的WebLogo比对分析 Fig. 3 The WebLogo alignment of CsinCSP1-5 and CSPs in other insects “*”表示4个高度保守的半胱氨酸残基 “*” indicates four highly conservative cysteine residues |
荔枝蒂蛀虫卵CsinCSP1~5蛋白的三维结构预测分析中,软件数据库比对建模筛选出的CsinCSP1~5结构模板为甘蓝夜蛾Mamestra brassicae CSP2的三维结构(PDB: d1n8va)。与其他昆虫的CSP一样,其编码蛋白主要由α−螺旋(α-helix)、β−折叠(β-strand)和卷曲环(loop)组成,这些结构形成一个与配体结合的空腔,空腔内部的氨基酸大部分为疏水性氨基酸,使得其内部可容纳疏水性的配体分子(图4)。
|
图 4 CsinCSP1~5的3D结构预测模型 Fig. 4 The 3D structure prediction of CsinCSP1−5 |
从NCBI的Pubchem Compound数据库得到荔枝、龙眼果园最常用的8种化学药剂的三维结构,然后利用AutoDock软件执行自动计算对接,以获得荔枝蒂蛀虫卵CsinCSPs与化学药剂分子的结合能。分子对接数据表明,5个CsinCSPs与所有配体对接相互作用能量值均为负值。其中,配体分子高效氯氟氰菊酯、高效氯氰菊酯与5个CsinCSPs结合能均为最小,结合亲和力最强;5个CsinCSPs与除虫脲、吡虫啉相互作用结合能均高于其他药剂的,表明CsinCSPs与除虫脲和吡虫啉的结合力最弱(表3)。
|
|
表 3 农药与荔枝蒂蛀虫卵CsinCSPs对接的结合能 Table 3 The binding capacities of insecticides and CsinCSPs of Conopomorpha sinensis eggs |
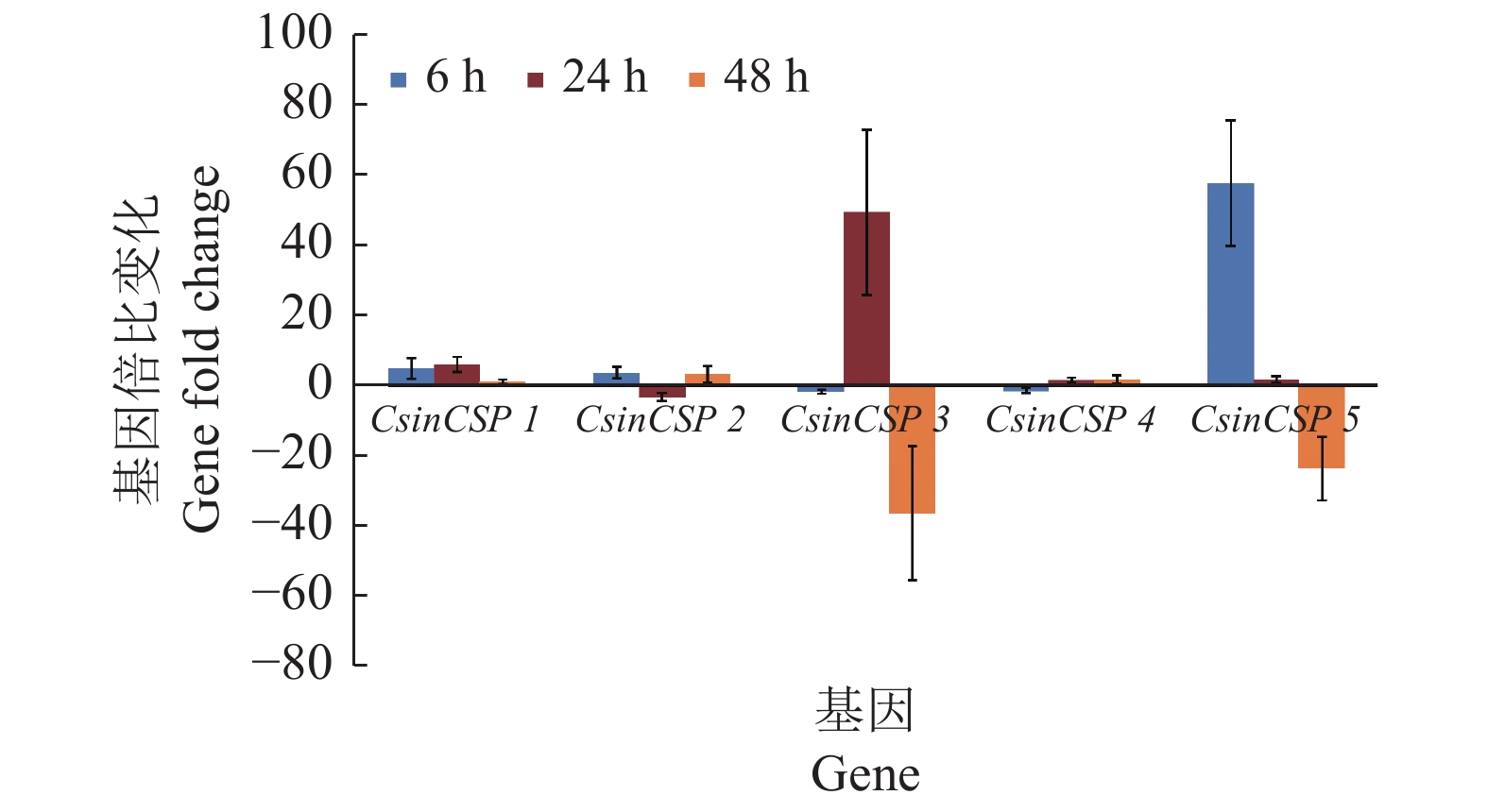
以亚致死剂量除虫脲处理荔枝蒂蛀虫1日龄卵,利用qRT-PCR检测虫卵5个CsinCSPs基因在处理后3个时间点的表达量,结果(图5)表明:与空白对照组相比,除虫脲处理后6、24、48 h,CsinCSP1、CsinCSP2和CsinCSP4的相对表达量变化不大。但是CsinCSP3在处理后24 h表达显著上升49.4倍,CsinCSP5在处理后6 h表达上升57.8倍,随后二者在处理后48 h表达则分别下降36.2和23.4倍,说明除虫脲能影响荔枝蒂蛀虫卵CsinCSP3和CsinCSP5的表达,但对其他3个CsinCSPs的表达无明显影响(图5)。
|
图 5 亚致死剂量的除虫脲对荔枝蒂蛀虫卵5个CsinCSPs基因表达量的影响 Fig. 5 Effects of diflubenzuron on expression of five CsinCSPs genes in Conopomorpha sinensis eggs at sublethal dose |
化学感受蛋白在昆虫感知外界信号分子的生化反应过程中具有重要生理学意义。本研究利用转录组测序和RACE-PCR的方法,从荔枝蒂蛀虫卵中克隆出5个CsinCSPs基因的全长序列,为首次从鳞翅目害虫卵中克隆同类蛋白序列。其中ORF最短和最长的CsinCSP分别为CsinCSP5和CsinCSP1,分别为318和438 bp,分别编码105和145个氨基酸,预测蛋白相对分子质量分别为11 900和16 400。普遍认为昆虫CSPs是一类相对分子质量约为10 000~12 000的酸性可溶性蛋白,编码100~115个氨基酸分子[10-11]。昆虫CSPs在进化上十分保守,在N端有高度保守区域,其序列多样性表现在蛋白序列的C端,有些CSPs则会在C端翻译提前终止而序列较短、相对分子质量更小,有些CSPs的C端有延伸而序列较长、相对分子质量更大,例如棉铃虫Helicoverpa armigera HarmiCSP12、HarmiCSP 14和HarmiCSP 25[12];食蚜蝇Episyrphus balteatus EbalCSP3、EbalCSP 4和EbalCSP6[13];柑橘木虱Diaphorina citri DcitCSP12[14]和褐飞虱Nilaparvata lugens NlugCSP3[15]等。本研究中CsinCSP1、CsinCSP2和CsinCSP3则属于C端有延伸的昆虫CSP类群。此外,在5个CsinCSPs的N端具有长度为16~22个氨基酸的信号肽序列,说明CsinCSPs具备分泌蛋白特征。亚细胞定位软件LocTree2预测结果显示,本研究中5个CsinCSPs主要为非膜蛋白,与上述推断一致。
5个荔枝蒂蛀虫卵CsinCSPs有保守的半胱氨酸位点,其位点排布模式均为C1-X6-C2-X18-C3-X2-C4,在C2和C3位点之间有多个高度保守的其他氨基酸位点,说明5个CsinCSPs基序的高度保守性。5个CsinCSPs在二级结构上相邻的半胱氨酸顺次连接形成2个二硫键,与报道的昆虫CSPs基本特征一致。在二级结构上CsinCSP1~3包括6个α−螺旋,而CsinCSP4和CsinCSP5有5个α−螺旋,在系统进化分析中证实了5个CsinCSPs属于不同CSP类群,利用在线软件预测CsinCSPs蛋白的三维结构也验证了5个CsinCSPs的α−螺旋数目不同这点。对功能蛋白而言,保守的基序和稳定的结构对其功能是非常重要的,因此由5个CsinCSPs二维及三维结构的区别可预测其生理功能的区别。与昆虫OBPs相比,CSPs在进化上更为保守,不同物种间序列相似度可高达40%~50%。昆虫CSPs序列进化的保守性也可能与其特征有关,比如它们对常见环境挥发性物质有较低结合力,而与通信有关的信号化学物质则有强结合力[6]。昆虫CSPs在三维结构上有5或6个α−螺旋,因其序列长度范围较广,三维结构多变,而被认为可结合更多种类的配体分子[7, 11]。在解析荔枝蒂蛀虫5个CsinCSPs三维结构基础上,本研究以荔枝、龙眼果园8种最常用药剂为配体,利用基于“锁−钥学说”的分子对接技术简单快速地模拟出配体与CsinCSPs蛋白之间的相互作用[16]。分子对接数据表明5个CsinCSPs与2个菊酯类杀虫剂分子的结合能力最强,其次为辛硫磷、毒死蜱、三唑磷和氯虫苯甲酰胺,与除虫脲和吡虫啉结合能力最弱。在实际生产应用中,除虫脲和吡虫啉可作为杀卵剂应用于防治荔枝蒂蛀虫[9, 17]。因此我们推测,荔枝蒂蛀虫卵CsinCSPs可能参与其他药剂的运输和降解,而无法包裹除虫脲和吡虫啉分子,最终导致除虫脲和吡虫啉对荔枝蒂蛀虫卵起到灭杀效果。但分子对接结果仅为模拟预测数据,后续需通过荧光竞争结合试验获得解离常数进一步确定其结合效力。
除了在昆虫嗅觉识别过程中发挥重要作用,CSPs还可能参与调节昆虫的生长发育、取食、感受机械刺激、免疫、信号传导等生理功能[11]。近年来研究发现,昆虫CSP与抗药性相关。对Bt抗性种群和Bt敏感种群的美洲条螟Diatraea saccharrlis幼虫进行基因表达水平检测发现,2个种群中的某些CSPs表达不同,表明这些CSPs可能参与了条螟的抗性反应[18]。亚致死剂量阿维菌素处理家蚕Bombyx mori成虫后,会导致BmorCSP3、BmorCSP 6和BmorCSP 7等多个CSP蛋白在多个组织中表达上调[19]。用闹羊花毒素III或苄氯菊酯处理小菜蛾Plutella xylostella成虫[20-21]、毒死蜱处理斜纹夜蛾Spodoptera litura幼虫[22]、噻虫嗪处理烟粉虱Bemisia tabaci成虫[23]、吡虫啉处理蜜蜂Apis cerana和Apis mellifera成虫[24-25]均得到同样的结果。此外,通过RNAi方法,以禾谷缢蚜Rhopalosiphum padi成虫为材料证实RpadCSP10与其对吡虫啉的抗性直接相关[26];以赤拟谷盗Tribolium castaneum若虫为材料[27],证明TcasCSP10与靶标害虫对敌敌畏和克百威的抗性相关。有学者推测:杀虫剂处理后昆虫CSPs表达变化,可能原因是成虫腹部表达的CSP蛋白可包裹有毒的杀虫剂分子,让其随粪便排出体外,对杀虫剂效力起到缓冲作用[9, 13]。但是同类研究在多种昆虫的幼虫期或成虫期均有所开展,在害虫卵期却鲜见文献报道。本研究利用害虫卵开展相关研究,结果显示亚致死剂量除虫脲处理荔枝蒂蛀虫卵后,CsinCSP3和CsinCSP5在处理后6和24 h的表达均上升40倍以上,随后二者在处理后48 h表达则下降20余倍,而另外3个CsinCSPs则变化不大,说明CsinCSP3和CsinCSP5可能参与荔枝蒂蛀虫卵对除虫脲的解毒过程。但是在分子对接分析中,CsinCSP2和CsinCSP3与除虫脲结合能力更强,CsinCSP5却与除虫脲结合能力较弱,说明分子对接结果不能完全预测CsinCSPs在昆虫化学药剂胁迫下解毒过程中的生理功能。
本研究以害虫卵为研究对象,对荔枝蒂蛀虫5个CsinCSPs基因进行了克隆及序列分析,并且在分子建模及分子对接的基础上,对除虫脲作用后虫卵中CsinCSPs基因表达情况进行了解析,结果证明在CsinCSPs可能参与荔枝蒂蛀虫卵在杀虫剂肋迫下的解毒过程,后续可通过RNAi或CRISPR基因编辑等技术在活体水平确定该类蛋白在害虫抗药性中的作用机制以及在昆虫卵期的相关功能。
| [1] |
陈厚彬. 中国荔枝龙眼产业现状[C]// 国家荔枝龙眼产业技术体系年度工作总结报告大会. 广州, 2019: 1-2.
(  0) 0) |
| [2] |
陈炳旭. 荔枝龙眼害虫识别与防治图册[M]. 北京: 中国农业出版社, 2017: 31-41.
(  0) 0) |
| [3] |
李文景, 董易之, 姚琼, 等. 荔枝蒂蛀虫研究进展[J]. 昆虫学报, 2018, 61(6): 721-732. (  0) 0) |
| [4] |
KAUPP B. Olfactory signalling in vertebrates and insects: Differences and commonalities[J]. Nature Reviews Neuroscience, 2010, 11(3): 188-200. DOI:10.1038/nrn2789 (  0) 0) |
| [5] |
IHARA S, YOSHIKAWA K, TOUHARA K. Chemosensory signals and their receptors in the olfactory neural system[J]. Neuroscience, 2013, 254(7): 45-60. (  0) 0) |
| [6] |
PELOSI P, IOVINELLA I, ZHU J, et al. Beyond chemoreception: Diverse tasks of soluble olfactory proteins in insects[J]. Biological Reviews of the Cambridge Philosophical Society, 2018, 93(1): 184-200. DOI:10.1111/brv.12339 (  0) 0) |
| [7] |
LIU G, XUAN N, RAJASHEKAR B, et al. Comprehensive history of CSP genes: evolution, phylogenetic distribution and functions[J]. Genes, 11(4): 413. doi:10.3390/genes11040413.
(  0) 0) |
| [8] |
董易之, 姚琼, 陈炳旭, 等. 荔枝蒂蛀虫的产卵选择性研究[J]. 果树学报, 2018, 35(2): 204-211. (  0) 0) |
| [9] |
YAO Q, QUAN L F, XU S, et al. Effect of diflubenzuron on the chitin biosynthesis pathway in Conopomorpha sinensis eggs[J]. Insect Science, 2020. https://doi.org/10.1111/1744.7917.12848.
(  0) 0) |
| [10] |
徐浩智, 游银伟, 张龙. 昆虫化学感受蛋白及其功能研究进展[J]. 农业生物技术学报, 2015, 23(1): 118-125. DOI:10.3969/j.issn.1674-7968.2015.01.013 (  0) 0) |
| [11] |
刘孝贺, 孙丽娜, 张怀江, 等. 昆虫化学感受蛋白研究进展[J]. 农学学报, 2020, 10(6): 22-26. (  0) 0) |
| [12] |
LI Z Q, ZHANG S, LUO J Y, et al. Expression analysis and binding assays in the chemosensory protein gene family indicate multiple roles in Helicoverpa armigera
[J]. Journal of Chemical Ecology, 2015, 41(5): 473-485. DOI:10.1007/s10886-015-0574-x (  0) 0) |
| [13] |
JIA H R, NIU L L, SUN Y F, et al Odorant binding proteins and chemosensory proteins in Episyrphus balteatus (Diptera: Syrphidae): Molecular cloning, expression profiling, and gene evolution[J]. Journal of Insect Science, 2020, 20 (4). doi:10.1093/jisesa/ieaa065.
(  0) 0) |
| [14] |
ZHANG H, CHEN J L, LIN J H, et al. Odorant-binding proteins and chemosensory proteins potentially involved in host plant recognition in the Asian citrus psyllid, Diaphorina citri
[J]. Pest Management Science, 2020, 76(8): 2609-2618. DOI:10.1002/ps.5799 (  0) 0) |
| [15] |
WARIS M I, YOUNAS A, AMEEN A, et al. Expression profiles and biochemical analysis of chemosensory protein 3 from Nilaparvata lugens (Hemiptera: Delphacidae)
[J]. Journal of Chemical Ecology, 2020, 46(4): 363-377. DOI:10.1007/s10886-020-01166-6 (  0) 0) |
| [16] |
汪宇, 孙浩, 朱家颖, 等. 云南切梢小蠹气味结合蛋白的分子对接[J]. 江苏农业科学, 2015, 43(5): 132-134. (  0) 0) |
| [17] |
陈炳旭, 董易之, 李文景, 等. 荔枝主要害虫防治技术研究进展与综合治理体系构建[J]. 广东农业科学, 2020, 47(11): 103-113. (  0) 0) |
| [18] |
GUO Z, CHENG Z Y, HUANG F, et al. Microarray analysis of global gene regulation in the Cry1Ab-resistant and Cry1Ab-susceptible strains of Diatraea saccharalis
[J]. Pest Management Science, 2012, 68(5): 718-730. DOI:10.1002/ps.2318 (  0) 0) |
| [19] |
XUAN N, GUO X, XIE H Y, et al. Increased expression of CSP and CYP genes in adult silkworm females exposed to avermectins[J]. Insect Science, 2015, 22(2): 203-219. DOI:10.1111/1744-7917.12116 (  0) 0) |
| [20] |
DONG X L, ZHAI Y F, HU M Y, et al. Proteomic and properties analysis of botanical insecticide rhodojaponin III-induced response of the diamondback moth, Plutella xyllostella (L.)
[J]. PLoS One, 2013, 8(7): e67723. DOI:10.1371/journal.pone.0067723 (  0) 0) |
| [21] |
BAUTISTA M A, BHANDARY B, WIJERATNE A J, et al. Evidence for trade-offs in detoxification and chemosensation gene signatures in Plutella xylostella
[J]. Pest Management Science, 2015, 71(3): 423-432. DOI:10.1002/ps.3822 (  0) 0) |
| [22] |
LIN X, JIANG Y, ZHANG L, et al. Effects of insecticides chlorpyrifos, emamectin benzoate and fipronil on Spodoptera litura might be mediated by OBPs and CSPs
[J]. Bull Entomology Research, 2018, 108(5): 658-666. DOI:10.1017/S0007485317001195 (  0) 0) |
| [23] |
LIU G X, XUAN N, CHU D, et al. Biotype expression and insecticide response of Bemisia tabaci chemosensory protein-1
[J]. Archives of Insect Biochemistry and Physiology, 2014, 85(3): 137-151. DOI:10.1002/arch.21148 (  0) 0) |
| [24] |
LI H, TAN J, SONG X, et al. Sublethal doses of neonicotinoid imidacloprid can interact with honey bee chemosensory protein 1 (CSP1) and inhibit its function[J]. Biochemical and Biophysical Research Communications, 2017, 486(2): 391-397. DOI:10.1016/j.bbrc.2017.03.051 (  0) 0) |
| [25] |
LI Z, YU T, CHEN Y, HEERMAN M, et al. Brain transcriptome of honey bees (Apis mellifera) exhibiting impaired olfactory learning induced by a sublethal dose of imidacloprid
[J]. Pesticide Biochemistry and Physiology, 2019, 156(56): 36-43. (  0) 0) |
| [26] |
PENG X, QU M J, WANG S J, et al. Chemosensory proteins participates in insecticide susceptibility in Rhopalosiphum padi, a serious pest on wheat crops[J]. Insect Molecular Biology, 2020. doi:10.1111/IMB.12683.
(  0) 0) |
| [27] |
XIONG W, GAO S, LU Y, et al. Latrophilin participates in insecticide susceptibility through positively regulating CSP10 and partially compensated by OBPC01 in Tribolium castaneum
[J]. Pesticide Biochemistry and Physiology, 2019, 159(4): 107-117. (  0) 0) |
 2021, Vol. 42
2021, Vol. 42


