2. 南京农业大学 农业资源与生态环境研究所,江苏 南京 210095
2. Institute of Agricultural Resources and Ecological Environment, Nanjing Agricultural University, Nanjing 210095, China
人参Panax ginseng C. A. Mey.为我国传统名贵药材,也是我国药用植物中非常具有代表性的忌连作药材。有研究认为栽培过人参的土壤需要10~30年的恢复期[1],原因在于人参栽培过程中,根际土壤逐渐由“细菌型”转化为“真菌型”,病原菌数量显著增加,对病原菌有拮抗作用的细菌、放线菌的数量减少,土壤微生物群落组成与结构逐渐劣变[2]。但关于栽参后土壤微生物群落具体发生了什么变化,目前还鲜见相关深入报道。
近年来,随着道地产区宜药土地资源不断减少,有关连作障碍土壤的生态修复技术引起了科研工作者与生产者的共同关注。目前主要研究的修复技术包括施用化学药剂、消毒、添加土壤有益菌以及增施生物质炭等[3-5]。其中生物质炭作为一种新型的原位土壤改良剂,其丰富的孔隙结构可为土壤有益微生物提供良好的附着空间和繁殖条件,促进微生物种群增长,同时生物质炭优良的保水、保肥能力也有助于土壤理化性质、供肥能力的改善[6-7]。目前的研究报道显示生物质炭在土壤改良方面具有广阔的应用前景[8]。
本研究在前期工作中发现生物质炭有助于提高连作参苗产量与品质,但上述变化与土壤质量、土壤微生物群落之间的关系还没有深入分析。本试验由此出发,拟采用3种不同原料制备的生物质炭对老参地土壤进行修复研究,结合Illumina MiSeq高通量测序技术重点分析栽参后土壤细菌群落变化及生物质炭对上述变化的影响,为探究栽参后土壤劣变规律与原因、开发参地土壤原位修复技术提供理论支撑。
1 试验方法 1.1 试验地老参地土壤改良试验于2017—2019年在吉林省白山市湾沟镇平川村(海拔719 m;126°23′~127°11′E,41°48′~42°13′N)进行,该地属温带大陆性季风气候,夏季短冬季长,年平均气温4.6 ℃。土壤前茬作物为三年生人参,起参后,结合深翻去除杂草等残余物。参地土壤为壤土,基本性质如下:有机碳38.45 mg·kg−1、碱解氮83.20 mg·kg−1、有效磷34.80 mg·kg−1、速效钾160 mg·kg−1、pH 5.06、电导率48.35 μs·cm−1。
1.2 试验设计试验设计5个处理,分别为老参地、老参地+玉米秸秆炭、老参地+稻壳炭、老参地+椰壳炭和新林土处理组。生物质炭具体施入方法:按1.5 kg/m2施入土壤中,施入后深翻2次与土壤混匀;自然放置1个冬季,于翌年5月起垄,播种人参种子,播种后日常田间管理技术参照当地人参生产质量管理规范(GAP)。生物质炭处理小区面积为10 m2,每个处理3次重复,分别以不添加生物质炭的老参地土壤和附近未开发利用过的森林土为老参地对照和新林土对照。2019年9月取出部分二年生人参及土壤样品,用于高通量测序分析。
土壤取样方法:按照五点法取样,将土壤迅速装入无菌离心管中,液氮处理后装入低温样品保存箱,迅速送回实验室用于相关分析。
1.3 土壤微生物结构多样性细菌总DNA的提取。采用OMEGA的E.Z.N.A. Mag-Bind Soil DNA Kit提取细菌总DNA,Qubit3.0 DNA检测试剂盒精确定量DNA浓度,琼脂糖凝胶检测DNA完整性。
PCR扩增及DNA纯化回收。引物融合了MiSeq测序平台的V3-V4通用引物:341F引物CCCTACACGACGCTCTTCCGATCTG (barcode) CCTACGGGNGGCWGCAG;805R引物GACTGGAGTTCCTTGGCACCCGAGAATTCCA GACTACHVGGGTATCTAATCC。扩增条件:94 ℃预变性3 min;94 ℃变性30 s,45 ℃退火20 s,65 ℃延伸30 s,5个循环;94 ℃延伸20 s,55 ℃退火20 s,72 ℃延伸30 s,20个循环。PCR扩增结束后,将纯化质检合格的扩增产物1∶1等量混合,利用MiSeq台式测序仪进行双端测序。
16S rRNA V3-V4区高通量测序由上海生工生物工程技术服务有限公司完成,对于MiSeq双端测序数据,首先根据PE reads之间overlap的关系,利用PEAR软件将成对reads拼接成一条序列,采用cutadapt软件去除原始序列3′端测序接头后根据barcode区分样本序列,并利用Prinseq软件对各样本序列进行质控和过滤,得到各样本数据。
1.4 数据统计与分析采用Microsoft office 2016、SPSS 22.0对相关数据进行统计分析。
2 结果与分析 2.1 土壤样本检测结果与质量控制不同处理土壤样品高通量测序结果与细菌群落多样性指数变化如表1所示。5个样本共获得有效序列310 356条,按照优化标准,去除不合格序列后共得高质量序列303 851条,共占有效序列的97.90%。高质量序列可用于样本间微生物多样性和丰富度的评价。
|
|
表 1 不同土壤样本序列数据统计与细菌群落Alpha多样性的差异 Table 1 Statistics of different soil sample sequence data and differences in Alpha diversity of bacterial communities |
与新林土相比,老参地土壤细菌丰度(ACE、Chao1指数)、多样性(Shannon指数)均呈下降趋势。采用生物质炭对老参地进行改良后上述指标均有所上升,其中Chao1与ACE指数增幅最大,分别达到25.05%、19.10%;表明生物质炭处理有助于老参地土壤中细菌物种丰度及多样性恢复,其中玉米秸秆炭及稻壳炭对上述指标影响较大。
2.2 生物质炭对老参地土壤细菌操作分类单元数量(OTUs)及多样性的影响分析不同处理人参根际土壤中细菌OTUs的变化,结果如图1。新林土数量最高,为4 650个。老参地土壤中OTUs下降为1 854个,仅为新林土中OTUs的39.87%。增施3种生物质炭后,玉米秸秆炭、稻壳炭、椰壳炭处理组中OTUs分别为2 408、2 233、2 235个,较老参地均有所上升,平均提升23.62%。
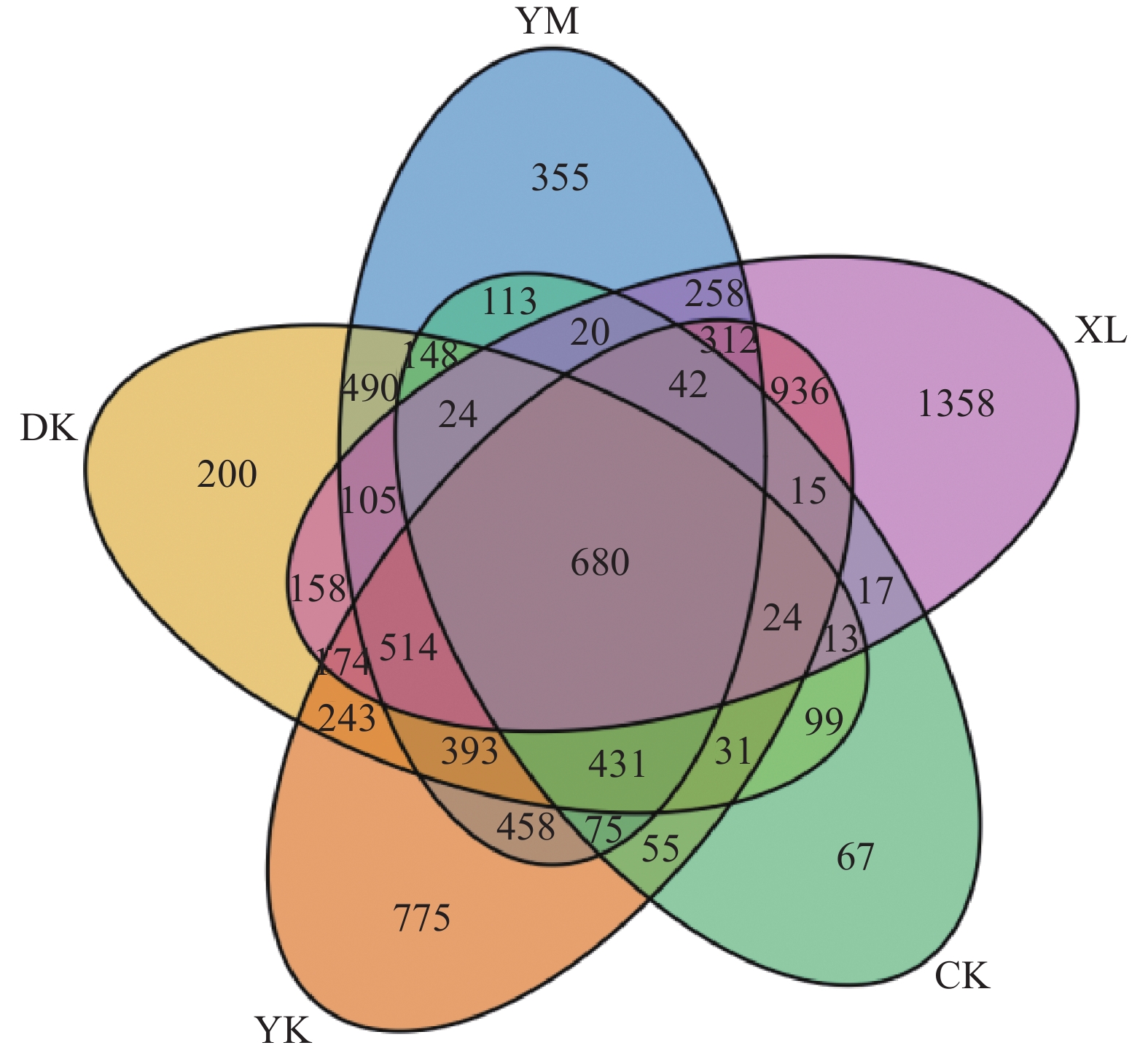
|
图 1 不同处理下老参地土壤OTUs的维恩图 Fig. 1 Venn diagram of soil OTUs in the continuous cropping ginseng field under different treatments YM:老参地+玉米秸秆炭,DK:老参地+稻壳炭,YK:老参地+椰壳炭,CK:老参地,XL:新林土 YM: Continuous cropping ginseng field + corn stalk biochar, DK: Continuous cropping ginseng field + rice husk biochar, YK: Continuous cropping ginseng field + coconut shell biochar, CK: Continuous cropping ginseng field, XL: New forest soil |
不同土壤样品中细菌群落结构门类比例变化如图2A所示。5个处理土壤样品中共检测到27个细菌门,共有门类21个。新林土中细菌门类最丰富(26个),含优势门类(占比>10%)4个,包括变形菌门Proteobacteria、放线菌门Actinobacteria、酸杆菌门Acidobacteria、疣微菌门Verrucomicrobia,4个门细菌OTUs占比达76%以上。老参地土壤中细菌门类总数下降为24个,优势门类数量下降为2个,包括变形菌门与放线菌门,二者细菌OTUs占比为65%。增施生物质炭后,除老参地+稻壳炭处理迷踪菌门Elusimicrobia细菌数量有所恢复外,其余处理参地土壤细菌门类总数与优势门类数量不变,但单优势门类占比较老参地中有所下降,为55%~65%;表明老参地土壤微生物群落出现单优势种群上升的特点,而生物质炭对上述变化趋势具有一定的调节作用。
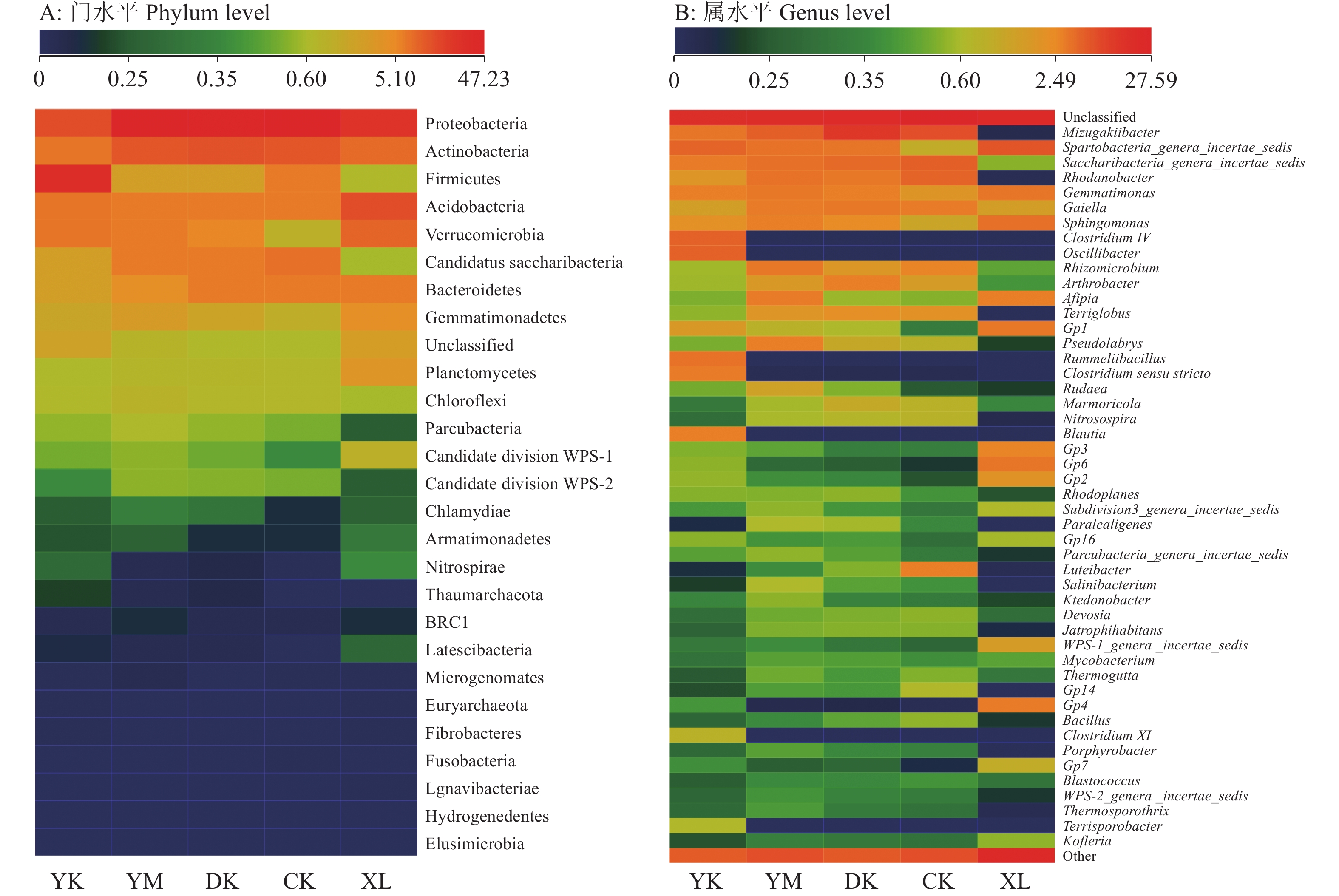
|
图 2 生物质炭对连作参地土壤细菌群落门类和属水平的影响 Fig. 2 Effect of biomass charcoal on the phylum and genus level of soil bacterial community in continuous cropping ginseng field YM:老参地+玉米秸秆炭,DK:老参地+稻壳炭,YK:老参地+椰壳炭,CK:老参地,XL:新林土 YM: Continuous cropping ginseng field+corn stalk biochar, DK: Continuous cropping ginseng field+rice husk biochar, YK: Continuous cropping ginseng field+coconut shell biochar, CK: Continuous cropping ginseng field, XL: New forest soil |
分析图2B中不同土壤样品中细菌群落属水平组成与数量变化,发现新林土、老参地、老参地+玉米秸秆炭处理、老参地+稻壳炭、老参地+椰壳炭中细菌OTUs可分别归属至291、177、203、186、180个属(仅列出排名前50,其余属名未列出)。老参地中细菌属总数下降,增施生物质炭后,土壤中细菌属分类数有所上升,表明丰富度有所增加。
2.4 土壤细菌分类和系统发育的变化采用环形树状图表示5个处理土壤样品中细菌优势物种分类与系统发育的变化,结果如图3所示。图3共标示出土壤优势门中变化显著的前20个物种。其中,变形菌门中具有显著变化的物种最多,为6个属;其次为酸杆菌门,5个属;放线菌门与厚壁菌门Firmicutes中各3个属;疣微菌门、芽单胞菌门Gemmatimonadetes、Candidatus saccharibacteria各1个属。
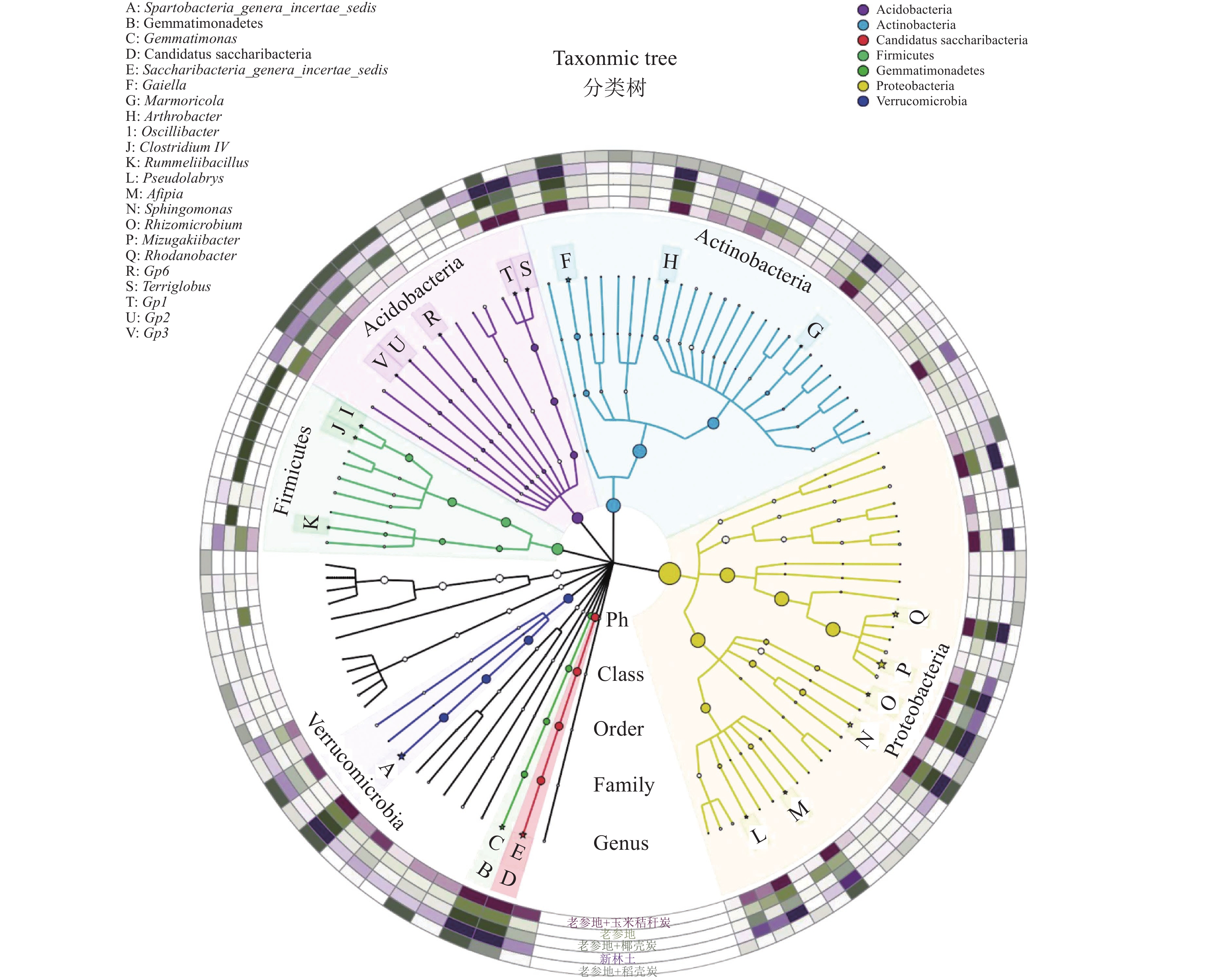
|
图 3 细菌分类和系统发育信息可视化图 Fig. 3 Visualization diagram of classification and phylogenetic information of bacteria 具有显著差异的属以“☆”标出 The genera having significant difference are marked with “☆” |
结合图2可知,上述发生显著变化的优势属中Spartobacteria_genera_incertae_sedis、Sphingomonas、Gemmatimonas、Afipia、Gp1、Gp2、Gp3、Gp6、Rummeliibacillus 9个属中细菌数量表现为新林土>老参地,老参地降幅为46.44%~100%。Gaiella、Saccharibacteria_genera_incertae_sedis、Rhizomicrobium、Arthrobacter、Marmoricola、Pseudolabrys、Mizugakiibacter、Rhodanobacter、Terriglobus、Clostridium IV、Oscillibacter 11个属中细菌数量表现为新林土<老参地,老参地增幅为33.33%~54 028.57%。施用生物质炭后,老参地中(显著降低的种属数量)平均增加27.52%,显著增加的种属中有61%的处理细菌数量有所降低,降幅为21.83%~133 28.57 %。
2.5 生物质炭对土壤细菌优势属的影响分析细菌优势属(占比>1%)变化如表2所示。5种土壤仅有4个共有优势属,即Gaiella、芽单胞菌属Gemmatimonas、鞘氨醇单胞菌属Sphingomonas和慢生根瘤菌属Spartobacteria_genera_incertae_sedis,四者在新林土、老参地、老参地+玉米秸秆炭、老参地+稻壳炭、老参地+椰壳炭处理中占比和分别为22.49%、8.36%、13.07%、14.15%、16.01%;表明较其他微生物而言,这4个属的微生物种群是森林土中相对较稳定的种群,受人参栽培的影响相对较小或者变化较慢,并且生物质炭处理可缓解其占比下降的趋势。
|
|
表 2 不同处理土壤优势属组成、占比及OTUs1) Table 2 Composition, proportion and OTUs of soil dominant genera in different treatments |
共有优势属中慢生根瘤菌属、鞘氨醇单胞菌属和芽单胞菌属数量表现为新林土>老参地(表2),老参地中三者OTUs分别降低了84.27%、64.41%、46.44%,以慢生根瘤菌属数量下降最为剧烈。增施生物质炭后,上述细菌数量均有所恢复,三者OTUs较老参地处理分别增加了240.02%、38.53%、64.02%,生物质炭处理对慢生根瘤菌属、芽单胞菌属细菌数量增加影响明显。共有优势属中Gaiella细菌数量表现为老参地>新林土(表2),其OTUs增加了81.71%;增施生物质炭后,该属细菌数量进一步增加,老参地+玉米秸秆炭、老参地+稻壳炭、老参地+椰壳炭处理OTUs分别较新林土增加了131.94%、115.74%、151.85%。表明栽培人参与使用生物质炭刺激了Gaiella属细菌增殖。此外,酸杆菌门Acidobacteria优势属Gp1在新林土中占比为3.59%,在老参地中占比下降至0.35%,经生物质炭处理后,其在老参地+玉米秸秆炭、老参地+稻壳炭、老参地+椰壳炭处理中占比分别增至1.76%、1.05%、1.05%;提示人参根系分泌物可能不利于Gp1属微生物生长,而生物质炭处理可削弱这种不利影响,促进Gp1属细菌数量增加,保持其属的优势地位。
综合上述分析可见,相较于同期临近新林土,栽培人参后的老参地细菌属组成及优势属占比大多不同程度地降低,而生物质炭处理对上述劣变趋势具有一定的正向调节作用,使其数量变化趋势趋向于新林土。
2.6 生物质炭对土壤细菌功能的影响 2.6.1 土壤细菌功能基因分类采用COG(Clusters of orthologous groups)预测分析不同处理土壤细菌功能差异,结果如图4所示。通过COG数据库对比,所有基因的功能可归为25个功能亚类,主要包括能量生产和转换6.11%~6.23%,氨基酸转运与代谢7.46%~7.96%,碳水化合物运输和代谢6.11%~6.40%,转录7.42%~7.68%,复制、重组和修复5.14%~5.29%,细胞壁/质膜/包膜生物合成6.39%~6.78%,仅常规功能预测11.92%~12.47%,信号转导机制5.85%~6.94%等。
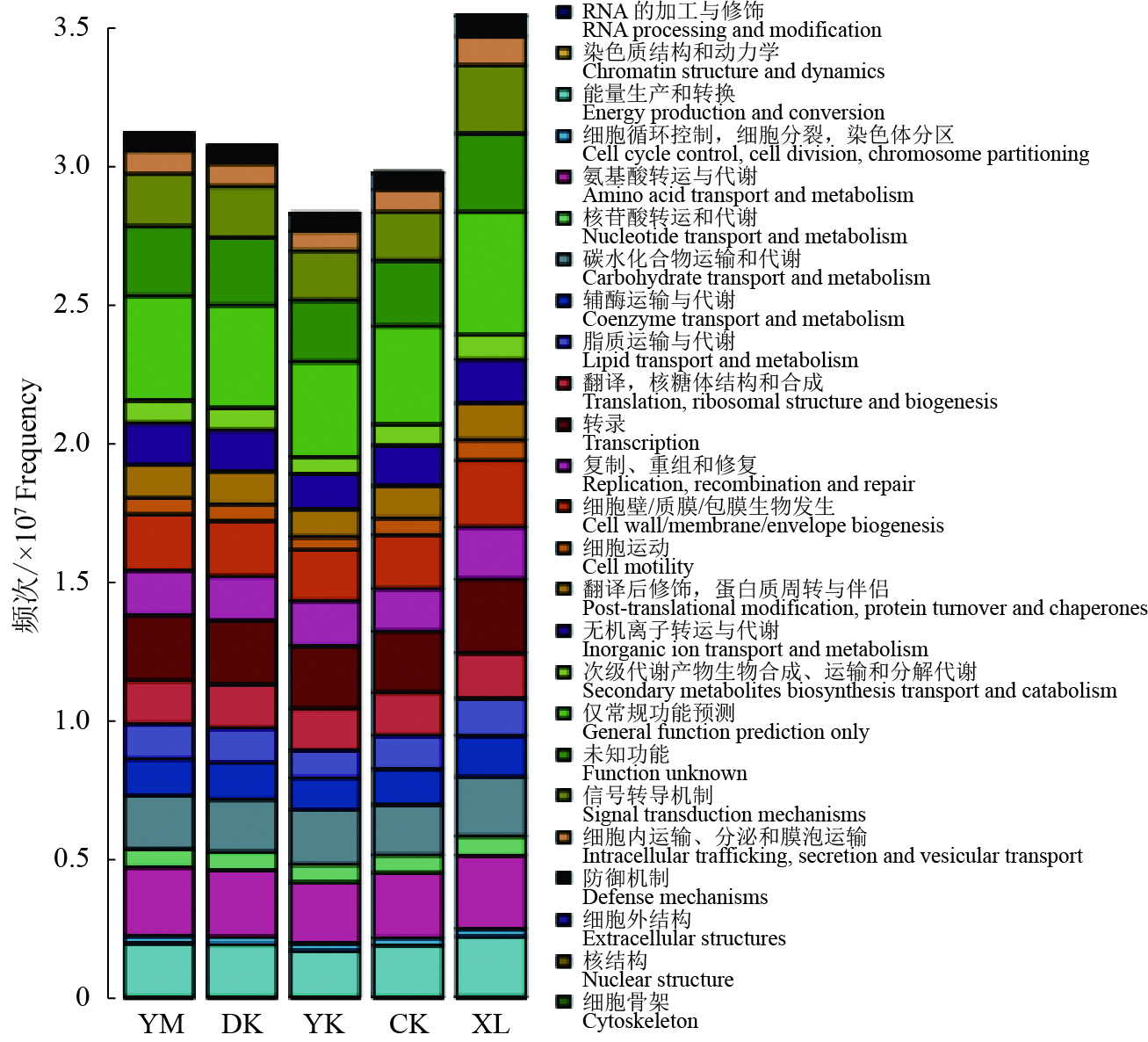
|
图 4 不同处理土壤细菌功能变化图 Fig. 4 Changes in soil bacterial function in different treatments YM:老参地+玉米秸秆炭,DK:老参地+稻壳炭,YK:老参地+椰壳炭,CK:老参地,XL:新林土 YM: Continuous cropping ginseng field+corn stalk biochar, DK: Continuous cropping ginseng field+rice husk biochar, YK: Continuous cropping ginseng field+coconut shell charcoal, CK: Continuous cropping ginseng field, XL: New forest soil |
基于 PICRUSt 软件的细菌基因组的基因功能构成分析结果如图5所示。老参地与新林土处理之间的土壤细菌功能基因除核结构和细胞外结构外均具有显著性差异(P<0.05),与新林土处理相比,老参地处理RNA加工和修饰、细胞循环控制、氨基酸转运和代谢、核苷酸转运和代谢、脂质运输与代谢、翻译后修饰以及蛋白质周转与伴侣、无机离子转运与代谢功能有所下降,整体下降幅度为0.06%~7.56%,其余功能显著上升,增幅为3.25%~33.16%,上升幅度最高的为染色质结构和动力学。
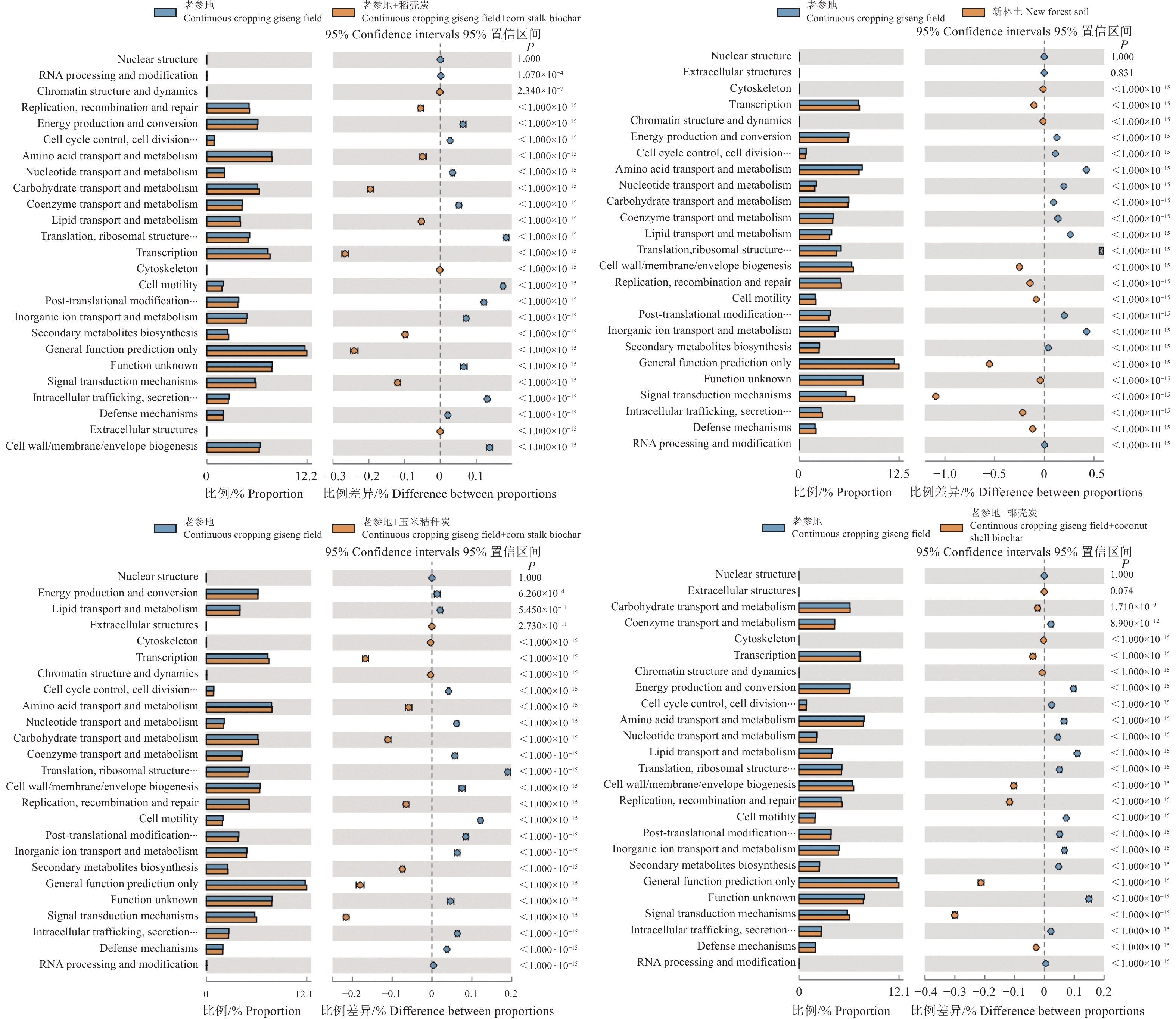
|
图 5 不同处理细菌基因功能差异性对比图 Fig. 5 Comparison of gene function differences of bacteria in different treatments |
相较于老参地处理,加入3种不同生物质炭后,土壤细菌RNA加工与修饰、能源生产和转化、细胞循环控制、核苷酸转运和代谢、辅酶运输与代谢、脂质运输和代谢、翻译后修饰以及蛋白质周转功能均下降,总体下降幅度在1.00%~6.65%之间;染色质结构和动力学,转录,复制、重组和修复,信号转导机制,仅常规功能预测和细胞防御功能提升,上升幅度在1.48%~29.89%之间。上述功能随着3种生物质炭的增加,逐渐向新林土靠近。其中玉米秸秆炭和稻壳炭的加入使碳水化合物的运输和代谢功能得到提升,而椰壳炭的加入主要强化了细胞运动、无机离子转运代谢以及细胞防御功能。
3 讨论土壤微生物群落结构能影响到土壤健康状况[9]。目前研究普遍认为生物质炭能够提升土壤细菌微生物群落多样性,从而提高土壤生态系统的稳定性和抗逆性,如Zheng等[10]在酸性水稻田中施用小麦秸秆生物质炭发现,施用生物质炭4年后明显提升了Alpha多样性。本研究试验表明施用生物质炭2年,也能够有效提升Alpha多样性,这说明生物质炭施入在短期和长期内均能够对土壤微生物多样性产生影响。一些短期室内试验表明生物质炭改变微生物多样性以及丰度是由自身性质的改变引起的[11-12],而一些长期的田间试验表明影响微生物多样性及丰度的主要原因是土壤理化性质得到了改善[13]。近些年来研究发现,在田间施用生物质炭后能够缓解作物与微生物两者对营养元素的竞争关系,一方面原因是生物质炭自身携带养分物质,另一方面原因是生物质炭促进植物生长,间接促进光合作用和营养由根部向土壤中输入,从而使微生物数量增长与繁殖速度加快[14-15],微生物群落结构的改变直接影响土壤养分循环[16]。
Ye等[17]研究发现有机肥和生物炭基肥的施加使土壤中绿弯菌门Chloroflexi、酸杆菌门、放线菌门、拟杆菌门和变形菌门细菌均发生显著变化。本试验研究结果表明,新林土中变形菌门、放线菌门、酸杆菌门和疣微菌门为优势门类,栽培人参后变形菌门、放线菌门数量增加,酸杆菌门和疣微菌门数量迅速减少,分析发现老参地土壤微生物群落变化与人参根际分泌物的驱动密切相关[18-19]。随着3种不同原料生物质炭的施加,厚壁菌门、疣微菌门、芽单胞菌门、变形菌门和假丝酵母糖化菌门等门类得到调节,使其数量趋近于新林土。其中变形菌门生长缓慢,一方面可能是由于本试验添加生物质炭2年后才进行取样,此时的土壤微生物群落已处于稳定状态,因此导致变形菌门生长较慢;另一方面可能是由于生物质炭呈碱性,加入后使自身携带的难分解有机碳稀释土壤可溶性有机碳,从而导致变形菌门细菌增加缓慢,同时刺激疣微菌门细菌的生长。
生物质炭能够增加土壤中的碳含量,对快速增殖细菌产生诱导作用,添加生物质炭后土壤细菌的代谢功能发生显著的变化。本研究发现较新林土,老参地处理细菌代谢功能下降,施入生物质炭后能够改善细菌核苷酸转运和代谢、辅酶运输与代谢、脂质运输和代谢、翻译后修饰及蛋白质周转与伴侣等功能;说明施入生物质炭后,土壤细菌具有选择性,土壤细菌功能转向代谢方向,从而调节对土壤有机质的保存能力,与张婷婷[20]研究结果一致。
综合上述分析可见,加入生物质炭能够提升土壤细菌多样性,调节细菌群落结构以及细菌功能,使老参地土壤朝良好的方向发展,但具体的调节机制尚未有明确的结果,仍需更多的试验加以证明。本研究结果能够为连作参地土壤的修复及人参栽培提供理论参考。
4 结论1)相较于新林土,栽培人参后的老参地土壤细菌数量、群落多样性、细菌分类组成及优势属占比均不同程度的下降,并表现出单优势种群比例上升的特点。生物质炭处理对上述劣变趋势具有一定的正向调节作用,使细菌数量变化趋势趋向于新林土,细菌功能中染色质结构和动力学,转录,复制、重组和修复,信号转导机制和细胞防御得到提升。
2)老参地中Spartobacteria_genera_incertae_sedis、Sphingomonas、Gemmatimonas、Afipia 、Gp1、Gp2、Gp3、Gp6、Rummeliibacillus 9个属细菌数量显著降低,提示栽培人参或人参根系分泌物可能不利于上述细菌的生长和种群数量的维持。
3)老参地中Gaiella属细菌数量显著增加,添加生物质炭后该属优势度进一步增加,表明表明栽培人参和施用生物质炭均可刺激Gaiella属细菌增殖。
| [1] |
奚广生. 不同土地利用方式下西洋参根际土壤养分与微生物特性研究[D]. 徐州: 中国矿业大学, 2020.
(  0) 0) |
| [2] |
李莉, 李东升, 赵晓松. 吉林省东部山区人参栽培基地土壤中微生物的生态分布[J]. 安徽农业科学, 2008, 36(31): 13729-13730. DOI:10.3969/j.issn.0517-6611.2008.31.104 (  0) 0) |
| [3] |
ZORNOZA R, ACOSTA J A, FAZ A, et al. Microbial growth and community structure in acid mine soils after addition of different amendments for soil reclamation[J]. Geoderma, 2016, 272: 64-72. DOI:10.1016/j.geoderma.2016.03.007 (  0) 0) |
| [4] |
陈晓天. 土壤改良剂及放线菌剂对镉(Cd)污染农田的修复作用研究[D]. 杨凌: 西北农林科技大学, 2020.
(  0) 0) |
| [5] |
刘文辉, 梁翔宇, 孙小涵, 等. 生物质炭作为土壤改良剂在农业上的应用研究进展[J]. 中国资源综合利用, 2020, 38(6): 108-110. DOI:10.3969/j.issn.1008-9500.2020.06.034 (  0) 0) |
| [6] |
XIAO R, AWASTHI M K, LI R, et al. Recent developments in biochar utilization as an additive in organic solid waste composting: A review[J]. Bioresource Technology, 2017, 246(S1): 203-213. (  0) 0) |
| [7] |
KAVITHA B, REDDY P V L, KIM B, et al. Benefits and limitations of biochar amendment in agricultural soils: A review[J]. Journal of Environmental Management, 2018, 227: 146-154. (  0) 0) |
| [8] |
吕玉德. 玉米秸秆生物炭对耕作土中硫形态转化及微生物群落结构的影响[D]. 兰州: 兰州交通大学, 2019.
(  0) 0) |
| [9] |
LIU J, WU F Z, YANG Y. Effects of cinnamic acid on bacterial community diversity in rhizosphere soil of cucumber seedlings under salt stress[J]. Agricultural Sciences in China, 2010, 9(2): 266-274. DOI:10.1016/S1671-2927(09)60092-4 (  0) 0) |
| [10] |
ZHENG J, CHEN J, PAN G, et al. Biochar decreased microbial metabolic quotient and shifted community composition four years after a single incorporation in a slightly acid rice paddy from southwest China[J]. Science of the Total Environment, 2016, 571: 206-217. DOI:10.1016/j.scitotenv.2016.07.135 (  0) 0) |
| [11] |
DOMENE X, MATTANA S, HANLEY K, et al. Medium-term effects of corn biochar addition on soil biota activities and functions in a temperate soil cropped to corn[J]. Soil Biology & Biochemistry, 2014, 72: 152-162. (  0) 0) |
| [12] |
ZHENG H, WANG X, LUO X, et al. Biochar-induced negative carbon mineralization priming effects in a coastal wetland soil: Roles of soil aggregation and microbial modulation[J]. Science of the Total Environment, 2018, 610: 951-960. (  0) 0) |
| [13] |
MAESTRINI B, HERRMANN A M, NANNIPIERI P, et al. Ryegrass-derived pyrogenic organic matter changes organic carbon and nitrogen mineralization in a temperate forest soil[J]. Soil Biology & Biochemistry, 2014, 69: 291-301. (  0) 0) |
| [14] |
KOLTON M, GRABER E R, TSEHANSKY L, et al. Biochar-stimulated plant performance is strongly linked to microbial diversity and metabolic potential in the rhizosphere[J]. New Phytologist, 2017, 213(3): 1393-1404. DOI:10.1111/nph.14253 (  0) 0) |
| [15] |
GE T, LIU C, YUAN H, et al. Tracking the photosynthesized carbon input into soil organic carbon pools in a rice soil fertilized with nitrogen[J]. Plant and Soil, 2015, 392(1/2): 17-25. (  0) 0) |
| [16] |
NIELSEN S, MINCHIN T, KIMBER S, et al. Comparative analysis of the microbial communities in agricultural soil amended with enhanced biochars or traditional fertilisers[J]. Agriculture Ecosystems & Environment, 2014, 191(S1): 73-82. (  0) 0) |
| [17] |
YE J, ZHANG R, NIELSEN S, et al. A combination of biochar-mineral complexes and compost improves soil bacterial processes, soil quality, and plant properties[J]. Frontiers in Microbiology, 2016, 7: 372. DOI:10.3389/fmicb.2016.00372 (  0) 0) |
| [18] |
应益昕. 人参连作对土壤微生物群落的影响研究[D]. 北京: 北京协和医学院, 2013.
(  0) 0) |
| [19] |
BAIS H P, WEIR T L, PERRY L G, et al. The role of root exudates in rhizosphere interactions with plants and other organisms[J]. Annual Review of Plant Biology, 2006, 57: 233-266. DOI:10.1146/annurev.arplant.57.032905.105159 (  0) 0) |
| [20] |
张婷婷. 增温及秸秆施用对豆−麦轮作土壤微生物群落结构的影响[D]. 南京: 南京信息工程大学, 2020.
(  0) 0) |
 2022, Vol. 43
2022, Vol. 43


