全氟辛酸(Perfuorooctanoic aid, PFOA)是一种耐光解、水解和生物降解的人工合成的全氟类化合物,因含有诸多碳氟键而具有极其稳定的性质,常被用作防油脂或防水剂以及衣服、家具和其他产品的保护性涂层,此外还可用作地板抛光剂、黏合剂、消防泡沫和电线绝缘等[1-3]。随着PFOA的广泛应用,在大气、河流、土壤等环境介质中均检测出PFOA残留:上海市41个室内灰尘样本中PFOA平均质量分数为279.4 ng/g,长江流域重庆段地表水中PFOA的检出率为100%,质量浓度在1.16~49.87 ng/L之间,全国31个省(自治区、直辖市)土壤中PFOA 的平均质量分数为0.35 ng/g[4-6],人类和动物可通过饮食饮水等方式暴露于PFOA,且由于PFOA半衰期长,有生物累积效应,故能在体内聚积,进而引发毒性,但不同物种、不同暴露年龄,引发毒性的浓度不同且差异较大[7]。研究发现,PFOA具有免疫毒性、发育毒性和内分泌干扰毒性[8]。在雌性生殖系统中,PFOA暴露会抑制卵巢激素分泌,损害卵泡发育,导致卵巢功能丧失[9]。并且PFOA还可通过氧化应激和凋亡显著抑制孕鼠黄体功能[10]。此外,新生大鼠注射PFOA可以减少生长卵泡和次级卵泡的数量[11]。虽然已有研究报道了PFOA暴露对生殖系统的影响,但关于PFOA对卵母细胞影响的研究依然很少。已知PFOA可以通过血卵屏障进入卵泡液[12],本试验通过给小鼠灌服PFOA模拟体内暴露来探讨其对小鼠卵母细胞成熟率及成熟质量的影响。通过检测活性氧(Reactive oxygen species,ROS)水平、纺锤体形态、细胞骨架来评估卵母细胞暴露于PFOA后的细胞变化。本研究将有助于揭示PFOA影响卵母细胞发育过程的毒理学机制,并引起人们对PFOA安全性的关注。
1 材料与方法 1.1 材料 1.1.1 试验动物6周龄体质量相近的昆明雌性小鼠,购买于广东省实验动物中心。
1.1.2 试剂PFOA(171468, Sigma),ROS检测试剂盒 (S0033, Beyotime),β-tubulin (T5293, Sigma),内磷酸化组蛋白H2A.X(Phospho-histone H2A.X,P-H2A.X,sc-51748, Santa Cruz),FITC偶联山羊抗鼠IgG (A11029, LIFE),Hoechst 33342 (H3570, LIFE),孕马血清促性腺激素(PMSG,宁波第二激素厂),人绒毛膜促性腺激素(hCG,宁波第二激素厂),透明质酸酶(H3506,Sigma)
1.1.3 试剂配制PFOA:超纯水溶解,配制不同浓度的PFOA以使得最终基于小鼠体质量的质量分数为0、5、10和20 mg/kg。
1.1.4 仪器CO2培养箱,体视显微镜,荧光倒置显微镜。
1.2 方法 1.2.1 试验动物分组将160只6周龄的昆明小鼠随机分为对照组、低剂量组、中剂量组和高剂量组,每个剂量组5个重复,每个重复8只小鼠。分笼后,先适应环境7 d,再进行药物灌服试验。饲养环境为12 h光照、12 h 黑暗交替,饮食饮水自由。
1.2.2 药物灌服处理适应环境1周后,以每天0、5、10、20 mg/kg的剂量分别给对照组、低剂量组、中剂量组和高剂量组小鼠灌服PFOA,每次灌服0.2 mL,连续灌服14 d。剂量及时间的选定参照PFOA相关的体内试验[13]。
1.2.3 卵母细胞的收集小鼠连续灌服PFOA 2周后进行超排处理,每只小鼠注射10 IU PMSG,间隔48 h后注射10 IU hCG,再间隔13.5 h后颈部脱臼处死,用体积分数为75%的乙醇溶液浸泡30 s消毒,随后解剖取出输卵管,找到膨大部,在含有PBS缓冲液的培养皿中用尖头镊撕开膨大部,用口吸管移出卵母细胞,放入预热好的1 g/L的透明质酸酶溶液中,处理2 min,待颗粒细胞脱掉以后将卵母细胞转移至PBS缓冲液中洗3遍。收集同一剂量处理组的小鼠卵母细胞至少100个。
1.2.4 统计卵母细胞成熟率卵母细胞排出第一极体视为成熟,取出卵母细胞后统计第一极体的排出率。
1.2.5 卵母细胞活性氧含量的检测每个剂量组随机取25~30个卵母细胞放入含有1 μmol/L DCFH-DA的成熟培养液液滴中洗涤2~3遍,再放入37 ℃、CO2体积分数为5%的培养箱孵育20 min。而后用DPBS-PVA缓冲液洗3次,每次1 min。在荧光显微镜下用同一曝光参数观察并拍照,应用ImageJ软件分析平均荧光强度[14]。
1.2.6 卵母细胞免疫荧光染色分析四孔板每个孔加入200 μL固定液,然后置于37 ℃、CO2体积分数为5%的培养箱预热30 min,每个剂量组随机取25~30个卵母细胞置入四孔板中,于培养箱中固定30 min。然后将卵母细胞放入加有洗脱缓冲液的四孔板中于培养箱内封闭2 h。再用β-tubulin(按照1∶1000的体积比稀释)或P-H2A.X(按照1∶200的体积比稀释) 4 ℃条件下孵育过夜。次日用洗脱缓冲液洗涤3次,每次10 min。然后与FITC偶联山羊抗鼠IgG(按照1∶100的体积比稀释)在37 ℃条件下孵育1 h。之后,避光环境下用洗脱缓冲液洗涤3次,每次10 min。用Hoechst 33342室温下进行DNA染色5 min。最后,将卵母细胞固定在载玻片上,并在荧光显微镜下观察和拍照。
1.3 统计分析每组试验重复5次,用SPSS 23.0进行单因素方差分析,采用LSD法进行多重比较分析,数据结果以平均值±标准误表示,作图软件为GraphPad 8。
2 结果与分析 2.1 灌服PFOA抑制小鼠卵母细胞体外成熟与对照组相比,每日灌服不同剂量(5、10和20 mg/kg)PFOA小鼠的卵母细胞成熟率有明显下降(表1)。10和20 mg/kg剂量组小鼠的卵母细胞成熟率分别下降了14.28%和28.17%;5 mg/kg剂量组和对照组差异不显著(P>0.05),10 mg/kg组和对照组差异显著(P<0.05),20 mg/kg组和对照组差异极显著(P<0.01)。5、10和20 mg/kg组别之间两两相比差异显著(P<0.05)。
|
|
表 1 PFOA对小鼠卵母细胞成熟率的影响 Table 1 Effect of PFOA on maturation of mouse oocytes |
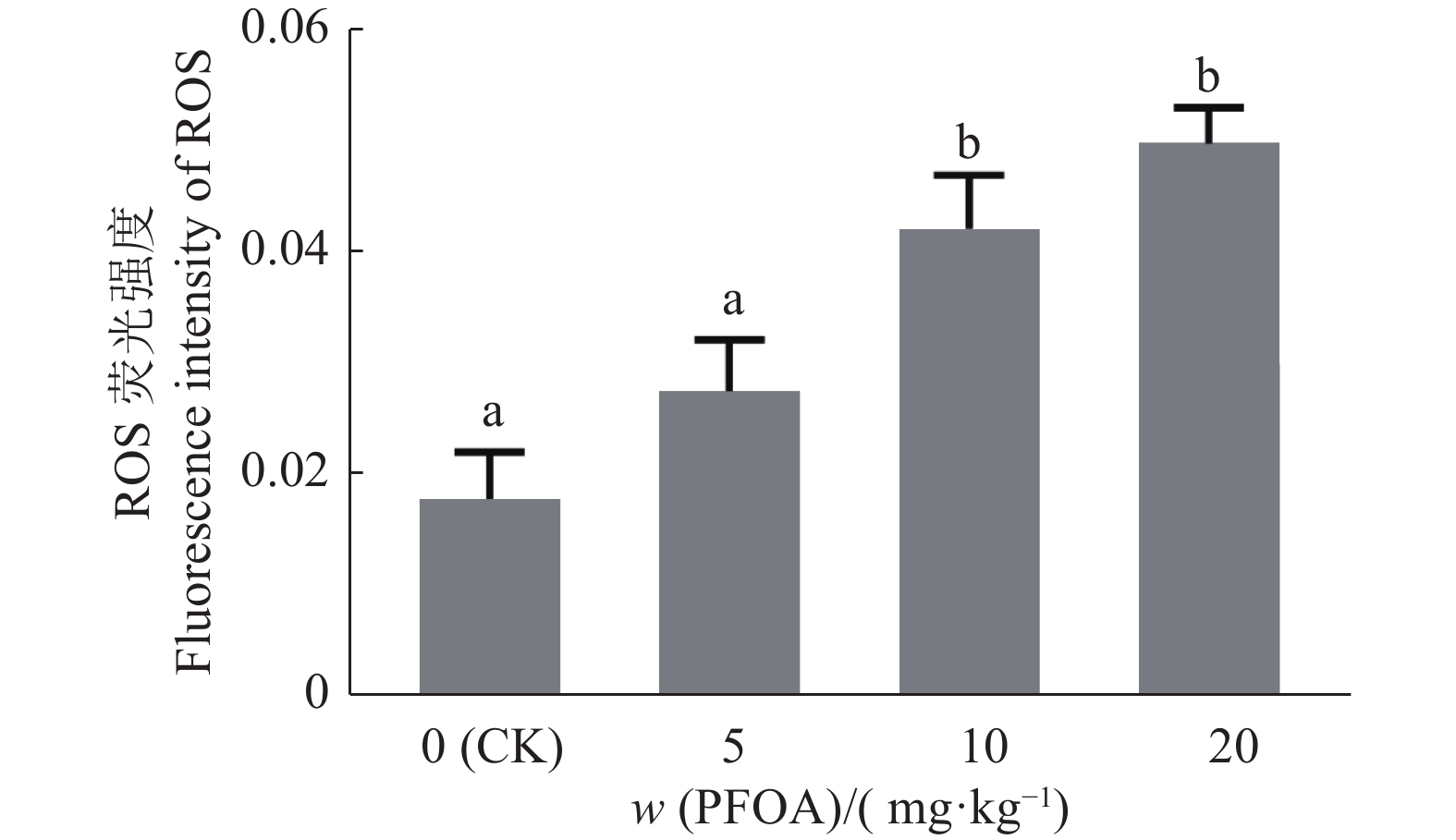
与对照组相比,每日灌服不同剂量PFOA小鼠的卵母细胞内ROS含量有明显升高(图1)。10和20 mg/kg组中卵母细胞内ROS含量分别升高了135%和177%;5 mg/kg组和对照组差异不显著(P>0.05),10和20 mg/kg组与对照组相比差异显著(P<0.05),10与20 mg/kg组之间差异不显著(P>0.05)(图2)。
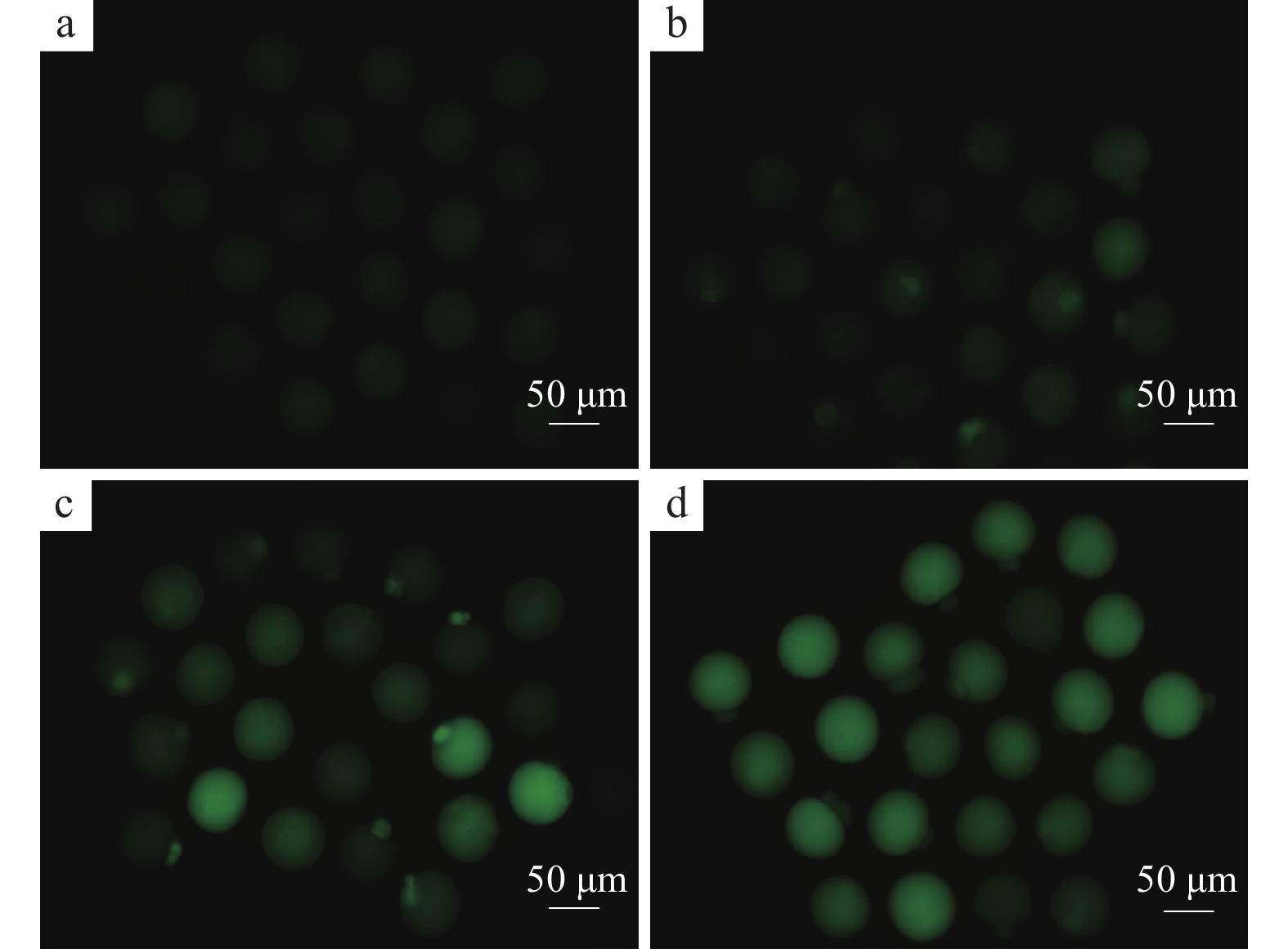
|
图 1 不同剂量 PFOA暴露的卵母细胞内活性氧(ROS)荧光图像 Fig. 1 Fluorescence images of reactive oxygen species (ROS) in oocytes exposed to different doses of PFOA a: 0 (CK);b: 5 mg/kg;c: 10 mg/kg;d: 20 mg/kg |
|
图 2 不同剂量 PFOA暴露的卵母细胞内活性氧(ROS)荧光强度 Fig. 2 The fluorescence intensities of reactive oxygen species (ROS) in oocytes exposed to different doses of PFOA 柱子上方的不同小写字母表示差异显著(P<0.05, LSD法) Different lowercase letters on bars indicate significant differences(P< 0.05, LSD method) |
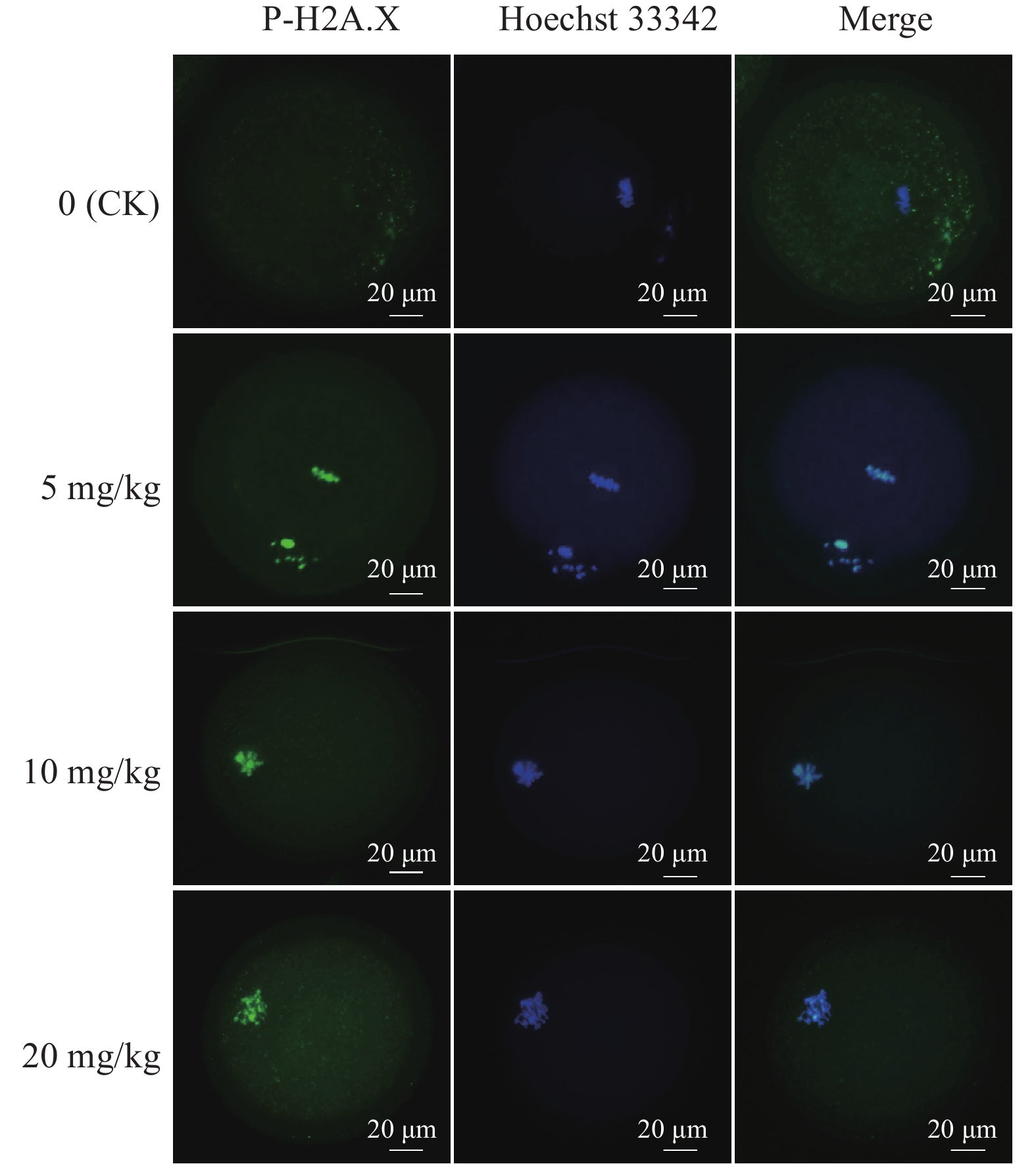
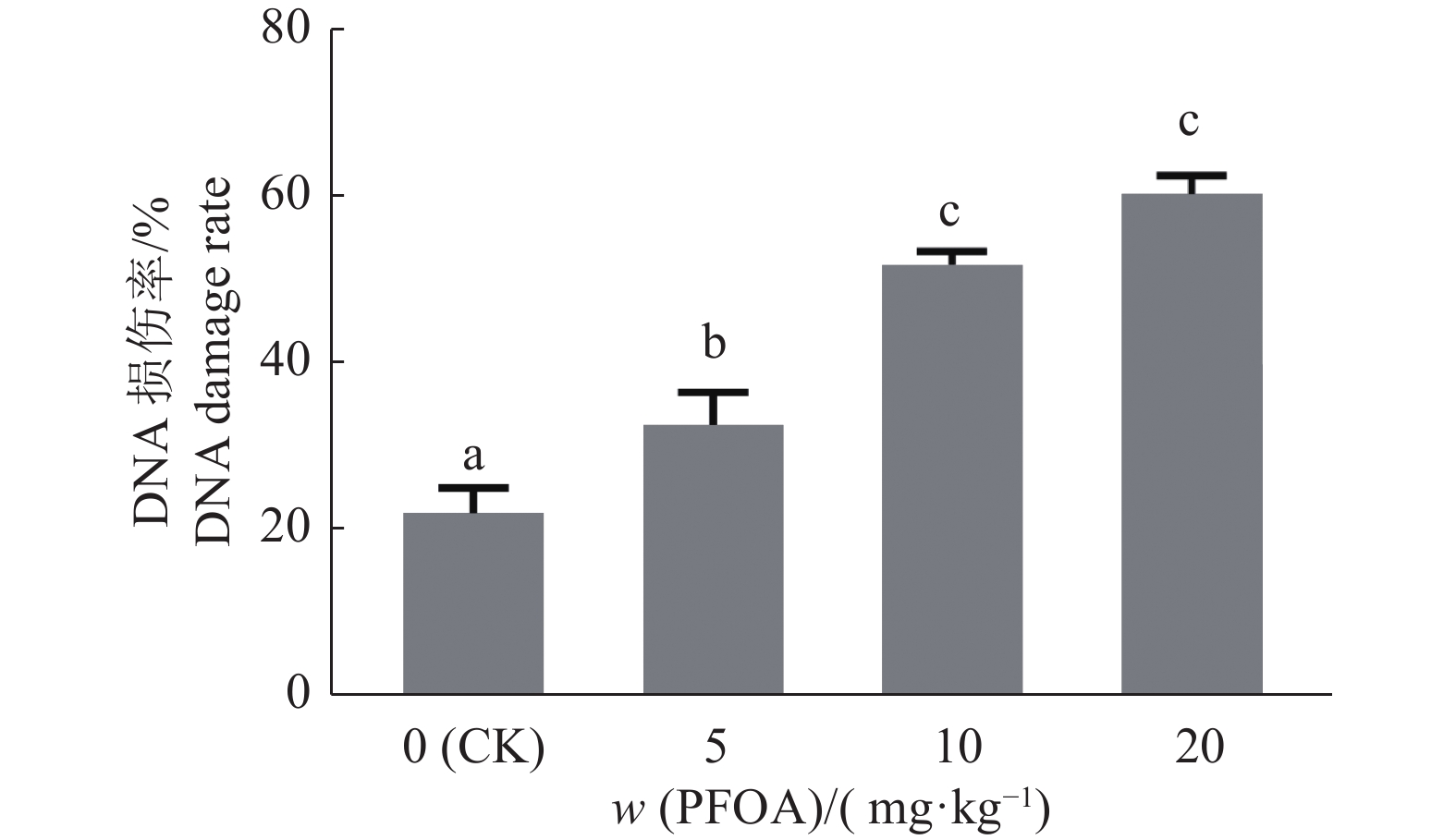
每日灌服不同剂量PFOA的小鼠卵母细胞P-H2A.X免疫荧光结果显示,细胞内DNA损伤情况有明显升高(图3)。其中,5、10和20 mg/kg组P-H2A.X 比例分别比对照组升高了47%、133%和171%。5 mg/kg组与对照组差异显著(P<0.05),10、20 mg/kg组与对照组相比差异极显著(P<0.01),10和20 mg/kg组之间差异不显著(P>0.05)(图4)。
|
图 3 不同剂量PFOA暴露的卵母细胞内P-H2A.X荧光图像 Fig. 3 Fluorescence images of P-H2A.X in oocytes exposed to different doses of PFOA |
|
图 4 不同剂量PFOA暴露的卵母细胞DNA损伤比例 Fig. 4 DNA damage rates of oocytes exposed to different doses of PFOA 柱子上方的不同小写字母表示差异显著(P<0.05, LSD法) Different lowercase letters on bars indicate significant differences (P< 0.05, LSD method) |
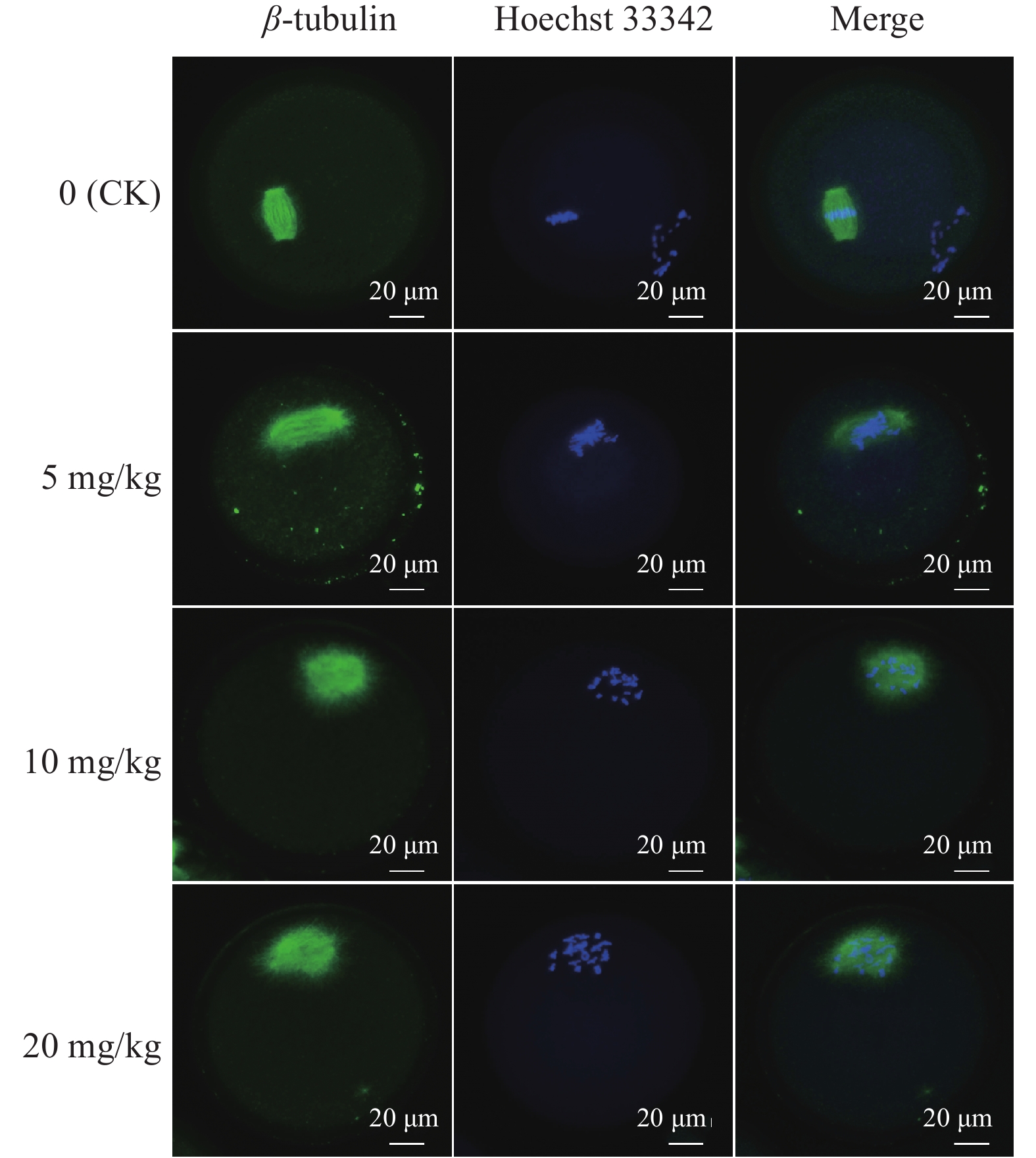
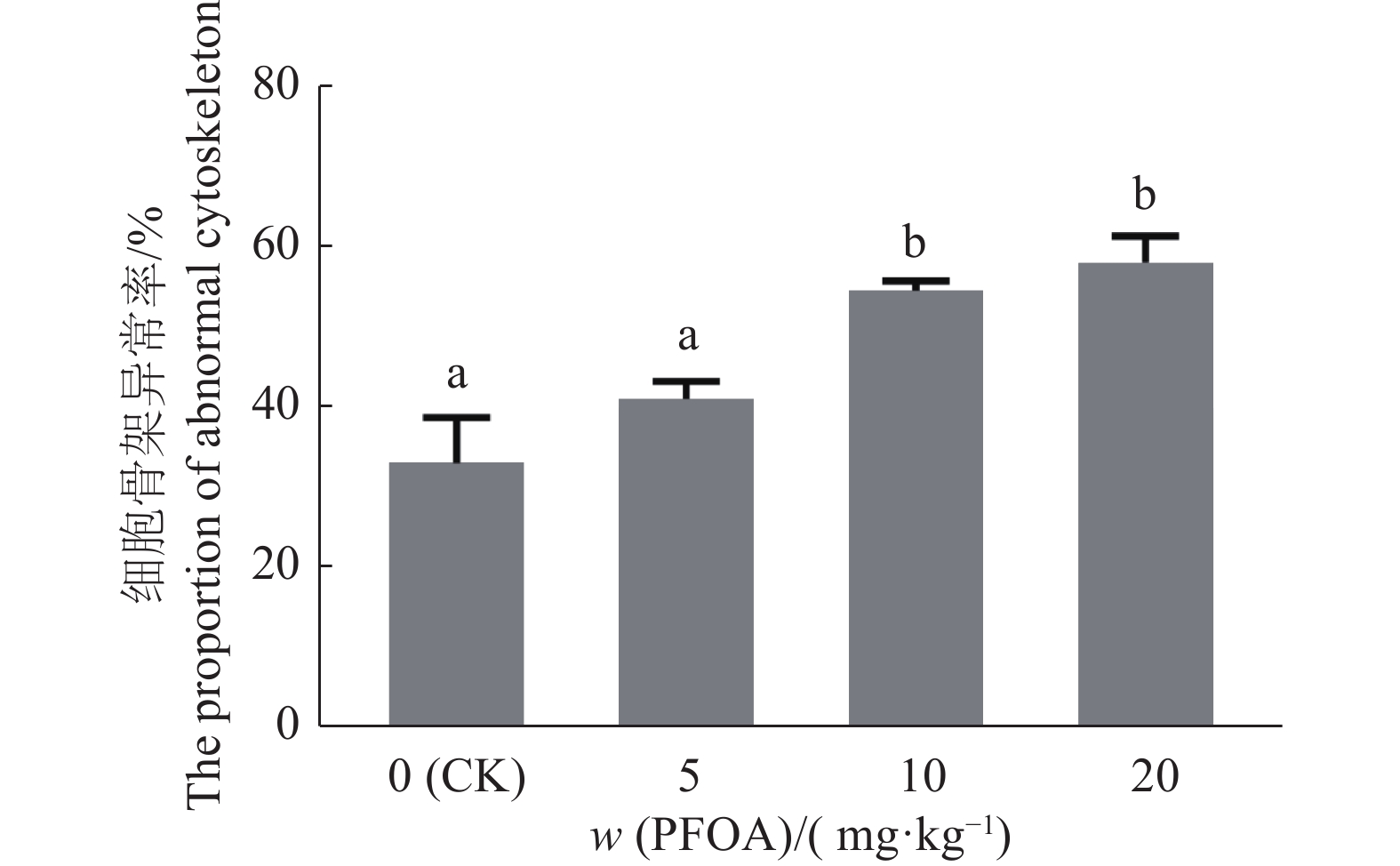
每日灌服不同剂量PFOA的小鼠卵母细胞β-tubulin、Hoechst 33342免疫荧光结果显示,细胞内纺锤体形态和染色体排列有明显异常(图5),且与PFOA剂量呈正相关。与对照组相比,10和20 mg/kg组中卵母细胞β-tubulin形态异常,染色体非整齐排列的比例分别升高了65.06%和75.60%。5 mg/kg组与对照组差异不显著(P>0.05),10、20 mg/kg组与对照组相比均差异显著(P<0.05),10和20 mg/kg组之间差异不显著(P>0.05)(图6)。
|
图 5 不同剂量PFOA暴露的卵母细胞骨架荧光图像 Fig. 5 Fluorescence images of cytoskeleton of oocytes exposed to different doses of PFOA |
|
图 6 不同剂量PFOA暴露的卵母细胞骨架异常比例 Fig. 6 The proportions of abnormal cytoskeleton in oocytes exposed to different doses of PFOA 柱子上方的不同小写字母表示差异显著(P<0.05, LSD法) Different lowercase letters on bars indicate significant differences (P< 0.05, LSD method) |
近年来,人们对环境污染物的关注度越来越高。PFOA作为一种稳定的有机化合物给工业和制造业带来便利的同时也带来了诸多“副作用”。PFOA在环境中持久存在,使得人类或动物很容易受到污染。饮食、饮水是人类暴露PFOA的主要途径。本试验通过给小鼠灌服PFOA模拟人类的暴露途径,观察PFOA对雌性哺乳动物的生殖毒性。结果证实了PFOA可通过氧化应激、DNA损伤和细胞骨架受损降低卵母细胞成熟率以及成熟质量。
ROS是细胞代谢的天然副产物,对细胞信号转导、稳态调节有着重要作用。当ROS的产生和中和不平衡时就会引起氧化应激。过量的ROS会导致脂质过氧化、蛋白降解、DNA损伤等[15]。研究发现,环境污染物和毒素往往会增加细胞内ROS的产生,最终诱导细胞内氧化应激并发挥毒性[16]。已有研究表明PFOA可引起小鼠卵巢内ROS升高,且呈剂量依赖性[15]。为了研究PFOA对卵母细胞发育能力的影响,我们检测了细胞内ROS水平,发现PFOA可显著增加细胞内ROS含量,诱导氧化应激,进而抑制卵母细胞发育,且剂量越高,氧化应激越强。
据报道,ROS相关氧化应激可诱导DNA损伤[17]。P-H2A.X被用作鉴定DNA损伤,在细胞发生DNA双链断裂的数分钟内,H2AX的139位丝氨酸残基被ATM、ATR、PRKC基因磷酸化形成P-H2A.X。因此,P-H2A.X的出现与DNA双链断裂紧密关联,故其可作为DNA双链断裂的标志物[18]。已有研究报道毒性化学制剂可诱导细胞DNA损伤,如双酚AF(Bisphenol AF)通过增加氧化应激和DNA损伤对小鼠卵母细胞体外成熟产生负面影响,对羟基苯甲酸丁酯(Butylparaben)通过DNA损伤抑制猪卵母细胞的体外成熟[19-20]。于是我们猜测,PFOA暴露会诱导卵母细胞DNA双链断裂。试验结果也证实了我们的猜想,PFOA处理组的P-H2A.X阳性卵母细胞比例显著高于对照组,提示PFOA暴露可通过诱导DNA双链断裂来抑制卵母细胞的成熟。
在减数分裂进程中,染色体的正确分离主要取决于染色体−微管的稳定连接。纺锤体微管的形态异常引起染色体的错误分离,导致卵母细胞和进一步胚胎发育过程中产生异倍体和基因组的不稳定现象。研究发现越来越多的环境毒素与纺锤体形态异常、染色体分裂错误有关。研究报道双酚A替代物双酚芴可引起卵母细胞骨架受损[21];邻苯二甲酸单酯能够干扰减数分裂过程中染色体分离和配子形成[22]。本研究中,PFOA处理后的卵母细胞有很大比例出现纺锤体异常和染色体错位。微管、肌动蛋白丝和染色质相互作用完成染色体分离,建立细胞不对称[23−24]。β-tublin在PFOA处理的卵母细胞中的异常定位是纺锤体缺陷的原因之一。纺锤体缺陷导致异常的染色体排列。因此,本文结果表明,PFOA暴露可通过诱导纺锤体缺陷和染色体排列异常进而抑制卵母细胞的成熟。这些发现有助于提高人们对PFOA生殖毒性的认识,为今后的研究提供参考依据。未来可以对PFOA损伤哺乳动物卵母细胞的分子机制做进一步研究。
综上所述,本研究评估了PFOA体内暴露对小鼠卵母细胞的影响,结果表明PFOA暴露会通过诱导ROS生成、DNA损伤、纺锤体形态发育缺陷、染色体排列异常等途径影响卵母细胞成熟率及成熟质量。
| [1] |
GIESY J P, KANNAN K, JONES P D. Global biomonitoring of perfluorinated organics[J]. Scientific WorldJournal, 2001, 1: 627-629. DOI:10.1100/tsw.2001.342 (  0) 0) |
| [2] |
KOSKELA A, FINNILA M A, KORKALAINEN M, et al. Effects of developmental exposure to perfluorooctanoic acid (PFOA) on long bone morphology and bone cell differentiation[J]. Toxicology and Applied Pharmacology, 2016, 301: 14-21. DOI:10.1016/j.taap.2016.04.002 (  0) 0) |
| [3] |
FROMME H, TITTLEMIER S A, VOLKEL W, et al. Perfluorinated compounds: Exposure assessment for the general population in Western countries[J]. International Journal of Hygiene & Environmental Health, 2009, 212(3): 239-270. (  0) 0) |
| [4] |
夏慧, 敖俊杰, 袁涛. 室内灰尘中全氟化合物的污染状况与人体暴露水平评估[J]. 生态毒理学报, 2016, 11(2): 223-230. (  0) 0) |
| [5] |
杜国勇, 蒋小萍, 卓丽, 等. 长江流域重庆段水体中全氟化合物的污染特征及风险评价[J]. 生态环境学报, 2019, 28(11): 2266-2272. (  0) 0) |
| [6] |
陈诗艳, 仇雁翎, 朱志良, 等. 土壤中全氟和多氟烷基化合物的污染现状及环境行为[J]. 环境科学研究, 2021, 34(2): 468-478. (  0) 0) |
| [7] |
JOGSTEN I E, PERELLO G, LLEBARIA X, et al. Exposure to perfluorinated compounds in Catalonia, Spain, through consumption of various raw and cooked foodstuffs, including packaged food[J]. Food and chemical toxicology, 2009, 47(7): 1577-1583. DOI:10.1016/j.fct.2009.04.004 (  0) 0) |
| [8] |
BACH C C, VESTED A, JORGENSEN K T, et al. Perfluoroalkyl and polyfluoroalkyl substances and measures of human fertility: A systematic review[J]. CRC Critical Reviews in Toxicology, 2016, 46(9): 735-755. DOI:10.1080/10408444.2016.1182117 (  0) 0) |
| [9] |
ZHANG S, TAN R, PAN R, et al. Association of perfluoroalkyl and polyfluoroalkyl substances with premature ovarian insufficiency in Chinese women[J]. The Journal of Clinical Endocrinology and Metabolism, 2018, 103(7): 2543-2551. DOI:10.1210/jc.2017-02783 (  0) 0) |
| [10] |
CHEN Y, ZHOU L, XU J, et al. Maternal exposure to perfluorooctanoic acid inhibits luteal function via oxidative stress and apoptosis in pregnant mice[J]. Reproductive Toxicology, 2017, 69: 159-166. DOI:10.1016/j.reprotox.2017.02.010 (  0) 0) |
| [11] |
DU G, HU J, HUANG Z, et al. Neonatal and juvenile exposure to perfluorooctanoate (PFOA) and perfluorooctane sulfonate (PFOS): Advance puberty onset and kisspeptin system disturbance in female rats[J]. Ecotoxicology and Environmental Safety, 2019, 167: 412-421. DOI:10.1016/j.ecoenv.2018.10.025 (  0) 0) |
| [12] |
KANG Q, GAO F, ZHANG X, et al. Nontargeted identification of per- and polyfluoroalkyl substances in human follicular fluid and their blood-follicle transfer[J]. Environment International, 2020, 139: 105686. DOI:10.1016/j.envint.2020.105686 (  0) 0) |
| [13] |
RASHID F, RAMAKRISHNAN A, FIELDS C, et al. Acute PFOA exposure promotes epigenomic alterations in mouse kidney tissues[J]. Toxicology Reports, 2020, 7: 125-132. DOI:10.1016/j.toxrep.2019.12.010 (  0) 0) |
| [14] |
XU W, LI L, SUN J, et al. Putrescine delays postovulatory aging of mouse oocytes by upregulating PDK4 expression and improving mitochondrial activity[J]. Aging (Albany NY), 2018, 10(12): 4093-4106. (  0) 0) |
| [15] |
LOPEZ-ARELLANO P, LOPEZ-ARELLANO K, LUNA J, et al. Perfluorooctanoic acid disrupts gap junction intercellular communication and induces reactive oxygen species formation and apoptosis in mouse ovaries[J]. Environmental Toxicology, 2019, 34(1): 92-98. DOI:10.1002/tox.22661 (  0) 0) |
| [16] |
YANG L L, ZHAO Y, LUO S M, et al. Toxic effects and possible mechanisms of hydrogen sulfide and/or ammonia on porcine oocyte maturation in vitro[J]. Toxicology Letters, 2018, 285: 20-26. DOI:10.1016/j.toxlet.2017.12.019 (  0) 0) |
| [17] |
YU Y, CUI Y, NIEDERNHOFER L J, et al. Occurrence, biological consequences, and human health relevance of oxidative stress-induced DNA damage[J]. Chemical Research in Toxicology, 2016, 29(12): 2008-2039. DOI:10.1021/acs.chemrestox.6b00265 (  0) 0) |
| [18] |
DING Z M, ZHANG S X, JIAO X F, et al. Doxorubicin exposure affects oocyte meiotic maturation through DNAdamage induced meiotic arrest[J]. Toxicological Sciences, 2019, 171(2): 359-368. (  0) 0) |
| [19] |
DING Z M, JIAO X F, WU D, et al. Bisphenol AF negatively affects oocyte maturation of mouse in vitro through increasing oxidative stress and DNA damage[J]. Chemico-Biological Interactions, 2017, 278: 222-229. DOI:10.1016/j.cbi.2017.10.030 (  0) 0) |
| [20] |
JEONG P S, LEE S, PARK S H, et al. Butylparaben is toxic to porcine oocyte maturation and subsequent embryonic development following in vitro fertilization[J]. International Journal of Molecular Sciences, 2020, 21(10): 3692. DOI:10.3390/ijms21103692 (  0) 0) |
| [21] |
JIAO X, DING Z, MENG F, et al. The toxic effects of Fluorene-9-bisphenol on porcine oocyte in vitro maturation[J]. Environmental Toxicology, 2020, 35(2): 152-158. DOI:10.1002/tox.22851 (  0) 0) |
| [22] |
TRANFO G, CAPOROSSI L, PACI E, et al. Urinary phthalate monoesters concentration in couples with infertility problems[J]. Toxicology Letters, 2012, 213(1): 15-20. DOI:10.1016/j.toxlet.2011.11.033 (  0) 0) |
| [23] |
BENNABI I, TERRET M E, VERLHAC M H. Meiotic spindle assembly and chromosome segregation in oocytes[J]. Journal of Cell Biology, 2016, 215(5): 611-619. DOI:10.1083/jcb.201607062 (  0) 0) |
| [24] |
AZOURY J, VERLHAC M H, DUMONT J. Actin filaments: Key players in the control of asymmetric divisions in mouse oocytes[J]. Biology of the Cell, 2009, 101(2): 69-76. DOI:10.1042/BC20080003 (  0) 0) |
 2022, Vol. 43
2022, Vol. 43


