土壤退化原因中,盐渍化作为最严重类型之一,已成为全世界关注的主要焦点,据估计约有9.32亿hm2土壤受到盐的毒害[1]。目前,全中国盐渍土面积已达9900多万 hm2,其中未被利用的约占80%[2]。受盐胁迫影响,植物通常会表现出生长指标、细胞膜透性、渗透调节物质、酶活性和光合作用的不利变化[3]。因此,土壤盐渍化导致可使用农田的大量减少,严重影响了我国农业经济的发展[4]。近年来,随着农业化肥和农药利用率的增加,土壤不仅受到盐毒害作用,同时也伴随着重金属污染的影响[5]。而重金属难降解的特性也造成其不断在土壤中累积,导致土壤质量恶化。在重金属污染盐渍化土壤中,盐分可显著影响重金属的移动性等环境行为,从而对其生物有效性造成影响,增加其潜在的环境风险[6]。因此,重金属污染盐渍化土壤的修复研究是提高我国农业可持续发展的重中之重。
丛枝菌根(Arbuscular mycorrhizal,AM)真菌在自然界中普遍存在,是一种能与80%~90%的维管植物和90%的农业作物共生的微生物,可显著提高植物抵抗非生物胁迫的能力[7]。盐胁迫下的AM真菌表现出水分和矿质营养元素吸收的促进作用,提高抗氧化酶防御系统,改善光合作用,促进植物生长[8]。AM共生植物能够控制Na+向地上部的转移,并调节内部的Na+浓度。这是由于AM真菌在分子结构上调控了植物的自噬、内吞和转运体的作用,从而能够将Na+隔离到液泡中或将其从细胞质和光合组织中转移出去,减少了Na+的吸收,降低了Na+的毒害作用[9-10]。同时,AM真菌可通过改善植物的生长来促进Na+的积累,进而达到了修复盐渍化土壤的目的。在重金属胁迫下,AM真菌减轻重金属毒性取决于植物种类、生长条件、重金属类型及其浓度[11]。AM共生植物的菌根菌丝体扩大了与土壤的接触位点,并通过菌丝体表面的吸附作用将重金属固定在菌丝上,降低了重金属的吸收[12-13]。重金属的选择性分布也可能是提高植物重金属耐受性的一种重要策略,例如镉(Cd)的细胞壁分布被认为是植物对重金属抗性的机制之一,而AM真菌可通过改变植物中重金属的亚细胞区域化和化学形式来帮助植物形成更好的耐受性[14]。研究显示,盐生植物更具有较强的盐和重金属的耐受性[15]。Zhou等[16]在盐生植物海滨锦葵Kosteletzkya pentacarpos对重金属污染盐渍化土壤响应研究中发现,盐度增加了植物对Cd和Zn的去除比例。Zhang等[17]研究发现,0.3%(w)的NaCl可通过减缓光合作用和刺激盐地碱蓬的抗氧化酶,显著减轻Cd的毒性。迄今为止,国内外关于AM真菌对盐生植物吸收积累盐分和重金属影响的研究还较少,AM真菌与盐生植物共生的联合修复潜力亦尚不清楚。因此,开展此方面的研究对我国重金属污染盐渍化土壤的联合修复治理具有非常重要的意义和实践运用价值。
盐生植物小果白刺Nitraria sibirica Pall.又名西伯利亚白刺,广泛分布于我国西北、华北及东部沿海盐碱地,表现出较强的耐盐耐旱能力。它是典型的盐生植物,具有较强的耐盐性和环境适应性[18]。小果白刺可通过其密集的根系吸收地下水分,进而造成地下水位降低;同时枝叶通过对地面的覆盖和自身蒸腾作用有效地防止了土壤水分的散失,抑制了土壤盐分的上升,从而起到盐碱化土壤改良的作用[19]。本研究采用盆栽试验法,模拟不同程度的Cd污染NaCl型土壤,研究接种AM真菌Funneliformis mosseae对重金属污染盐渍化土壤中小果白刺生长、元素吸收、离子平衡、钠和镉吸收积累的影响,探索AM真菌与小果白刺联合修复重金属污染盐渍化土壤的潜力,旨在为微生物−植物联合修复重金属污染盐渍化土壤提供理论依据和数据支持。
1 材料与方法 1.1 供试基质、植物和菌种供试的土壤采自内蒙古呼和浩特市绿植区非盐渍化土壤,采样深度为0~20 cm,取表层土壤,经测定,土壤pH为7.44, 土壤中含0.084 mg·kg−1重金属Cd、13.9 g·kg−1有机质、0.79 g·kg−1总氮、0.73 g·kg−1总磷、18.25 g·kg−1总钾、40.5 mg·kg−1有效氮、3.93 mg·kg−1有效磷、76.0 mg·kg−1速效钾。土壤自然风干后破碎过筛(2 mm),参照我国土壤环境质量农用地土壤污染风险管控标准(试行)(GB 15618—2018)[20],并根据自然环境下重金属盐渍化土壤中的盐分和Cd含量范围[21],通过添加一定体积的氯化镉(CdCl2·2.5H2O)溶液和NaCl溶液使得土壤中Cd质量分数分别达到0、2、5 mg·kg−1(以干土计),Na+质量分数分别达到0、1.5 g·kg−1(以干土计),以模拟不同程度Cd污染NaCl型盐渍化土壤。将混合均匀的土壤在室温条件下保持80%的田间最大持水量,进行1个月的平衡老化,随后高压蒸汽灭菌2 h(121 ℃)后自然风干备用。
本研究选取小果白刺作为供试植物,将种子进行蒸馏水浸泡并搓去种皮,经质量分数为10%的H2O2溶液浸泡消毒10 min后,用蒸馏水冲洗后保持潮湿状态,催芽2~3 d。选取AM真菌中的摩西球囊霉(BGC NM02A,1511C0001BGCAM0045)作为供试菌种,由北京农林科学院提供,以玉米和白三叶草为宿主植物在砂、土质量比1∶1的灭菌土壤中扩繁得到的内含菌丝、真菌孢子和植物根段等繁殖体的根际砂土混合物作为接种菌剂。
1.2 试验设计试验模拟6种Cd污染NaCl型土壤基质,包括3个Cd处理水平(0、2、5 mg·kg−1,Cd0、Cd2、Cd5)和2个NaCl处理水平(0、1.5 g·kg−1,Na0、Na1.5),分别表示为Cd0Na0、Cd0Na1.5、Cd2Na0、Cd2Na1.5、Cd5Na0、Ca5Na1.5,同时设对照CK和接种AM真菌F. mosseae 2种处理,共12个处理,设重复4次(共48盆),随机排列。培养容器为圆形花盆(上径15.5 cm×下径11.5 cm×高13.5 cm),内置消毒塑料自封袋,单盆土壤基质2 kg,接种处理加菌剂50 g,对照处理加灭菌后菌剂50 g,充分混匀。每盆播种催芽处理后的小果白刺种子15颗,发芽后待生长40 d后对其进行间苗,选取长势相近的植株保留6株。试验期间自然采光,定时补水以维持80%的田间最大持水量。植物出芽后,待其生长16周收获。
1.3 样品制备与分析测定植物收获时,将剪下的完整的地上部和根系样品用自来水冲洗至干净,再用蒸馏水冲洗3次,65 ℃烘干至恒质量并称质量,通过计算记录每种处理平均每盆质量。随机选取约0.5 g新鲜的根,冲洗干净后先用质量分数为10%的KOH溶液进行脱色处理,再用质量分数为0.05%的台盼蓝在乳酸、甘油体积比为1∶1的溶液中对根进行染色,染色结束后将染色剂冲洗干净并制片保存,利用根段频率法测定菌根侵染率。
将烘干样品通过粉碎机粉碎后,称取约25 mg地上部和根部样品,利用元素分析仪(Vario ELⅢ,CHNOS Elemental Analyzer,Elemental Co,Germany)测定N元素含量。称取约0.5 g粉碎后的地上部和根部样品,加入5 mL BV(III)级HNO3在120 ℃开放式消解待测。分别使用电感耦合等离子体发射光谱仪(ICP-OES,Optima 7000DV,PerkinElmer,USA)和电感耦合等离子体质谱仪(ICP-MS,Optima 3300DV,PerkinElmer,USA)测定待测溶液中的P、K、Ca、Mg、Na含量和重金属Cd含量,并计算得出每种处理平均每盆积累量。
1.4 数据分析试验测得所有指标数据均使用Excel 2016计算均值和标准误差,使用Origin 2017绘图软件制图,用SPSS 25.0软件进行统计分析,Duncan's新复极差检验法检验差异显著性,呈现非正态分布的数据(菌根侵染率)经过反正弦转换后再用同样的方法进行分析。利用多因素方差分析盐分、重金属和接种作用及三者交互作用对相关测定指标的影响。
2 结果与分析 2.1 菌根侵染率和生物量分析在Cd污染NaCl型土壤中,菌根侵染率和生物量的数据分析结果如图1所示。对照组根系均未观察到菌根侵染,接种组植物均与真菌建立共生关系,菌根侵染率为12.68%~21.90%。与Cd0Na0相比,1.5 g·kg−1NaCl使得植物的菌根侵染率降低了6.63%;与Cd5Na0相比,1.5 g·kg−1NaCl使得植物的菌根侵染率降低了7.31%;与Cd0Na0和Cd5Na0相比,Cd2Na0处理使得菌根侵染率分别降低42.10%和40.33%。与Cd2Na0相比,Cd5Na0处理显著降低了小果白刺地上部干质量;所有处理与不接种CK相比,接种处理使地上部、根部和总干质量分别增加了77.78%~191.55%、133.33%~342.86%和101.35%~215.29%。多因素分析结果显示,NaCl和Cd交互作用对侵染率具有显著影响(P<0.05),NaCl和接种的交互作用以及Cd和接种的交互作用对侵染率具有极显著影响(P<0.01),NaCl、Cd和接种三因素共同作用对侵染率具有显著影响(P<0.05)。
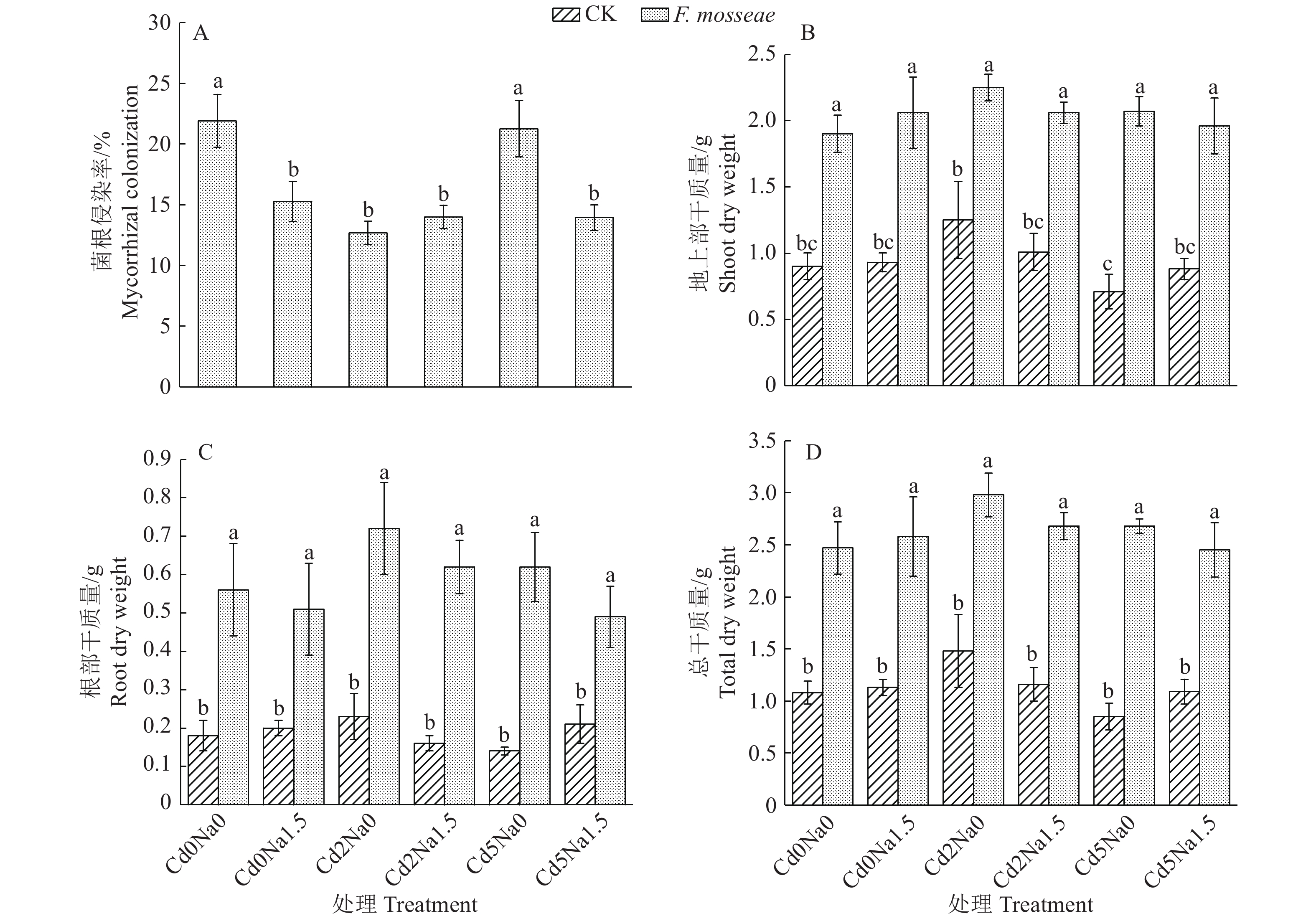
|
图 1 Funneliformis mosseae处理对Cd污染NaCl型土壤中菌根侵染率和生物量的影响 Fig. 1 Effects of Funneliformis mosseae treatment on mycorrhizal infection rate and biomass in Cd-contaminated NaCl type soil 各图中,柱子上方的不同小写字母表示处理间差异显著(P<0.05,Duncan’s法) In each figure,different lowercase letters on bars indicate significant differences among treatments (P<0.05, Duncan’s test) |
Cd污染NaCl型土壤中植物N、P、K、Ca和Mg吸收积累的数据分析结果如图2所示。在不接种处理组,与Cd0Na0相比,Cd2Na0处理显著增加了地上部N的积累量;与Cd2Na0相比,Cd5Na0处理显著降低了地上部和根部N的积累量。在接种处理组,与Cd0Na0和Cd5Na0相比,Cd2Na0处理显著增加了根部N的积累量;Cd2Na1.5与Cd2Na0和Cd5Na1.5与Cd5Na0相比,均显著降低了根部N的积累量;与Cd0Na0相比,Cd2Na0处理显著增加了根部K的积累量。与不接种CK相比,接种AM真菌仅对Cd2Na0处理地上部N积累量无显著影响,使得其他处理地上部N、P、K、Ca和Mg的积累量分别增加53.57%~89.99%、68.92%~216.50%、64.74%~128.23%、47.55%~125.89%和55.87%~164.09%。与不接种CK相比,接种AM真菌使得所有处理根部N和K积累量分别增加了123.73%~516.60%和135.16%~362.10%;除Cd5Na1.5处理外,AM真菌使得其他处理根部P积累量增加了189.36%~855.56%;除Cd0Na1.5和Cd5Na1.5处理外,AM真菌使得其他处理根部Ca积累量增加了189.81%~270.55%;AM真菌使得Cd2Na0和Cd5Na0处理根部Mg积累量分别增加了196.97%和450.00%。多因素分析结果显示,NaCl和接种交互作用对根部N积累量具有极显著影响(P<0.01)。
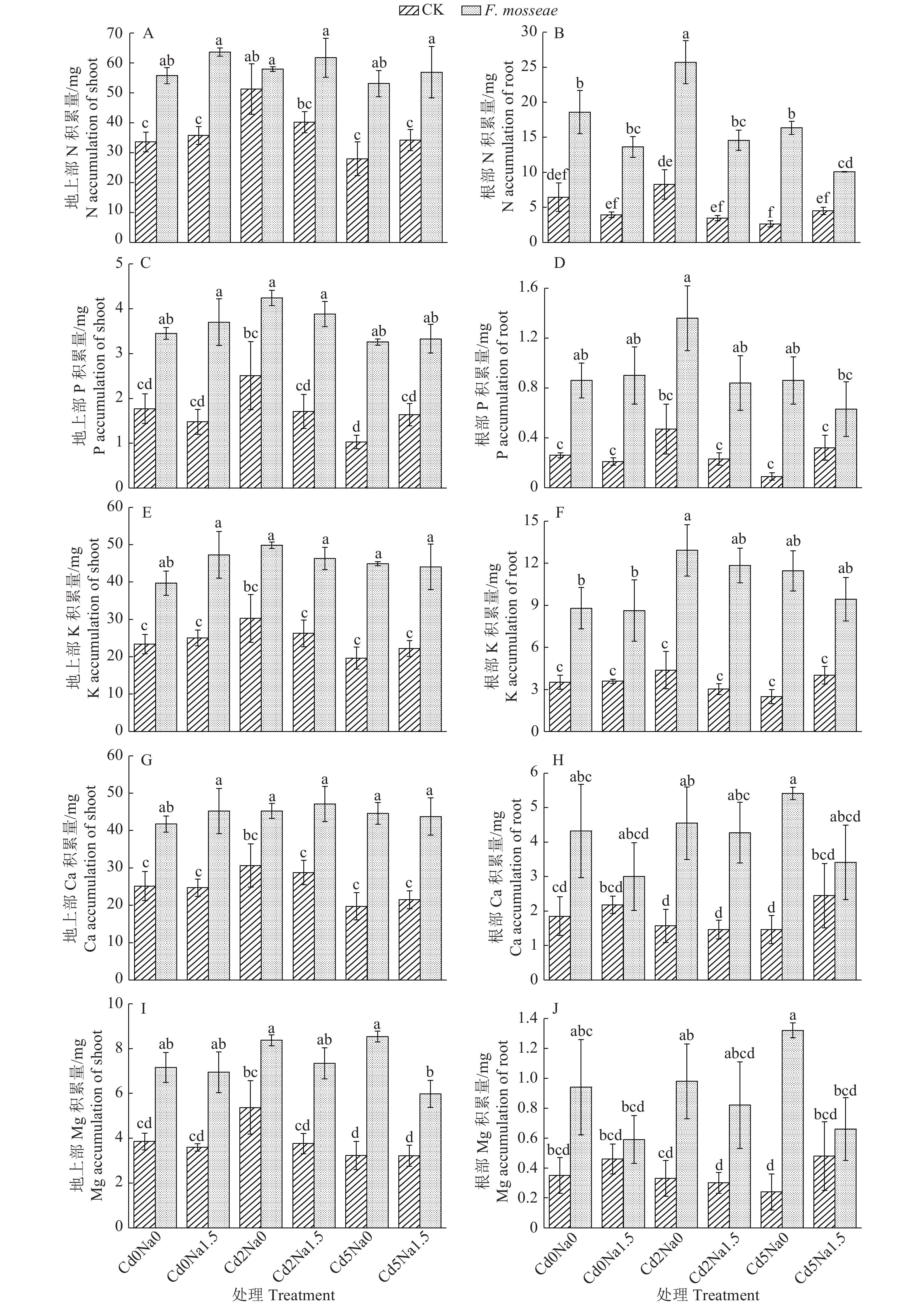
|
图 2 Funneliformis mosseae处理对Cd污染NaCl型土壤中地上部和根部N、P、K、Ca和Mg含量的影响 Fig. 2 Effects of Funneliformis mosseae treatment on the contents of N, P, K, Ca and Mg of shoot and root in Cd-contaminated NaCl type soil 各图中,柱子上方的不同小写字母表示处理间差异显著(P<0.05,Duncan’s法) In each figure,different lowercase letters on bars indicate significant differences among treatments (P<0.05, Duncan’s test) |
Cd污染NaCl型土壤中植物Na+吸收的数据分析结果如图3所示。随着土壤中Na+含量的增加小果白刺地上部和根部Na+含量和积累量均呈现逐渐增加的趋势。在不接种处理组,与Cd0Na1.5和Cd2Na1.5相比,Cd5Na1.5处理显著增加了地上部Na+含量。在接种处理组,与Cd0Na1.5相比,Cd2Na1.5和Cd5Na1.5处理显著增加了地上部Na+含量;与Cd0Na0和Cd5Na0相比,Cd2Na0处理显著增加了根部Na+的积累量。与不接种CK相比,接种AM真菌显著降低了所有处理地上部和根部Na+的含量,同时显著增加了所有处理根部Na+积累量。
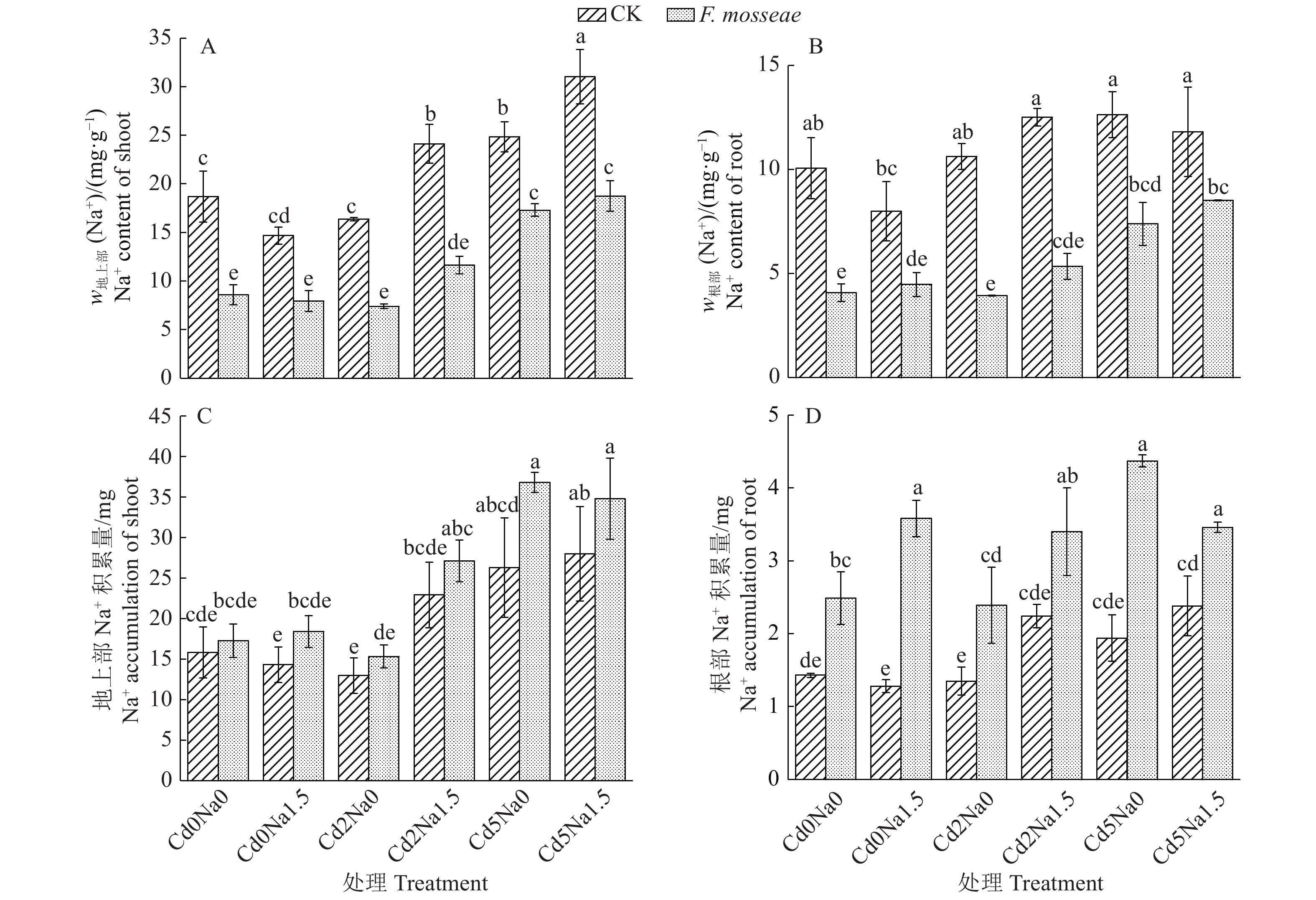
|
图 3 Funneliformis mosseae处理对Cd污染NaCl型土壤中地上部和根部Na+含量和积累量的影响 Fig. 3 Effects of Funneliformis mosseae treatment on Na+ content and accumulation of shoot and root in Cd-contaminated NaCl type soil 各图中,柱子上方的不同小写字母表示处理间差异显著(P<0.05,Duncan’s法) In each figure,different lowercase letters on bars indicate significant differences among treatments (P<0.05, Duncan’s test) |
Cd污染NaCl型土壤中植物Cd吸收的数据分析结果如图4所示。随着土壤中Cd含量的增加小果白刺地上部和根部Cd含量和积累量均呈现逐渐增加的趋势。在不接种处理组,与Cd2Na0和Cd5Na0相比,Cd2Na1.5和Cd5Na1.5处理显著增加了地上部和根部Cd含量;与Cd5Na0相比,Cd5Na1.5处理显著增加了根部Cd积累量。在接种处理组,与Cd5Na0相比,Cd5Na1.5处理显著增加了根部Cd含量和Cd积累量。与不接种CK相比,接种处理显著降低了Cd2Na0、Cd2Na1.5、Cd5Na0和Cd5Na1.5处理的地上部Cd含量以及Cd2Na1.5、Cd5Na0和Cd5Na1.5处理的根部Cd含量。多因素分析结果显示,NaCl和Cd交互作用对根部Cd含量具有极显著影响(P<0.001),对根部Cd积累量具有极显著影响(P<0.01);Cd和接种交互作用对地上部和根部Cd含量具有极显著影响(P<0.001)。
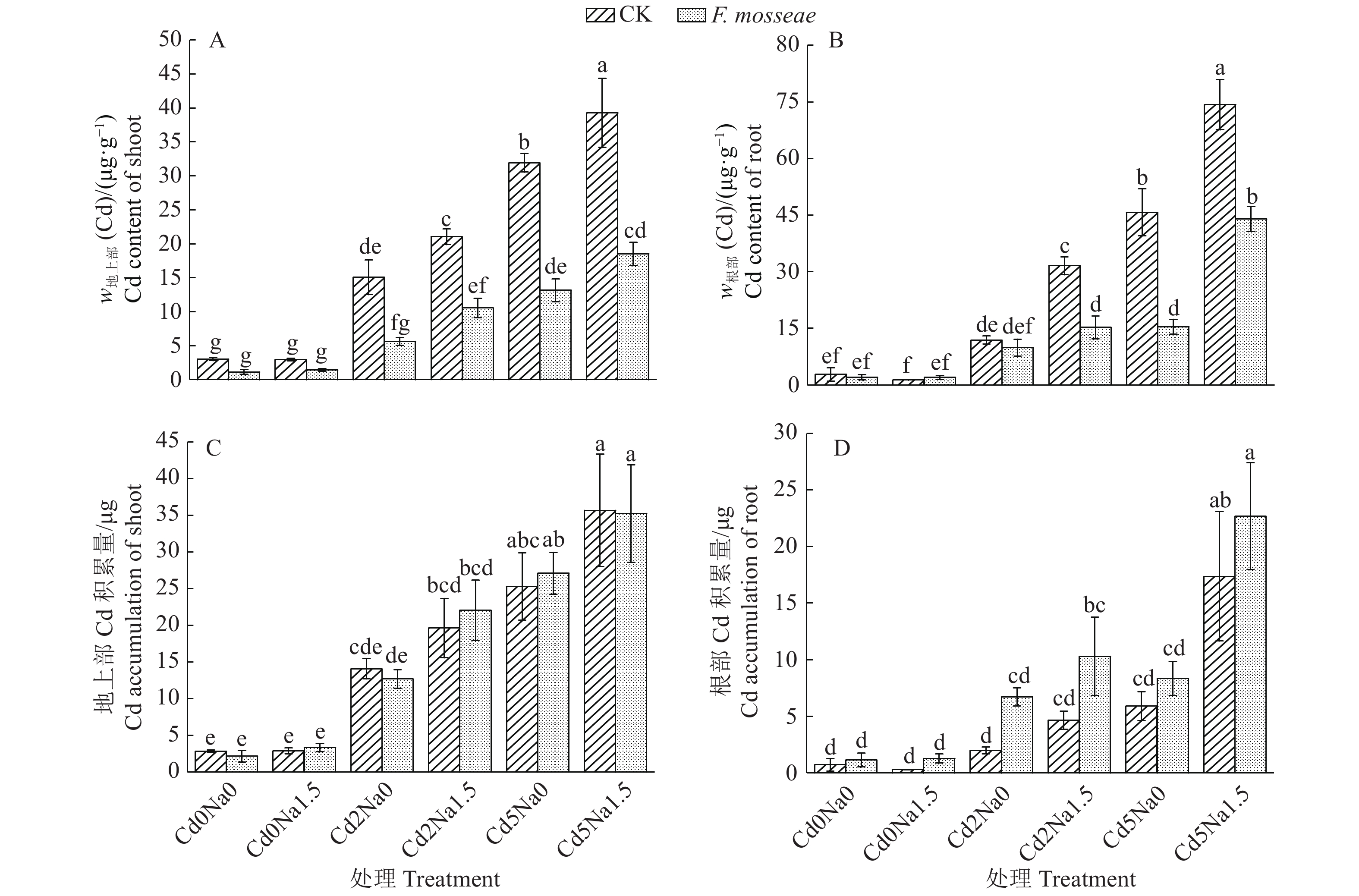
|
图 4 Funneliformis mosseae处理对Cd污染NaCl型土壤中地上部和根部Cd含量和积累量的影响 Fig. 4 Effects of Funneliformis mosseae treatment on Cd contents and accumulations of shoot and root in Cd-contaminated NaCl type soil 各图中,柱子上方的不同小写字母表示处理间差异显著(P<0.05,Duncan’s法) In each figure,different lowercase letters on bars indicate significant differences among treatments (P<0.05, Duncan’s test) |
Cd污染NaCl型土壤中植物地上部和根部K+/Na+、Ca2+/Na+、P5+/Na+的数据分析结果如表1所示。无论是否接种AM真菌,随着土壤中Na+浓度的增加,小果白刺地上部K+/Na+、Ca2+/Na+、P5+/Na+总体上呈现降低的趋势,而根部仅在接种AM真菌处理组总体上呈现降低的趋势。在接种处理组,与Cd0Na0和Cd2Na0相比,Cd5Na0处理显著增加了地上部的Ca2+/Na+和根部的K+/Na+;与Cd2Na0相比,Cd5Na0处理显著增加了根部Ca2+/Na+;与Cd0Na1.5相比,Cd2Na1.5和Cd5Na1.5处理显著降低了地上部的K+/Na+、Ca2+/Na+和根部的P5+/Na+;与Cd0Na1.5相比,Cd5Na1.5处理显著降低了地上部P5+/Na+。与不接种CK相比,接种AM真菌使得地上部K+/Na+仅在Cd2Na1.5和Cd5Na1.5处理时无显著影响,Ca2+/Na+仅在Cd2Na1.5处理时无显著影响,P5+/Na+仅在Cd5Na1.5处理时无显著影响,其余处理地上部K+/Na+、Ca2+/Na+和P5+/Na+均显著增加。与不接种CK相比,接种使得根部K+/Na+显著增加(除Cd5Na1.5处理),Cd0Na0和Cd5Na0处理根部Ca2+/Na+显著增加,根部P5+/Na+显著增加(除Cd2Na1.5和Cd5Na1.5处理)。多因素分析结果(表2)表明,NaCl和Cd交互作用对地上部的K+/Na+和Ca2+/Na+具有显著影响,NaCl和接种交互作用对地上部和根部的K+/Na+、Ca2+/Na+、P5+/Na+均有显著影响,NaCl、Cd和接种三者交互作用对根部的K+/Na+具有显著影响。
|
|
表 1 Funneliformis mosseae处理对Cd污染NaCl型土壤中地上部和根部离子平衡的影响1) Table 1 Effects of Funneliformis mosseae treatment on ion balance of shoot and root in Cd-contaminated NaCl type soil |
|
|
表 2 Funneliformis mosseae 处理对Cd 污染NaCl 型土壤中地上部和根部离子平衡影响的多因素方差分析1) Table 2 Multi-factor analysis of variance for the effects of Funneliformis mosseae treatment on ion balance of shoot and root in Cd-contaminated NaCl type soil |
菌根侵染率可展示出AM真菌和宿主植物亲和共生关系,评估AM真菌的环境适应能力[22]。本研究结果显示,在不同程度的重金属Cd和NaCl处理下,接种后植物根系平均菌根侵染率为12.68%~21.90%,表明F. mosseae对重金属Cd和NaCl均具有一定的耐受性和适应性。在0和5 mg·kg−1 Cd污染下,1.5 g·kg−1NaCl处理显著降低了菌根侵染率。周昕南等[23]的研究结果显示,1.5 g·kg−1NaCl处理显著降低了接种F. mosseae的向日葵菌根侵染率。Zhang等[10]的研究发现,100 mmol ·L−1 NaCl处理显著降低了接种Rhizophagus irregularis芦笋的菌丝、丛枝和囊泡的侵染率。土壤中较高的盐分影响了AM真菌自身的繁殖,抑制了菌丝生长,降低了AM真菌的适应性,从而降低了AM真菌对植物的侵染[24]。此外,在相同NaCl处理时,只有在施加Cd2Na0处理下侵染率显著降低,其余均无显著变化。You等[25]在研究芦苇接种R. irregularis的效应时发现,施加0~20 mg·L−1Cd后,菌根侵染率在1 mg·L−1Cd污染时达到最大。而刘双洋[26]研究发现Cd质量分数在0~15 mg·kg−1时对F. mosseae侵染水稻并无显著影响。因此,研究表明重金属和盐分含量、植物和AM真菌的种类均可能会影响植物根系的菌根侵染率。
3.2 生物量植物在面对逆境胁迫时的生物量能直观地反映出其耐受性[8]。有研究发现,小果白刺随着NaCl浓度的升高各部位的生物量先升高后降低[27]。左凤月[28]在研究小果白刺耐盐性时发现3%NaCl处理显著增加了小果白刺的生物量。在本研究中,盐分处理对小果白刺的生物量并没有产生显著影响,这可能是因为1.5 g·kg−1NaCl处理浓度较低,既没有对小果白刺的生长产生促进作用,也未达到小果白刺的耐盐阈值。本研究显示,只有在不接种AM真菌处理组,Cd5Na0处理显著降低了Cd2Na0地上部生物量,而其他处理均未受到Cd含量的显著影响,这可能说明了小果白刺对重金属Cd的耐受性比较高。盐生植物通常能够在细胞水平上将重金属束缚在细胞壁和细胞膜上,从而阻止重金属进入细胞内对其产生毒害[29]。同时,盐生植物能够在抵御盐胁迫时合成脯氨酸,提高对重金属的耐受性[30]。已有研究结果证明,AM真菌能显著地促进盐胁迫下番茄的生长和重金属Cd胁迫下玉米的生长[31-32]。本研究结果显示,AM真菌与植物共生后显著促进了Cd污染NaCl型土壤中小果白刺的生长。这可能是接种AM真菌后真菌菌丝扩大了植物根系吸收营养元素的范围,同时也影响了植物对Na+和Cd的吸收积累,从而促进了植物的生长。
3.3 矿质营养吸收植物的生长发育和新陈代谢离不开N、P、K、Ca和Mg等矿质营养元素,同时营养元素通过改变植物的生理生化来增加植物对逆境胁迫的抵抗。Al-Karaki[31]通过研究将电导率为2.4 ds·m−1的盐水浇灌番茄后,发现与不浇灌盐水的番茄相比,显著降低了地上部P的浓度以及地上部P和K的积累量,而接种AM真菌后又显著增加了地上部P和K的积累量。此外,有研究发现Cd胁迫下接种R. irregularis显著增加了芦竹地上部N积累量和根部N、P积累量[33]。杨九扬[34]研究发现,接种AM真菌处理显著提高了小果白刺对矿质营养元素的积累。本试验结果显示,在重金属Cd和NaCl处理下,接种显著改善了植物对N、P、K、Ca和Mg的积累,表明在Cd污染NaCl型土壤环境中AM真菌可显著促进植物对营养元素的吸收。AM真菌的菌丝比植物根系更能够穿越细小的毛孔,由此将菌丝吸收网络扩展到植物根际养分消耗区以外,提高了营养元素的吸收,帮助植物应对盐分、重金属等生物和非生物胁迫[7]。
3.4 Na+的吸收和离子平衡本研究显示,AM真菌显著降低了小果白刺地上部和根部Na+含量,同时也增加了根部Na+的积累。植物受到盐胁迫时,Na+可以通过非选择性阳离子通道进入根部,进而进入地上部被吸收[35]。研究发现接种F. mosseae可显著降低受盐水浇灌的番茄地上部Na+浓度[31]。张义飞等[36]研究发现在0~3 g·kg−1NaCl胁迫下,接种F. mosseae显著降低了羊草地上部的Na+浓度。另有研究将0、100和200 mmol ·L−1 NaCl浇灌刺槐后,接种R. irregularis显著降低了地上部Na+浓度,根部则无显著变化[37]。李涛等[38]研究大豆接种F. mosseae发现,在100 mmol ·L−1 NaCl处理时地上部Na+积累量显著降低,而在50和150 mmol ·L−1处理时则无显著变化。因此,接种F. mosseae对Na+的吸收的影响可能与菌种和植物的不同以及基质盐分含量等因素相关。此外,在本研究中用1.5 g·kg−1NaCl处理时,在不接种对照组5 g·kg−1Cd处理显著增加了植物地上部Na+含量,而在接种组2 和5 g·kg−1Cd处理均显著增加了其地上部Na+含量。因此,Cd对植物Na+吸收的影响因素需要去进一步的研究和探讨。
由于K+和Na+的相似性,导致Na+常常与K+竞争一些蛋白功能的结合位点,但是Na+并不能替代K+行使正常的细胞功能,因此在盐胁迫下K+的吸收面临着Na+竞争,最终导致了细胞质中K+/Na+的下降[35]。在本研究中,1.5 g·kg−1NaCl处理使得小果白刺K+/Na+、Ca2+/Na+和P5+/Na+显著下降,反映了NaCl处理对植物的毒害作用。而在相同处理下,接种AM真菌使得小果白刺K+/Na+、Ca2+/Na+和P5+/Na+增加,调节了植株体内的离子平衡,缓解了盐的毒害作用。Diao等[39]研究发现400 mmol·L−1 NaCl浇灌盐地碱蓬后接种AM真菌显著增加了地上部的K+/Na+和Ca2+/Na+。王英逵等[24]研究在电导率为559 μs·cm−1的盐碱土壤中种植羊草,接种AM真菌后地上部的K+和Ca2+浓度分别提高了9.81%和28.94%,K+/Na+和Ca2+/Na+分别提高了31.91%和50.00%。这可能是因为菌根植物的菌丝能够吸收更多的矿质营养元素,并且在分子水平上AM真菌共生能够通过调控耐盐相关基因的表达,调节离子平衡,缓解Na+的胁迫[39]。
3.5 Cd的吸收盐和重金属胁迫对植物生长常常产生毒害作用,而在重金属盐渍化土壤中,两者又存在着复杂的交互作用,盐分可显著影响重金属的移动性等环境化学行为[6]。本研究结果显示,在不接种处理组,随着外源Cd含量的增加小果白刺地上部和根部Cd含量显著增加,而生物量却没有显著变化,表明小果白刺对重金属Cd具有较好的耐受性,已有研究表明与甜土植物相比盐生植物具有较强的重金属耐受性或积累重金属的能力[15]。本研究结果显示,在2和5 g·kg−1Cd处理时,1.5 g·kg−1NaCl处理显著增加了植物地上部和根部Cd含量,表明NaCl处理促进了小果白刺对Cd的吸收;但是,接种AM真菌改变了NaCl对小果白刺Cd吸收的影响,仅在5 g·kg−1Cd处理时,NaCl使得根部Cd含量显著增加。已有研究发现,盐浓度的增大显著影响了甜瓜叶片中Cd的含量,使其显著增加[40]。可能的原因是NaCl的阴离子Cl−不可避免地与Cd2+形成稳定的化合物,而这种化合物的稳定性和溶解度都高于Cd与土壤固相颗粒的亲和力[41]。本研究结果显示,总体上看接种处理降低了地上部和根部Cd含量,增加了根部Cd的积累。Liu等[32]研究发现,AM接种处理显著降低了Cd(3、6 mg·kg−1)污染土壤中玉米植株对Cd的吸收。同样,研究显示在超过10 mg·kg−1Cd污染时接种AM真菌后,水稻组织内Cd含量差异并不显著[26]。这可能是因为AM真菌的菌丝体提供了更多的吸附位点和Cd区格化空间,进而减少了重金属污染的侵害,当Cd含量太高后,将会超过菌根自身能力范围,也可能是由于AM真菌菌种和植物种类的不同所导致。
3.6 结论1)小果白刺接种AM真菌F. mosseae的菌根侵染率为12.68%~21.90%;1.5 g·kg−1 Na+和2.0 mg·kg−1 Cd处理使得小果白刺菌根侵染率分别降低了30.27%~34.40%和42.10%。
2) AM真菌显著促进了Cd污染NaCl型土壤中小果白刺的生长,使得总干质量增加了101.35%~215.29%。
3) AM真菌显著改善了小果白刺在Cd污染NaCl型土壤中对营养元素的吸收积累,调节了K+/Na+、Ca2+/Na+和P5+/Na+离子平衡。
4) AM真菌显著降低了小果白刺地上部和根部Na+和Cd含量,但仅显著增加了根部Na+的积累量。
| [1] |
PAN C C, LIU C G, ZHAO H L, et al. Changes of soil physico-chemical properties and enzyme activities in relation to grassland salinization[J]. European Journal of Soil Biology, 2013, 55: 13-19. DOI:10.1016/j.ejsobi.2012.09.009 (  0) 0) |
| [2] |
王娜, 何俐蓉. 盐渍化土壤的成因及改良材料的应用[J]. 南方农机, 2021, 52(5): 72-73. DOI:10.3969/j.issn.1672-3872.2021.05.030 (  0) 0) |
| [3] |
张晓婷, 王雪松, 贾文飞, 等. 植物在盐处理下的研究进展[J]. 北方园艺, 2021(6): 137-143. (  0) 0) |
| [4] |
张辉, 宋琳, 陈晓琳, 等. 土壤退化的原因与修复作用研究[J]. 海洋科学, 2020, 44(8): 147-161. (  0) 0) |
| [5] |
ZHOU T, ZHAO M H, ZHAO X, et al. Simultaneous remediation and fertility improvement of heavy metals contaminated soil by a novel composite hydrogel synthesized from food waste[J]. Chemosphere, 2021, 275: 129984. DOI:10.1016/j.chemosphere.2021.129984 (  0) 0) |
| [6] |
李晓婧, 郑向群, 郑顺安. 污灌区盐渍化土壤重金属Cd的形态分析及其影响因素[J]. 中国农学通报, 2017, 33(12): 43-47. DOI:10.11924/j.issn.1000-6850.casb17010085 (  0) 0) |
| [7] |
DIAGNE N, NGOM M, DJIGHALY P I, et al. Roles of arbuscular mycorrhizal fungi on plant growth and performance: Importance in biotic and abiotic stressed regulation[J]. Diversity, 2020, 12(10): 370. DOI:10.3390/d12100370 (  0) 0) |
| [8] |
SHENG M, TANG M, CHEN H, et al. Influence of arbuscular mycorrhizae on photosynthesis and water status of maize plants under salt stress[J]. Mycorrhiza, 2008, 18(6/7): 287-296. (  0) 0) |
| [9] |
EVELIN H, DEVI T S, GUPTA S, et al. Mitigation of salinity stress in plants by arbuscular mycorrhizal symbiosis: Current understanding and new challenges[J]. Frontiers in Plant Science, 2019, 10: 470. DOI:10.3389/fpls.2019.00470 (  0) 0) |
| [10] |
ZHANG X H, GAO H M, LIANG Y Q, et al. Full-length transcriptome analysis of asparagus roots reveals the molecular mechanism of salt tolerance induced by arbuscular mycorrhizal fungi[J]. Environmental and Experimental Botany, 2021, 185:104402. (  0) 0) |
| [11] |
HILDEBRANDT U, REGVAR M, BOTHE H. Arbuscular mycorrhiza and heavy metal tolerance[J]. Phytochemistry, 2007, 68(1): 139-146. DOI:10.1016/j.phytochem.2006.09.023 (  0) 0) |
| [12] |
HE S Y, HE Z L, YANG X E, et al. Soil biogeochemistry, plant physiology, and phytoremediation of cadmium-contaminated soils[J]. Advances in Agronomy, 2015, 134: 135-225. (  0) 0) |
| [13] |
SAXENA G, PURCHASE D, MULLA S I, et al. Phytoremediation of heavy metal-contaminated sites: Eco-environmental concerns, field studies, sustainability issues, and future prospects[J]. Reviews of Environmental Contamination and Toxicology, 2020, 249: 71-131. (  0) 0) |
| [14] |
RIAZ M, KAMRAN M, FANG Y Z, et al. Arbuscular mycorrhizal fungi-induced mitigation of heavy metal phytotoxicity in metal contaminated soils: A critical review[J]. Journal of Hazardous Materials, 2021, 402: 123919. DOI:10.1016/j.jhazmat.2020.123919 (  0) 0) |
| [15] |
LIANG L C, LIU W T, SUN Y B, et al. Phytoremediation of heavy metal contaminated saline soils using halophytes: Current progress and future perspectives[J]. Environmental Reviews, 2017, 25(3): 269-281. DOI:10.1139/er-2016-0063 (  0) 0) |
| [16] |
ZHOU M, ENGELMANN T, LUTTS S. Salinity modifies heavy metals and arsenic absorption by the halophyte plant species Kosteletzkya pentacarpos and pollutant leaching from a polycontaminated substrate
[J]. Ecotoxicology and Environmental Safety, 2019, 182: 109460. DOI:10.1016/j.ecoenv.2019.109460 (  0) 0) |
| [17] |
ZHANG S L, NI X L, ARIF M, et al. NaCl improved Cd tolerance of the euhalophyte Suaeda glauca but not the recretohalophyte Limonium aureum
[J]. Plant and Soil, 2020, 449(1/2): 303-318. DOI:10.1007/s11104-020-04475-7 (  0) 0) |
| [18] |
高峰, 杜红霞. 小果白刺的生态特性与栽培利用[J]. 内蒙古林业, 2020(8): 35-36. (  0) 0) |
| [19] |
TANG X Q, ZHANG H L, SHABALA S, et al. Tissue tolerance mechanisms conferring salinity tolerance in a halophytic perennial species Nitraria sibirica Pall.
[J]. Tree Physiology, 2021, 41(7): 1264-1277. DOI:10.1093/treephys/tpaa174 (  0) 0) |
| [20] |
中华人民共和国生态环境部土壤环境管理司、科技标准司. 土壤环境标准 农用地土壤污染风险管控标准(试行): GB15618—2018[S]. 中国环境科学出版社, 2018.
(  0) 0) |
| [21] |
ACOSTA J A, JANSEN B, KALBITZ K, et al. Salinity increases mobility of heavy metals in soils[J]. Chemosphere, 2011, 85(8): 1318-1324. DOI:10.1016/j.chemosphere.2011.07.046 (  0) 0) |
| [22] |
王晓英, 王冬梅, 陈保冬, 等. 丛枝菌根真菌群落对白三叶草生长的影响[J]. 生态学报, 2010, 30(6): 1456-1462. (  0) 0) |
| [23] |
周昕南, 杨亮, 许静, 等. 接种AM真菌对不同盐度土壤中向日葵生长的影响[J]. 农业资源与环境学报, 2020, 37(5): 744-752. (  0) 0) |
| [24] |
王英逵, 杨玉荣, 王德利. 盐碱胁迫下AMF对羊草的离子吸收和分配作用[J]. 草业学报, 2020, 29(12): 95-104. DOI:10.11686/cyxb2020036 (  0) 0) |
| [25] |
YOU Y Q, WANG L, JU C, et al. Effects of arbuscular mycorrhizal fungi on the growth and toxic element uptake of Phragmites australis (Cav. ) Trin. ex Steud under zinc/cadmium stress
[J]. Ecotoxicology and Environmental Safety, 2021, 213: 112023. DOI:10.1016/j.ecoenv.2021.112023 (  0) 0) |
| [26] |
刘双洋. 丛枝菌根真菌对水稻镉胁迫响应及其转运过程的影响研究[D]. 哈尔滨: 哈尔滨工业大学, 2015.
(  0) 0) |
| [27] |
唐晓倩, 李焕勇, 杨秀艳, 等. NaCl胁迫对西伯利亚白刺根系生长及K+/Na+平衡的影响
[J]. 西北农林科技大学学报(自然科学版), 2019, 47(8): 83-89. (  0) 0) |
| [28] |
左凤月. 盐胁迫对3种白刺生长、生理生化及解剖结构的影响[D]. 重庆: 西南大学, 2013.
(  0) 0) |
| [29] |
梁丽琛, 刘维涛, 张雪, 等. 盐土植物提取修复重金属污染盐土研究进展[J]. 农业环境科学学报, 2016, 35(7): 1233-1241. DOI:10.11654/jaes.2016.07.002 (  0) 0) |
| [30] |
VAN OOSTEN M J, MAGGIO A. Functional biology of halophytes in the phytoremediation of heavy metal contaminated soils[J]. Environmental and Experimental Botany, 2015, 111: 135-146. DOI:10.1016/j.envexpbot.2014.11.010 (  0) 0) |
| [31] |
AL-KARAKI G N. Nursery inoculation of tomato with arbuscular mycorrhizal fungi and subsequent performance under irrigation with saline water[J]. Scientia Horticulturae, 2006, 109(1): 1-7. DOI:10.1016/j.scienta.2006.02.019 (  0) 0) |
| [32] |
LIU L, LI J W, YUE F X, et al. Effects of arbuscular mycorrhizal inoculation and biochar amendment on maize growth, cadmium uptake and soil cadmium speciation in Cd-contaminated soil[J]. Chemosphere, 2018, 194: 495-503. DOI:10.1016/j.chemosphere.2017.12.025 (  0) 0) |
| [33] |
滕秋梅, 张中峰, 李红艳, 等. 丛枝菌根真菌对镉胁迫下芦竹生长、光合特性和矿质营养的影响[J]. 土壤, 2020, 52(6): 1212-1221. (  0) 0) |
| [34] |
杨久扬. AM真菌和改良剂对小果白刺生长和沙化土壤改良效应的影响[D]. 呼和浩特: 内蒙古大学, 2019.
(  0) 0) |
| [35] |
VAN ZELM E, ZHANG Y X, TESTERINK C. Salt tolerance mechanisms of plants[J]. Annual Review of Plant Biology, 2020, 71: 403-433. DOI:10.1146/annurev-arplant-050718-100005 (  0) 0) |
| [36] |
张义飞, 王平, 毕琪, 等. 不同强度盐胁迫下AM真菌对羊草生长的影响[J]. 生态学报, 2016, 36(17): 5467-5476. (  0) 0) |
| [37] |
CHEN J, ZHANG H Q, ZHANG X L, et al. Arbuscular mycorrhizal symbiosis alleviates salt stress in black locust through improved photosynthesis, water status, and K+/Na+ homeostasis
[J]. Frontiers in Plant Science, 2017, 8: 1739. DOI:10.3389/fpls.2017.01739 (  0) 0) |
| [38] |
李涛, 刘润进, 陈敏, 等. 盐渍条件下AM真菌对大豆生长和离子含量的影响[J]. 菌物学报, 2009, 28(3): 410-414. (  0) 0) |
| [39] |
DIAO F W, DANG Z H, XU J, et al. Effect of arbuscular mycorrhizal symbiosis on ion homeostasis and salt tolerance-related gene expression in halophyte Suaeda salsa under salt treatments
[J]. Microbiological Research, 2021, 245: 126688. DOI:10.1016/j.micres.2020.126688 (  0) 0) |
| [40] |
GABRIJEL O, DAVOR R, ZED R, et al. Cadmium accumulation by muskmelon under salt stress in contaminated organic soil[J]. The Science of the Total Environment, 2009, 407(7): 2175-2182. DOI:10.1016/j.scitotenv.2008.12.032 (  0) 0) |
| [41] |
ZHAO S, FENG C H, WANG D X, et al. Salinity increases the mobility of Cd, Cu, Mn, and Pb in the sediments of Yangtze Estuary: Relative role of sediments’ properties and metal speciation[J]. Chemosphere, 2013, 91(7): 977-984. DOI:10.1016/j.chemosphere.2013.02.001 (  0) 0) |
 2022, Vol. 43
2022, Vol. 43


