2. 安徽农业大学 资源与环境学院, 安徽 合肥 230036;
3. 合肥学院 生物食品与环境学院, 安徽 合肥 230601;
4. 合肥工业大学 资源与环境工程学院, 安徽 合肥 230009
2. School of Resources and Environment, Anhui Agricultural University, Hefei 230036, China;
3. School of Biological Food and Environment, Hefei University, Hefei 230601, China;
4. School of Resources and Environmental Engineering, Hefei University of Technology, Hefei 230009, China
淮北矿区拥有丰富的煤炭资源,煤炭开采历史久远,为区域的经济社会发展做出了突出贡献,但长期掠夺式的矿产开发形成了典型的采煤塌陷区。在塌陷区内,由煤炭开采、堆放和使用而产生的污染元素会通过多种途径迁移和转化进入周边水质和土壤,并通过食物链在动植物和人体内富集,给矿区人们的生产生活和身体健康带来潜在的威胁[1-3]。近年来,煤矿开采引起的地表沉陷、地下水污染和土壤重金属超标等一系列生态环境问题受到了广泛关注。要解决这些矿区生态环境问题,首先应该对矿区环境质量进行科学有效的评价。有学者通过测定矿区水质的营养元素含量,结合单因子指数法评价矿区地下水环境质量[4]。有学者测定了矿区土壤的重金属含量,并通过单因子污染指数法、内梅罗综合污染指数法揭示矿区土壤重金属污染特征及评价生态风险[5-6]。当前针对淮北矿区生态环境质量的研究多集中于地下水的养分含量、土壤重金属含量等,对矿区生态环境生物安全性监测的报道相对较少[7-8]。这些评价监测方法一般仅用污染物质的浓度值来评估矿区环境质量,难以灵敏地反映出淮北矿区生态系统中生物调控的细微变化[9]。因此,建立一种科学的生物评价方法,更加灵敏有效地反映矿区水环境质量和土壤环境质量状况,对于淮北矿区生态环境的监测预警尤为重要。
土壤线虫作为土壤中最丰富的后生动物,存在于任何土壤环境中,处于土壤食物网的中心位置[3, 10]。土壤线虫的群落组成可以反映当地土壤的健康状况、污染状况、有机物质的输入状况及自然和外界干扰程度等[11-13]。秀丽隐杆线虫Caenorhabditis elegans作为土壤线虫的一种,是一种国际公认的模式生物,具有结构简单、易于实验室培养、生长周期短的优势,且具有60%~80%的人类同源基因,常被应用于环境评价、生态毒理、生命科学等各个领域[14-15]。本文以安徽淮北采煤矿区为研究对象,通过活体秀丽隐杆线虫对矿区水环境的响应来指示矿区水环境质量,以及通过土壤线虫群落结构来指示矿区土壤环境质量,以期为淮北采煤矿区生态环境质量的生物学监测提供科学有效的理论依据。
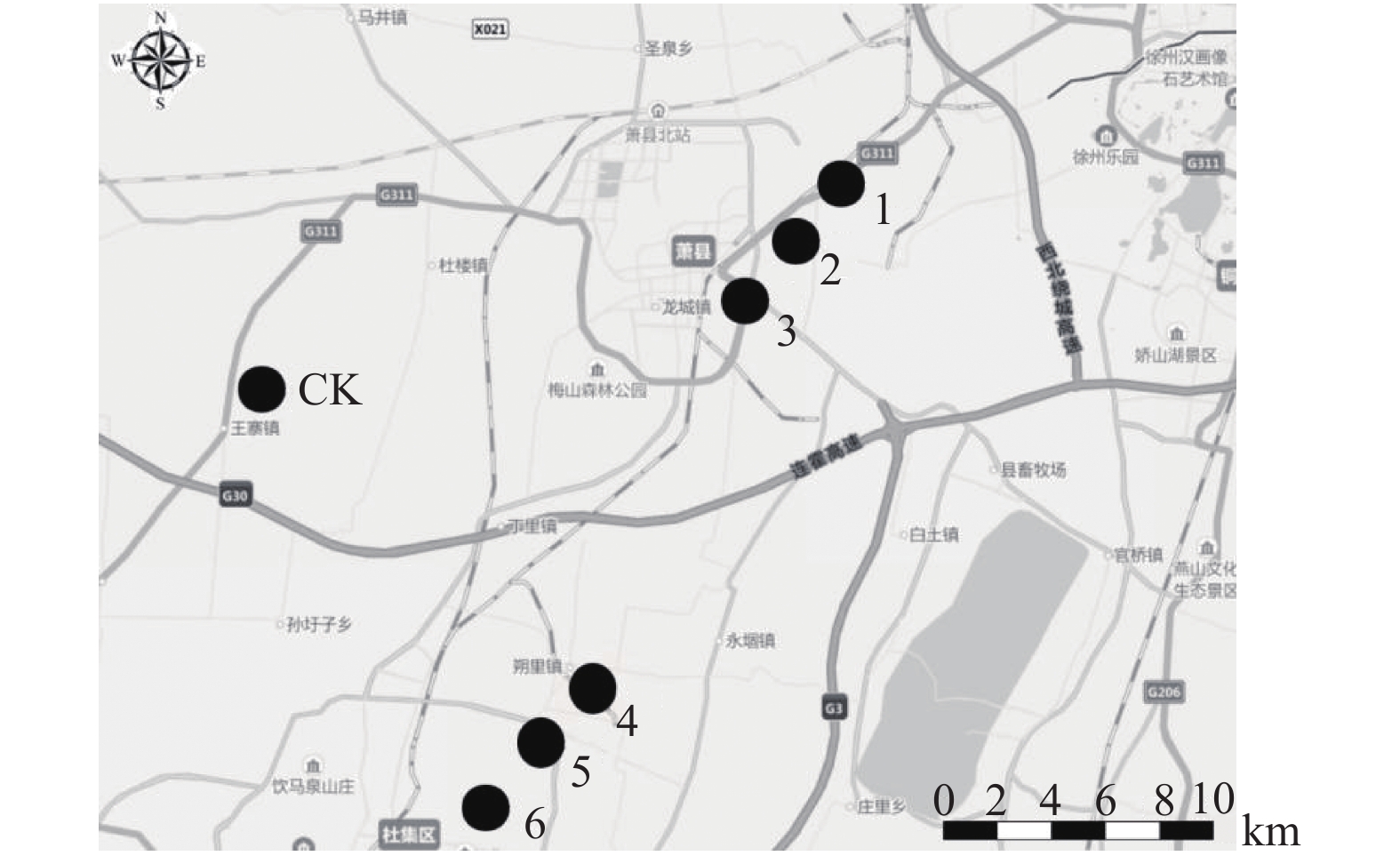
1 材料与方法 1.1 试验设计及样品采集取样地点设在安徽省淮北市杜集区沈庄煤矿和石台煤矿,均是安徽淮北典型的采煤塌陷区,沈庄煤矿已有多年开采历史,而石台煤矿开采时间相对较短。采样共设7个样点,分别是CK:对照区,1:距离沈庄矿井100 m的矿区,2:距离沈庄矿井1 500 m的矿区,3:距离沈庄矿井3 000 m的矿区,4:距离石台矿井100 m的矿区,5:距离石台矿井1 500 m的矿区,6:距离石台矿井3 000 m的矿区(图1)。采集矿区附近的水塘水环境样品和农田土壤样品。水环境样品分别记为WCK、W1、W2、W3、W4、W5、W6,取自0~30 cm水层。土壤样品分别记为SCK、S1、S2、S3、S4、S5、S6,取自0~20 cm耕层土壤。采样时均为晴天,每个样点按照“S”形取样法采集5个点的样品并混匀成1个样品,每个采样点共取回约2 kg土样和1 000 mL水样,放在4 ℃冰箱保存。
|
图 1 采样点分布示意图 Fig. 1 Distribution of sampling site CK:对照区,1:距离沈庄矿井100 m的矿区,2:距离沈庄矿井1 500 m的矿区,3:距离沈庄矿井3 000 m的矿区,4:距离石台矿井100 m的矿区,5:距离石台矿井1 500 m的矿区,6:距离石台矿井3 000 m的矿区 CK: Control area, 1: Mining area of 100 m away from Shenzhuang Mine, 2: Mining area of 1 500 m away from Shenzhuang Mine, 3: Mining area of 3 000 m away from Shenzhuang Mine, 4: Mining area of 100 m away from Shitai Mine, 5: Mining area of 1 500 m away from Shitai Mine, 6: Mining area of 3 000 m away from Shitai Mine |
在进行矿区水环境检测时,选用的秀丽隐杆线虫品系为N2 Bristol野生型。矿区水环境样品用0.22 μm的微孔滤膜过滤后用于秀丽隐杆线虫的培养。每个样品做3次重复,主要检测秀丽隐杆线虫的半数致死时间、体长、产卵数、细胞凋亡等发育指标,检测方法参照文献[16-18]。
1.2.2 土壤线虫的分离鉴定土壤线虫采用高效、常用的蔗糖离心漂浮法[19]分离。称取50 g鲜土,加入0.8 g·mL−1蔗糖溶液进行离心浮选,分离的线虫经24 h饥饿处理后,用TAF固定液(体积分数为40%的甲醛溶液7 mL、三乙醇胺2 mL、蒸馏水91 mL)固定,在生物显微镜下进行线虫属的鉴定和计数。每个样品做3次重复。根据线虫头部、尾部的形态学特征和取食特性将其划分为4个营养类群:植物寄生线虫、食细菌线虫、食真菌线虫和杂食/捕食线虫[20-21],具体分类检索方法参见《中国土壤动物检索图鉴》[22]。
1.2.3 土壤线虫生态指标1)香农多样性指数
水中重金属铜、锌、铬、砷的含量采用电感耦合等离子−质谱法(安捷伦科技有限公司Agilent8800电感耦合等离子体质谱仪)测定,氟化物采用离子色谱法(美国戴安公司ICS-1100离子色谱仪)测定。土壤中重金属铜、铅、锌、铬、镉、砷、汞含量采用原子分光光度法(日本日立公司Z-2000原子吸收分光光度计)测定。
1.3 数据统计统计数据采用SPSS 25.0软件进行方差分析及主成分分析,用LSD新复极差法进行显著性检验,图表采用Microsoft Excel 2010生成。
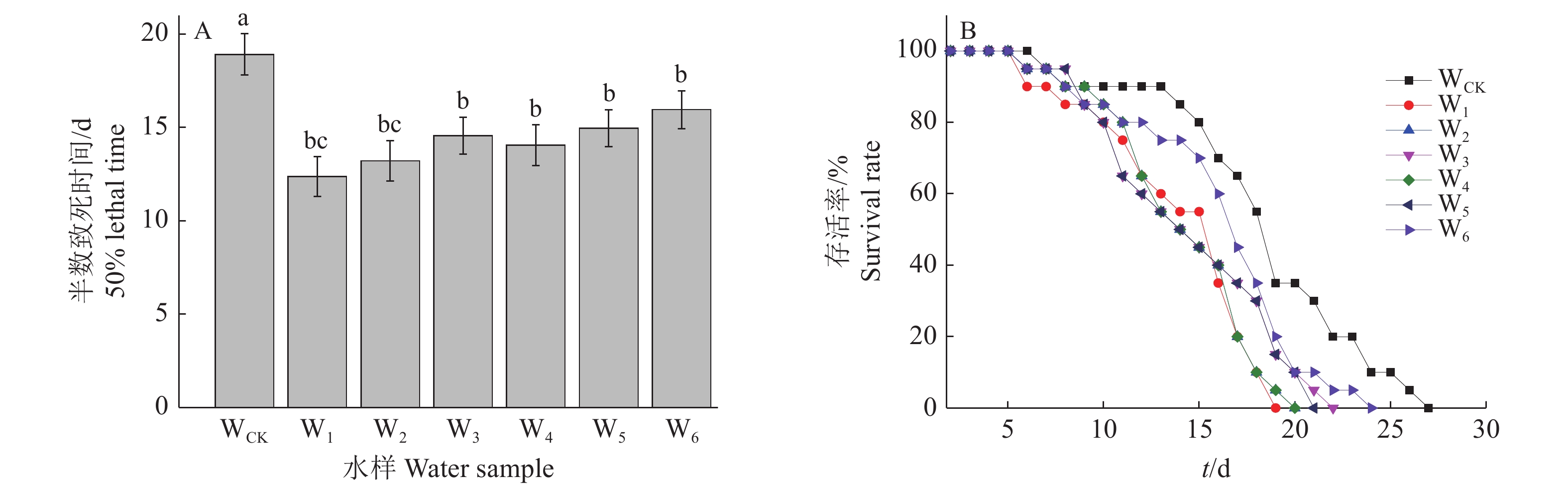
2 结果与分析 2.1 秀丽隐杆线虫发育指标对淮北矿区水环境的响应 2.1.1 矿区水环境对线虫寿命和存活率的影响通过对采取的水样进行秀丽隐杆线虫暴露试验,测得秀丽隐杆线虫的半数致死时间和存活率结果如图2所示。图2A显示,与WCK相比,矿区水环境样品W1、W2、W3、W4、W5和W6的线虫半数致死时间分别显著降低了34.58%、30.18%、23.04%、25.68%、20.93%和15.63%(P<0.05),表明采煤矿区水环境显著降低了线虫的半数致死时间。图2B显示,矿区水环境样品中秀丽隐杆线虫线虫存活时间为18~26 d,其中W1、W2、W3、W4、W5和W6的秀丽隐杆线虫的存活率曲线较WCK明显左移,表明采煤矿区水环境降低了线虫的存活率;可能随着煤矿开采时间的增加,矿区水环境中产生了更多的有害成分[23],从而对线虫产生更大的毒性。
|
图 2 矿区水环境对秀丽隐杆线虫半数致死时间和存活率的影响 Fig. 2 Influence of mining area water environment on lethal time of 50% and survival rate of Caenorhabditis elegans 图A柱子上的不同小写字母表示样品间差异显著(P<0.05,LSD法) Different lowercase letters on the columns in Fig. A indicate significant differences among different samples (P<0.05, LSD method) |
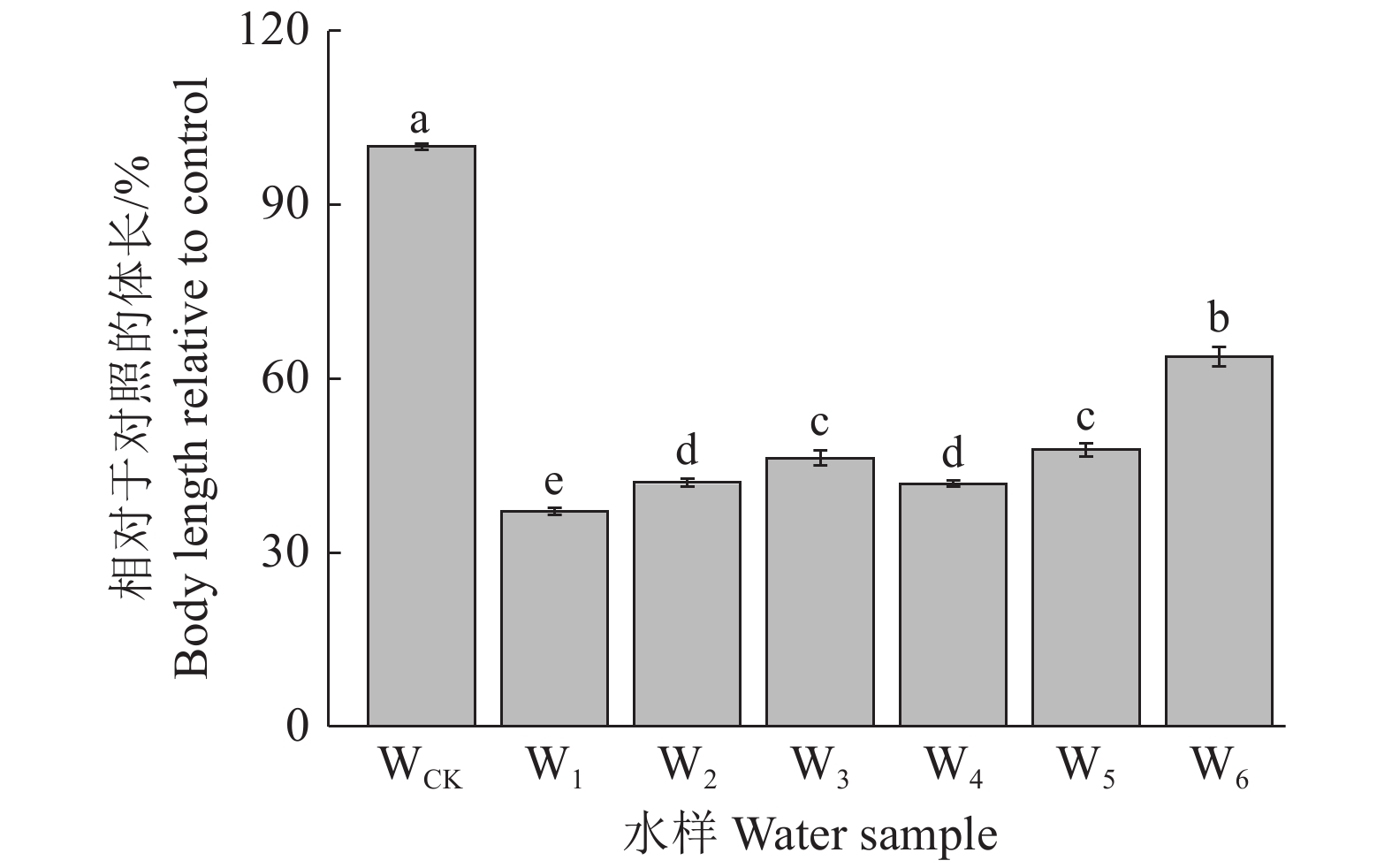
同步化的秀丽隐杆线虫从L1期开始暴露于不同的水环境,72 h后取出测量体长,结果如图3所示。与WCK相比,矿区水环境样品W1、W2、W3、W4、W5和W6的线虫体长分别显著降低了62.86%、57.87%、53.68%、58.14%、52.27%和36.23%(P<0.05)。从开采年限上看,W1与W4的线虫体长存在显著差异,W1比W4显著降低了11.28%(P<0.05)。从采样点离矿井距离上来看,沈庄矿点W1、W2、W3及石台矿点W4、W5、W6之间的秀丽隐杆线虫体长存在显著差异(P<0.05),其中W2、W3的体长分别为W1的1.13倍和1.25倍,W5、W6的体长分别为W4的1.14倍和1.52倍,表明与矿井距离越近,对线虫体长的抑制作用越强。
|
图 3 矿区水环境对秀丽隐杆线虫体长的影响 Fig. 3 Effects of mining area water environment on body length of Caenorhabditis elegans 柱子上的不同小写字母表示样品间差异显著(P<0.05,LSD法) Different lowercase letters on the columns indicate significant differences among different samples (P<0.05, LSD method) |
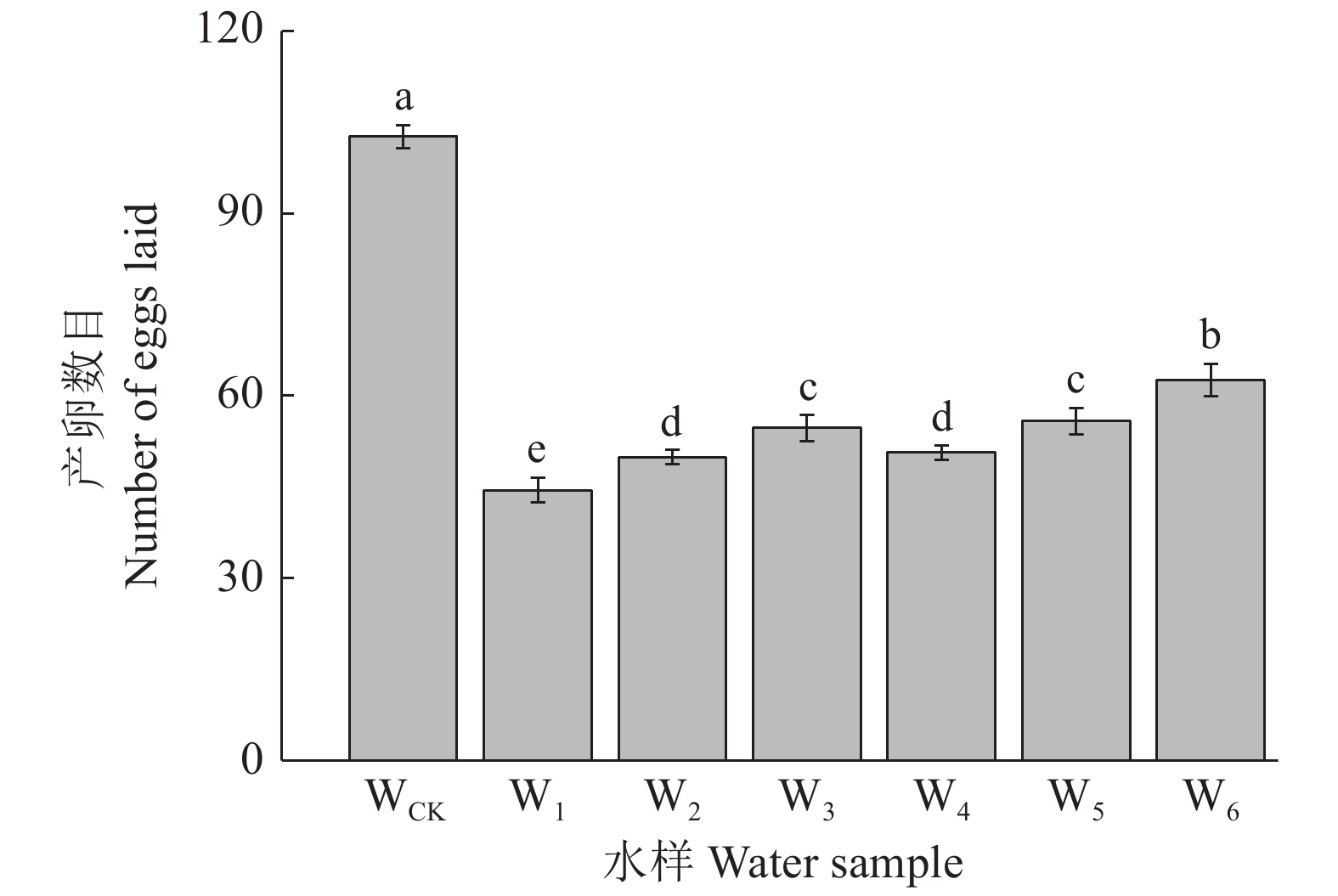
线虫暴露于矿区水环境对产卵数影响的结果如图4所示。与WCK相比,矿区水环境样品W1、W2、W3、W4、W5和W6的线虫产卵数分别显著降低了56.70%、51.38%、46.72%、50.58%、45.60%和39.00%(P<0.05)。从开采年限上看,W1的线虫产卵数较W4显著降低了12.37%(P<0.05),表明煤矿开采时间越长,线虫后代产卵数目越少。从采样点离矿井距离上来看,沈庄矿点W1、W2、W3及石台矿点W4、W5、W6之间的产卵数目存在显著差异(P<0.05),其中,W2、W3的体长分别为W1的1.12倍和1.23倍,W5、W6的体长分别为W4的1.10倍和1.23倍,表明与矿井距离越近,线虫后代产卵数目越少。
|
图 4 矿区水环境对秀丽隐杆线虫产卵数的影响 Fig. 4 Effects of mining area water environment on the number of eggs laid by Caenorhabditis elegans 柱子上的不同小写字母表示样品间差异显著(P<0.05,LSD法) Different lowercase letters on the columns indicate significant differences amnong different samples (P<0.05, LSD method) |
线虫的生殖腺是一个非常敏感的组织模型,试验选用线虫生殖细胞凋亡作为检测终点,探究矿区周边不同水环境对线虫生殖发育的影响。将同步化的L1期线虫暴露于不同水体72 h后,检测线虫1条性腺臂的细胞凋亡数目,结果如图5所示。与WCK(生殖细胞凋亡数目为3.37)相比,矿区水环境样品W1、W2、W3的线虫生殖细胞凋亡数目分别显著增加了44.34%、33.03%、18.96%(P<0.05)。从开采年限上看,W1的线虫生殖细胞凋亡数目比W4显著增加了12.37%(P<0.05),表明煤矿开采时间的增加会诱导线虫生殖细胞凋亡数目显著增加。从采样点离矿井距离上来看,沈庄矿点W1、W2与W3之间存在显著差异(P<0.05),表明距离矿井越近,生殖细胞凋亡数目越多。
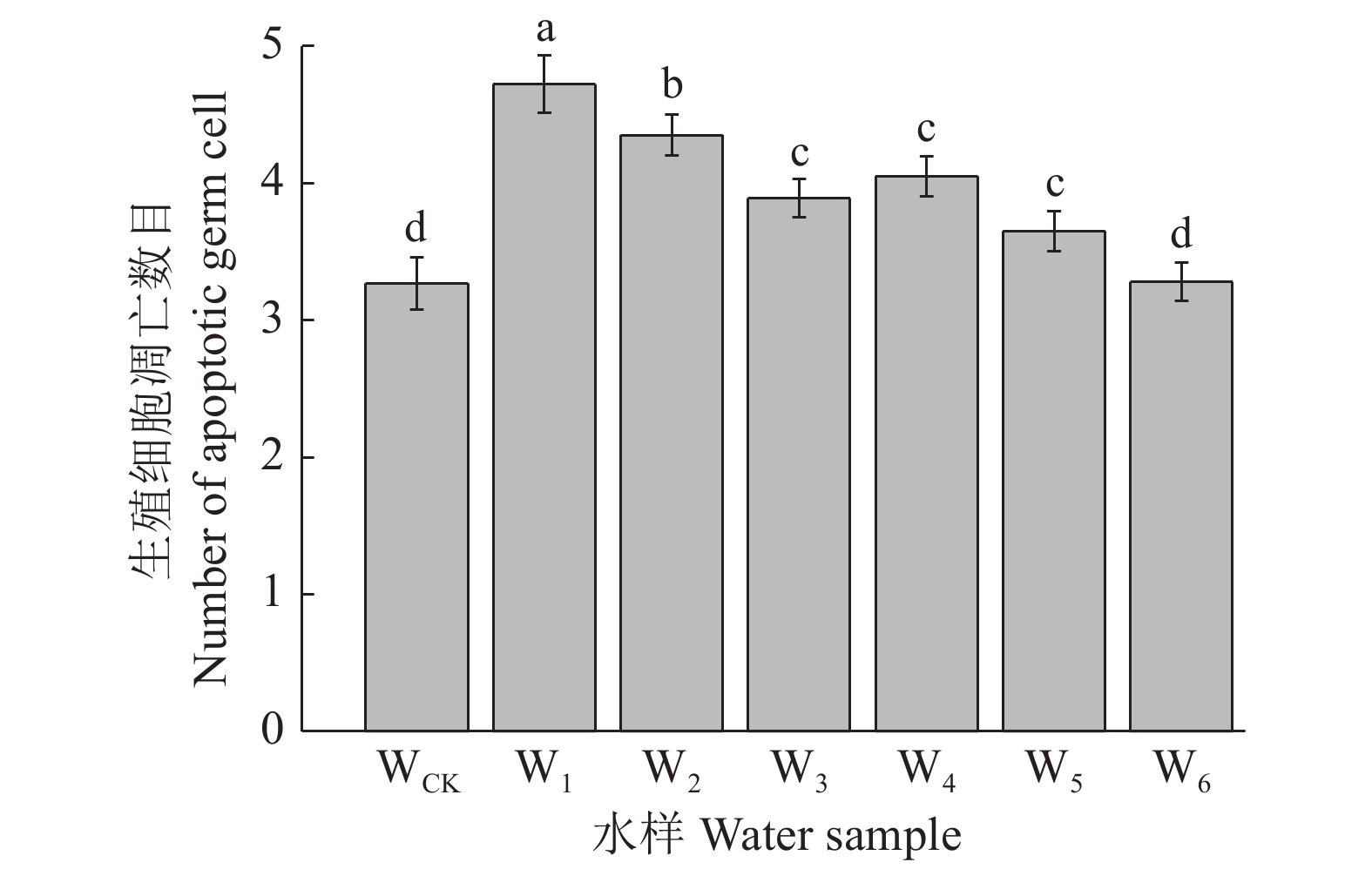
|
图 5 矿区水环境诱导的秀丽隐杆线虫生殖细胞凋亡 Fig. 5 The apoptosis of Caenorhabditis elegans germ cells induced by mining area water environment 不同样品柱子上的不同小写字母表示样品间差异显著(P<0.05,LSD法) Different lowercase letters on the columns indicate significant differences among different samples (P<0.05, LSD method) |
由于采煤矿区环境常有重金属污染的风险,而秀丽隐杆线虫生长发育与其有明显的关联[24],因此我们对水样的污染元素含量做了检测,结果见表1。地表水环境质量标准GB 3838—2002 Ⅱ类水标准[25]规定,地表水环境中铜、锌、铬、砷、氟的标准限值分别为1.0、1.0、0.05、0.05、1.0 mg·L−1。由表1可以看出,矿区水环境样品中铜质量浓度为0.43~1.45 μg·L−1,锌质量浓度为0.23~5.01 μg·L−1,铬质量浓度为11.12~22.77 μg·L−1,砷质量浓度为5.36~15.85 μg·L−1,氟质量浓度为0.73~2.20 μg·L−1。由此可以发现,采煤塌陷区水环境中铜、锌、铬、砷、氟含量远低于标准GB 3838—2002 Ⅱ类水标准[25]限值。其中,W1、W2、W3、W4、W5、W6的铜含量分别是WCK的36.25、26.50、19.50、29.75、17.75、10.75倍,铬含量分别是WCK的3.23、2.39、1.78、2.35、1.66、1.58倍,砷含量分别是WCK的8.95、5.39、4.10、6.54、3.03、3.49倍,氟含量分别是WCK的5.79、4.13、3.32、3.50、2.82、1.92倍。
将水样污染元素的含量与秀丽隐杆线虫生长发育指标做相关性分析得到表2,由表2可以看出,水环境中铜、铬、砷、氟含量与秀丽隐杆线虫的半数致死时间、体长、产卵数目呈显著负相关关系,与线虫生殖细胞凋亡数目呈显著正相关关系。
|
|
表 1 矿区水样主要污染元素的含量1) Table 1 Contents of the major pollutant elements in water samples of mining area |
|
|
表 2 秀丽隐杆线虫发育指标与水环境中污染元素含量的相关性分析1) Table 2 Correlation analyses of Caenorhabditis elegansgrowth and development indexes and pollution element contents in water environment |
矿区水环境中铜、铬、砷、氟的含量差异较大,结合相关性分析结果可以发现,水环境对秀丽隐杆线虫发育的抑制作用可能与铜、铬、砷、氟含量密切相关,矿区水环境中铜、铬、砷、氟含量的增加对秀丽隐杆线虫的发育造成了一定的影响。
2.2 土壤线虫群落结构对淮北矿区土壤环境的响应 2.2.1 矿区土壤环境对土壤线虫营养类群的影响对不同矿区土壤的线虫群落结构进行分析,共鉴定出19个属(表3),SCK、S1、S2、S3、S4、S5、S6分别鉴定出18、15、16、15、16、16、16个属。矿区土壤样品S1、S2、S3、S4、S5、S6鉴定出的线虫属数均低于SCK,表明采煤矿区的土壤环境能够降低土壤线虫属的数目。图6显示,不同矿区土壤样地的线虫优势类群均为植物寄生线虫。土壤线虫个体数目占线虫群落个体总数10%以上的为优势线虫属,SCK的优势属为短体属,矿区土壤样品S1的优势属为螺旋属,S2的优势属为螺旋属、矮化属、短体属和丝尾垫刃属,S3的优势属为螺旋属、矮化属和垫刃属,S4的优势属为螺旋属、矮化属和短体属,S5的优势属为螺旋属、矮化属和短体属,S6的优势属为螺旋属和矮化属。
|
|
表 3 不同类群的土壤线虫占比 Table 3 The proportions of different soil nematode genera |
与SCK相比,S1、S2、S3、S4、S5、S6的植物寄生线虫相对丰度分别增加了42.36%、25.77%、28.55%、19.86%、21.03%、12.34%;而食细菌线虫相对丰度明显低于SCK,S1、S2、S3、S4、S5的食细菌线虫相对丰度较SCK分别减少了51.96%、54.21%、55.17%、47.58%、23.12%。从开采年限看,与S4相比,S1的植物寄生线虫相对丰度增加了18.77%;从采样点离矿井距离来看,石台矿点S4、S5、S6的食细菌线虫相对丰度存在明显差异,S5、S6的食细菌线虫相对丰度较S4分别增加了46.68%、112.45%。上述结果表明,采煤矿区土壤中线虫属的数目减少,植物寄生线虫相对丰度增加。
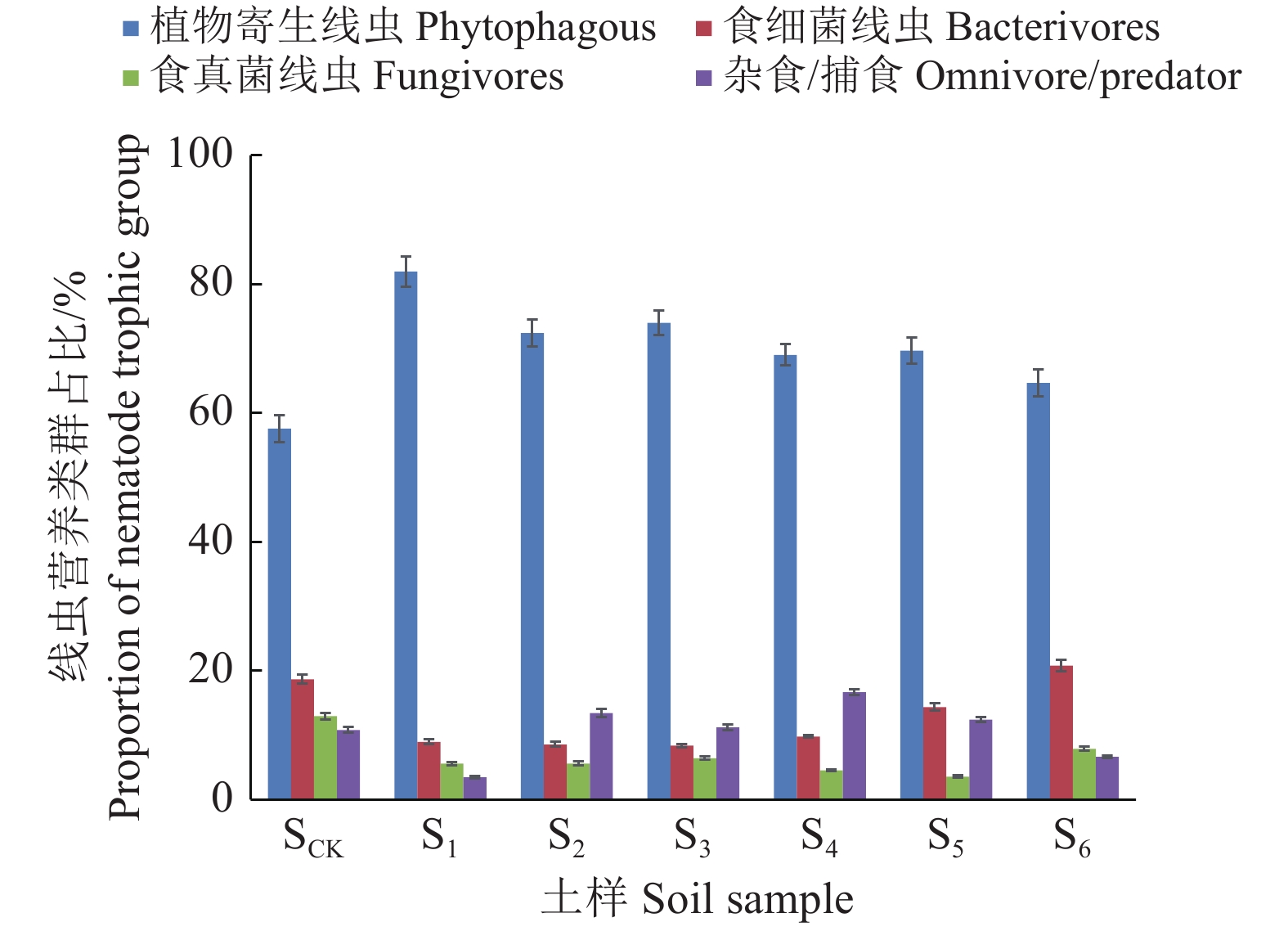
|
图 6 不同营养类群的土壤线虫占比 Fig. 6 The proportions of different soil nematode trophic groups |
矿区不同样地的土壤线虫生态指数测定结果见表4,由表4可以发现,与SCK相比,矿区土壤样品S1、S2、S3、S4、S5、S6的香农多样性指数(H′)、瓦斯乐斯卡指数(WI)显著低于SCK,而植物寄生线虫成熟度指数(PPI)显著高于SCK(P<0.05),其中,S1、S2、S3、S4、S5、S6的香农多样性指数较SCK分别降低了36.84%、8.50%、5.67%、11.74%、8.91%、6.88%,瓦斯乐斯卡指数较SCK分别降低了67.27%、63.64%、63.64%、61.82%、52.73%、20.00%,植物寄生线虫成熟度指数较SCK分别增加了48.77%、24.69%、20.99%、24.07%、24.69%、15.43%;表明采煤矿区土壤的线虫群落结构稳定性降低,土壤健康状况变差。
|
|
表 4 矿区土壤样品中线虫的生态指数1) Table 4 The ecological indices of nematode in soil samples of mining area |
从开采年限上看,与S1相比,S4的香农多样性指数、瓦斯乐斯卡指数、均匀度指数、自由生活线虫成熟度指数显著增加,优势度指数和植物寄生线虫成熟度指数显著降低(P<0.05),表明采矿时间的增加会降低土壤质量,其中S4的香农多样性指数、瓦斯乐斯卡指数、均匀度指数、自由生活线虫成熟度指数分别为S1的1.40、1.17、1.42、2.50倍,而优势度指数比S1降低了68.29%,植物寄生线虫成熟度指数降低了16.60%;表明采矿时间的增加使土壤线虫群落结构稳定性降低,土壤健康状况变差。
从采样点与矿井距离来看,沈庄矿点S1、S2、S3的植物寄生线虫成熟度指数存在显著差异(P<0.05),距离矿井越远,植物寄生线虫成熟度指数越小;石台矿点S4、S5、S6的瓦斯乐斯卡指数和自由生活线虫成熟度指数存在显著差异(P<0.05),距离矿井越远,瓦斯乐斯卡指数越大,自由生活线虫成熟度指数越小。结果表明随着采样点与矿井距离的增加,土壤线虫群落结构稳定性增强,土壤质量更好。
2.2.3 土壤线虫群落结构与矿区土壤中主要污染元素的关系由于采煤矿区土壤环境常有重金属污染的风险,而土壤线虫群落结构与其有明显的相关性[26],因此我们对土样主要重金属含量做了检测,结果见表5。土壤环境质量标准GB 15618—1995国家二级标准[27]规定,土壤环境中铬、铜、锌、铅、镉、砷、汞的标准限值分别为200、100、250、300、0.30、30、0.50 mg·kg-1。由表5可以看出,矿区土壤样品中铬质量分数为45.84~54.24 mg·kg−1,铜质量分数为17.91~23.62 mg·kg−1,锌质量分数为50.99~60.58 mg·kg−1,铅质量分数为15.78~23.77 mg·kg−1,镉质量分数为0.10~0.19 mg·kg−1,砷质量分数为9.28~16.35 mg·kg−1,汞质量分数为0.09~0.28 mg·kg−1。其中,S1、S2、S3、S4、S5、S6的铬含量较SCK分别提高了30.79%、19.51%、10.66%、25.03%、10.54%、16.88%,铜含量较SCK分别提高了59.38%、38.19%、29.82%、28.07%、44.67%、20.85%,锌含量较SCK分别提高了44.00%、37.60%、25.12%、31.00%、26.72%、21.20%;表明矿区土壤中铬、铜、锌的含量差异较大。
|
|
表 5 土壤样品中主要污染元素含量1) Table 5 Contents of major pollutant elements in soil samples |
将矿区土壤样品重金属含量与土壤线虫群落结构的相关指标做相关性分析得到表6,由表6可以看出,土壤样品中铬含量与香农多样性指数显著负相关,与植物寄生线虫成熟度指数显著正相关(P<0.05);铜含量与食真菌线虫相对丰度、香农多样性指数、瓦斯乐斯卡指数、自由生活线虫成熟度指数显著负相关(P<0.05),与植物寄生线虫相对丰度、植物寄生线虫成熟度指数极显著正相关(P<0.01);锌含量与食真菌线虫相对丰度、瓦斯乐斯卡指数显著、极显著负相关(P<0.05、P<0.01),与植物寄生线虫相对丰度、植物寄生线虫成熟度指数极显著正相关(P<0.01);铅含量与香农多样性指数、均匀度指数显著负相关(P<0.05),与优势度指数、植物寄生线虫成熟度指数显著正相关(P<0.05)。
|
|
表 6 土壤线虫生态指标与土壤环境中污染元素含量的相关性分析1) Table 6 Correlation analysis of soil nematode ecological indexes and pollution element contents in soil environment |
结合表5、表6结果可以发现,土壤线虫群落结构的变化可能与铬、铜、锌含量的差异密切相关,矿区土壤中铬、铜、锌含量的增加对土壤线虫群落结构的稳定性造成了一定的损害。
3 讨论与结论 3.1 线虫发育指标对矿区水环境的响应秀丽隐杆线虫是一种国际公认的模式生物,结构简单,具有60%~80%的人类同源基因,一直应用于相关的毒理学试验,被当做是生物安全性测试的一个组成部分[28]。吉宗慧等[29]研究显示,高浓度的硫化汞会在一定程度上抑制线虫的生长发育;郭肖颖等[16]研究显示,随着铁矿区水环境中重金属含量的增加,线虫生殖生长发育的毒性也会增大。上述结果表明,秀丽隐杆线虫暴露在含重金属的水环境中,会对线虫的生长发育造成不同程度的损害。本研究模式生物秀丽隐杆线虫的水环境暴露试验结果显示,采煤矿区的水环境会降低线虫寿命和存活率、减少线虫体长、降低后代产卵数,同时诱导线虫生殖细胞凋亡,且煤矿开采时间越长,采样点离矿井越近,对线虫发育指标的抑制作用越显著。
水中污染元素含量的检测结果揭示,矿区水质各项污染元素含量均符合国家地表水环境质量标准GB3838—2002 Ⅱ类水标准[25],表明采煤塌陷区水环境质量达到了集中式生活饮用水地表水源地一级保护区的水质要求,这与蔡月等[30]研究结果相一致。另一方面,虽然试验所取水环境样品都符合GB3838—2002 Ⅱ类水标准[25],但由于水中污染元素的种类和含量不同,对线虫生长、生殖发育的影响也不同,煤矿开采时间越长,采样点离矿井越近,线虫生长发育受到的抑制作用越大。相关性分析结果显示,秀丽隐杆线虫的发育抑制作用可能与矿区水环境中铜、铬、砷、氟的含量密切相关,表明活体秀丽隐杆线虫对矿区水环境质量的监测预警效果更灵敏,更能反映矿区水环境质量的细微变化。
3.2 线虫群落结构对矿区土壤环境的响应在土壤生态系统中,土壤线虫是一类十分活跃的生物,对于土壤有机质的分解、养分循环和土壤理化性状的改善等都具有十分重要的作用,在土壤生态链中占有重要地位[31]。土壤线虫的群落组成可以反映当地土壤的健康状况、污染状况、有机物质的输入状况及自然和外界干扰的程度等[11-13]。随着对土壤线虫生态多样性研究的深入,土壤线虫常作为生物多样性的指示因子评价土壤的健康状况和土壤生态系统的稳定性[32-33]。华建峰等[34]研究发现,矿区土壤中砷浓度的增加会降低土壤线虫群落的环境质量,土壤线虫食物网受到的外界干扰显著增大。高雅等[35]研究发现,煤矿开采会减少土壤线虫群落结构的多样性,降低稳定性。本文土壤线虫群落结构的分析结果表明,采煤矿区土壤环境会降低土壤线虫属的数目,增加土壤中有害线虫植物寄生线虫的相对丰度,同时土壤线虫香农多样性指数、瓦斯乐斯卡指数、均匀度指数、自由生活线虫成熟度指数显著降低,优势度指数和植物寄生线虫成熟度指数显著增加,表明矿区环境降低了土壤线虫物种多样性和线虫群落结构的稳定性,土壤健康状况显著变差。煤矿开采时间越长,采样点离矿井越近,对土壤线虫的影响愈大。
土壤中污染元素含量的分析结果揭示,矿区土壤各项污染元素含量符合土壤环境质量标准GB 15618—1995国家二级标准[27],土壤状况总体良好,土壤指标符合保障农业生产、维护人体健康的土壤需求,这与孙浩等[36]对淮北矿区土壤重金属环境评价的结果一致。另一方面,虽然所取土壤样品都符合GB 15618—1995土壤二级标准[27],但由于土壤重金属的种类和含量不同,线虫群落结构对其的响应也不同,煤矿开采时间越长,采样点离矿井越近,土壤线虫群落结构的多样性和稳定性越低,土壤健康状况越差。相关性分析结果显示,土壤线虫群落结构的变化可能与矿区土壤中铬、铜、锌的含量密切相关。表明土壤线虫群落结构的变化对矿区土壤环境的监测预警更灵敏,更能反映矿区土壤环境的细微变化。
综上所述,采煤矿区水环境使秀丽隐杆线虫寿命和成活率降低、体长变短、产卵数减少,同时诱导线虫生殖细胞凋亡,且煤矿开采时间越长,采样点距离矿井愈近,对线虫发育指标的抑制作用越显著。采煤矿区土壤环境使土壤线虫属的数目减少,植物寄生线虫的相对丰度增加,同时线虫香农多样性指数、瓦斯乐斯卡指数和自由生活线虫成熟度指数显著降低,植物寄生线虫成熟度指数显著提高;表明矿区环境降低了土壤质量,且煤矿开采时间越长,采样点距离矿井愈近,对土壤线虫群落结构的影响越大。因此,秀丽隐杆线虫发育指标对水环境的响应,以及土壤线虫群落结构对土壤环境的响应,可以很好地指示出淮北采煤矿区的水环境质量和土壤环境质量。
| [1] |
张妍, 张磊, 程红光, 等. 南方某矿区土壤镉污染及作物健康风险研究[J]. 农业环境科学学报, 2020, 39(12): 2752-2761. DOI:10.11654/jaes.2020-0485 (  0) 0) |
| [2] |
耿宜佳, 彭书传, 王晓辉, 等. 淮南煤矿区生态环境综合评价[J]. 安徽农业科学, 2016, 44(17): 73-76. DOI:10.3969/j.issn.0517-6611.2016.17.026 (  0) 0) |
| [3] |
周晓雪, 孙建明, 刘建霞. 某大型铁钛矿区地下水环境现状调查与评价[J]. 城市地质, 2013, 8(3): 35-38. DOI:10.3969/j.issn.1007-1903.2013.03.009 (  0) 0) |
| [4] |
陆金, 赵兴青. 铜陵狮子山矿区土壤重金属污染特征及生态风险评价[J]. 环境化学, 2017, 36(9): 1958-1967. DOI:10.7524/j.issn.0254-6108.2017010304 (  0) 0) |
| [5] |
张浩, 王辉, 汤红妍, 等. 铅锌尾矿库土壤和蔬菜重金属污染特征及健康风险评价[J]. 环境科学学报, 2020, 40(3): 1085-1094. (  0) 0) |
| [6] |
杨莎, 程雨蒙, 王雷, 等. 安徽淮北百善煤矿废弃地土壤重金属污染评价[J]. 江苏师范大学学报(自然科学版), 2017, 35(2): 4-6. (  0) 0) |
| [7] |
孙立强, 孙崇玉, 刘飞, 等. 淮北煤矿周边土壤重金属生物可给性及人体健康风险[J]. 环境化学, 2019, 38(7): 1453-1460. DOI:10.7524/j.issn.0254-6108.2018092801 (  0) 0) |
| [8] |
OCHIAGHA K E, OKOYE P A C, EBOAGU N C. The geo-accumulation index of some heavy metals in the roadsides soils of Onitsha South Local Government Area Anambra State[J]. Science Journal of Chemistry, 2020, 8(2): 42-47. (  0) 0) |
| [9] |
YEATES G W. Nematodes as soil indicators: Functional and biodiversity aspects[J]. Biology and Fertility of Soils, 2003, 37(4): 199-210. DOI:10.1007/s00374-003-0586-5 (  0) 0) |
| [10] |
BONGERS T. The maturity index: An ecological measure of environmental disturbance based on nematode species composition[J]. Oecologia, 1990, 83(1): 14-19. DOI:10.1007/BF00324627 (  0) 0) |
| [11] |
WANG X, NIELSEN U N, YANG X, et al. Grazing induces direct and indirect shrub effects on soil nematode communities[J]. Soil Biology & Biochemistry, 2018, 121: 193-201. (  0) 0) |
| [12] |
LIU Y B, LI X Y, LIU Q Z. Soil nematode communities in jujube (Ziziphus jujuba Mill. ) rhizosphere soil under monoculture and jujube/wheat (Triticum aestivum Linn. ) intercropping systems, a case study in Xinjiang arid region, northwest of China
[J]. European Journal of Soil Biology, 2016, 74: 52-59. DOI:10.1016/j.ejsobi.2016.02.001 (  0) 0) |
| [13] |
KALETTA T, HENGARTNER M O. Finding function in novel targets: C. elegans as a model organism
[J]. Nature Reviews Drug Discovery, 2006, 5(5): 387-398. DOI:10.1038/nrd2031 (  0) 0) |
| [14] |
GILES A C, RANKIN C H. Behavioral and genetic characterization of habituation using Caenorhabditis elegans
[J]. Neurobiology of Learning and Memory, 2009, 92(2): 139-146. DOI:10.1016/j.nlm.2008.08.004 (  0) 0) |
| [15] |
LAKOWSKI B, HEKIMI S. Determination of life-span in Caenorhabditis elegans by four clock genes
[J]. Science, 1996, 272(5264): 1010-1013. DOI:10.1126/science.272.5264.1010 (  0) 0) |
| [16] |
郭肖颖, 王磊, 王斌, 等. 铁矿区水环境样品对秀丽隐杆线虫的毒性研究[J]. 生态毒理学报, 2015, 10(6): 219-228. (  0) 0) |
| [17] |
DHAWAN R, DUSENBERY D B, WILLIAMS P L. Comparison of lethality, reproduction, and behavior as toxicological endpoints in the nematode Caenorhabditis elegans
[J]. Journal of Toxicology and Environmental Health: Part A, 1999, 58(7): 451-462. DOI:10.1080/009841099157179 (  0) 0) |
| [18] |
KELLY K O, DERNBURG A F, STANFIELD G M, et al. Caenorhabditis elegans msh-5 is required for both normal and radiation-induced meiotic crossing over but not for completion of meiosis
[J]. Genetics, 2000, 156(2): 617-630. DOI:10.1093/genetics/156.2.617 (  0) 0) |
| [19] |
JENKINS W R. A rapid centrifugal-flotation technique for separating nematodes from soil[J]. Plant Disease Reporter, 1964, 48: 692-692. (  0) 0) |
| [20] |
YEATES G W, BONGERS T. Nematode diversity in agroecosystems[J]. Agriculture Ecosystems and Environment, 1999, 74(1/2/3): 113-135. (  0) 0) |
| [21] |
YEATES G W, BONGERS T, DE GOEDE R G, et al. Feeding habits in soil nematode families and genera: An outline for soil ecologists[J]. Journal of Nematology, 1993, 25(3): 315-331. (  0) 0) |
| [22] |
尹文英. 中国土壤动物检索图鉴[M]. 北京: 科学出版社, 1998: 51-89.
(  0) 0) |
| [23] |
HARADA H, KURAUCHI M, HAYASHI R, et al. Shortened lifespan of nematode Caenorhabditis elegans after prolonged exposure to heavy metals and detergents
[J]. Ecotoxicology and Environmental Safety, 2007, 66(3): 378-383. DOI:10.1016/j.ecoenv.2006.02.017 (  0) 0) |
| [24] |
TEJEDA-BENÍTEZ L, NOGUERA-OVIEDO K, AGA D S, et al. Toxicity profile of organic extracts from Magdalena River sediments[J]. Environmental Science and Pollution Research, 2018, 25(2): 1519-1532. DOI:10.1007/s11356-017-0364-9 (  0) 0) |
| [25] |
国家环境保护总局科技标准司. 地表水环境质量标准: GB3838—2002[S]. 北京: 中国标准出版社, 2002: 1-5.
(  0) 0) |
| [26] |
ŠALAMÚN P, HANZELOVÁ V, MIKLISOVÁ D. Variability in responses of soil nematodes to trace element contamination[J]. Chemosphere, 2018, 210: 166-174. DOI:10.1016/j.chemosphere.2018.07.009 (  0) 0) |
| [27] |
国家环境保护局科技标准司. 土壤环境质量标准: GB15616—1995[S]. 北京: 中国标准出版社, 1995: 1-3.
(  0) 0) |
| [28] |
HUNT P R. The C. elegans model in toxicity testing
[J]. Journal of Applied Toxicology, 2017, 37(1): 50-59. DOI:10.1002/jat.3357 (  0) 0) |
| [29] |
吉宗慧, 高珊, 王旗, 等. 硫化汞对灭活菌喂饲的秀丽隐杆线虫生长发育的影响[J]. 毒理学杂志, 2019, 33(3): 173-178. (  0) 0) |
| [30] |
蔡月, 李小平, 赵亚楠, 等. 蒙陕大型煤矿开采区水质化学特征与健康风险[J]. 生态学杂志, 2018, 37(2): 482-491. (  0) 0) |
| [31] |
HOEKSEMA J D, LUSSENHOP J, TEERI J A. Soil nematodes indicate food web responses to elevated atmospheric CO2[J]. Pedobiologia, 2000, 44(6): 725-735. DOI:10.1078/S0031-4056(04)70085-2 (  0) 0) |
| [32] |
LI J, WANG D, FAN W, et al. Comparative effects of different organic materials on nematode community in continuous soybean monoculture soil[J]. Applied Soil Ecology, 2018, 125: 12-17. DOI:10.1016/j.apsoil.2017.12.013 (  0) 0) |
| [33] |
SONG D, TARIQ A, PAN K, et al. Effects of straw mulching practices on soil nematode communities under walnut plantation[J]. Scientific Reports, 2020, 10(1): 15351. DOI:10.1038/s41598-020-72530-5 (  0) 0) |
| [34] |
华建峰, 林先贵, 尹睿, 等. 矿区砷污染对土壤线虫群落结构特征的影响[J]. 生态与农村环境学报, 2009, 25(1): 79-84. DOI:10.3969/j.issn.1673-4831.2009.01.016 (  0) 0) |
| [35] |
高雅, 陆兆华, 魏振宽, 等. 露天煤矿区生态风险受体分析: 以内蒙古平庄西露天煤矿为例[J]. 生态学报, 2014, 34(11): 2844-2854. (  0) 0) |
| [36] |
孙浩, 周春财, 徐仲雨, 等. 淮北矿区土壤重金属空间分布与环境评价[J]. 中国科学技术大学学报, 2018, 48(7): 560-566. DOI:10.3969/j.issn.0253-2778.2018.07.006 (  0) 0) |
 2022, Vol. 43
2022, Vol. 43


