2. 甘肃省农业科学院 植物保护研究所, 甘肃 兰州 730070
2. Institute of Plant Protection, Gansu Academy of Agricultural Sciences, Lanzhou 730070, China
茎属线虫Ditylenchus Filipjev隶属于动物界Animalia线虫门Nematode垫刃目Tylenchida粒科Anguinidae[1],已报道的茎属线虫近100种[2],但目前被承认的茎属线虫有效种只有60多个[3]。与其他线虫相比,茎属线虫具有食性较广的特点,多数种以真菌为食,只有少数种可以侵染高等植物。一般为害植物的块茎、球茎和鳞茎,也可为害地上部分,引起组织变色、坏死、腐烂和畸形,造成重大的经济损失[4]。茎属线虫中危害较大的有水稻茎线虫D. angustus、鳞球茎线虫D. dipsaci、腐烂茎线虫D. destructor、非洲茎线虫D. africanus与食菌茎线虫D. myceliophagus[2, 5]。其中,鳞球茎线虫、腐烂茎线虫和水稻茎线虫,可对农业生产造成严重危害[5]。鳞球茎线虫寄主范围超过500种,主要发生于气候温和地带,危害植物鳞茎及地上部分[6]。腐烂茎线虫可侵染200多种植物,主要发生于温带地区,为害植物地下部分,在缺少高等植物的情况下还可取食多种真菌[7]。2014年Zhang等[8]在中国花生主要种植地区发现1种新的茎线虫,并将其鉴定为花生茎线虫D. arachis。
中药党参为桔梗科Campanulaceae植物党参Codonopsis pilosula (Franch) Nannf、素花党参C. pilosula (Franch) Nannf.var.modesta (Nannf.) L.T.Shen或川党参(C. tangshen Oliv.)的干燥根,主要功效为补血、降压、补中益气、增强机体抵抗能力、增加血红蛋白与红细胞、治疗贫血和降低血压等[9]。在甘肃省,党参主要产于定西、陇南、天水和平凉等地,产量约占全国产量的70%和出口量的80%,已成为甘肃省农民增收的重要经济作物之一[10]。目前,已报道的危害党参的茎线虫仅有腐烂茎线虫[11]。2019年甘肃农业大学植物保护学院线虫实验室在甘肃党参主产区调查党参线虫病发生分布时,发现1种与腐烂茎线虫差异较大的茎线虫群体,本文拟通过形态与分子生物学相结合的方法,明确党参中分离的茎线虫分类地位,为该线虫的有效防治提供理论依据。
1 材料与方法 1.1 材料供试线虫分离自甘肃省渭源县(104° 15′ 5.76″E,35° 11′ 30.84 ″N)党参病样。
1.2 方法 1.2.1 线虫分离将党参病样冲洗干净,自然晾干后拍照观察。采用改良贝曼漏斗法[12]分离线虫,将病根切成约1 cm小段,放入漏斗内铺垫的两层面巾纸上,加水浸没党参根段。10~12 h后,收集指形管中的线虫悬浮液,备用。
将线虫悬浮液移入1.5 mL离心管,用有效氯为5 g/L的 NaClO溶液消毒2 min后,3000 r/min离心2 min,弃上清液,随后将下层线虫悬浮液用无菌水冲洗2~3遍。以5 g/L硫酸链霉素与5 g/L氨苄青霉素混合液消毒10 min后,再次离心,吸出消毒液,无菌水冲洗3遍后定容,在4 ℃条件下保存备用,方法参考文献[13]。
1.2.2 形态学鉴定参照谢辉等[14]方法将线虫温热杀死固定后,在Axio Lab.A1显微镜(德国Carl Zeiss公司)下观察形态特征,并进行形态特征测量,参照文献[2,7]方法计算测量值。
1.2.3 分子生物学鉴定参照王江岭等[15]方法略有改进,提取单条线虫DNA。挑取单条雌虫于无菌水中清洗3遍,然后挑入装有10 μL 线虫裂解液(Worm lysis buffer,WLB)的200 μL PCR反应管中,离心后依次在液氮中处理1 min,85 ℃水浴2 min,步骤重复2次。随后加入1 mg/mL蛋白酶K 1 μL,于PCR仪中65 ℃温育1 h,保持95 ℃ 10 min使蛋白酶K失活,14000 r/min离心5 min,最后于4 ℃条件下保存备用。
采用线虫ITS区通用引物18S:5′-TTGATTACGTCCCTGCCCTTT-3′、26S:5′-TTTCACT-CGCCGTTACTAAGG-3′[16]与TW81:5′-G-TTTCCGTAGGTGAACCTGC-3′、AB28:5′-ATATG-CTTAAGTTCAGCGGGT-3′[17];28S区引物D2A:5′-ACAAGTACCGTGAGGGAAAGTTG-3′与D3B:5′-TCGGAAGGAACCAGCTACTA-3′[18],对线虫ITS-rDNA、28S D2/D3基因序列进行PCR扩增。反应采用25 μL体系:上、下游引物(10 μmol/L)各1 μL,2× San Taq Fast PCR Master Mix (含蓝色染料) 12.5 μL(上海生工),DNA模板3 μL,ddH2O 7.5 μL。
扩增程序:94 ℃ 4 min;94 ℃ 10 s,55 ℃ 20 s,72 ℃ 15 s,38个循环;72 ℃ 5 min,于4 ℃条件下保存备用。
扩增产物经电泳检测后送往北京擎科西安分公司测序,使用软件SeqMan进行序列拼接,于NCBI进行BLAST比对,下载相似性较高的序列,以BI法构建系统发育树:使用MAFFT比对分析后,用DAMBE检测饱和度,用软件MrMTgui连接PAUP与MrModelTest进行模型选择,最后使用Mrbayes以最佳模型构建系统发育树,用FigTree修正发育树。
1.2.4 特异性引物PCR扩增参照Zhang等[19]花生茎线虫ITS区特异性引物DARF (5′-GGGAAGGCGAAGCTAAGCTA-3′)与DARR(5′-AACTTAGAGGCCAACGAAGCC-3′),对“1.2.3”中提取的DNA模板和腐烂茎线虫群体DNA模板进行PCR扩增,扩增程序为:94 ℃ 4 min;94 ℃ 10 s,52 ℃ 20 s,72 ℃ 15 s,38个循环;72 ℃ 5 min,4 ℃保存。取5 μL扩增产物用25 g/L的琼脂糖凝胶电泳,用凝胶成像系统观察、拍照。
1.2.5 ITS-rDNA区段PCR-RFLP分析选用DdeⅠ、HinfⅠ、Tru9Ⅰ(MseⅠ)、SduⅠ这4种内切酶,参照Subbotin等[20]的方法对线虫ITS-rDNA区PCR产物进行酶切。酶切体系20 μL:PCR纯化产物8 μL,内切酶(10 U/μL)1 μL,与内切酶相对应的Buffer 2 μL,ddH2O 9 μL。37 ℃条件下反应 1.5 h,以腐烂茎线虫作为对照。反应产物用20 g/L的琼脂糖凝胶电泳,使用凝胶成像系统观察、拍照。使用在线软件Wbcuter 2.0(
雌虫:虫体圆柱形,两端较细,经温热杀死后呈“J”字型,尾部稍向腹部弯曲(图1A)。唇区低平,稍有溢缩。口针长8.2~9.8 μm。中食道球梭形,有瓣。基部球较发达(图1B),半月体较清晰,位于排泄孔前1至数个体环处(图1C)。食道腺稍覆盖于肠背部。侧线6条。阴门横裂,稍有突起,位于虫体后端。单生殖腺前伸,后阴子宫囊发达,长度是肛阴距的55%。尾部向末端逐渐变窄,端圆(图1D、1G)。
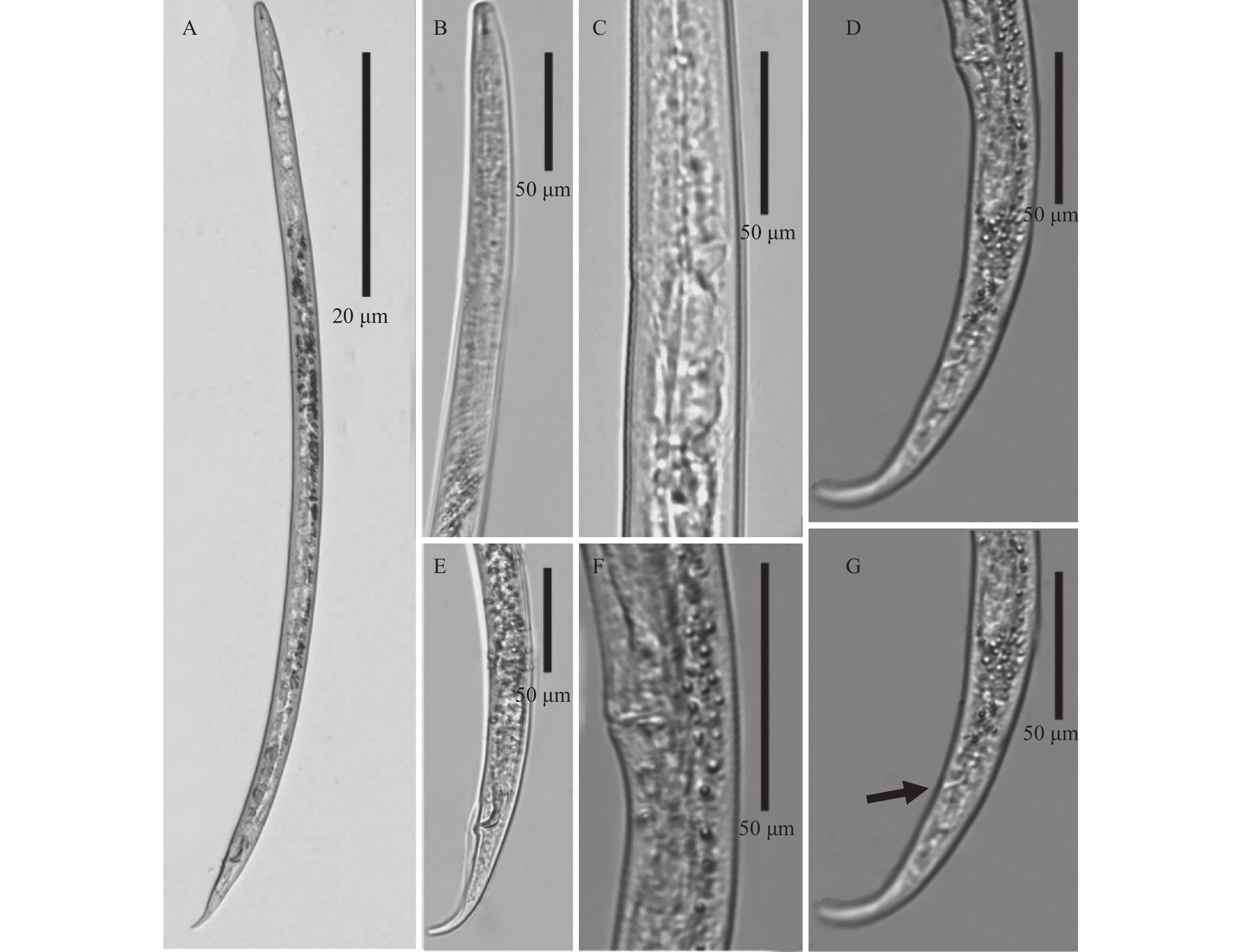
|
图 1 花生茎线虫的光学显微镜结果 Fig. 1 Light photomicrographs of Ditylenchus arachis A:雄虫虫体;B:线虫体前端;C:半月体和排泄孔;D:雌虫尾;E:雄虫尾;F:阴门;G:肛门 A: Male entire body; B: Anterior body; C: Hemizonid and excretory pore; D: Female tail; E: Male tail; F: Vulva; G: Anus |
雄虫:除生殖系统外,与雌虫相似。交合刺后端向腹面弯曲,引带较短;交合伞明显,较长,自交合刺前端向后延伸,约至尾长的70%(图1E)。
2.2 形态特征指标对分离得到的茎线虫群体进行形态特征测量,将其测量值与花生茎线虫河北群体测量值进行比较(表1),甘肃党参茎线虫群体与花生茎线虫河北群体的形态特征测量均值虽存在差异,其中,甘肃党参茎线虫群体除体长、阴门至头端的长度与体长的比值、尾长均值略大外,其他均值均略小。但是所有测量范围值基本一致,故根据形态学特征初步将甘肃党参茎线虫群体鉴定为花生茎线虫。
|
|
表 1 甘肃党参茎线虫群体与河北原始群体测量值比较1) Table 1 Morphometrics comparison of Ditylenchus arachis population from Codonopsis pilosula in Gansu with original Hebei population of D. arachis |
采用花生茎线虫特异性引物对甘肃党参茎线虫群体与腐烂茎线虫群体进行PCR扩增,结果(图2)显示,甘肃党参茎线虫群体扩增条带为150~200 bp,符合花生茎线虫特异性引物扩增条带长度(171 bp),而腐烂茎线虫未扩增到任何片段。
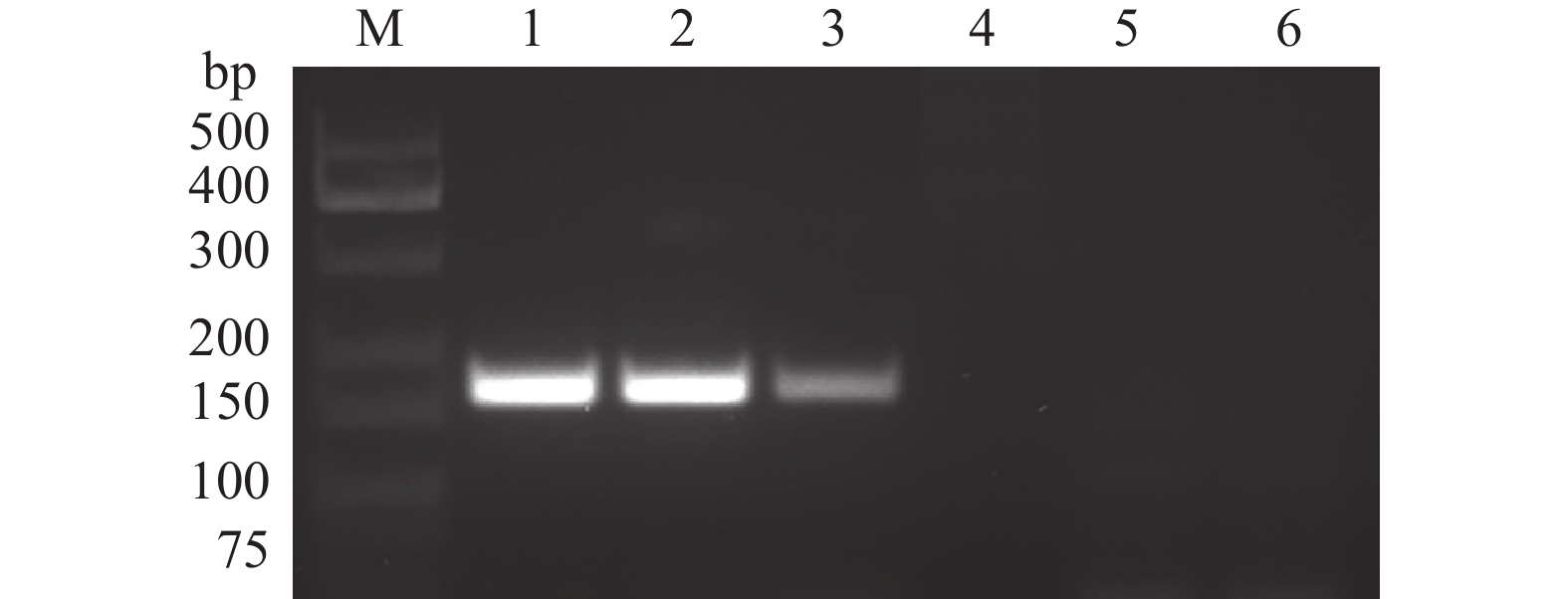
|
图 2 甘肃党参茎线虫群体与腐烂茎线虫ITS特异性引物扩增电泳图 Fig. 2 Electrophoresis of PCR products amplified from Ditylenchus arachis from Codonopsis pilosula in Gansu and D. destructor using species-specific ITS primers M:DNA分子量标准(75~500 bp);1~3:甘肃党参茎线虫群体;4~6:腐烂茎线虫 M:DNA marker (75−500 bp);1−3:D. arachis population from Codonopsis pilosula in Gansu;4−6:D. destructor |
采用线虫ITS区通用引物18S、26S与TW81、AB28双向测序后拼接序列,比对后得到引物TW81、AB28扩增的具体序列长度,为816 bp,上传至NCBI获得序列号为MW207369和MW207370。28S区引物D2A与D3B双向测序后拼接序列,得到序列长度为777 bp,上传至NCBI,获得序列号为MW207367和MW207368。NCBI中BLAST比对发现,甘肃党参茎线虫群体ITS-rDNA序列与河北花生茎线虫群体KX426050序列相似性为99.75%,仅存在2个碱基差异;28S D2/D3区序列与河北花生茎线虫群体KX426054序列相似性为100%,无碱基差异。
基于ITS-rDNA构建的系统发育树(图3A),甘肃党参茎线虫群体与花生茎线虫聚为一枝,与腐烂茎线虫聚为一大枝,结果表明甘肃茎线虫群体ITS-rDNA序列与花生茎线虫亲缘关系最近,其次为腐烂茎线虫,与其他茎属线虫距离较远。
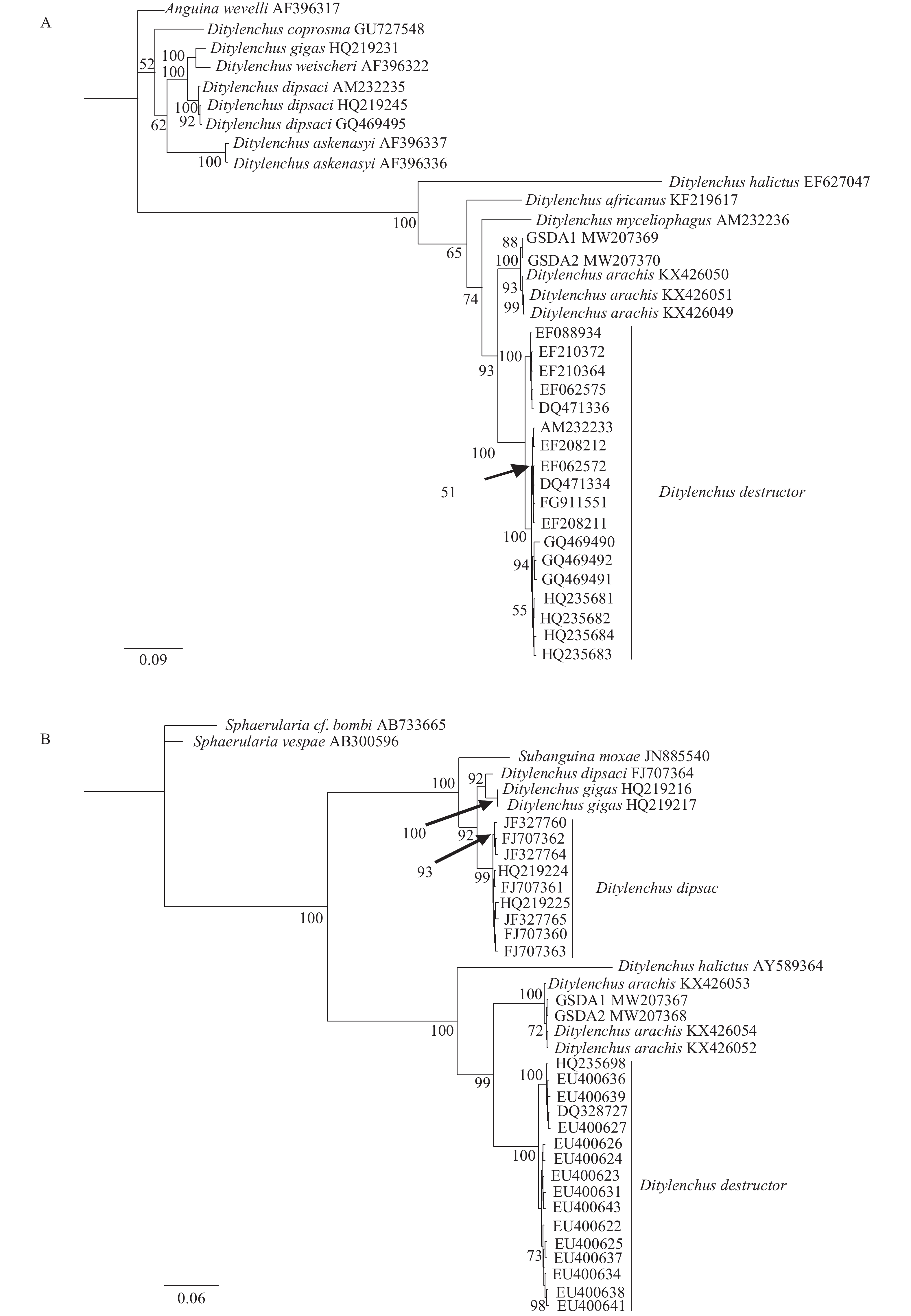
|
图 3 基于 ITS-rDNA (A) 和28s D2/D3 (B)的甘肃党参茎线虫(GSDA1、GSDA2)系统发育树 Fig. 3 Phylogenetic tree of stem nematode (GSDA1、GSDA2) from Codonopsis pilosula in Gansu Province based on ITS-rDNA (A) and 28s D2/D3 (B) 最佳模型均为GTR+I+G,分支上数字表示后验概率 All best model were GTR+I+G; The posterior probability values exceeding 50% are given on appropriate clades |
采用贝叶斯法构建28S D2/D3区系统发育树(图3B)。结果显示,甘肃党参茎线虫群体与花生茎线虫聚为一支,与腐烂茎线虫聚为一大支,表明甘肃党参茎线虫群体28S D2/D3区序列与花生茎线虫亲缘关系最近,其次为腐烂茎线虫,与其他茎属线虫距离较远。据此,将甘肃党参茎线虫群体鉴定为花生茎线虫。
2.5 ITS-rDNA区段PCR-RFLP分析在NCBI数据库中下载花生茎线虫序列KX426050,使用软件BioEdit与线虫ITS-rDNA通用引物TW81/AB28比对,截去序列两端,得到以引物TW81/AB28扩增的花生茎线虫序列。以软件Wbcuter 2.0使用4种内切酶DdeⅠ、HinfⅠ、SduⅠ、Tru9Ⅰ(MseⅠ)对甘肃党参茎线虫群体、花生茎线虫与腐烂茎线虫进行酶切,得到酶切片段数量及大小(表2)。由表2可知,甘肃党参茎线虫群体与花生茎线虫群体酶切片段大小一致,且明显区别于腐烂茎线虫。以内切酶DdeⅠ、HinfⅠ、Tru9Ⅰ(MseⅠ)和SduⅠ对甘肃党参茎线虫群体与腐烂茎线虫ITS-rDNA区PCR纯化产物进行酶切,结果如图4所示,结果与使用软件Wbcuter 2.0的酶切结果一致,甘肃党参茎线虫群体与腐烂茎线虫群体酶切结果存在明显差异。
|
|
表 2 软件Wbcuter酶切甘肃党参茎线虫和腐烂茎线虫ITS序列结果 Table 2 Enzyme digestion results of Ditylenchus arachis population from Codonopsis pilosula in Gansu and D. destructor ITS sequences by Wbcuter |
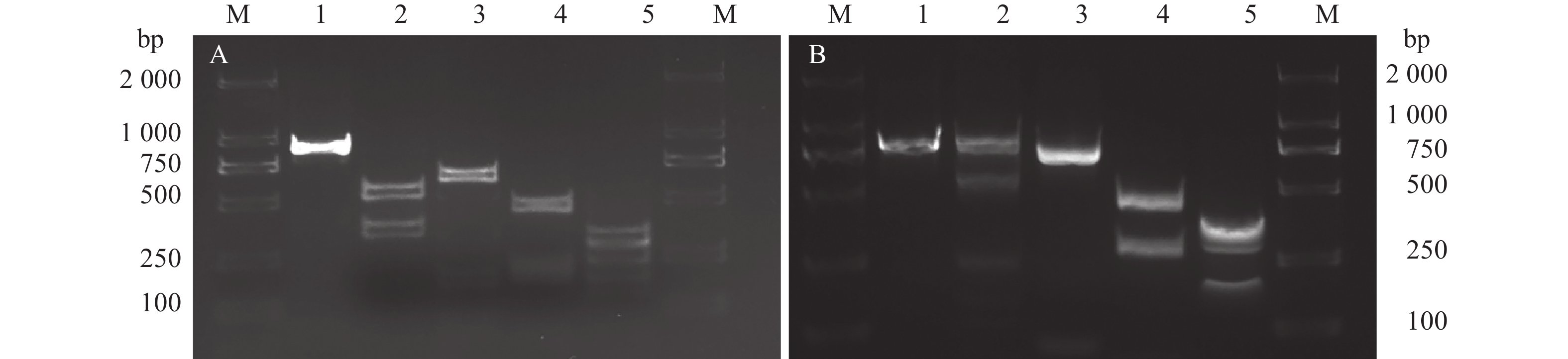
|
图 4 腐烂茎线虫(A)与甘肃党参茎线虫(B)ITS-rDNA区段PCR-RFLP结果 Fig. 4 Electrophoresis of ITS-rDNA amplified by PCR-RFLP for Ditylenchus destructor (A) and D. arachis population in Gansu (B) M:DNA marker(100~2000 bp);1:PCR;2:DdeⅠ;3:HinfⅠ;4:Tru9Ⅰ(MseⅠ);5:SduⅠ |
茎线虫属是植物线虫病害中一类重要的病原,也是最难进行种类鉴定的属之一,大多数种类的特征描述仍然存在着不完善的问题[2, 4]。花生茎线虫病普遍发生于我国花生主产区,一段时间误认为是腐烂茎线虫为害,章淑玲[21]对采集到的线虫群体,进行形态特征与分子特征的比对分析,发现该种虽与腐烂茎线虫亲缘关系较近,却与腐烂茎线虫存在差异,明显区别于其他茎属线虫,将其命名为花生茎线虫D. arachis。本研究对采集的甘肃党参茎线虫群体进行鉴定,通过形态特征与分子特征比对分析,发现该线虫群体形态特征与花生茎线虫相符,形态测量值除体长、阴门至头端的长度与体长比、尾长均值略大外,其他测量值均值均略小,但是所有测量范围基本一致,差异可能是地理环境因素造成的。通过ITS-rDNA与28S D2/D3区序列系统发育分析,发现甘肃党参茎线虫群体与花生茎线虫群体聚为一支,明显区别于腐烂茎线虫。花生茎线虫特异性引物PCR扩增与ITS-rDNA区段PCR-RFLP结果显示,甘肃党参茎线虫群体与花生茎线虫群体ITS-rDNA区段无明显差异。综上所述,将甘肃党参茎线虫群体鉴定为花生茎线虫。
花生茎线虫主要为害花生地下部分,发病植株呈现矮化、黄化症状,严重时可导致全株枯死,植株地下部分表现出根系发育不良、固氮根瘤减少、结荚数减少、果荚表面呈黑褐色腐烂斑、种皮褐变皱缩等症状,线虫可侵染花生的果荚、种粒、胚栓及根茎,研究表明,2年内干燥的果荚和种皮还可分离出线虫[22]。本研究采集的发病党参,芦头部表面呈黑褐色腐烂斑、表皮褐变皱缩等症状,与花生茎线虫为害花生果荚症状相似,但由于分离得到的线虫群体较少,未得到大量繁殖群体,致病性测定困难,故花生茎线虫是否为害党参及为害时具体症状需要进一步研究。
研究表明该线虫适生性强、食性广、抗逆性强,对其他作物有潜在危害风险,是一种危害较大的病原线虫[23-25]。该线虫经缓慢脱水处理,在−80 ℃条件下保存35 d后,仍有部分线虫可以复苏为害[24]。花生性喜温暖,种子萌发温度较高,生长最适温度为23~30 ℃[26-27]。党参喜冷凉湿润气候,最适温度18~20 ℃[28]。渭源县党参种植区温度较低,由于采集环境存在较大差异,本研究采集线虫群体与河北地区花生茎线虫群体在致病性、适生性等方面是否存在差异,有待进一步研究分析。
本研究对甘肃省渭源县党参病样中分离的茎线虫,结合形态特征与分子特征进行鉴定,将其鉴定为花生茎线虫,结果表明花生茎线虫已在甘肃省定殖。甘肃省渭源县以中药材和马铃薯为主要经济作物,其产品为地下块根和块茎,而线虫主要为害植物地下部,因此,应该对该地区线虫病害予以足够的重视。
| [1] |
ANON. Tylenchida parasites of plants and insects[J]. Journal of Phytopathology, 2001, 149(7/8): 491. DOI:10.1046/j.1439-0434.2001.0596k.x (  0) 0) |
| [2] |
谢辉. 植物线虫分类学[M]. 第2版. 北京: 高等教育出版社, 2005.
(  0) 0) |
| [3] |
VOVLAS N, TROCCOLI A, PALOMARES-RIUS-RIUS J E, et al. A new stem nematode, Ditylenchus oncogenus n. sp. (Nematoda: Tylenchida), parasitizing sowthistle from Adriatic coast dunes in southern Italy
[J]. Journal of Helminthology, 2016, 90(2): 152-165. DOI:10.1017/S0022149X14000947 (  0) 0) |
| [4] |
STURHAN D, BRZESKI M W, NICKLE W R. Stem and bulb nematodes, Ditylenchus spp.[M]. Boca Raton: CRC Press, 2020.
(  0) 0) |
| [5] |
段玉玺. 植物线虫学[M]. 北京: 科学出版社, 2011.
(  0) 0) |
| [6] |
龙海, 齐小峰, 谢泳桂, 等. 影响全球食品安全的植物线虫综述[J]. 中国植保导刊, 2017, 37(12): 78-83. DOI:10.3969/j.issn.1672-6820.2017.12.017 (  0) 0) |
| [7] |
赵洪海, 梁晨, 张浴, 等. 腐烂茎线虫 (Ditylenchus destructor Thorne, 1945) 生物学研究进展
[J]. 生物技术通报, 2021, 37(7): 45-55. (  0) 0) |
| [8] |
ZHANG S L, LIU G K, JANSSEN T, et al. A new stem nematode associated with peanut pod rot in China: Morphological and molecular characterization of Ditylenchus arachisn. sp. (Nematoda: Anguinidae)
[J]. Plant Pathology, 2014, 63(5): 1193-1206. DOI:10.1111/ppa.12183 (  0) 0) |
| [9] |
杜毛笑, 邱黛玉, 任凤英, 等. 间作植物和茬口对连作党参生长和品质产量的影响[J]. 西北植物学报, 2021, 41(11): 1884-1892. (  0) 0) |
| [10] |
徐雪芬, 倪春辉, 李惠霞, 等. 党参根腐病病原菌鉴定及其室内毒力测定[J]. 浙江农业学报, 2021, 33(1): 96-103. DOI:10.3969/j.issn.1004-1524.2021.01.12 (  0) 0) |
| [11] |
NI C H, ZHANG S L, LI H X, et al. First report of potato rot nematode, Ditylenchus destructor Thorne, 1945 infecting Codonopsis pilosula in Gansu province, China
[J]. Journal of Nematology, 2020, 52: e2020-e2087. DOI:10.21307/jofnem-2020-087 (  0) 0) |
| [12] |
HOOPER D J. Extraction and processing of plant and soil nematodes[M]//LUC M, SIKORA R A, BRIDGE J. Plant Parasitic Nematodes in Subtropical and Tropical Agriculture. Wallingford: CAB International, 1990: 45-68.
(  0) 0) |
| [13] |
徐鹏刚. 甘肃定西马铃薯腐烂茎线虫的发生、病原学研究及品种抗性评价[D]. 兰州: 甘肃农业大学, 2016.
(  0) 0) |
| [14] |
谢辉, 冯志新. 丝尾垫刃属新种的描述 (线虫门: 垫刃科) Ⅱ: 异头丝尾垫刃线虫新种和香港丝尾垫刃线虫新种[J]. 植物病理学报, 1996, 26(3): 283-288. (  0) 0) |
| [15] |
王江岭, 张建成, 顾建锋. 单条线虫DNA提取方法[J]. 植物检疫, 2011, 25(2): 32-35. (  0) 0) |
| [16] |
VRAIN T C, WAKARCHUK D A, LEVESQUE A C, et al. Intraspecific rDNA restriction fragment length polymorphism in the Xiphinema americanum group
[J]. Fundamental and Applied Nematology, 1992, 15(6): 563-573. (  0) 0) |
| [17] |
SUBBOTIN S A, VIERSTRAETE A, DE LEY P, et al. Phylogenetic relationships within the cyst-forming nematodes (Nematoda, Heteroderidae) based on analysis of sequences from the ITS regions of ribosomal DNA[J]. Molecular Phylogenetics and Evolution, 2001, 21(1): 1-16. DOI:10.1006/mpev.2001.0998 (  0) 0) |
| [18] |
SUBBOTIN S A, STURHAN D, CHIZHOV V N, et al. Phylogenetic analysis of Tylenchida Thorne, 1949 as inferred from D2 and D3 expansion fragments of the 28S rRNA gene sequences[J]. Nematology, 2006, 8(3): 455-474. DOI:10.1163/156854106778493420 (  0) 0) |
| [19] |
ZHANG S L, CHENG X, LIU G K, et al. Development of species-specific primer pairs for the molecular diagnosis of Ditylenchus arachis
[J]. International Journal of Agriculture and Biology, 2019, 21(1): 99-104. (  0) 0) |
| [20] |
SUBBOTIN S A, DEIMI A M, ZHENG J W, et al. Length variation and repetitive sequences of Internal Transcribed Spacer of ribosomal RNA gene, diagnostics and relationships of populations of potato rot nematode, Ditylenchus destructor Thorne, 1945 (Tylenchida: Anguinidae)
[J]. Nematology, 2011, 13(7): 773-785. DOI:10.1163/138855410X551923 (  0) 0) |
| [21] |
章淑玲. 花生茎线虫 (Ditylenchus arachis n. sp. ) 新种鉴定、生物学及快速检测技术[D]. 福州: 福建农林大学, 2016.
(  0) 0) |
| [22] |
王文玉. 花生茎线虫 (Ditylenchus arachis) 的生物学特性及种群多样性[D]. 福州: 福建农林大学, 2017.
(  0) 0) |
| [23] |
邓明雪, 肖顺, 王文玉, 等. 花生茎线虫对花生根的趋向、定位及侵染特性[J]. 福建农林大学学报(自然科学版), 2018, 47(2): 148-152. (  0) 0) |
| [24] |
陈思怡, 邓明雪, 陈晶伟, 等. 花生茎线虫的脱水存活方式及耐低温能力[J]. 福建农林大学学报(自然科学版), 2020, 49(5): 577-582. (  0) 0) |
| [25] |
章淑玲, 林谷园, 肖顺. 花生茎线虫 Ditylenchus arachis 在真菌上的培养条件研究
[J]. 植物保护, 2018, 44(2): 100-103. (  0) 0) |
| [26] |
谢明惠, 陈浩梁, 张光玲, 等. 温度、土壤湿度和播种深度对花生种子萌发及幼苗生长的影响[J]. 花生学报, 2017, 46(2): 52-59. (  0) 0) |
| [27] |
中国农业百科全书总编辑委员会农业经济卷编辑委员会, 中国农业百科全书编辑部. 中国农业百科全书: 农业经济卷[M]. 北京: 中国农业出版社, 1991.
(  0) 0) |
| [28] |
王静. 中兽医中草药党参的临床应用与育苗栽培技术[J]. 中兽医学杂志, 2019(5): 105. (  0) 0) |
 2022, Vol. 43
2022, Vol. 43


