番石榴Psidium guajava又名芭乐、鸡屎果,是桃金娘科Myrtaceae番石榴属Psidium的常绿灌木或小乔木,原产美洲热带地区,现已在广东、广西、福建、海南等地广泛种植[1-3]。番石榴果实营养丰富, 清香可口,富含多种人体所必需的营养成分及抗氧化物质,具有很高的食用和药用价值[4-5],现已成为岭南地区果农增收的主要经济作物之一。
番石榴果实品质是决定其商品价值及能否推广的重要依据。进行果实品质的科学评价,对优化番石榴品种结构、筛选优良种质及创制新品种等具有重要意义。目前在番石榴果实品质评价研究中,大多数是基于对番石榴单一品种不同成熟期的品质评价或采后营养物质和生物活性功能研究[6-8],而基于主成分分析方法探讨番石榴不同品种间的果实品质差异却鲜见报道。主成分分析法是剔除多个变量中相互重叠的信息,即通过降维的思想将多个信息转化为几个不相关的综合变量的多元统计方法[9],适用于综合评价候选个体。这种方法既能把握待评类型的综合性状表现,又能简化评价程序,已被广泛应用于果蔬品质指标筛选和品质综合评价研究[10-13]。
转录组学是从RNA水平研究物种的基因表达,目前已成为挖掘植物功能基因、探索其有效成分的生物合成途径与调控机制、阐明基因功能的重要手段,不论是否存在参考基因组,均能获得转录本、差异基因表达、转录发生位点、次生代谢产物途径等信息,为理解物种的生物学及生物化学等信息提供技术手段[14]。鉴于此,本研究选用6个品种的番石榴果实为研究对象,对果实品质的11个指标进行测定,并结合主成分分析方法综合评价其品质优劣。同时进行RNA-seq分析,结合生物信息学方法对转录组数据的功能基因进行注释分类,并分析代谢通路,深入挖掘黄酮类化合物合成相关的功能基因,为番石榴品种选育、种植结构优化升级及分子育种提供参考依据。
1 材料与方法 1.1 材料及试剂6个品种‘红宝石’、‘西瓜红’、‘胭脂红’、‘珍珠’、‘水晶’和‘金斗香’的番石榴果实于2021年6月统一采收于广东省中山市坦洲镇,挑取大小一致、色泽和形状相近、九分成熟度且无病虫危害的番石榴果实。
试剂盒均购自苏州科铭生物技术有限公司,常规试剂氢氧化钠、酚酞、碳酸氢钠、磷酸氢二钠、磷酸二氢钠等均为国产分析纯,购买于赛默飞世尔科技(中国)有限公司。
1.2 方法 1.2.1 果实品质测定将6种番石榴果实,每种设3个生物学重复,每个重复10个果实,送往广东省农业科学院农业质量标准与监测技术研究所,进行可溶性固形物、总酸、总糖、还原糖和蔗糖含量等果实品质测定。
1.2.2 总酚与类黄酮含量测定分别按照植物总酚和植物类黄酮试剂盒说明书进行操作,计算公式如下:
| $ 总酚含量= 0.890 \times (D_{760 \;{\rm{nm}}}-0.001\;2) \div m_{干},$ | (1) |
| $ 类黄酮含量= 0.797 \times (D_{760\; {\rm{nm}}} -0.000\;7) \div m_{干},$ | (2) |
式中,m干为样品干质量。
1.2.3 总抗氧化能力测定根据总抗氧化能力(DPPH法和ABTS法)试剂盒说明书操作规程,总抗氧化能力计算公式如下:
| $ {\rm{DPPH}}清除能力=1.414 \times (D_{515 \;{\rm{nm}}} + 0.008\;1) \div m_{鲜},$ | (3) |
| $ {\rm{ABTS}}清除能力=1.424 \times (D_{515 \;{\rm{nm}}} +0.001\;2) \div m_{鲜},$ | (4) |
式中,m鲜为样品鲜质量,以标准曲线上获得的抗氧化剂 Trolox 的物质的量来表示样本的DPPH自由基清除能力和ABTS 自由基清除能力。
1.2.4 还原型抗坏血酸与单宁含量测定分别根据还原型抗坏血酸(Ascorbic acid,AsA)和单宁含量测定试剂盒说明书进行操作,计算公式如下:
| $ {\rm{AsA}}含量=227.270 \times (D_{350\; {\rm{nm}}} +0.018) \div m_{鲜},$ | (5) |
| $ 单宁含量=1.218 \times (D_{275 \;{\rm{nm}}} - 0.013\;4) \div m_{鲜}。$ | (6) |
利用植物总RNA提取试剂盒抽提6个品种番石榴果实的总RNA,送至北京诺禾致源科技股份有限公司进行高通量测序。将纯化后的总RNA检测其完整性后进行浓度测定,用合格的RNA样品构建文库。质检合格后进行Illumina测序,将预处理的数据进行过滤获得Clean reads,结合番石榴基因组,采用Trinity将Clean reads 进行拼接、组装,获得参考基因用于后续的定量差异分析。
通过 FPKM 标准化对番石榴样本的基因表达量进行分析,然后利用edgeR软件进行差异基因的表达分析。将获得的原始reads进行标准化校正,随后通过统计学分析模型计算假设检验概率(P),最后进行多重假设检验校正,得到FDR,基于FDR≤0.01和|log2FC|≥2 (FC为上下调倍数)筛选差异基因,建立差异表达基因(Differentially expressed gene,DEG)集,随后将DEG通过GOseq和KOBAS软件分别进行GO功能富集和KEGG通路富集分析。
1.2.6 荧光定量PCR(qPT-PCR)分析根据天根生化科技有限公司的多糖多酚植物总RNA提取试剂盒RNAprep Pure的说明书进行总RNA抽提。参照FastKing Gdna Dispelling RT SuperMix反转录试剂盒(TaKaRa)说明书的操作步骤进行反转录,以GAPDH作为内参基因,FLS、CYP73A、CYP75A和CHS基因的特异性引物均利用 NCBI 网站设计,委托上海生工生物工程股份有限公司进行引物合成,序列见表1。利用TaKaRa公司的 TB Green® Premix Ex TaqTM II(Tli RNaseH Plus)试剂盒和Applied Biosystems实时荧光定量PCR仪进行扩增,通过2−ΔΔCt方法计算出不同番石榴品种的基因表达量。
|
|
表 1 差异表达基因的qRT-PCR引物序列 Table 1 Primer sequences of differentially expressed genes for qRT-PCR |
试验数据使用SPSS 22.0软件进行单因素ANOVA和主成分分析。
2 结果与分析 2.1 番石榴果实品质分析将6个品种番石榴果实的营养成分测定结果进行方差分析及 LSD多重比较(表2),由表中数据可见,不同品种间变异系数较大。可溶性固形物含量由高到低依次为:‘珍珠’ > ‘红宝石’ > ‘水晶’ > ‘西瓜红’ > ‘胭脂红’ > ‘金斗香’,平均值为8.74%;总糖含量的平均值为65.06 mg/g,变化趋势类似可溶性固形物;蔗糖含量的平均值为18.26 mg/g,含量最高的‘红宝石’可达30.91 mg/g,是含量最低的‘西瓜红’(13.38 mg/g)的2.31倍;总酸含量最高的为‘金斗香’和‘胭脂红’,与其他4组相比差异显著( P<0.05);总酚含量最高的为‘金斗香’(11.51 mg/g),最低的为‘水晶’(7.67 mg/g),两者差异显著,而‘红宝石’和‘珍珠’间差异不显著;类黄酮含量的平均值为7.75 mg/g,高含量组为‘金斗香’和‘胭脂红’,低含量组为‘水晶’和‘西瓜红’,两组差异显著;抗坏血酸含量最高为‘红宝石’,可达2.42 mg/g,与其他品种相比差异显著,最低的为‘水晶’,仅有1.09 mg/g;单宁含量由高到低依次为:‘水晶’ > ‘西瓜红’ > ‘红宝石’ > ‘金斗香’ > ‘胭脂红’ > ‘珍珠’,平均值为5.31 mg/g;ABTS清除能力的平均值为31.72 μmol/g,‘金斗香’和‘胭脂红’的ABTS清除能力较高,‘西瓜红’和‘水晶’的ABTS清除能力较低;DPPH清除能力最高的为‘胭脂红’(1004.30 μmol/g),最低的为‘西瓜红’(333.77 μmol/g),前者是后者的3.01倍。
|
|
表 2 番石榴果实的营养成分比较1) Table 2 Comparison of the nutritional components of guava fruits |
|
|
采用SPSS 20.0软件对数据进行主成分分析,结果见表3。前3个主成分的累计方差贡献率达84.533%,可代表11个番石榴指标的绝大部分信息,能够作为番石榴选优、评价的综合指标。为更好地评价各参数与成分因子之间的关系,旋转处理所提取的主成分因子,使单个变量在较少的几个因子上具有较高的载荷,其载荷值的大小反映各变量在主成分中的重要程度[15](表4)。主成分1的主要正相关因素有可溶性固形物、总酸、总糖、蔗糖、还原糖、单宁、类黄酮和总酚含量,ABTS和DPPH清除能力。这些指标中,蔗糖含量的正向载荷最大;其次载荷较大的是DPPH清除能力、总酚及还原糖含量。主成分1主要展现的是番石榴的营养和口感,该评价结果与通常果实品质的评价结果一致;类黄酮含量和ABTS清除能力作为主成分2的代表指标;单宁含量作为主成分3的代表指标。
|
|
表 3 主成分的特征值、方差贡献率和累计方差贡献率 Table 3 Eigenvalue, variance contribution rate and cumulative variance contribution rate of principal components |
|
|
表 4 番石榴果实主要质地参数相关矩阵的规格化特征向量 Table 4 Normalized eigenvectors of correlation matrix of main textural parameters in guava fruits |
上述3个主成分能综合反映6个番石榴品种的果实品质指标。将主要品质指标原始数据标准化后,计算3个主成分的得分,以所选主成分对应的特征值占3个特征值总和的比例为权重,计算出不同番石榴品种的综合评价得分值(Y),各得分值与相应特征值的方差贡献百分率的乘积累加得出不同番石榴品种的综合评价指数(S = 0.41194 Y1 + 0.25950 Y2 + 0.17389 Y3),以此来评价不同番石榴品种的果实品质。由表5可知,6个番石榴品种中,综合品质排名依次为‘金斗香’、‘胭脂红’、‘红宝石’、‘珍珠’、‘西瓜红’和‘水晶’。
|
|
表 5 不同番石榴品种的主成分得分与综合评价指数 Table 5 Scores of principal components and synthetic analysis indexes for different guava cultivars |
将6个品种番石榴转录组数据进行功能注释后筛选出DEG。基于GO和KEGG 数据库,对DEG可能参与的生物过程和信号通路进行富集分析,结果见表6和表7。根据 KEGG分类,DEG主要注释到了苯丙烷的生物合成途径、淀粉和蔗糖的代谢途径以及植物激素信号转导;DEG的GO分析结果显示,3450个DEG,被分配到生物学过程的有321个,占总数的9.30%;被分配到细胞学组分的有74个,占总数的2.14%;被分配到分子功能的有3055个,占总数的88.55%(表7)。
|
|
表 6 番石榴果实差异表达基因(DEG)的KEGG 信号通路富集分析 Table 6 KEGG enrichment analysis of differentially expressed genes (DEGs) in guava fruit |
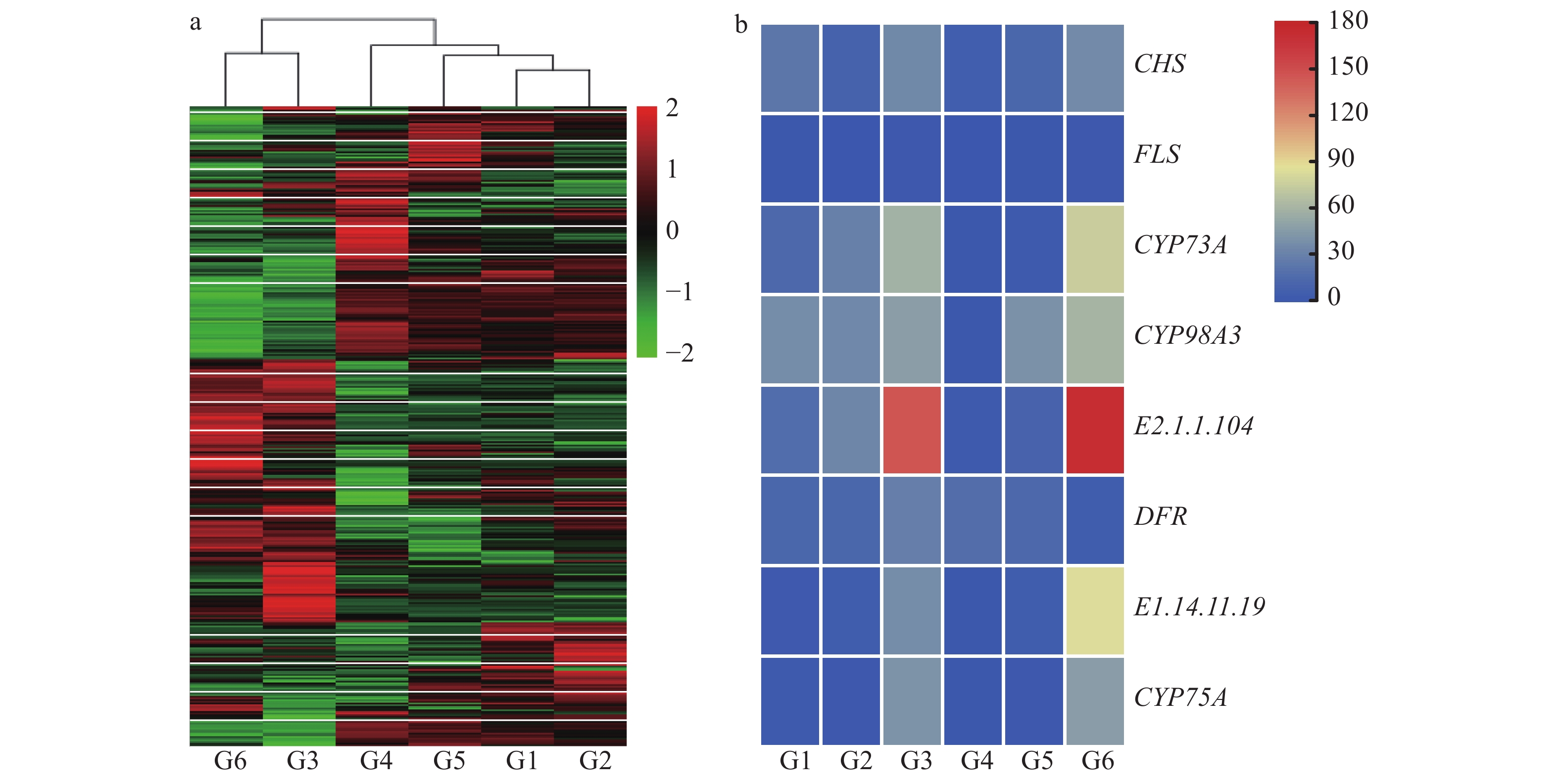
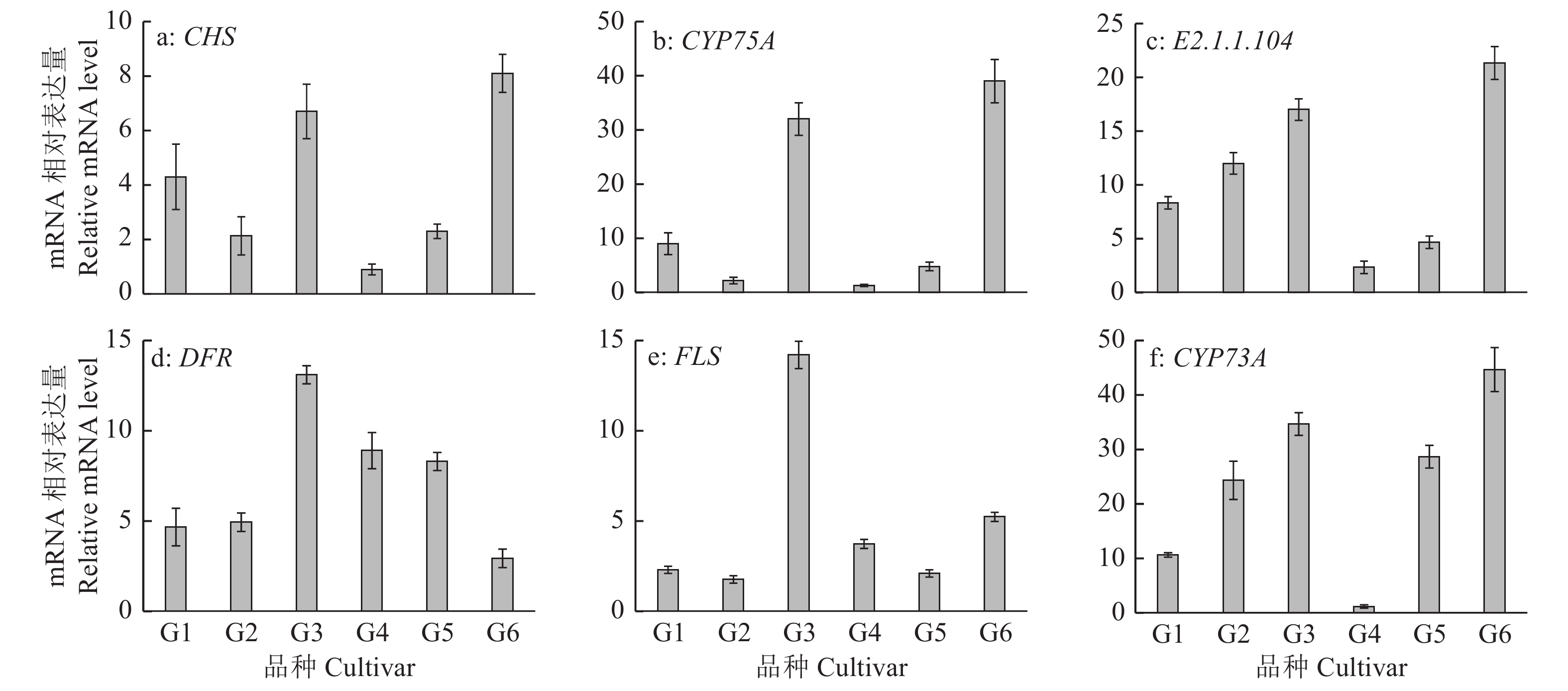
将差异基因进行聚类,根据DEG表达量热图(图1a)可知,‘红宝石’和‘西瓜红’的DEG聚为一类,‘胭脂红’和‘金斗香’的DEG聚为一类。深入分析黄酮类化合物的生物合成途径,发现基因CHS、CYP73A、FLS、CYP98A3、DFR、E2.1.1.104、E1.14.11.19和CYP75A在‘胭脂红’和‘金斗香’中显著上调表达(图1b)。通过qRT-PCR验证表明FLS基因在‘胭脂红’中表达量最高,‘西瓜红’中表达量最低,前者表达量是后者的10倍以上,CYP73A、CYP75A、E2.1.1.104和CHS基因均在‘金斗香’中表达量最高,‘珍珠’中表达量最低,其中CYP73A和CYP75A基因在‘金斗香’的中的表达量是‘珍珠’的30倍以上,而DFR基因在‘胭脂红’中表达量较高,‘金斗香’中表达量较低(图2)。这一结果不仅证实了转录组数据的可靠性,同时更好地解释了表2 中‘胭脂红’和‘金斗香’2组的类黄酮含量显著高于其他各组的原因。
|
图 1 6个品种番石榴果实差异基因(DEG)的表达情况 Fig. 1 The expressions of differential genes (DEGs) in fruits of six guava cultivars a:差异基因表达量热图;b:类黄酮合成信号通路中的DEG;G1:红宝石,G2:西瓜红,G3:胭脂红,G4:珍珠,G5:水晶,G6:金斗香 a:Heat map of differential gene expression; b: The DEGs in flavonoid synthesis signaling pathway; G1: Hongbaoshi, G2: Xiguahong, G3: Yanzhihong, G4: Zhenzhu, G5: Shuijing, G6: Jindouxiang |
|
图 2 差异表达基因的qRT-PCR分析 Fig. 2 The qRT-PCR analysis of differentially expressed genes G1:红宝石;G2:西瓜红;G3:胭脂红;G4:珍珠;G5:水晶;G6:金斗香 G1: Hongbaoshi; G2: Xiguahong; G3: Yanzhihong; G4: Zhenzhu; G5: Shuijing; G6: Jindouxiang |
|
|
表 7 番石榴果实差异表达基因(DEG)的GO 生物功能分析 Table 7 GO biofunctional analysis of differentially expressed genes (DEG) in guava fruit |
番石榴作为岭南地区的特色水果之一,其全身皆宝。番石榴叶被加入到民间药物中用来降血糖和降血压[16],番石榴果实具有治疗腹泻、痔疮,抑菌,抗氧化及抗肿瘤等多种活性[17-18]。番石榴品种众多且栽培历史悠久,在不同栽培环境下生长状态不同,外观色泽、风味也存在差异[19],品质良莠不齐。对番石榴果实进行综合评价,是有效利用和选择优异种质资源并推广栽培的基础和前提。本文选取了华南地区最常见的6个番石榴品种‘金斗香’、‘胭脂红’、‘水晶’、‘西瓜红’、‘珍珠’和‘红宝石’为研究对象,对其果实品质的11个指标进行全面分析,结合主成分分析方法,筛选得到‘金斗香’和‘胭脂红’的综合品质较佳,‘水晶’和‘西瓜红’较差,‘珍珠’和‘红宝石’居中。‘金斗香’番石榴是广东省农业科学院果树研究所在2018年从本地番石榴实生苗中选育出的新品种,该品种肉质细嫩软滑、香气浓郁且风味独特[20]。‘胭脂红’番石榴是广东著名的传统品种,近年来由于品种退化、管理放松、病虫害严重等原因,栽培面积和产量日渐减少。相比传统番石榴品种,大果番石榴(‘水晶’、‘西瓜红’、‘珍珠’和‘红宝石’)产量较高、早结丰产,但综合品质不及‘金斗香’和‘胭脂红’,尤其是类黄酮含量及自由基清除能力显著低于这2个品种。可见,‘金斗香’和‘胭脂红’可作为研究番石榴抗氧化活性遗传特性的重要资源。
黄酮类化合物是番石榴中重要的生物活性物质,其不仅是植株重要的抗逆物质,也是其果实发挥食用和药用价值的重要原因[21-22]。近年来的研究表明,不同果树品种黄酮类化合物的含量差异较大,如文良娟等[23]研究了不同品种芒果黄酮的抗氧化活性,发现不同品种间的抗氧化活性显著不同;曾少敏等[24]在不同品种梨的多酚类物质的抗氧化活性研究中也发现不同梨品种间的抗氧化能力存在差异;以及在柑橘、荔枝研究中发现的不同品种间黄酮类化合物的差异性[25-26]。本文研究发现6个品种番石榴间类黄酮含量差异较大,变异系数为0.46,变化范围在5.74~10.05 mg/g,‘金斗香’和‘胭脂红’的类黄酮含量较高,分别为9.76和10.05 mg/g,是‘水晶’(5.74 mg/g)的1.5倍以上。因果实中总酚含量和DPPH 清除能力与类黄酮含量存在显著正相关性[27],故本文中测得的总酚含量和DPPH清除能力的变异系数也较大。
黄酮类化合物的生物合成途径目前已基本清楚,各步骤催化反应所需的酶及其基因均有大量研究[28-29]。为解析不同番石榴品种间黄酮类化合物的差异机理及挖掘其合成的关键基因,本文进一步通过转录组测序技术分析6个品种番石榴的差异表达基因,发现黄酮类化合物生物合成途径中的关键基因CHS、FLS、CYP73A、CYP98A3、DFR、E2.1.1.104、E1.14.11.19和CYP75A在‘金斗香’和‘胭脂红’2个品种中明显上调,其中查尔酮合成酶(CHS)基因参与此生物合成途径中的多步反应,可见这8个基因在番石榴黄酮类化合物的生物合成过程中起关键作用,但具体的调控机制有待深入研究。本研究不仅为番石榴的品种选育和品种改良等提供理论基础,还为后续开展黄酮类物质的合成和积累等相关研究奠定基础。
| [1] |
宁琳, 陈豪君, 潘祖健, 等. 我国南亚热带地区番石榴种质资源保护现状[J]. 中国南方果树, 2015, 44(5): 147-149. DOI:10.13938/j.issn.1007-1431.20140650 (  0) 0) |
| [2] |
OSMAN S, EL-RAHMAN A A. Effect of slow release nitrogen fertilization on growth and fruiting of Guava under mid sinai conditions[J]. Australian Journal of Basic & Applied Sciences, 2009, 3(4): 4366-4375. (  0) 0) |
| [3] |
邵雪花, 赖多, 朱华兴, 等. 不同杀菌剂对番石榴枝枯病病原菌的毒力和田间防效[J]. 植物保护, 2019, 45(2): 199-203. DOI:10.16688/j.zwbh.2018144 (  0) 0) |
| [4] |
LIN C Y, YIN M C. Renal protective effects of extracts from guava fruit (Psidium guajava L.) in diabetic mice
[J]. Plant Foods for Human Nutrition, 2012, 67(3): 303-308. DOI:10.1007/s11130-012-0294-0 (  0) 0) |
| [5] |
PATEL P, SUNKARA R, WALKER L T, et al. Effect of drying techniques on antioxidant capacity of guava fruit[J]. Food and Nutrition Sciences, 2016, 7(7): 544-554. DOI:10.4236/fns.2016.77056 (  0) 0) |
| [6] |
彭燕, 张敏, 崔小丽, 等. 珍珠番石榴果实中的营养成分与活性物质分析[J]. 食品与机械, 2020, 36(8): 36-40. DOI:10.13652/j.issn.1003-5788.2020.08.006 (  0) 0) |
| [7] |
邱珊莲, 林宝妹, 张少平, 等. 不同成熟期番石榴果实品质特征与评价[J]. 食品安全质量检测学报, 2020, 11(24): 9230-9238. DOI:10.19812/j.cnki.jfsq11-5956/ts.2020.24.029 (  0) 0) |
| [8] |
GABER N B, EL-DAHY S I, SHALABY E A. Comparison of ABTS, DPPH, permanganate, and methylene blueassays for determining antioxidant potential of successive extracts from pomegranate and guava residues[J/OL]. Biomass Conversion and Biorefinery, 2021. [2021-12-30] https://doi.org/10.1007/s13399-021-01386-0.
(  0) 0) |
| [9] |
李跃红, 冉茂乾, 徐孟怀, 等. 不同产地红心猕猴桃品质的主成分及聚类分析[J]. 食品工业科技, 2021, 42(10): 222-228. DOI:10.13386/j.issn1002-0306.2020040315 (  0) 0) |
| [10] |
林蝉蝉, 何舟阳, 单文龙, 等. 基于主成分与聚类分析综合评价杨凌地区红色鲜食葡萄果实品质[J]. 果树学报, 2020, 37(4): 520-532. DOI:10.13925/j.cnki.gsxb.20190428 (  0) 0) |
| [11] |
LAUREATI M, BERTOLI S, BERGAMASCHI V, et al. Food neophobia and liking for fruits and vegetables are not related to Italian children’s overweight[J]. Food Quality & Preference, 2015, 40: 125-131. (  0) 0) |
| [12] |
郭海如, 崔雪梅, 李春生, 等. 基于主成分分析的硒、铜交互作用下油菜生理响应机制研究[J]. 西南农业学报, 2017, 30(11): 2468-2473. DOI:10.16213/j.cnki.scjas.2017.11.013 (  0) 0) |
| [13] |
LU C, FENG J, CHEN Y, et al. Tensor robust principal component analysis with a new tensor nuclear norm[J]. IEEE Transactions on Pattern Analysis and Machine Intelligence, 2020, 42(4): 925-938. DOI:10.1109/TPAMI.2019.2891760 (  0) 0) |
| [14] |
陈育青, 陈荣珠, 邹毅辉, 等. 闽草药公石松转录组分析及黄酮类合成功能基因的挖掘[J]. 分子植物育种, 2022, 20(14): 4654-4664. DOI:10.13271/j.mpb.020.004654 (  0) 0) |
| [15] |
池毓斌, 朱丽娟, 黄敏杰, 等. 鲜食橄榄品质综合评价模型的建立与验证[J]. 果树学报, 2017, 34(8): 1051-1060. DOI:10.13925/j.cnki.gsxb.20170051 (  0) 0) |
| [16] |
OJEWOLE J. Hypoglycemic and hypotensive effects of Psidium guajava Linn. (Myrtaceae) leaf aqueous extract
[J]. Methods & Findings in Experimental & Clinical Pharmacology, 2005, 27(10): 689-695. (  0) 0) |
| [17] |
COUTIO-RODRIGUEZ R, HERNANDEZ-CRUZ P, GILES-RIOS H. Lectins in fruits having gastrointestinal activity: Their participation in the Hemagglutinating property of Escherichia coli O157: H7
[J]. Archives of Medical Research, 2001, 32(4): 251-257. DOI:10.1016/S0188-4409(01)00287-9 (  0) 0) |
| [18] |
SHARMA R, KULKARNI G, SONAWANE M S, et al. A new endophytic species of Arthrinium (Apiosporaceae) from Jatropha podagrica
[J]. Mycoscience, 2014, 55(2): 118-123. (  0) 0) |
| [19] |
OLIVEIRA D, LOBATO A L, RIBEIRO S M R, et al. Carotenoids and vitamin C during handling and distribution of guava (Psidium guajava L. ), mango (Mangifera indica L. ), and papaya (Carica papaya L. ) at commercial restaurants
[J]. Journal of Agricultural Food Chemistry, 2010, 58(10): 6166-6172. DOI:10.1021/jf903734x (  0) 0) |
| [20] |
匡石滋, 朱华兴, 赖多, 等. 番石榴新品种‘金斗香’的选育[J]. 果树学报, 2018, 35(5): 646-648. (  0) 0) |
| [21] |
FU Y, CHEN J, LI Y J, et al. Antioxidant and anti-inflammatory activities of six flavonoids separated from licorice[J]. Food Chemistry, 2013, 141(2): 1063-1071. DOI:10.1016/j.foodchem.2013.03.089 (  0) 0) |
| [22] |
KANG J, XIE C, LI Z, et al. Flavonoids from acai (Euterpe oleracea Mart. ) pulp and their antioxidant and anti-inflammatory activities
[J]. Food Chemistry, 2011, 128(1): 152-157. DOI:10.1016/j.foodchem.2011.03.011 (  0) 0) |
| [23] |
文良娟, 刘昊, 王维. 不同品种芒果总黄酮的抗氧化活性[J]. 食品科学, 2011, 32(19): 79-82. (  0) 0) |
| [24] |
曾少敏, 杨健, 王龙, 等. 梨果实酚类物质含量及抗氧化能力[J]. 果树学报, 2014, 31(1): 39-44. DOI:10.13925/j.cnki.gsxb.2014.01.009 (  0) 0) |
| [25] |
钱井. 柑橘黄酮类化合物组分鉴定与抗氧化活性研究[D]. 杭州: 浙江大学, 2017.
(  0) 0) |
| [26] |
蒋侬辉, 刘伟, 金峰, 等. 35个荔枝品种抗氧化活性评价[J]. 果树学报, 2020, 37(4): 553-564. DOI:10.13925/j.cnki.gsxb.20190543 (  0) 0) |
| [27] |
PATHARE P, NILEGAONKAR S, AGTE V. Factors influencing the nutraceutical activity of guava fruits[J]. Advances in Food Science and Engineering, 2017, 1(3): 107-111. (  0) 0) |
| [28] |
YANG Y N, YAO G F, ZHENG D, et al. Expression differences of anthocyanin biosynthesis genes reveal regulation patterns for red pear coloration[J]. Plant Cell Reports, 2015, 34(2): 189-198. (  0) 0) |
| [29] |
邹丽秋, 王彩霞, 匡雪君, 等. 黄酮类化合物合成途径及合成生物学研究进展[J]. 中国中药杂志, 2016, 41(22): 4124-4128. (  0) 0) |
 2023, Vol. 44
2023, Vol. 44


