猪繁殖与呼吸综合征(Porcine reproductive and respiratory syndrome,PRRS),俗称“猪蓝耳病”,是导致养猪业重大损失的主要疾病之一;其防控较为困难与该病病原猪繁殖与呼吸综合征病毒(Porcine reproductive and respiratory syndrome virus,PRRSV)的遗传多样性有关。PRRSV是约15 kb的单链RNA病毒,有2种特征明确的基因型:Ⅰ型,又称为欧洲型(EU型);Ⅱ型,也称为北美型(NA型)。我国流行的PRRSV毒株绝大部分为NA型。2006年中国第1次爆发高致病性猪蓝耳病疫情,对养猪业造成了巨大损失[1-2] 。2013年,中国首次发现新的重组PRRSV毒株,称为类NADC30 (NADC30-like),该毒株引起的呼吸道症状不明显,死亡率低,但却会对母猪繁殖性能造成严重影响,母猪流产率高达30%[3-4]。近几年流行病学调查表明NADC30-like毒株已成为优势流行毒株,特别是在华南地区呈扩散态势,对养猪业构成了重大挑战[5]。过去,疫苗接种一直是预防PRRSV感染的主要策略。针对PRRSV的多种改良活疫苗和灭活疫苗已经开发出来,然而由于PPRSV的高度重组和变异,这些疫苗未能提供可持续的保护[6-8],猪场蓝耳病仍时有出现,因此急需一种行之有效的方法来抵抗PRRSV在猪场的传播。
利用CRISPR/Cas9基因编辑技术敲除PRRSV关键宿主因子是一个很有前景的方法。想要通过基因编辑技术制备出能够抵抗某一种病毒的猪,重要的前提条件是,需要知道该病毒与宿主互作的关键受体基因。目前只有为数不多的几种病毒受体得到了鉴定[9-11],CD163基因是目前最广为认知的病毒受体,Whitworth等[12]在2015年证实CD163基因敲除(CD163 gene knockout,CD163-KO)大白猪表现出显著的PRRSV耐药性,并且CD163基因修饰猪没有出现病毒血症和临床症状。2018年,华南农业大学吴珍芳教授课题组利用类似试验验证了CD163-KO杜洛克猪可以完全抵抗高致病性PRRSV的感染[13]。近年来国内外大量研究也证明CD163是PRRSV感染宿主细胞必不可少的蛋白分子,敲除CD163基因可使猪抵抗PRRSV的感染[14-20]。
本研究是在团队前期研究的基础上,利用CRISPR/Cas9基因编辑技术和体细胞核移植的方法,成功获得CD163-KO大白猪。接种国内目前流行的NADC30-like毒株进行攻毒试验,通过临床观察、免疫荧光试验、检测血清中抗体滴度和病毒RNA水平等方法,证明了所获得的CD163-KO大白猪能够完全抵抗NADC30-like毒株的感染;同时,为了评估基因修饰对种猪生产和繁殖性能的影响,我们对CD163-KO大白猪的生长速度、繁殖性能、肉料比等生产性能进行了分析,评估其生产性能和育种价值,为其可能的产业化应用奠定基础。
1 材料与方法 1.1 试验材料大白猪胎儿成纤维细胞由华南农业大学吴珍芳教授课题组分离培养并保存,代孕母猪由广东中芯种业科技有限公司提供。猪蓝耳病NADC30-like毒株为温氏食品集团股份有限公司研究院猪病研究室惠赠。
1.2 试验方法 1.2.1 猪CD163基因gRNA设计及靶向质粒pX330-CD163的构建针对猪CD163基因外显子7 (Exon 7)设计gRNA:选择GGTCGTGTTGAAGTACAACA为打靶位点,TGG为引导识别位点(图1)。表达gRNA的DNA序列在两端带上的酶切位点为BbsI,生物合成gRNA互补双链——正义链:5′-CACCGGTCGTGTTGAAGTACAACA-3′,反义链:5′-AAACTGTTGTACTTCAACACGACC-3′,退火后连接到载体pX330-U6-Chimeric_BB-CBh-hSpCas9(简称PX330,Addgene,货号42230),构成靶向质粒pX330-CD163。
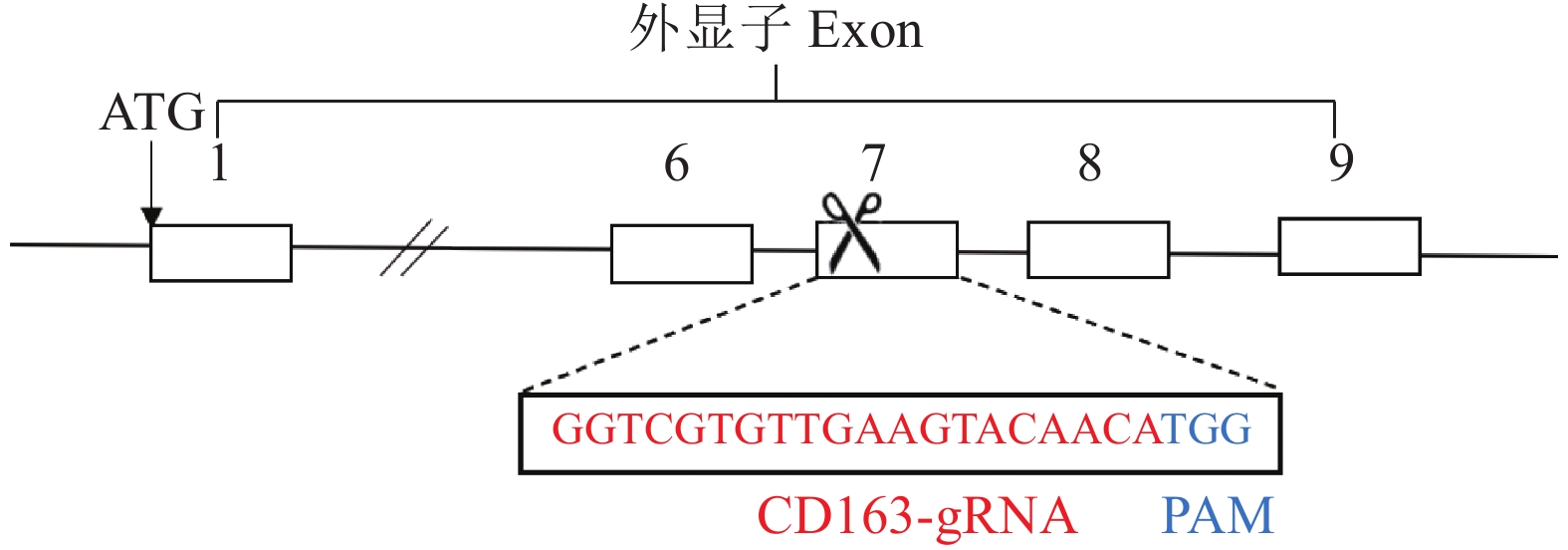
|
图 1 猪CD163基因示意图和CD163-gRNA序列 Fig. 1 Genetic map of pig CD163 gene and sequence of CD163-gRNA |
复苏大白猪胎儿成纤维细胞,用含15% (φ)胎牛血清的DMEM完全培养基,于38 ℃、5% (φ) CO2的培养箱中培养,当细胞长至80%汇合度时消化备用,按照Lonza原代成纤维细胞转染试剂盒说明书将10 μg靶向质粒pX330-CD163转染至1×106个猪胎儿成纤维细胞中,使用A-033程序进行瞬时转染后,将细胞按照每cm2 10个细胞的密度接种到直径10 cm的培养皿中连续培养10 d,中途换液1次。10 d后挑取单克隆至48孔板中继续培养,48孔长满后取少许细胞直接裂解并进行PCR检测,筛选CD163阳性细胞,剩余细胞转移至24孔板继续培养。PCR引物为CD163-F:GAATTGTCTCCAGGGAAGGA,CD163-R:AGCCCAGATCTGTCCACTTC;产物长度:380 bp。阳性细胞长满后即可作为供体细胞进行体细胞核移植操作,每头受体母猪移植200~250个操作胚胎。
1.2.3 CD163-KO大白猪鉴定新生克隆猪采耳组织再进行PCR测序鉴定。死亡仔猪采肺脏、脾脏、淋巴结、骨髓组织,提取总蛋白,进行CD163蛋白的Western blot检测,一抗选用anti-CD163抗体(兔多克隆抗体,ab87099),100倍稀释,二抗选用HRP羊抗兔IgG (博士德,BA1054),内参一抗选用GAPDH小鼠单抗(上海康成,KC-5G4),二抗用HRP羊抗小鼠IgG (博士德,BA1050)。另取一头瘦弱仔猪,在实验室取肺冲出肺泡巨噬细胞,用鼠抗猪CD163 RPE (伯乐,MCA2311PE)免疫荧光染色,荧光显微镜观察到CD163-KO大白猪无CD163蛋白表达。
1.2.4 CD163-KO大白猪攻毒试验取30日龄的11头CD163-KO大白猪和5头野生型大白猪(对照),用NADC30-like毒株进行攻毒,毒价为1×107 TCID50/mL,采用滴鼻1 mL和肌注1 mL的攻毒方式,攻毒当天测量温度,采集血清,连续14 d记录体温,攻毒后第3、7、10和14天采集血清,检测血清中PRRSV含量和抗体水平。14 d后杀猪取肺脏组织进行免疫荧光检测。
1.2.5 CD163-KO大白猪单核细胞诱导分化的巨噬细胞对血红蛋白−结合珠蛋白复合物的摄取试验分别取CD163-KO大白猪与野生型大白猪抗凝外周血10 mL,根据TBD动物外周血单核细胞分离液试剂盒方法分离外周血单核细胞(Peripheral blood mononuclear cell,PBMC),将分离到的细胞沉淀用含20% (φ)胎牛血清的1640培养液重悬,调整细胞密度为5×106~10×106/mL,以每孔2 mL加入6孔板培养2 h,待PBMC贴壁,用37 ℃培养基轻轻洗涤3遍,去除悬浮细胞。换上含10% (φ)胎牛血清和hM-CSF(巨噬细胞集落刺激因子,20 ng/mL)的1640诱导分化培养基,培养7 d,中间换液1次,诱导成巨噬细胞。
按照FITC蛋白偶联试剂盒(生工,货号:D601049)标记血红蛋白,再将血红蛋白−FITC与结合珠蛋白按照1∶1的质量比混合,形成FITC荧光标记的血红蛋白−结合珠蛋白复合物,将复合物按照终质量浓度10 μg/mL加入到诱导分化的巨噬细胞培养液中,37 ℃条件下避光孵育30 min,PBS溶液洗2遍后拍照,观察细胞荧光情况。
1.2.6 CD163-KO大白猪生产性能和公猪的繁殖性能测定统计CD163-KO大白猪和野生型大白猪的出生质量、终测数据及公猪的精液质量等指标,分析CD163基因敲除是否影响大白猪的生产性能和公猪的繁殖性能。
2 结果与分析 2.1 CD163-KO大白猪的克隆与鉴定筛选得到3个阳性单克隆细胞,移植5头受体母猪,共分娩18头克隆仔猪,采集耳组织提取基因组DNA,经PCR和测序鉴定,18头克隆仔猪的CD163基因都是插入1个A碱基(表1)。采集CD163-KO克隆猪肺脏、脾脏、淋巴结和骨髓,Western blot检测结果表明成功获得CD163-KO大白猪(图2),CD163-KO大白猪的肺泡巨噬细胞CD163免疫荧光结果也证实CD163蛋白完全缺失(图3)。
|
|
表 1 阳性单克隆细胞及CD163-KO大白猪测序结果 Table 1 Sequencing results of positive monoclonal cells and CD163-KO Large White pigs |

|
图 2 野生型和CD163-KO大白猪取样组织中CD163蛋白表达 Fig. 2 CD163 protein expression in sampling tissues of wild type and CD163-KO Large White pigs |

|
图 3 野生型和CD163-KO大白猪肺泡巨噬细胞表面CD163免疫荧光检测 Fig. 3 Immunofluorescence detection of CD163 on the surface of pulmonary alveolar macrophages in wild type and CD163-KO Large White pigs |
野生型大白猪于攻毒后第3天开始发热,直到第14天体温维持在40 ℃左右,没有出现明显的呼吸道症状,没有死亡;CD163-KO大白猪没有任何临床症状,体温正常(图4A)。检测攻毒CD163-KO猪第0、3、7、10和14天血清中PRRSV病毒和抗体含量,发现5头野生型大白猪病毒核酸水平快速增长,第3天病毒核酸含量达到81g RNA拷贝数/mL,而11头CD163-KO大白猪在此期间血清中病毒含量一直为0 (图4B)。野生型大白猪的抗体水平在第10和14天时,滴度明显提高,而11头CD163-KO大白猪抗体一直是阴性(图4C)。猪肺脏组织免疫荧光结果显示,野生型大白猪肺脏巨噬细胞表面存在大量的PRRSV,而CD163-KO大白猪完全没有该病毒存在(图5)。
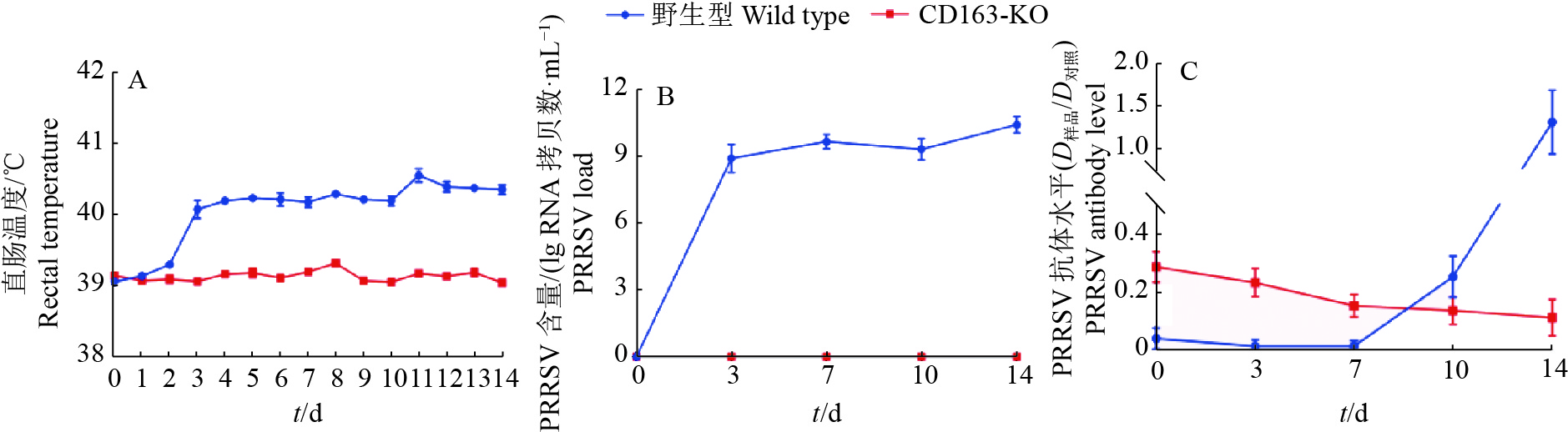
|
图 4 野生型和CD163-KO大白猪攻毒后直肠温度、血清中PRRSV含量和抗体水平 Fig. 4 Rectal pemperature, PRRSV load and antibody level in serum of wild type and CD163-KO Large White pigs post infection |

|
图 5 野生型和CD163-KO大白猪攻毒后第14天肺脏PRRSV免疫荧光结果 Fig. 5 Immunofluorescence result of PRRSV in lung of wild type and CD163-KO Large White pigs at 14 d post infection |
野生型和CD163-KO大白猪得到相同结果,体外分离得到的单核细胞利用hM-CSF体外诱导得到的巨噬细胞能够正常摄取血红蛋白−结合珠蛋白复合物(图6),并不影响其正常的生理功能。
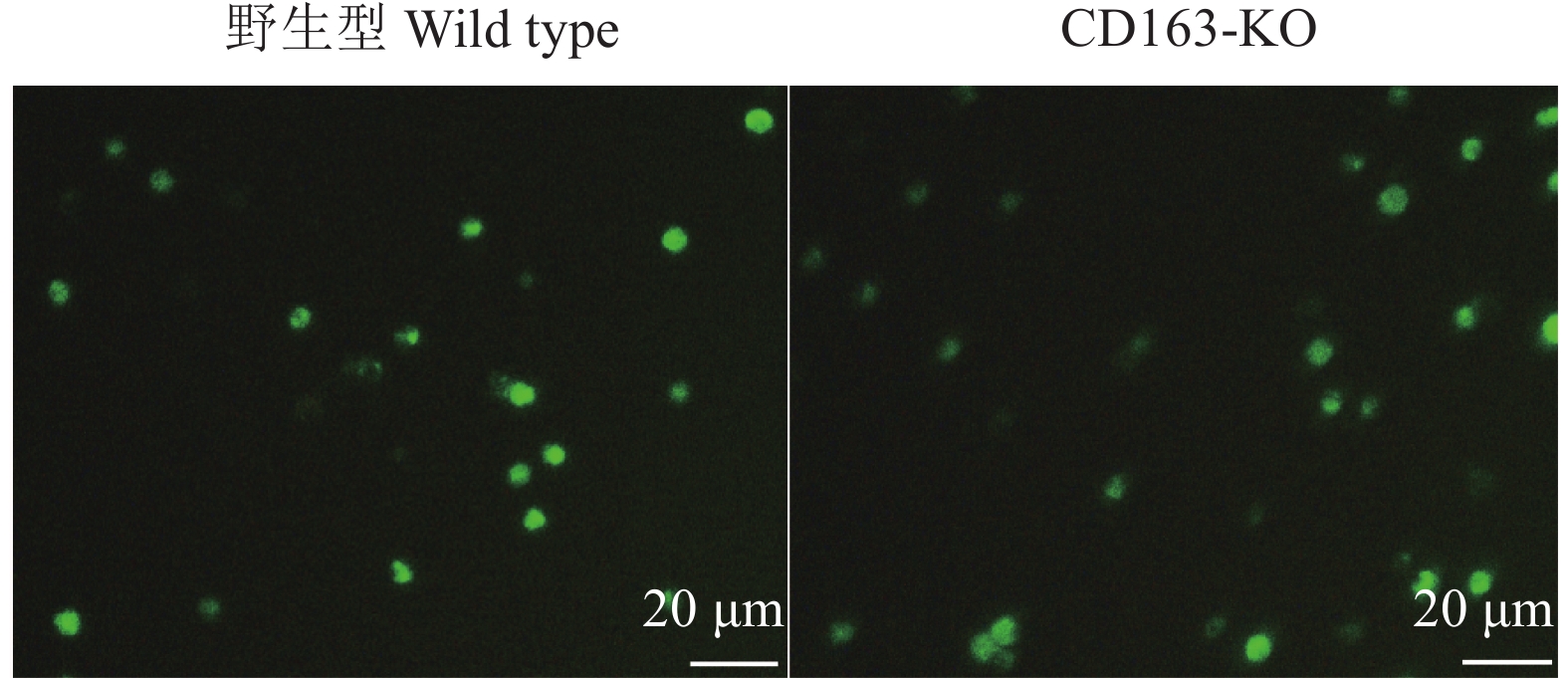
|
图 6 野生型和CD163-KO大白猪巨噬细胞对血红蛋白−结合珠蛋白复合物的摄取能力 Fig. 6 Uptake capacity of macrophages from wild type and CD163-KO Large White pigs to hemoglobin-haptoglobin complex |
取10头品系相同、年龄和体质量相近的野生型大白猪为阴性对照,对5头F0代CD163-KO公猪的出生体质量、体长、体高、115 kg背膘厚和115 kg眼肌面积、30~115 kg测定期平均日增体质量和饲料转化率进行测定,结果如表2所示。F0代基因敲除猪的出生体质量、体高、体长、115 kg肌内脂肪、115 kg背膘厚、115 kg眼肌面积、平均日增体质量和饲料转化效率等指标与野生型对照没有明显差异。
|
|
表 2 野生型(n=10)和CD16-KO (n=5)大白猪生产性能比较1) Table 2 Comparison of the productive performance of wild type and CD163-KO Large White pigs |
取10份F0代CD163-KO大白猪的精液样本、20份一级野生型大白猪的精液,进行精液质量分析,统计结果如表3显示。CD163-KO大白猪采精量,精液1∶1稀释后精子活力、密度与野生型大白猪无明显差异,其中畸形率略低于野生型大白猪。
|
|
表 3 野生型(n=20)与CD163-KO (n=10)大白猪精液质量比较1) Table 3 Comparison of the quality of the semen from wild type and CD163-KO Large White pigs |
大量研究表明,PRRSV进入细胞是由多种细胞受体介导的,如唾液粘附素(Sn/CD169)、CD151、硫酸肝素、CD163[21-23]。其中,目前已经证明CD163是PRRSV感染过程中的关键受体。CD163被称为清道夫受体,是一种I型跨膜糖蛋白,在单核细胞/巨噬细胞系(如肺泡巨噬细胞)和非洲绿猴胚胎肾细胞(MAC145)表面表达。CD163由富含半胱氨酸的9个清道夫受体结构域(SRCR1~9)组成,其中SRCR2被证明支持红细胞的黏附,促进红细胞成熟,SRCR3可以清除血浆中的游离血红蛋白,SRCR5对PRRSV进入靶细胞至关重要[24-25]。本研究通过设计靶向CD163基因的SRCR5区域(对应外显子7)的gRNA,通过单克隆筛选只有1个A碱基插入的突变型作为供体细胞移植,获得18头CD163-KO克隆猪,克隆效率处于较高水平,在方法学上也为制备CD163-KO大白猪提供了一定的参考。
本研究证实了利用CRISPR/Cas9基因编辑技术获得的CD163-KO大白猪对当前本地区流行的蓝耳病NADC30-like毒株具有完全抗性,并且不损伤猪的主要生产性能。CD163基因缺失并没有影响猪正常生理功能,体外单核细胞诱导分化的巨噬细胞能够保持吞噬细胞外血红蛋白的功能[24, 26],但是CD163基因敲除是否会影响CD163的其他一些功能还需要更多研究进行验证。下一步工作需要尽可能详尽地追踪CD163-KO大白猪的生长性能和繁殖性能,扩大群体规模,为后期应用提供更多数据支撑。
本研究敲除CD163基因没有改变猪的生产性能等指标。CD163-KO大白猪与自然分娩的野生型大白猪在出生体质量和料肉比等性状上无明显差异,这一结果和多数研究结果相似。研究报道,克隆猪的出生、3周龄和断奶体质量以及30~110 kg平均日增体质量、料肉比、背膘厚等性状与对照猪均无明显差异[27-29]。
对于猪常见的其他传染性疾病,目前还没发现很有效的受体基因。一方面是因为病毒侵袭宿主基因组很可能是多个基因协同作用的结果,这导致仅修饰单个基因很难达到抵抗病毒入侵的目的;其次,目前的分子试验技术很难一次性精准找到与病毒相互作用的关键基因,而会识别出大量的候选基因,导致后期验证工作量异常艰巨,进展缓慢。2020年,华中农业大学赵书红教授团队首次利用猪全基因组CRISPR敲除文库,对抗乙型脑炎病毒(Japanese encephalitis virus,JEV)基因进行了筛选,筛选到几个显著影响JEV病毒在细胞内复制的关键基因[29] ,然而这些基因并不是JEV病毒进入细胞的膜受体,所以并不能阻止病毒进入细胞。此外,即使找到了病毒的关键受体基因,也不能简单地将其敲除。基因组的每个编码基因不仅执行特定功能,而且参与多个基因通路,起着不同的作用,如果简单地敲除,必然会影响宿主某一方面的功能;或者有些基因至关重要,敲除后会导致胚胎致死等情况。这些都决定了病毒受体的寻找和利用难度非常大,还有更多的工作要做。
| [1] |
HAN J, ZHOU L, GE X, et al. Pathogenesis and control of the Chinese highly pathogenic porcine reproductive and respiratory syndrome virus[J]. Veterinary Microbiology, 2017, 209: 30-47. DOI:10.1016/j.vetmic.2017.02.020 (  0) 0) |
| [2] |
TIAN K, YU X, ZHAO T, et al. Emergence of fatal PRRSV variants: Unparalleled outbreaks of atypical PRRS in China and molecular dissection of the unique hallmark[J]. PLoS One, 2007, 2(6): e526. DOI:10.1371/journal.pone.0000526 (  0) 0) |
| [3] |
ZHAO K, YE C, CHANG X, et al. Importation and recombination are responsible for the latest emergence of highly pathogenic porcine reproductive and respiratory syndrome virus in China[J]. Journal of Virology, 2015, 89(20): 10712-10716. DOI:10.1128/JVI.01446-15 (  0) 0) |
| [4] |
WANG H M, LIU Y G, TANG Y D, et al. A natural recombinant PRRSV between HP-PRRSV JXA1-like and NADC30-like strains[J]. Transboundary and Emerging Diseases, 2018, 65(4): 1078-1086. DOI:10.1111/tbed.12852 (  0) 0) |
| [5] |
YU Y, ZHANG Q, CAO Z, et al. Recent advances in porcine reproductive and respiratory syndrome virus NADC30-like research in China: Molecular characterization, pathogenicity, and control[J]. Frontiers in Microbiology, 2022, 12: 791313. DOI:10.3389/fmicb.2021.791313 (  0) 0) |
| [6] |
ZHOU L, YANG B, XU L, et al. Efficacy evaluation of three modified-live virus vaccines against a strain of porcine reproductive and respiratory syndrome virus NADC30-like[J]. Veterinary Microbiology, 2017, 207: 108-116. DOI:10.1016/j.vetmic.2017.05.031 (  0) 0) |
| [7] |
CHAI W, LIU Z, SUN Z, et al. Efficacy of two porcine reproductive and respiratory syndrome (PRRS) modified-live virus (MLV) vaccines against heterologous NADC30-like PRRS virus challenge[J]. Veterinary Microbiology, 2020, 248: 108805. DOI:10.1016/j.vetmic.2020.108805 (  0) 0) |
| [8] |
RENUKARADHYA G J, MENG X J, CALVERT J G, et al. Inactivated and subunit vaccines against porcine reproductive and respiratory syndrome: Current status and future direction[J]. Vaccine, 2015, 33(27): 3065-3072. DOI:10.1016/j.vaccine.2015.04.102 (  0) 0) |
| [9] |
熊胜利, 龙清孟, 陈大方, 等. 抗病育种技术在引进美国SPF种猪后代选育中应用探究[J]. 养猪, 2014(3): 73-74. DOI:10.13257/j.cnki.21-1104/s.2014.03.028 (  0) 0) |
| [10] |
YUAN H, YANG L, ZHANG Y, et al. Current status of genetically modified pigs that are resistant to virus infection[J]. Viruses, 2022, 14(2): 417. DOI:10.3390/v14020417 (  0) 0) |
| [11] |
PROUDFOOT C, LILLICO S, TAIT-BURKARD C. Genome editing for disease resistance in pigs and chickens[J]. Animal Frontiers, 2019, 9(3): 6-12. DOI:10.1093/af/vfz013 (  0) 0) |
| [12] |
WHITWORTH K M, ROWLAND R R R, EWEN C L, et al. Gene-edited pigs are protected from porcine reproductive and respiratory syndrome virus[J]. Nature Biotechnology, 2016, 34(1): 20-22. DOI:10.1038/nbt.3434 (  0) 0) |
| [13] |
YANG H, ZHANG J, ZHANG X, et al. CD163 knockout pigs are fully resistant to highly pathogenic porcine reproductive and respiratory syndrome virus[J]. Antiviral Research, 2018, 151: 63-70. (  0) 0) |
| [14] |
BURKARD C, LILLICO S G, REID E, et al. Precision engineering for PRRSV resistance in pigs: Macrophages from genome edited pigs lacking CD163 SRCR5 domain are fully resistant to both PRRSV genotypes while maintaining biological function[J]. PLOS Pathogens, 2017, 13(2): e1006206. DOI:10.1371/journal.ppat.1006206 (  0) 0) |
| [15] |
WELCH S K W, CALVERT J G. A brief review of CD163 and its role in PRRSV infection[J]. Virus Research, 2010, 154(1/2): 98-103. DOI:10.1016/j.virusres.2010.07.018 (  0) 0) |
| [16] |
XU Y, WU S, LI Y, et al. A porcine alveolar macrophage cell line stably expressing CD163 demonstrates virus replication and cytokine secretion characteristics similar to primary alveolar macrophages following PRRSV infection[J]. Veterinary Microbiology, 2020, 244: 108690. DOI:10.1016/j.vetmic.2020.108690 (  0) 0) |
| [17] |
XU K, ZHOU Y, MU Y, et al. CD163 and pAPN double-knockout pigs are resistant to PRRSV and TGEV and exhibit decreased susceptibility to PDCoV while maintaining normal production performance[J]. eLife, 2020, 9: e57132. (  0) 0) |
| [18] |
韩晓松, 高杨, 刘海龙, 等. 利用CRISPR/Cas9技术制备CD163基因SRCR5序列敲除猪[J]. 农业生物技术学报, 2020, 28(9): 1535-1542. (  0) 0) |
| [19] |
GUO C, WANG M, ZHU Z, et al. Highly efficient generation of pigs harboring a partial deletion of the CD163 SRCR5 domain, which are fully resistant to porcine reproductive and respiratory syndrome virus 2 infection[J]. Frontiers in Immunology, 2019, 10: 1846. DOI:10.3389/fimmu.2019.01846 (  0) 0) |
| [20] |
CHEN J, WANG H, BAI J, et al. Generation of pigs resistant to highly pathogenic-porcine reproductive and respiratory syndrome virus through gene editing of CD163[J]. International Journal of Biological Sciences, 2019, 15(2): 481-492. DOI:10.7150/ijbs.25862 (  0) 0) |
| [21] |
VAN GORP H, VAN BREEDAM W, DELPUTTE P L, et al. Sialoadhesin and CD163 join forces during entry of the porcine reproductive and respiratory syndrome virus[J]. Journal of General Virology, 2008, 89: 2943-2953. DOI:10.1099/vir.0.2008/005009-0 (  0) 0) |
| [22] |
ZHANG Q, YOO D. PRRS virus receptors and their role for pathogenesis[J]. Veterinary Microbiology, 2015, 177(3/4): 229-241. (  0) 0) |
| [23] |
VAN BREEDAM W, VERBEECK M, CHRISTIAENS I, et al. Porcine, murine and human sialoadhesin (Sn/Siglec-1/CD169): Portals for porcine reproductive and respiratory syndrome virus entry into target cells[J]. Journal of General Virology, 2013, 94: 1955-1960.
(  0) 0) |
| [24] |
GRAVERSEN J H, MADSEN M, MOESTRUP S K. CD163: A signal receptor scavenging haptoglobin-hemoglobin complexes from plasma[J]. International Journal of Biochemistry & Cell Biology, 2002, 34(4): 309-314. (  0) 0) |
| [25] |
KRISTIANSEN M, GRAVERSEN J H, JACOBSEN C, et al. Identification of the haemoglobin scavenger receptor[J]. Nature, 2001, 409(6817): 198-201. DOI:10.1038/35051594 (  0) 0) |
| [26] |
SCHAER C A, VALLELIAN F, IMHOF A, et al. CD163-expressing monocytes constitute an endotoxin-sensitive Hb clearance compartment within the vascular system[J]. Journal of Leukocyte Biology, 2007, 82(1): 106-110. DOI:10.1189/jlb.0706453 (  0) 0) |
| [27] |
石俊松, 周荣, 曾海玉, 等. 体细胞克隆猪繁殖性能及后代生长性能评估[J]. 华南农业大学学报, 2019, 40(S1): 100-103. (  0) 0) |
| [28] |
ADACHI N, YAMAGUCHI D, WATANABE A, et al. Growth, reproductive performance, carcass characteristics and meat quality in F1 and F2 progenies of somatic cell-cloned pigs[J]. Joural of Reproduction and Development, 2014, 60(2): 100-105. DOI:10.1262/jrd.2012-167 (  0) 0) |
| [29] |
KAWARASAKI T, ENYA S, OTAKE M, et al. Reproductive performance and expression of imprinted genes in somatic cell cloned boars[J]. Animal Science Journal, 2017, 88(11): 1801-1810. DOI:10.1111/asj.12838 (  0) 0) |
 2023, Vol. 44
2023, Vol. 44


