2. 广西扬翔农牧有限责任公司,广西 贵港 537000;
3. 广西贵港秀博基因科技股份有限公司, 广西 贵港 537000
2. Guangxi Yangxiang Agriculture and Animal Husbandry Co., Ltd., Guigang 537000, China;
3. Guangxi Guigang Xiubo Gene Technology Co., Ltd., Guigang 537000, China
外泌体(Exosome, EX)是指包含了复杂RNA和蛋白质,直径为30~150 nm的膜性小囊泡。外泌体存在于体液中,是多泡体(Multivesicular body,MVB)与细胞质膜融合并且以胞外方式降解释放的小泡[1],参与调控精子体内的生理活动[2]。由于细胞类型不同,外泌体通过旁分泌和自分泌的调节方式,与靶细胞融合或传递其内载物,参与免疫应答等生理和病理过程[3-4]。外泌体携带细胞来源的多种蛋白质、脂类、DNA、mRNA、miRNA等,与细胞间通信、细胞迁移、血管新生和免疫调节等过程有关。精液中富含的外泌体称为精浆外泌体(Seminal plasma exosome,spEX)。研究表明,精浆和细胞外囊泡(外泌体和微囊泡)不仅是精子的载体,在其他生殖生理活动中也起着至关重要的作用[5]。spEX具有改善精液质量、调节精子活力、影响精子受精能力的功能[6]。有研究表明,精浆外泌体产生的胞外三磷酸腺苷(Extracelluar adenosine triphosphate,exATP)可以通过孵育新鲜猪精子达到提高精子活力、调节线粒体代谢并控制精子运动的目的[7]。miRNA(microRNA)是一类由内源基因编码、长度约为20~25个核苷酸的非编码单链RNA分子[8],广泛存在于生物体各种组织或器官中,调控机体生长发育和细胞凋亡。哺乳动物中,miRNA与靶mRNA不完全互补,可在翻译水平上抑制靶基因表达,调控生命活动[9]。有研究表明,miRNA通过识别并结合目标mRNA的部分互补位点,介导精子和精浆两者细胞间的接触,形成诱导的沉默复合物的一部分,miRNA通过翻译抑制或降解靶mRNA而沉默基因[1],具有调节基因表达的作用[10]。miRNA可以潜在地调控精子发生和成熟的许多方面,包括增殖、分化发育[11]和凋亡[12]。但目前对spEX与miRNA之间的调控关系研究较少。
随着人工受精技术的普及,种公猪的地位显著提高,公猪的精液品质也愈发受人关注。中国是养猪大国,在繁育过程中,良好的猪精液质量可以带来更大的经济效益,深入了解精子活力的影响因素以及寻找决定精子活力的关键因子成为当前亟需解决的技术难题之一[13]。本研究通过对大白公猪精浆外泌体进行分离提取和鉴定[14],测序分析spEX miRNA表达谱在精子受精中的调控作用,可以更好地了解精子获能与精浆外泌体之间的表达情况,这些数据可为改善精液质量、提高精子受精能力等方面的研究提供一定参考价值。
1 材料与方法 1.1 材料选取5头25~32月龄的优秀大白公猪作为研究对象,所有公猪均来自同一猪场(广西某猪场),处于相同饲养管理条件下,按时接种疫苗。采精间隔5~7 d。室温手握法进行采精,初次射出的5~10 mL的精液不收集。所有样品均采用计算机辅助精液分析仪(CASA)检测精子的活力和形态[2]。样本在17 ℃、2840 r/min离心10 min使精子和精浆初分离,精浆保存于−40 ℃,用干冰运回实验室。
1.2 方法 1.2.1 外泌体分离37 ℃条件下解冻精浆,取10 mL精浆于4 ℃、5620 r/min离心30 min收集上清液,继续在4 ℃、11240 r/min离心70 min分离出细胞外大囊泡,得到的每份样品液依次使用0.45 μm、0.22 μm针孔滤器过滤,将过滤后的液体在4 ℃、33200 r/min离心80 min,去除上清液后加入PBS溶液反复吹打,白色胶絮状物质即为外泌体,进一步在4 ℃、33200 r/min离心80 min纯化外泌体,加400 μL PBS溶液于−80 ℃存放备用。
1.2.2 透射电镜分析取10 μL外泌体样品置于碳涂层铜网格上吸附20 min,干燥后避光,用15 μL醋酸双氧铀负染1 min。在Hitachi H-7700透射电子显微镜下拍照,检测外泌体的形态。
1.2.3 纳米颗粒跟踪分析取5 μL外泌体样品稀释至30 μL,用ZetaView Nanoparticle Tracker测量外泌体的平均直径和浓度,分析外泌体的粒径大小分布情况。
1.2.4 Western blot鉴定分析取外泌体样品加入适量的SDS-PAGE缓冲液,99 ℃变性10 min。用SDS-PAGE凝胶快速配置试剂盒(上海碧云天生物有限公司),进行制胶、电泳、转膜、封闭、孵育一抗Calnexin (Abcam,ab133615)、Hsp70 (Abcam,ab181606)、β-Actin (Beyotime,ab8226)和Tsg101(Beyotime,ab125011),一抗均已以1:1000的体积比稀释,然后根据说明书配制显色液,通过成像系统对条带进行曝光拍照。
1.2.5 miRNA的提取用miRNeasy®Mini试剂盒(Qiagen)从分离鉴定取得的样品中提取和纯化miRNA。提取后的miRNA用Agilent Bioanalyzer 2100系统(Agilent Technologies)及配套的RNA Nano 6000 Assay Kit进行质控。
1.2.6 cDNA文库构建及测序用QIAseq miRNA(Library Kit,Qiagen)构建文库。5个单独测序样品在属性序列中额外加入索引代码,最终经Bioanalyzer 2100(Agilent)和qPCR评估miRNA文库构建的质量,并用Illumina Hiseq2000 (Illumina)进行miRNA测序。
1.2.7 miRNA数据处理及分析用Bowtie软件,将测序得到的miRNA分别与Silva、GTRNAdb、Rfam和Repbase数据库进行序列比对,筛选出miRNA并计算miRNA的表达量(Transcript per million,TPM),公式为TPM=Readcount ×106/MappedReads(Readcount表示比对到某一miRNA的Read数目;MappedReads表示比对到所有miRNA上的Read数目)。
1.2.8 miRNA靶基因的预测、GO分类及KEGG富集分析根据鉴定得到的高表达量的miRNA,基于3′UTR作为靶向序列,用miRanda和RNAhybrid软件预测miRNA的靶基因,用GO( http://www.geneonUology.org)和KEGG( http://www.genome.jp/kegg/)对预测的靶基因进行功能注释和通路分析。
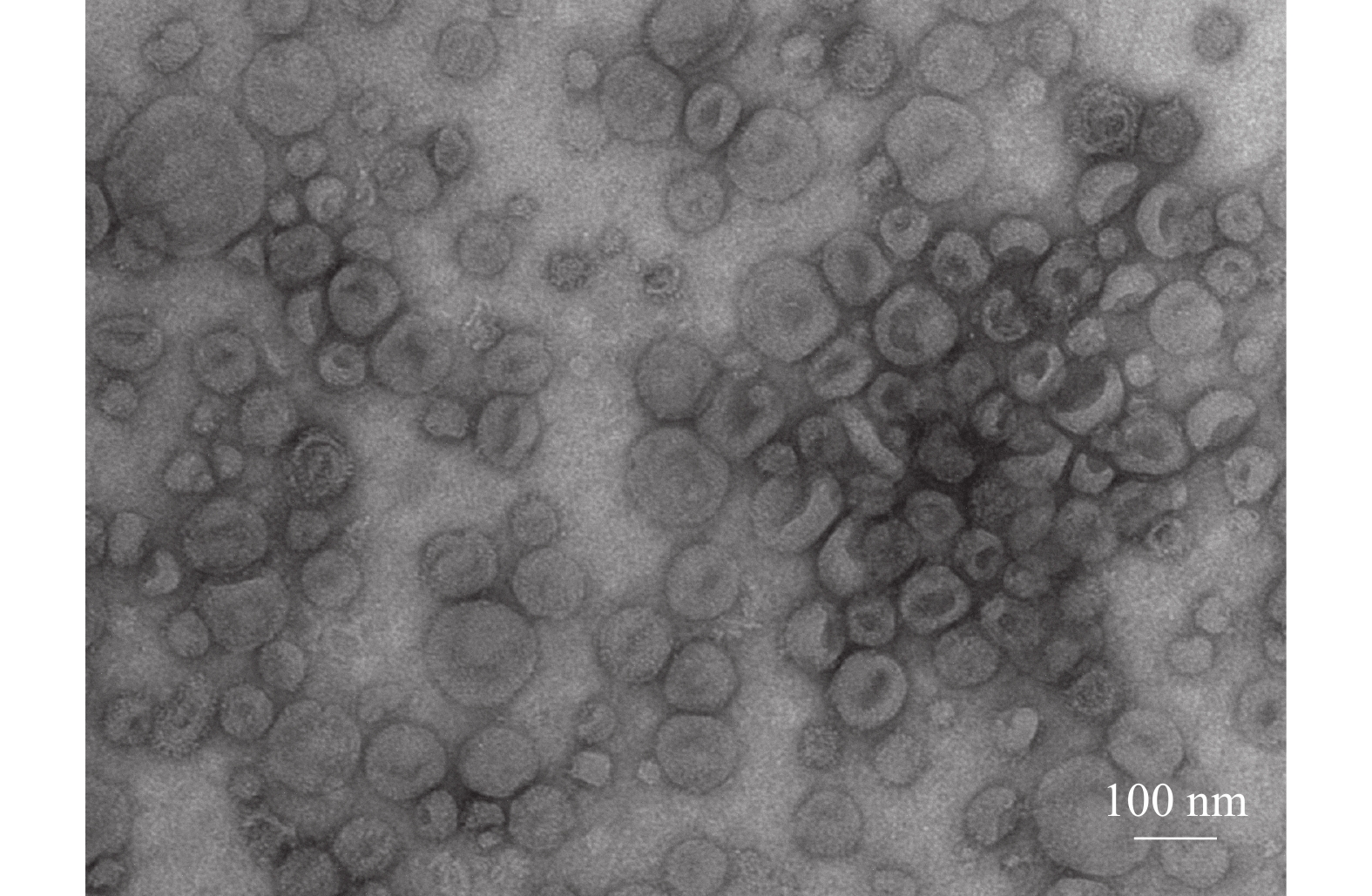
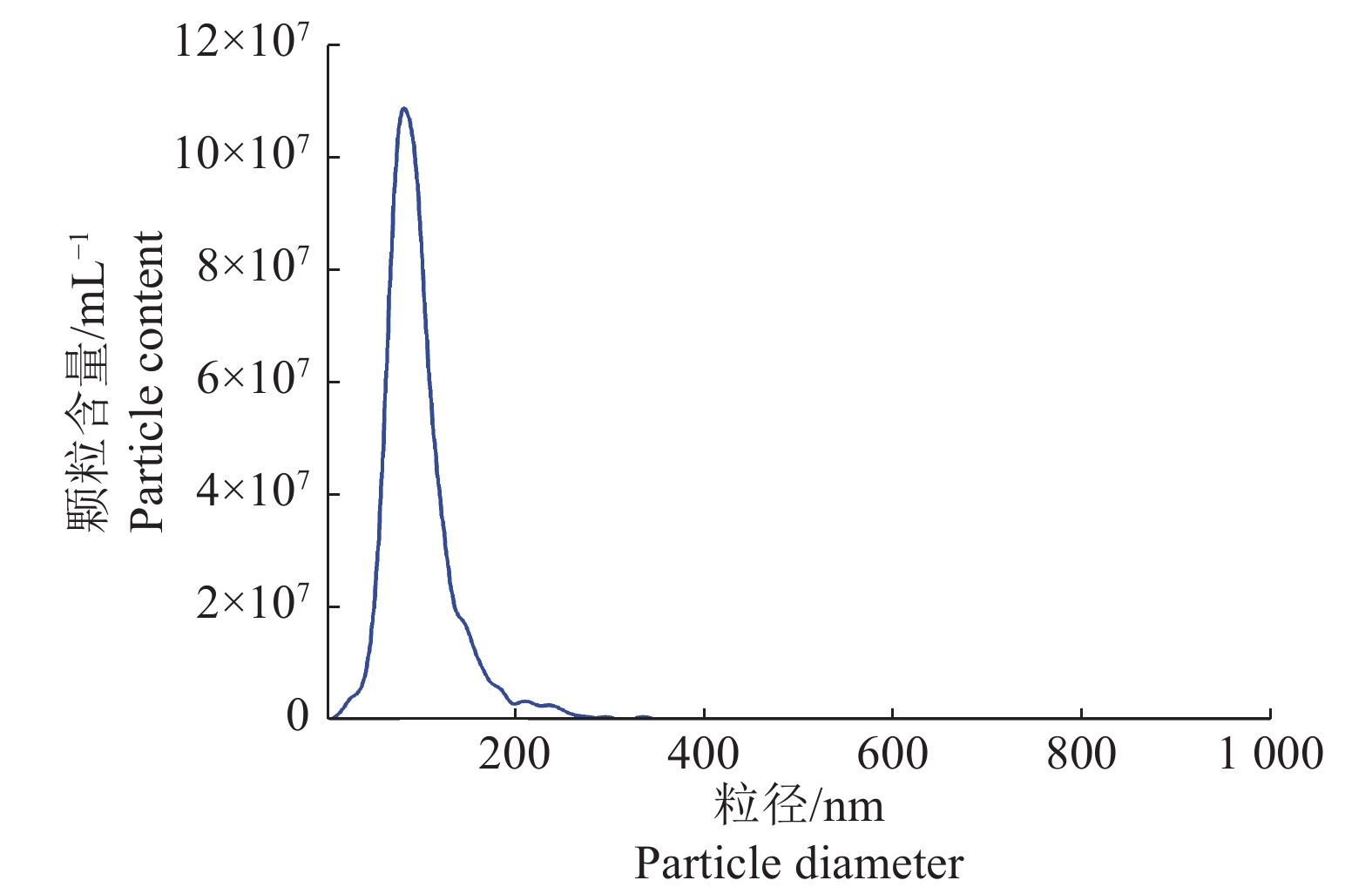
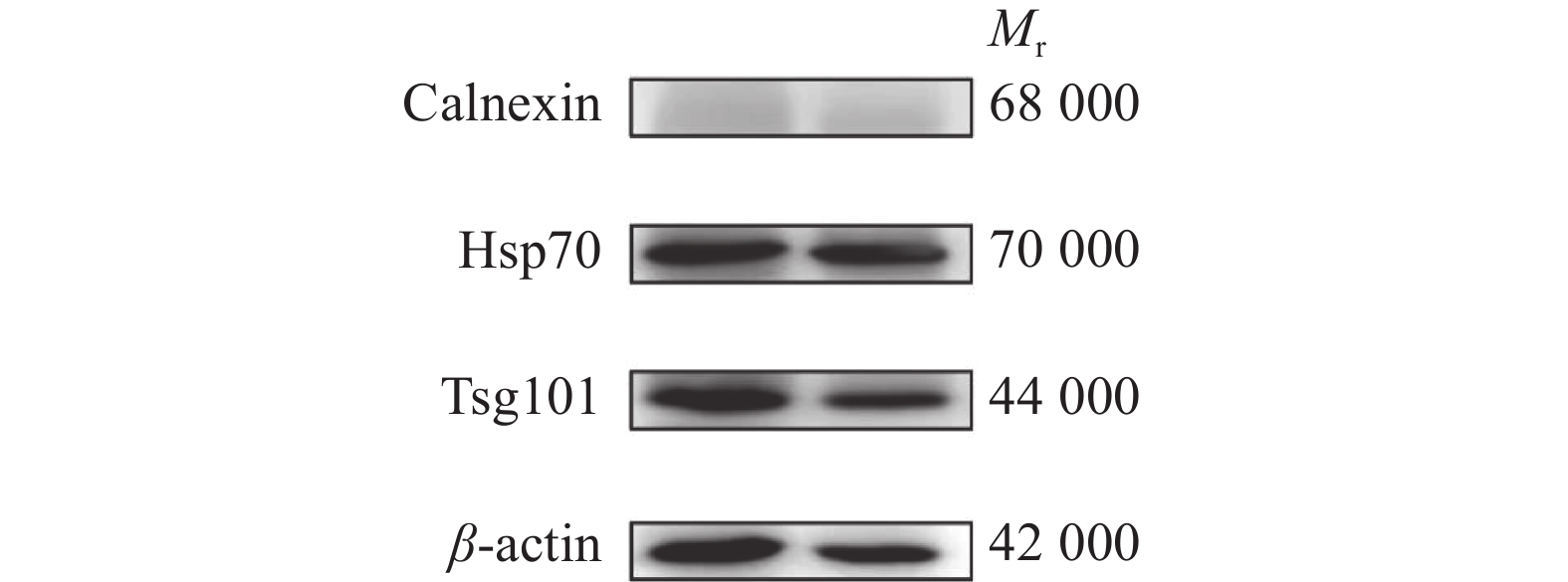
2 结果与分析 2.1 精浆外泌体的鉴定CASA系统对大白公猪原始精液的精子活力检测(表1),结果显示精子活力良好,符合国家制定的种猪常温精液质量标准[15]。透射电子显微镜观察精浆中所分离的细胞外囊泡,可见明显的立体膜结构散在分布,呈圆形或椭圆形,大小较为均一,其形态具有典型的茶杯托样特征(图1);粒径分析显示囊泡粒子平均粒径为96.9 nm,粒径主峰占比为94.9%(图2);Western blot结果显示囊泡包含Tsg101、Hsp70等外泌体标志性膜蛋白,Tsg101和Hsp70蛋白表达为阳性(图3)。这些数据与前人的研究一致,表明精浆中所分离的细胞外囊泡为外泌体。
|
|
表 1 精液质量基本信息 Table 1 Basic information of semen quality |
|
图 1 精浆外泌体透射电镜检测结果 Fig. 1 Transmission electron microscopic detection of seminal plasma exosomes |
|
图 2 精浆外泌体粒径分析 Fig. 2 Particle size analysis of seminal plasma exosomes 精浆外泌体的平均粒径为96.9 nm;粒径主峰为85.2 nm;主峰占检测所有峰的比例为94.9%;颗粒含量为3.4×107 mL−1 The average particle diameter of seminal plasma exosomes was 96.9 nm; The particle diameter of main peak was 85.2 nm; The main peak accounted for 94.9% of all the detected peaks; The particle content was 3.4×107 mL−1 |
|
图 3 精浆外泌体标志性蛋白的Western blot检测 Fig. 3 Western blot assay of marker proteins in seminal plasma exosomes 2个条带为5个样品中随机挑选的2个样品 The two strips were two samples randomly selected out of five samples |
对5头大白公猪spEX样品miRNA测序,检测到Raw read数量为108849665 ,Clean read数量为60882083,碱基质量值(Q30)范围为96.89%~97.40%,共鉴定出329个已知miRNA。miRNA片段长度为19~24 bp,其中22 bp的片段占比超过45%。根据计算miRNA的表达量TPM,筛选前20个代表性miRNA(表2)。
|
|
表 2 精浆外泌体中标志性miRNA Table 2 Representative miRNAs in seminal plasma exosomes |
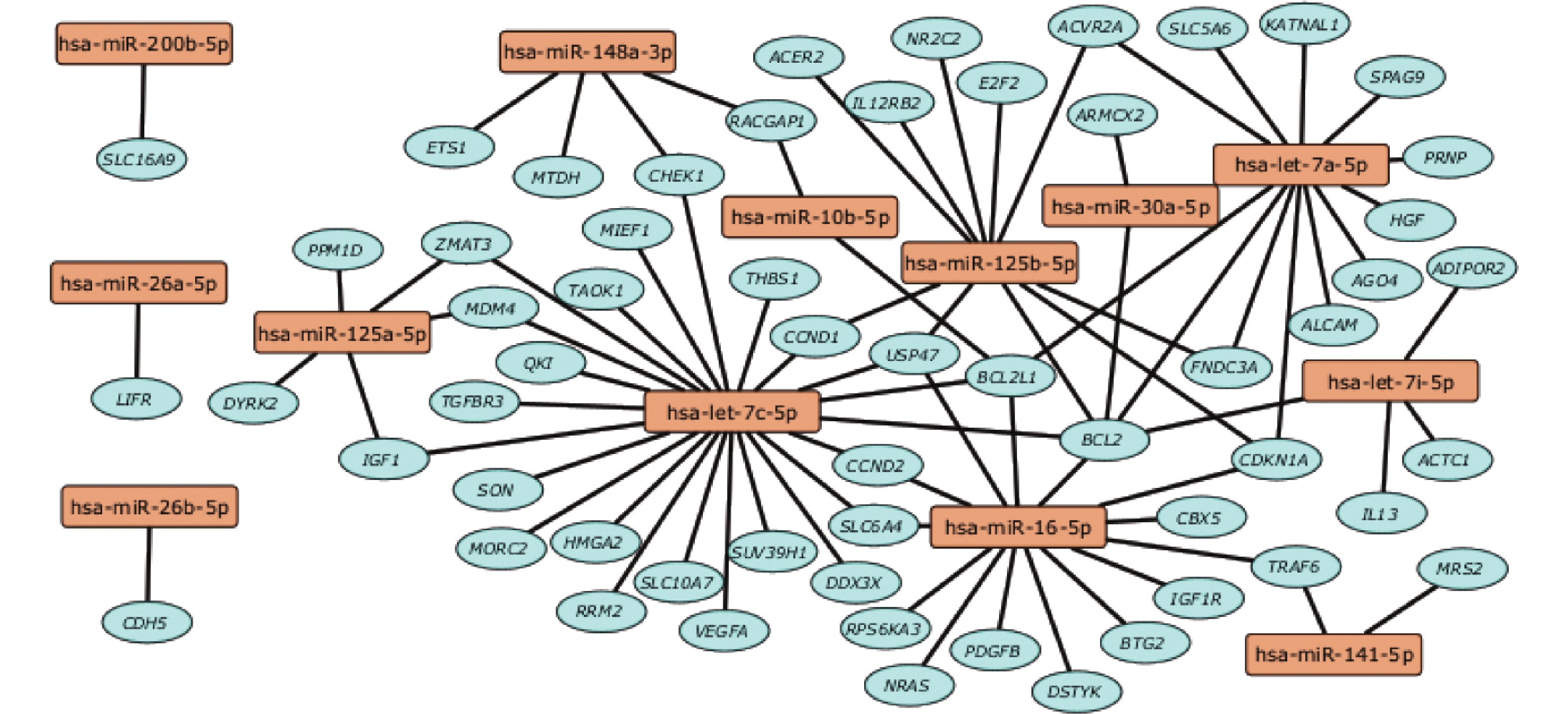
用miRanda和RNAhybrid软件预测和筛选得到miR-10家族(miR-10b和miR-10a-5p)、let-7家族(let-7c、let-7a、let-7f-5p和let-7e)等前10个高表达miRNA的靶基因。利用Cytoscape软件对miRNA与靶基因互作分析进行可视化(图4)。富集结果显示,miRNA中高表达的miR-let-7c-5p潜在调控染色质重塑蛋白MORC家族CW型锌指结构蛋白2(MORC family CW-type zinc finger 2,MORC2)、人转化生长因子β受体3(Transforming growth factor beta receptor 3,TGFBR3)、DEAD-box RNA解旋酶3(DEAD-box RNA helicase 3 X-linked,DDX3X)、核糖核苷酸还原酶M2 (Ribonucleotide reductase regulatory subunit M2,RRM2)等多个靶基因;MiR-125a-5p潜在调控镁离子依赖的蛋白磷酸酶(Protein phosphatase, Mg2+/Mn2+dependent 1D,PPM1D)和双特异性酪氨酸磷酸化调节激酶−2(Dual specificity tyrosine phosphorylation regulated kinase 2,DYRK2),且和miR-let-7c-5p联合调控靶基因鼠双微体4(Murine double minute 4,MDM4)、锌指基质蛋白型蛋白3(Zinc finger matrin-type protein 3,ZMAT3)和胰岛素样生长因子1(Insulin like growth factor 1,IGF1);miR-16-5p潜在调控血小板衍生生长因子(Platelet derived growth factor subunit B,PDGFB)、核糖体蛋白S6激酶多肽3(Ribosomal protein S6 kinase A3,RPS6KA3)、神经母细胞瘤鼠肉瘤同系物(NRAS proto-oncogene, GTPase,NRAS)、胰岛素样生长因子1受体(Insulin like growth factor 1 receptor,IGF1R)等多个靶基因;miR-let-7a-5p潜在调控活化白细胞黏附分子(Activated leukocyte cell adhesion molecule,ALCAM)、精子相关抗原9(Sperm associated antigen 9,SPAG9)、肝细胞生长因子(Hepatocyte growth factor,HGF)、类剑蛋白p60亚基A1(Katanin catalytic subunit A1 like 1,KATNAL1)等多个靶基因;miR-let-7i-5p潜在调控靶基因Th2型炎症因子(Interleukin 13,IL13)、α−心脏肌动蛋白(Actin alpha cardiac muscle 1,ACTC1)、脂联素2型受体(Adiponectin receptor 2,ADIPOR2)和B淋巴细胞瘤−2(BCL2 apoptosis regulator,BCL2);miR-125b-5p潜在调控E2F家族转录因子2(E2F transcription factor 2,E2F2)、受体亚家族2C成员2(Nuclear receptor subfamily 2 group C member 2,NR2C2)、碱性神经酰胺酶2(Alkaline ceramidase 2,ACER2)、Ⅲ型纤维连接蛋白域蛋白3A(Fibronectin type III domain containing 3A,FNDC3A)等多个靶基因;其中泛素特异性蛋白酶47(Ubiquitin specific peptidase 47,USP47)、B细胞淋巴瘤−2(BCL2 apoptosis regulator,BCL2)、细胞周期蛋白依赖激酶抑制剂1A(Cyclin dependent kinase inhibitor 1A,CDKN1A)被多个miRNA联合调控。
|
图 4 精浆外泌体miRNA与靶基因互作分析 Fig. 4 Interaction analysis between miRNAs in seminal plasma exosomes and target genes 橘色方框代表miRNA,蓝色圆圈代表miRNA靶向的靶基因 The orange box represents miRNA, and the blue circle represents the target gene of the miRNA |
GO和KEGG富集分析结果显示,spEX中miRNA的调控功能主要表现在射精、P53信号通路、前列腺癌、细胞对DNA损伤刺激的反应、负调控凋亡过程、跨膜运输、质膜外侧、顶体膜结合、受精等通路中发挥潜在调控作用(图5)。其中,射精通路中,miR-16-5p的靶基因包括ACVR2A和SLC6A4;P53信号通路中,let-7c-5p的靶基因包括BCL2L1、IGF1、CCND1和CDKN1A;细胞对DNA损伤刺激反应通路中,miR-125a-5p的靶基因包括MORC2、BTG2和TRAF6;精子受精通路中,let-7c-5p的靶基因包括BCL2L1和FNDC3A;质膜外侧的通路中,miR-16-5p的靶基因是TGFBR3,miR-200b-5p的靶基因是IL12RB2,miR-148a-3p的靶基因是ALCAM,let-7i-5p的靶基因是IL13,let-7a-5p的靶基因是THBS1,miR-125a-5p的靶基因是LIFR,miR-125b-5p的靶基因是CDH5。
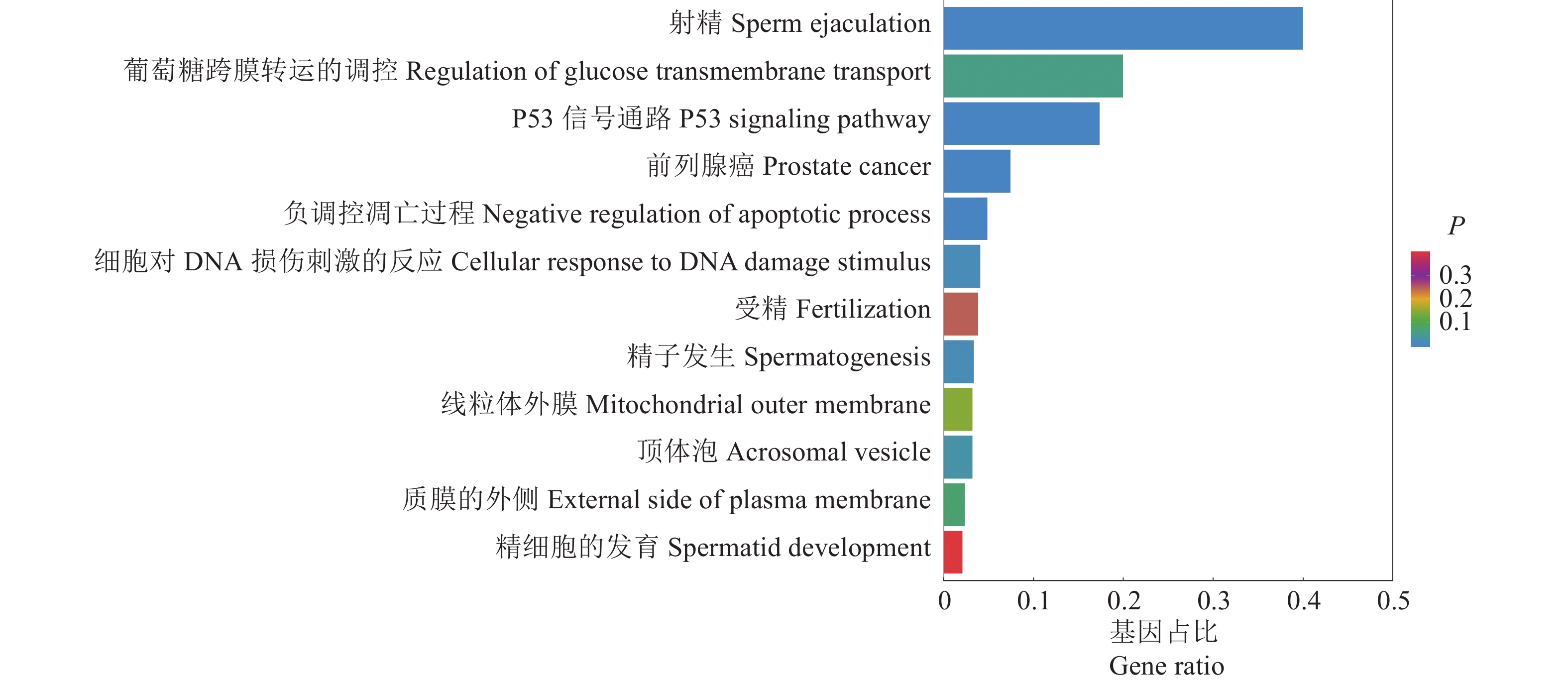
|
图 5 精浆外泌体miRNA靶基因功能GO和KEGG富集分析 Fig. 5 GO and KEGG enrichment analyses of miRNA target gene functions of seminal plasma exosomes |
外泌体可携带多种核酸、蛋白质、脂质以及小分子物质等重要信息物质,形成细胞间通信,直接影响细胞迁移、免疫反应和细胞分化生长等过程。外泌体具有脂质双层膜结构,其组成成分和功能具有特异性,被其包裹的内容物可稳定存在[16]。外泌体的形成以及被包裹内容物的分拣、释放是一系列精细调控的过程,需要很多蛋白质和能量的参与。细胞通过不断吸收释放外泌体,实现了与外界微环境的信息交互,参与到各种生理病理疾病中。本研究提取的大白猪spEX平均粒径约为96.9 nm,电镜下形态呈茶杯托状结构,Western blot结果显示大白公猪精浆外泌体中Tsg101和Hsp70 蛋白表达为阳性,这与其他报道EX的特征结果一致[17],表明已成功提取到大白猪精液中的spEX。
精液中的EX主要是睾丸、附睾、副性腺分泌物的混合物,即精浆外泌体。其成分因动物物种而异[18]。在外泌体运载的生物分子中,越来越多miRNA的作用被发掘关注。有研究表明miRNA是外泌体中含量最丰富的细胞间信息交流的主要分子之一[19],外泌体携带的生物活性调节分子参与精子发生、修饰加工及受精能力的调控[20]。一些miRNA的数量和种类一旦改变会导致配子发育停滞、精卵受精障碍和各种生殖系统疾病的产生,显示出EX携带的miRNA在配子发育和精子加工中起重要作用[20-21]。本研究主要对大白公猪spEX miRNA的表达情况进行检测,并对前10个高丰度的miRNA相关功能进行预测,分析发现高表达的前10个miRNA中let-7家族占了4个(let-7c、let-7a、let-7f-5p、let-7e),显著高于其他miRNA。其中,let-7家族在哺乳动物、昆虫和植物中高度表达和保守,是基本生物学过程中最重要的miRNA调节因子之一[22]。有研究表明在公猪睾丸中miR-let-7家族的成员(let-7a-5p、let-7f-5p、let-7c-5p)高度表达,这与本研究预测结果基本一致,let-7家族可能与公猪睾丸的发育和睾丸中精子发生有关[23],在生精过程中,高水平的let-7表达可能会改变正常生精所需的蛋白质的产生,从而影响与精子形态和运动性相关的蛋白质[24]。miR-let-7a在猪睾丸[23]、小鼠附睾精液[25]、人精浆[26]中均有发现,提示其可抑制维甲酸诱导的精原细胞分离并介导胚胎附着[27]。精子获能的过程需要能量,miR-26a与精子能量代谢有关,其可能影响精子活力和凋亡[28],有研究表明PDHX基因可能是miR-26a的潜在靶点,其参与丙酮酸氧化脱酸连接糖酵解和氧化磷酸化的关键步骤,可以调节糖代谢途径,最终影响公猪精子的活力和存活率[29]。范宇[30]研究表明,miR-26a可以调节PTEN表达,通过靶向调控PTEN减少精子细胞凋亡和促存活作用,这可能是雄性不育的原因。在公猪中,miR-26a被多个环状RNA靶向以调节精子活力,这也表明miR-26a 具有作为精子质量和雄性生育能力的非侵入性生物标志物的潜力[31]。精子的发生包括3个主要发育阶段:精原干细胞自我更新、精原干细胞分化和精子细胞变形,在每个阶段中均检测到miRNA表达,许多miRNA参与调节睾丸的发育阶段和控制精子发生[32-33]。有研究报道血浆外泌体中高表达的miRNA没有发现miR-10家族[34],这排除了miR-10家族来自血浆的可能性。有研究分析miR-10b在不同年龄的小鼠睾丸中表达,且在睾丸发育过程中表达降低[35],Li等[36]研究发现miR-10b主要在thy1细胞中表达,并且在出生后第6天的小鼠睾丸中高表达,这些结果表明miR-10b在精原干细胞有丝分裂的调节中起作用,可能与精子发生有关。本研究结果显示spEX也检测到miR-10家族,说明了miR-10家族可能是在附睾或副性腺等生殖器官中特异性表达。
GO和KEGG通路分析表明,高表达miRNA的靶基因在P53信号通路、精子受精、负调控凋亡过程、跨膜运输和能量代谢等方面具有潜在的调控作用。P53是细胞内最重要的蛋白之一,能介导细胞应答诸多类型的应激信号。P53蛋白通过参与促进DNA损伤修复、诱导细胞周期阻断、细胞衰老凋亡等通路来维持基因组的稳定性和完整性[37]。有研究表明,P53信号通路与男性生殖能力有关[23],这也说明了精浆外泌体中的miRNA可能与公猪繁育有关。有些前列腺小体(前列腺分泌的外泌体)可以特异性地将遗传物质和生物活性物质传递给精子,随后可以提高精液质量和公猪的受精率[38]。有研究发现,前列腺癌患者血清中miR-141的含量明显增高,且与特异性抗原(PSA)相比较,两者具有相关性,表明miRNA在前列腺癌的发生中起着非常重要的作用[39]。因此这些表达失调的miRNA可能可以用于癌症的诊断、治疗以及治疗效果的评价。此外,通路分析表明,高表达miRNA的靶基因参与了氧化磷酸化和泛素介导的蛋白水解等活动。蛋白质磷酸化对精子活力至关重要,研究显示,核糖体蛋白S6激酶A3(RPS6KA3)与磷酸化(V-ATPase)运输调节有关,RPS6KA3磷酸化各种底物,这种蛋白质的活性与控制细胞生长和分化有关[40]。泛素蛋白酶体系统可通过降解有毒蛋白质聚集体和错误折叠的蛋白质来参与调节精子蛋白质的稳态[41]。在附睾运输过程中,附睾起始段的精子蛋白与附睾尾段的精子蛋白不一致,意味着运输过程中精子蛋白选择性丢失[42]。泛素介导的蛋白水解过程可能在精子附睾成熟阶段发挥作用。
综上,本研究报道大白公猪精浆外泌体高表达的前10个miRNA,通过靶基因预测和通路富集分析,预测了这些miRNA可能与精子的发生、P53信号通路、线粒体外膜调节、精细胞发育等过程有关,为大白公猪精浆外泌体中miRNA基因表达调控研究提供基础数据,这将有助于确定与精子的生育能力有关的基因及利用miRNA作为生物标志物预测公猪的生育力。但本研究结果基于生物信息学预测,所涉miRNA、靶基因及其相关通路还需进一步试验验证。
| [1] |
SHAO H, IM H, CASTRO C M, et al. New technologies for analysis of extracellular vesicles[J]. Chemical Reviews, 2018, 118(4): 1917-1950. DOI:10.1021/acs.chemrev.7b00534 (  0) 0) |
| [2] |
SUN J, ZHAO Y, HE J, et al. Small RNA expression patterns in seminal plasma exosomes isolated from semen containing spermatozoa with cytoplasmic droplets versus regular exosomes in boar semen[J]. Theriogenology, 2021, 176: 233-243. DOI:10.1016/j.theriogenology.2021.09.031 (  0) 0) |
| [3] |
杜冠潮, 王福, 张继伟, 等. 精浆外泌体在精子成熟过程中的调节机制研究进展[J]. 山东医药, 2020, 60(36): 105-107. DOI:10.3969/j.issn.1002-266X.2020.36.028 (  0) 0) |
| [4] |
THERY C, OSTROWSKI M, SEGURA E. Membrane vesicles as conveyors of immune responses[J]. Nature Reviews Immunology, 2009, 9(8): 581-593. DOI:10.1038/nri2567 (  0) 0) |
| [5] |
SAINT-DIZIER M, MAHE C, REYNAUD K, et al. Sperm interactions with the female reproductive tract: A key for successful fertilization in mammals[J]. Molecular and Cellular Endocrinology, 2020, 516: 110956. DOI:10.1016/j.mce.2020.110956 (  0) 0) |
| [6] |
秦佳丽, 孙敬帅, 曹婷婷, 等. 精浆外泌体的转运机制及生物学功能研究进展[J]. 中国畜牧杂志, 2022, 58(2): 52-58. (  0) 0) |
| [7] |
GUO H, CHANG Z, ZHANG Z, et al. Extracellular ATPs produced in seminal plasma exosomes regulate boar sperm motility and mitochondrial metabolism[J]. Theriogenology, 2019, 139: 113-120. DOI:10.1016/j.theriogenology.2019.08.003 (  0) 0) |
| [8] |
杨秀芹, 万洪宇, 王金奎, 等. 猪miR-101表达特性分析[J]. 东北农业大学学报, 2016, 47(6): 74-80. (  0) 0) |
| [9] |
曲波, 甄贞, 仇有文, 等. 基于生物信息学方法挖掘奶山羊miRNAs研究[J]. 东北农业大学学报, 2015, 46(1): 86-93. DOI:10.3969/j.issn.1005-9369.2015.01.014 (  0) 0) |
| [10] |
TWENTER H, KLOHONATZ K, DAVIS K, et al. Transfer of MicroRNAs from epididymal epithelium to equine spermatozoa[J]. Journal of Equine Veterinary Science, 2020, 87: 102841. DOI:10.1016/j.jevs.2019.102841 (  0) 0) |
| [11] |
FOSHAY K M, GALLICANO G I. miR-17 family miRNAs are expressed during early mammalian development and regulate stem cell differentiation[J]. Developmental Biology, 2009, 326(2): 431-443. DOI:10.1016/j.ydbio.2008.11.016 (  0) 0) |
| [12] |
BOUHALLIER F, ALLIOLI N, LAVIAL F, et al. Role of miR-34c microRNA in the late steps of spermatogenesis[J]. RNA, 2010, 16(4): 720-731. DOI:10.1261/rna.1963810 (  0) 0) |
| [13] |
薛林涛, 黄悦悦, 施文. 精浆外泌体在精子发生与功能调控中的研究进展[J]. 右江医学, 2021, 49(9): 706-709. (  0) 0) |
| [14] |
吴志胜, 陈慧芳, 刘俊杰, 等. 长白猪精浆外泌体miRNAs的鉴定与功能分析[J]. 农业生物技术学报, 2021, 29(2): 279-287. (  0) 0) |
| [15] |
白绪祥, 韩帅琪, 胡建宏. 猪精液常温保存研究进展[J]. 畜牧兽医杂志, 2021, 40(1): 28-30. (  0) 0) |
| [16] |
舒密. 外泌体miRNAs在结直肠癌中的研究进展[J]. 医学信息, 2021, 34(15): 15-18. (  0) 0) |
| [17] |
卞玉莹. 精浆外泌体miRNA作为男性不育症新型分子标志物的临床研究[D]. 镇江: 江苏大学, 2020.
(  0) 0) |
| [18] |
MCGRAW L A, SUAREZ S S, WOLFNER M F. On a matter of seminal importance[J]. BioEssays, 2015, 37(2): 142-147. DOI:10.1002/bies.201400117 (  0) 0) |
| [19] |
TEOW S, LIEW K, KHOO A S, et al. Pathogenic role of exosomes in Epstein-Barr virus (EBV)-associated cancers[J]. International Journal of Biological Sciences, 2017, 13(10): 1276-1286. DOI:10.7150/ijbs.19531 (  0) 0) |
| [20] |
陈慧芳, 杨镁楹, 吴志胜, 等. 外泌体miRNA在配子发育和受精中的调控作用[J]. 中国畜牧杂志, 2021, 57(1): 17-24. DOI:10.19556/j.0258-7033.20200304-01 (  0) 0) |
| [21] |
SANTONOCITO M, VENTO M, GUGLIELMINO M R, et al. Molecular characterization of exosomes and their microRNA cargo in human follicular fluid: bioinformatic analysis reveals that exosomal microRNAs control pathways involved in follicular maturation[J]. Fertility and Sterility, 2014, 102(6): 1751-1761. DOI:10.1016/j.fertnstert.2014.08.005 (  0) 0) |
| [22] |
ROUSH S, SLACK F J. The let-7 family of microRNAs[J]. Trends in Cell Biology, 2008, 18(10): 505-516. DOI:10.1016/j.tcb.2008.07.007 (  0) 0) |
| [23] |
LUO Z, DAI X, RAN X, et al. Identification and profile of microRNAs in Xiang pig testes in four different ages detected by Solexa sequencing[J]. Theriogenology, 2018, 117: 61-71. DOI:10.1016/j.theriogenology.2017.06.023 (  0) 0) |
| [24] |
CURRY E, SAFRANSKI T J, PRATT S L. Differential expression of porcine sperm microRNAs and their association with sperm morphology and motility[J]. Theriogenology, 2011, 76(8): 1532-1539. DOI:10.1016/j.theriogenology.2011.06.025 (  0) 0) |
| [25] |
LUO M, HAO L, HU F, et al. MicroRNA profiles and potential regulatory pattern during the early stage of spermatogenesis in mice[J]. Science China Life Sciences, 2015, 58(5): 442-450. DOI:10.1007/s11427-014-4737-8 (  0) 0) |
| [26] |
WU W, HU Z, QIN Y, et al. Seminal plasma microRNAs: Potential biomarkers for spermatogenesis status[J]. Molecular Human Reproduction, 2012, 18(10): 489-497. DOI:10.1093/molehr/gas022 (  0) 0) |
| [27] |
HOSSEINI S, HOSSEINI S, SALEHI M. Upregulation of Toll-like receptor 4 through anti-miR-Let-7a enhances blastocyst attachment to endometrial cells in mice[J]. Journal of Cellular Physiology, 2020, 235(12): 9752-9762. DOI:10.1002/jcp.29787 (  0) 0) |
| [28] |
BISSONNETTE N, LÉVESQUE-SERGERIE J, THIBAULT C, et al. Spermatozoal transcriptome profiling for bull sperm motility: A potential tool to evaluate semen quality[J]. Reproduction (Cambridge, England), 2009, 138(1): 65-80. DOI:10.1530/REP-08-0503 (  0) 0) |
| [29] |
WANG W, LIANG K, CHANG Y, et al. miR-26a is Involved in glycometabolism and affects boar sperm viability by targeting PDHX[J]. Cells, 2020, 9(1): 146. DOI:10.3390/cells9010146 (  0) 0) |
| [30] |
范宇. 睾酮缺乏诱导miR-26a-5p和let-7g-5p作为信号递质靶向作用于PTEN和PMAIP1调控公猪精子细胞凋亡[D]. 雅安: 四川农业大学, 2018.
(  0) 0) |
| [31] |
GODIA M, CASTELLÓ A, ROCCO M, et al. Identification of circular RNAs in porcine sperm and evaluation of their relation to sperm motility[J]. Scientific Reports, 2020, 10(1): 1-11. DOI:10.1038/s41598-019-56847-4 (  0) 0) |
| [32] |
GONZALEZ-GONZALEZ E, LOPEZ-CASAS P P, DEL MAZO J. Gene silencing by RNAi in mouse Sertoli cells[J]. Reproductive Biology and Endocrinology, 2008, 6: 29. DOI:10.1186/1477-7827-6-29 (  0) 0) |
| [33] |
KOTAJA N, BHATTACHARYYA S N, JASKIEWICZ L, et al. The chromatoid body of male germ cells: Similarity with processing bodies and presence of Dicer and microRNA pathway components[J]. Proceedings of the National Academy of Sciences of the United States of America, 2006, 103(8): 2647-2652. DOI:10.1073/pnas.0509333103 (  0) 0) |
| [34] |
HUNTER M P, ISMAIL N, ZHANG X, et al. Detection of microRNA expression in human peripheral blood microvesicles[J]. PLoS One, 2008, 3(11): e3694. DOI:10.1371/journal.pone.0003694 (  0) 0) |
| [35] |
梅星星, 李小勇, 吴际. 一组miRNAs在睾丸发育中的表达及miR-125a对精原干细胞发育的调节作用[J]. 上海交通大学学报(医学版), 2015, 35(5): 625-630. (  0) 0) |
| [36] |
LI J, LIU X, HU X, et al. MicroRNA-10b regulates the renewal of spermatogonial stem cells through Kruppel-like factor 4[J]. Cell Biochemistry and Function, 2017, 35(3): 184-191. DOI:10.1002/cbf.3263 (  0) 0) |
| [37] |
王道光. p53蛋白介导的细胞DNA损伤响应的动力学机制研究[D]. 南京: 南京大学, 2017.
(  0) 0) |
| [38] |
SANTO G D, FRASCA M, BERTOLI G, et al. Identification of key miRNAs in prostate cancer progression based on miRNA-mRNA network construction[J]. Computational and Structural Biotechnology Journal, 2022, 20: 864-873. DOI:10.1016/j.csbj.2022.02.002 (  0) 0) |
| [39] |
RAUHALA H E, JALAVA S E, ISOTALO J, et al. miR-193b is an epigenetically regulated putative tumor suppressor in prostate cancer[J]. International Journal of Cancer, 2010, 127(6): 1363-1372. DOI:10.1002/ijc.25162 (  0) 0) |
| [40] |
MERKULOVA M, PĂUNESCU T G, AZROYAN A, et al. Mapping the H+ (V)-ATPase interactome: Identification of proteins involved in trafficking, folding, assembly and phosphorylation[J]. Scientific Reports, 2015, 5: 14827. DOI:10.1038/srep14827 (  0) 0) |
| [41] |
SILVA J V, SANTIAGO J, SOUSA M, et al. New evidences of ubiquitin-proteasome system activity in human sperm[J]. Biochimica et Biophysica Acta-Molecular Cell Research, 2021, 1868(3): 118932. DOI:10.1016/j.bbamcr.2020.118932 (  0) 0) |
| [42] |
IJIRI T W, MERDIUSHEV T, CAO W, et al. Identification and validation of mouse sperm proteins correlated with epididymal maturation[J]. Proteomics, 2011, 11(20): 4047-4062. DOI:10.1002/pmic.201100075 (  0) 0) |
 2023, Vol. 44
2023, Vol. 44


