2. 广东省农业环境与耕地质量保护中心/广东省农业农村投资项目中心, 广东 广州 510640
2. Agricultural Environment and Cultivated Land Quality Protection Center of Guangdong Province /Guangdong Agricultural and Rural Investment Project Center, Guangzhou 510640, China
合成孕激素是一类新兴环境内分泌干扰物,因其极强的生物活性引起了全世界的广泛关注[1-3]。合成孕激素通过模拟机体内源激素的生物学效应,干扰生物体内激素的合成、释放、转运、代谢等,从而影响生物体的繁殖能力、基因表达、生长发育和免疫功能[4-6]。例如,去氢孕酮(Dydrogesterone, DYD)在质量浓度89 ng·L−1水平下可导致斑马鱼Danio rerio及其胚胎的基因转录发生明显变化[6]。黑头呆鱼Pimephales promelas持续暴露在2 ng·L−1的炔诺酮溶液中21 d后,其产卵量显著下降[7]。DYD是众多合成孕激素的典型代表,广泛用于兽药和人类药物,包括人类避孕、促进动物生长和调节发情周期等[2, 5, 8-9]。目前,全球对DYD的使用量仍不清楚,但部分发达国家对其用量做了初步评估。例如,2004年法国对DYD的消耗量达到744.70 kg,在所有合成孕激素用量中排名第2[8]。当前暂无数据报道DYD在中国的消耗量,但博思数据研究中心行业报告中指出,中国自2010年起,口服避孕药的消费量逐年递增[10]。DYD被人和动物摄入后无法完全代谢,因此通过尿液或粪便的方式直排水体,或通过废水处理厂(Wastewater treatment plant, WWTP)不完全处理后进入水体[11-12]。例如在广州从化流溪河段检出DYD,平均质量浓度为9.6 ng·L−1[13]。DYD进入地表水后,除了被悬浮颗粒和沉积物吸附,还会经历光化学转化、矿物催化转化以及生物转化等作用[14-16]。其中,光化学转化被认为是合成孕激素在地表水中的关键环境过程[17-18]。例如,在自然光照下,合成孕激素地诺孕素的直接光解半衰期为1~10 min[14],而烯丙孕素的直接光解速率更快,半衰期仅25 s[19]。然而,目前鲜有DYD在水中光降解方面的研究。另外,光降解速率还受到地表水的温度、pH、溶解性有机物等多重因素的影响[20-23]。不同的环境条件通过影响合成孕激素的表面电荷和电离状态、反应底物分解、自由基生成等作用影响光反应过程[23]。另外,有研究报道显示,一些合成孕激素的光解产物的分子骨架较之于母物质未发生明显变化,因此产物仍具有相当的生物活性以及更高的环境持久性[19],对水生生物可能造成不可预见的影响。因此,本文选取典型合成孕激素DYD作为研究对象,探究其在模拟太阳光下的直接光解动力学过程,并研究温度、pH和天然有机质(Natural organic matter,NOM)对直接光解的影响机制,最后通过超高效液相色谱–飞行时间质谱(UHPLC-QTOF-MS)等手段鉴定DYD的主要光解产物和反应路径,以期为厘清DYD在地表水中的环境过程及其环境风险提供依据。
1 材料与方法 1.1 试验材料孕酮–D9标准品(质量分数98.3%)、水、甲醇、乙腈、乙酸乙酯和异丙醇(色谱纯),购自上海安谱实验科技股份有限公司;DYD标准品(质量分数98%),购自上海源叶科技有限公司;醋酸铵(质量分数≥99.0%)和醋酸(质量分数≥99.9%),购自上海麦克林生化科技有限公司;磷酸二氢钾和三水合磷酸氢二钾(质量分数≥99.5%),购自上海阿拉丁生化科技股份有限公司;NOM购自国际腐殖质协会(2R101N,IHSS国际腐殖酸协会)。光降解试验用水(pH = 7,溶解性有机碳质量浓度为1.98 mg·L−1)购自新晖水处理设备有限公司。固相萃取小柱(SPE,Oasis, N-vinylpyrrolidone-m-divinylbenzene copolymer, 200 mg,6 mL)购置于Waters公司。
1.2 紫外吸收光谱测定配制1 mg·L−1的DYD水溶液,取2 mL样品置于石英比色皿中进行紫外可见吸收光谱测定。紫外可见分光光度计(UV-2600,日本岛津有限公司)设置为全扫模式,检测波长范围200~800 nm,狭缝宽1 nm。
1.3 光降解试验DYD光降解试验于广州市(113.17 °E,23.8 °N)开展。该地区年平均温度22.1 ℃,辐照度为400~600 W·m−2。光解试验在配置1000 W氙灯和循环冷凝装置的光化学反应仪(购于上海科銮仪器有限公司)内进行。玻璃冷阱固定氙灯于光反应器中央,以保证四周光源的均匀性。向容积600 mL玻璃光反应罐中加入5 mmol·L−1磷酸盐缓冲液500 mL,然后加入初始质量浓度为100 mg·L−1的目标孕激素母液250 μL,最终形成50 μg·L−1的反应液(甲醇体积分数<0.05%,避免溶剂效应),反应罐底部加入磁力搅拌器,反应全程以800 r·min−1转速搅拌,并用恒温水浴控温,以保证污染物浓度和温度相对均匀。光降解试验开始前,打开氙灯稳定约2 h,使其辐照度逐渐稳定至500 W·m−2左右。光解试验开始后,定期收集1 mL样品溶液,加入2 mL的棕色色谱瓶中,添加40 mg·L−1的内标孕酮−D9 50 μL,用甲醇定容至2 mL,待测。测定前,样品贮存在−20 ℃冰箱中,以防止取样后进一步降解。另外,设置暗反应(无光照)对照试验,监测DYD是否有其他转化作用和吸附损失。试验同时开展不同初始酸碱度(pH = 5、7和9)、温度(15 、25 和35 ℃)和NOM(0、5 和20 mg·L−1)对DYD光降解的影响试验,步骤同上。
1.4 DYD质量浓度检测DYD质量浓度由超高效液相色谱–串联质谱(AB Sciex Triple QuadTM 4500,购自Woodlands Central Indus. Estate., Singapore,LC-MS/MS)测定,在电喷雾正离子化(ESI+)和多反应监测模式(Multiple reaction monitoring, MRM)下进行定量。气帘气压力为172.38 kPa,碰撞气流速为800 mL·min−1,离子喷雾电压为5500 V,温度为550 ℃,喷雾气体压力为379.23 kPa,加热气体压力为413.7 kPa。DYD检测定量离子为313.2 > 91.2,定性离子为313.2 > 43.1,去簇电压为107 V,碰撞能为77 eV。光降解样品通过自动进样器进样,进样量5 μL,通过液相色谱柱(2.1 mm × 100 mm内径, 3 μm颗粒直径,购自天津博纳艾杰尔科技有限公司)分离,色谱柱前接保护柱(4.6 mm × 2.1 mm,购自天津博纳艾杰尔科技有限公司),流动相为纯水(A)和乙腈(B),流速设置为0.4 mL·min −1。梯度洗脱程序:乙腈初始体积比为60%,保持2.0 min,在3.0 min内升至98%,并保持1.8 min,然后在0.5 min内降至20%,保持0.5 min,在0.5 min内升至90%,然后在0.7 min内降至20%,测定总时长为9.0 min。
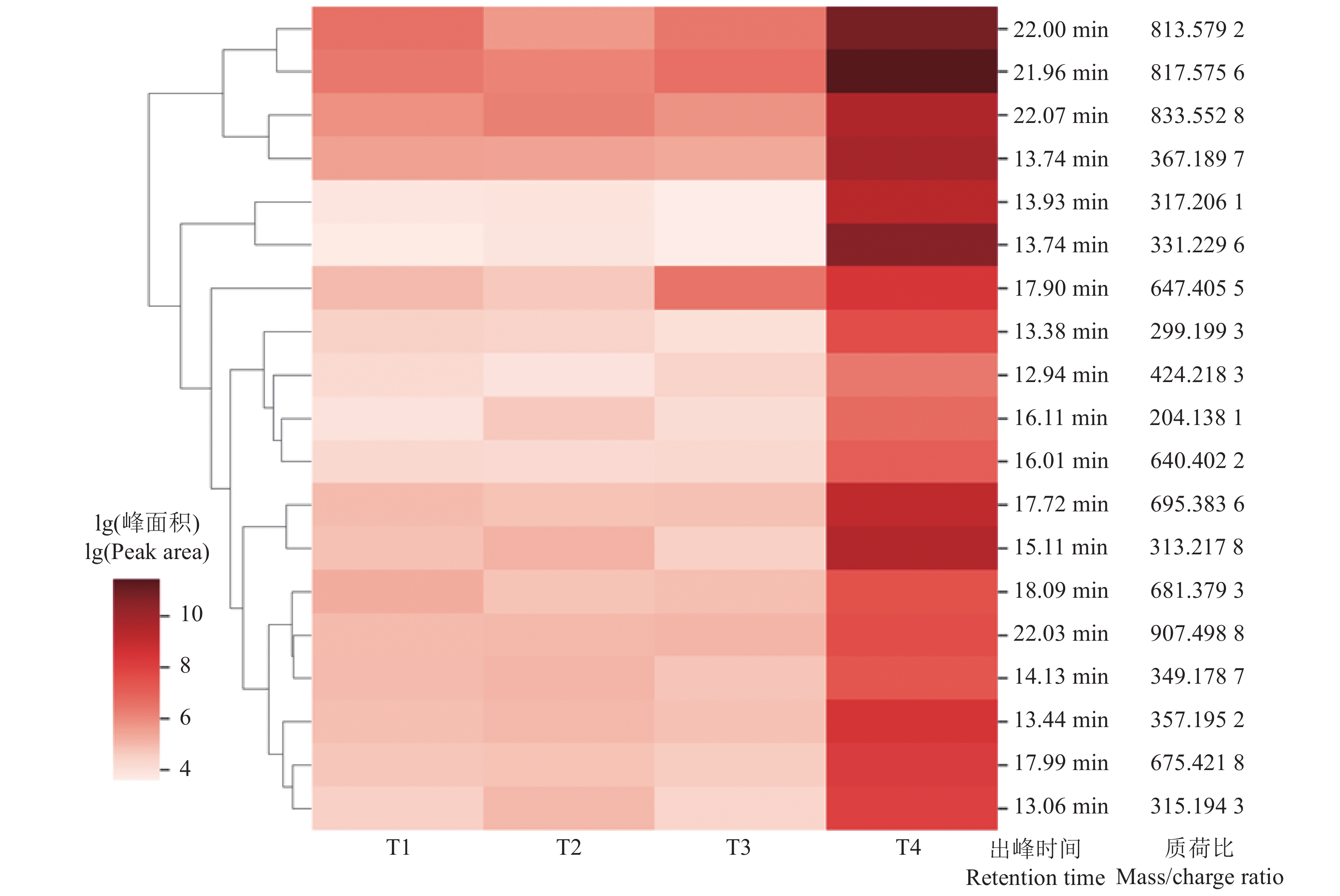
1.5 DYD光降解产物的鉴定为了鉴别光降解产物,设置4个不同处理:T1为甲醇,作溶剂空白;T2为不添加DYD的体积分数为0.05%的甲醇溶液,作基质空白;将DYD初始质量浓度升至1 mg·L−1,分别开展避光处理(T3)和光照处理(T4)试验,试验步骤同“1.3”。采用SPE小柱对试验样品进行浓缩净化。SPE小柱先用15 mL甲醇和15 mL去离子水活化,然后放干。萃取前,向小柱中加入3 mL去离子水,然后将光照样品通入小柱,同时调节真空度,让样品流速保持在5 mL·min−1左右。萃取后,小柱用4 mL乙酸乙酯淋洗3次,并收集萃取液。萃取液在高纯氮气下吹至近干,然后加入2 mL甲醇,过0.22 μm滤膜后待测。4种不同处理的样品分别用UV-2600和UHPLC-QTOF-MS(Waters Acquity I Class UPLC-Xevo G2-XS QTof HRMS)分析,用紫外吸收光谱鉴定目标合成孕激素的降解产物,步骤参见“1.2”。样品通过UHPLC-QTOF-MS自动进样器进样,进样量为0.5 μL,然后用C18色谱柱(2.1 mm × 100 mm,颗粒直径1.7 μm,Waters ACQUITY UPLC® CSHTM)进行分离,柱温为40 ℃,流速设置为0.35 mL·min−1。流动相A相为5 mmol/L醋酸铵+ 0.1% (φ)醋酸溶液,B相为乙腈,洗脱梯度为:乙腈初始体积分数为2%,维持0.5 min,在18 min内升至98%,维持6 min,然后在0.1 min内降至2%,维持2.9 min,总检测时间为27.5 min。检测条件包括:ESI+模式,碰撞气流速为1.65 L·min−1,离子喷雾电压为1030 V,离子源温度为150 ℃。采集数据模式为Sensitivity(质荷比m/z: 50~1000),毛细管电压为1.75 kV,脱溶剂气流量为800 L·h−1,碰撞能为6.0 eV。产物鉴定过程中,先利用非靶向筛查数据处理软件包pyHRMS将UHPLC-QTOF-MS采集的Raw数据文件格式转化为mzML格式再进行数据分析。T4以T1、T2和T3为对照,通过峰值拾取、峰值对齐、空白减法等过程,筛选出值得关注的特征峰,然后再做进一步处理。T4所有的特征峰有特定的出峰时间和质荷比,根据筛选出来的特征峰对4种处理的峰面积进行积分,使用Python中的Seaborn中的Heatmap功能进行绘图,根据颜色深浅体现峰面积的差异,即各特征峰对应的化合物在不同样品中含量的变化。
1.6 光降解动力学模型合成孕激素的光降解动力学数据可用一阶动力学模型拟合,公式如下:
| $ \rho _{t} = \rho _{0} {\rm{e}}^{-kt} \text{,} $ | (1) |
式中:ρt和ρ0分别为t和0时间点合成孕激素的液相质量浓度,µg·L−1;k为一阶光解动力学速率常数,h−1。t1/2是降解半衰期,h,可用以下公式计算:
| $ t_{1/2} = \ln 2 / k 。$ | (2) |
为了测定温度对DYD的动力学,利用Arrhenius方程计算活化能:
| $ \ln k = \ln K_{0}-(E_{{\rm{a}}}/{\rm{R}}T) ,$ | (3) |
式中:Ea为活化能,kJ/mol;R为摩尔气体常数,8.314 J·mol−1·K−1;T为光解反应的绝对温度,K;K0为频率因子,h−1。
1.7 数据处理与分析采用UV Probe 2.61采集分析紫外吸收光谱数据,采用AB Sciex MultiQuantTM分析Analyst Software Quantitate采集的LC-MS/MS数据,采用MassLynx V4.1采集分析光解产物数据。所有数据采用Excel 2007、Origin 2021b、Python 2.7和ChemDraw 20.0进行处理、拟合和绘图等工作。
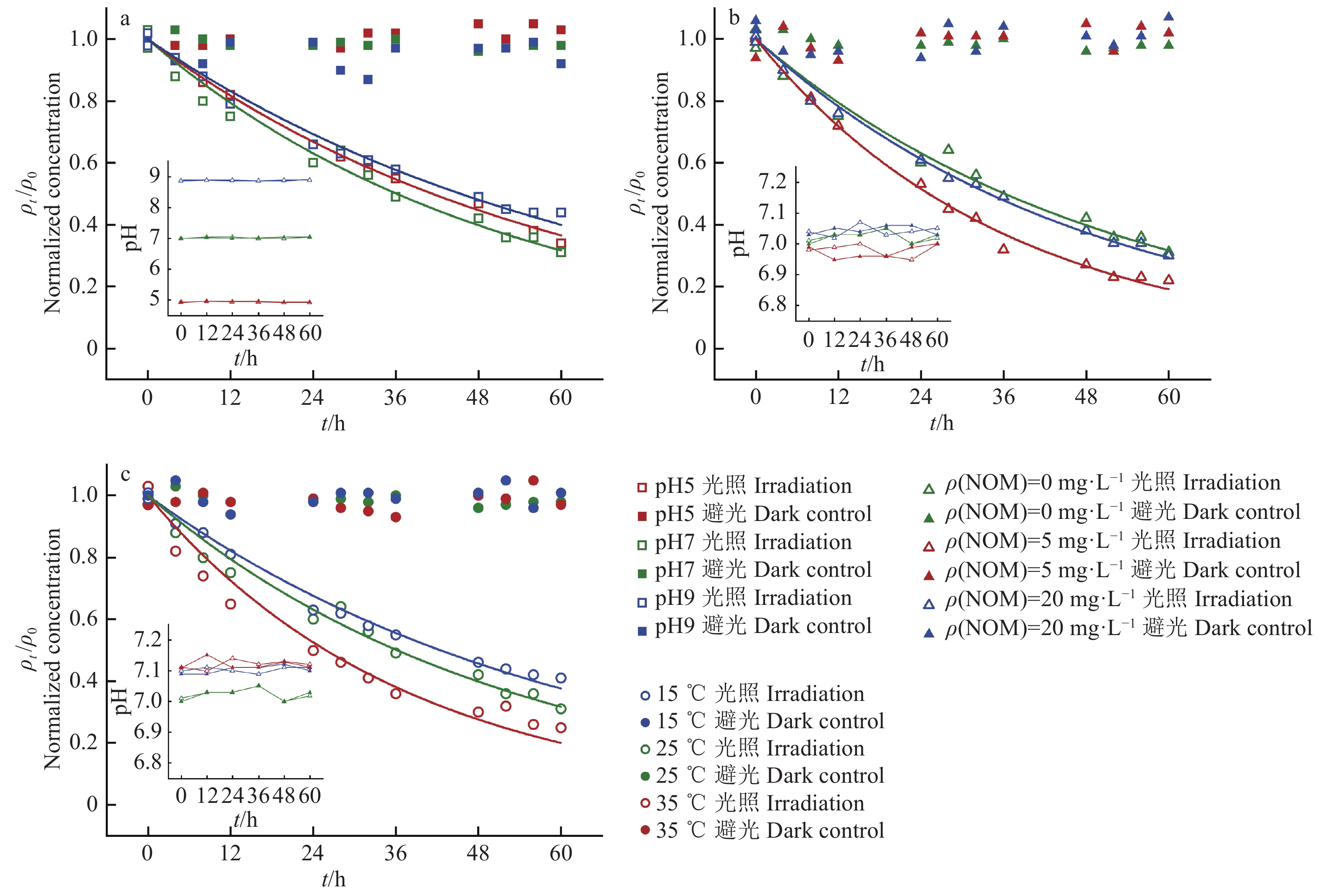
2 结果与分析 2.1 光解动力学及其影响因素如图1所示,DYD在避光条件下,其质量浓度(ρ)随时间基本保持稳定,说明DYD并未发生任何降解或吸附损失。光照条件下,DYD的质量浓度随着时间逐渐下降,其浓度变化可用一阶动力学方程较好地拟合(R2 = 0.97~0.99,表1)。结果表明,DYD在水中的一阶降解动力学速率常数k在0.017~0.028 h−1范围内,降解半衰期t1/2为25.0~45.1 h。由图1可知,pH在5、7和9条件下的k和t1/2均差异较小(P > 0.05),说明pH对DYD光降解的影响不大。随着温度升高,DYD的降解速率有一定幅度提升,k从0.016 h−1增加至0.027 h−1。NOM质量浓度为5 mg·L−1时的DYD光解的k是0 mg·L−1条件下的1.43倍,但NOM在20 mg·L−1条件下的DYD光解的k(0.0205 h−1)又下降至与0 mg·L−1条件下相近(k = 0.019 h−1),说明NOM质量浓度升高,DYD光解过程先促进后抑制。不同条件下反应前后溶液的pH动态稳定,说明DYD光降解对pH的影响不大。反应物从常态达到反应的过渡态所需要的能量为活化能Ea,根据Arrhenius模型计算出DYD光降解的Ea为19.21 kJ·mol−1,符合正温度效应,说明DYD发生光降解过程迅速[24-25]。
|
图 1 DYD在不同环境条件下的光降解动力学曲线 Fig. 1 Phototransformation dynamic curves of DYD under different environmental conditions |
|
|
表 1 DYD在不同环境条件下的光解动力学参数1) Table 1 Phototransformation kinetic parameters of DYD under different environmental conditions |
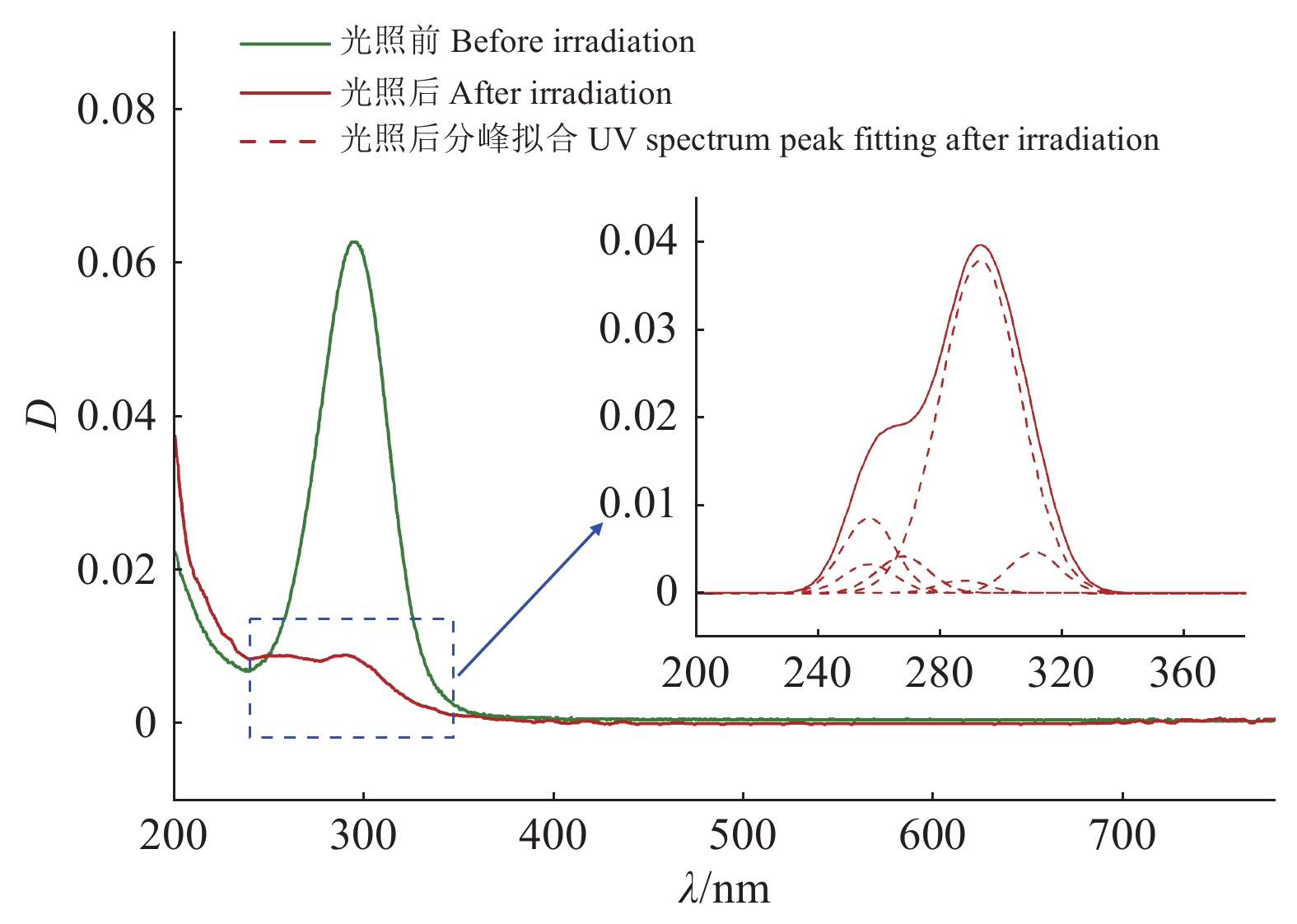
由图2可知,DYD最大吸收波长为295 nm左右,光解后此峰的丰度明显降低,且在峰的周围出现了一系列的小吸收峰(如292、256和267 nm等),说明在光照作用下DYD发生了降解过程,且大部分新峰的最大吸收波长在太阳辐射波长范围之外。以上现象说明DYD转化产物的光稳定性总体增强,很难发生进一步降解。通过聚类分析(图3)可知,较之于溶剂空白和基质空白,DYD产物的热图颜色较深,进一步说明DYD发生了明显的光解。DYD在光照条件下生成丰富的产物,通过对转化产物的质谱图进行分析以及和溶剂空白等谱图对比(表2)可知,DYD光降解后至少生成了19种产物。根据新生成的潜在产物峰面积变化,判断主要产物有DYD-P3、DYD-P5、DYD-P6、DYD-P9、DYD-P15、DYD-P16和DYD-P17。
|
图 2 DYD在光降解前后的紫外可见吸收光谱 Fig. 2 UV-Vis absorbance of DYD before and after phototransformation |
|
图 3 飞行时间质谱提取的不同处理样品中质荷比对比 Fig. 3 Comparisons of mass/charge ratios for samples with different treatments extracted by UHPLC-QTOF-MS T1:甲醇(溶剂空白);T2:不添加DYD的φ为0.05%的甲醇水溶液(基质空白);T3:DYD避光处理(对照样品);T4:DYD光照处理(试验样品) T1: Methanol (solvent blank); T2: Methanol solution of φ= 0.05% without DYD (matrix blank); T3: Dark treatment of DYD (control sample); T4: Irradiation treatment of DYD (experimental sample) |
|
|
表 2 DYD潜在的光转化产物 Table 2 Potential photoproducts of DYD |
在13.75~16.07 min之间提取到了5个质荷比(m/z)为313.2162的峰。因此,推断DYD-P3(分子式C21H28O2,质荷比313.2162)可能是DYD的同分异构体。在激素常见的异构体中,对映异构化是最常见的异构反应[16, 20]。DYD-P5(分子式C21H32O2,质荷比317.2475)在13.93 min出峰,比DYD提前了2.60 min,说明极性较DYD有所增强;比DYD质荷比增加4.0313,推断其为DYD的加氢产物。DYD-P6(分子式C21H30O3,质荷比331.2268)在13.74 min出峰,较DYD提前了2.79 min,极性较DYD有所增强;比DYD质荷比增加18.0007,推断它为DYD的羟基化+加氢产物[19]。DYD-P9(分子式C21H34O5,质荷比367.2479)在12.96 min出峰,较DYD提前了3.57 min,极性较DYD有所增强;比DYD质荷比增加54.0582,推断其为DYD的三羟基化作用和加氢作用后形成的产物。DYD-P13(分子式C42H58O7,质荷比675.4255)在17.99 min出峰,极性较DYD有所减弱,可能是DYD发生缩聚生成二聚体后进一步羟基化的产物。DYD-P15(分子式C42H62O8,质荷比695.4517)在17.72 min出峰,较DYD延后了1.19 min,极性较DYD-P13有所增强;比DYD-P13质荷比增加20.0262,推断DYD-P15为DYD-P13的进一步羟基化+加氢的产物。另外,在22.00和21.96 min提取到DYD-P16(分子式C58H64O2,质荷比813.6544)和DYD-P17(分子式C58H88O2,质荷比817.6857),推断它们是DYD以及二聚体部分光解产物的缩聚产物或者DYD缩聚生成三聚体再发生光解的产物。
通过以上产物可知,DYD在光解过程中主要反应路径包括5个方面:
1)DYD首先发生羟基化作用,进一步发生加氢作用;
2)DYD发生加氢链式反应;
3)DYD发生缩聚作用生成二聚体或三聚体后进一步光解或DYD部分光解产物发生缩聚的链式反应;
4)DYD发生光异构化;
5)DYD及其缩聚体开环形成产物。
3 讨论与结论以往研究表明,光降解是合成孕激素进入地表水后的重要环境过程[17, 19],DYD的光解速率和激素的其他环境过程如生物转化、矿物界面催化转化等速率相当[26-29]。本研究发现,pH对DYD的光解速率影响不大。这可能是因为DYD在水中的解离常数pKa为19.4[30],其在pH 5~9范围内保持中性,难以发生解离;而且DYD分子结构上的甲基、酮基、乙酰基等基团不如酯基等官能团容易水解。随着温度的升高,DYD的光降解速率升高,主要是由于温度升高时,分子的运动速率增加,原子间的相对作用发生变化,从而引起化学键的松动,因此升温在一定程度上会促进光降解过程[19, 31]。季节的交替会影响地表水体的温度,因此研究温度对DYD光降解的影响具有一定意义。低浓度的NOM促进DYD的光解,而高浓度的NOM抑制了DYD的光解。主要原因可能是在试验浓度范围内,NOM浓度较低时,可作为光敏剂促进体系中活性氧(如·OH、1O2和3NOM*)的产生,从而促进目标孕激素的降解[32];当NOM浓度较高时,可能会和DYD竞争吸收光子,通过光屏蔽作用抑制DYD光解,或通过吸附作用减缓或抑制其光解[33-35]。
本研究共检测出19种DYD的光解产物,DYD主要发生了羟基化、加氢、缩聚、光异构化以及开环的链式反应。传统的环境过程及毒理学研究通常假设物质发生转化后伴随的是毒性的降低甚至消失[29]。然而,Wammer等[19]报道了合成孕激素烯丙孕素在水中的光降解过程,发现其转化产物具有较强的雄激素活性。本研究发现,相较DYD母物质结构,所有的光降解产物的分子骨架没有发生变化,仅增加或减少了部分活性官能团。DYD的光降解产物可能对环境仍具有潜在的内分泌干扰性。另外,研究发现,部分光解产物在反相色谱柱的保留时间相对于DYD提前,说明其极性有所增加。因此,这些极性光解中间产物在环境中的迁移性可能更强,传统的植被过滤带、生物篱、河岸缓冲带等农业措施可能对产物的去除能力较弱,因此增加了环境生物对DYD转化产物的暴露风险。
本研究结论如下:1)DYD在水中的光解过程可用一阶动力学模型模拟。pH对DYD的光解影响不大,主要是由于DYD不发生解离,且DYD分子上缺乏可水解的基团;DYD光解符合正温度效应,主要是由于温度升高促进了分子的运动速率。另外,NOM在低浓度时可生成活性自由基促进DYD光解,但高浓度NOM通过光屏蔽或吸附作用减缓或抑制DYD光解;2)DYD在光解过程中至少生成了19种产物,主要反应包括羟基化、加氢、缩聚、光异构化以及开环。
| [1] |
KUMAR V, JOHNSON A C, TRUBIROHA A, et al. The challenge presented by progestins in ecotoxicological research: A critical review[J]. Environmental Science & Technology, 2015, 49(5): 2625-2638. (  0) 0) |
| [2] |
童心, 胡柏杨, 陈兴财, 等. 类固醇雌激素的环境暴露及其迁移转化[J]. 浙江大学学报(农业与生命科学版), 2017, 43(6): 734-746. (  0) 0) |
| [3] |
DOMINGUES J T, ORLANDO R M, ALMEIDA M R, et al. Extraction of estrogen hormones from water samples using an aqueous two-phase system: A new approach for sample preparation in the analysis of emerging contaminants[J]. Microchemical Journal, 2021, 166: 106231. DOI:10.1016/j.microc.2021.106231 (  0) 0) |
| [4] |
赵砚彬, 胡建英. 环境孕激素和糖皮质激素的生态毒理效应: 进展与展望[J]. 生态毒理学报, 2016, 11(2): 6-17. (  0) 0) |
| [5] |
罗鑫. 太湖中甾体激素污染特征及生态风险研究[D]. 无锡: 江南大学, 2021.
(  0) 0) |
| [6] |
ZHAO Y, CASTIGLIONI S, FENT K. Synthetic progestins medroxyprogesterone acetate and dydrogesterone and their binary mixtures adversely affect reproduction and lead to histological and transcriptional alterations in zebrafish (Danio rerio)
[J]. Environmental Science & Technology, 2015, 49(7): 4636-4645. (  0) 0) |
| [7] |
PAULOS P, RUNNALLS T J, NALLANI G, et al. Reproductive responses in fathead minnow and Japanese medaka following exposure to a synthetic progestin, Norethindrone[J]. Aquatic Toxicology, 2010, 99(2): 256-262. DOI:10.1016/j.aquatox.2010.05.001 (  0) 0) |
| [8] |
BESSE J P, GARRIC J. Progestagens for human use, exposure and hazard assessment for the aquatic environment[J]. Environmental Pollution, 2009, 157(12): 3485-3494. DOI:10.1016/j.envpol.2009.06.012 (  0) 0) |
| [9] |
王蓓颖, 王海云. 孕激素在口服避孕药中应用[J]. 世界临床药物, 2015, 36(2): 73-76. (  0) 0) |
| [10] |
博思数据研究中心. 2014-2019年中国避孕药市场现状分析及投资前景研究报告[R/OL]. (2014-03-11) [2022-03-18]. http://www.bosidata.com/xiyao1403/S027163LS6.html.
(  0) 0) |
| [11] |
ZHANG J N, CHEN J, YANG L, et al. Occurrence and fate of androgens, progestogens and glucocorticoids in two swine farms with integrated wastewater treatment systems[J]. Water Research, 2021, 192: 116836. DOI:10.1016/j.watres.2021.116836 (  0) 0) |
| [12] |
ZHANG J N, YING G G, YANG Y Y, et al. Occurrence, fate and risk assessment of androgens in ten wastewater treatment plants and receiving rivers of South China[J]. Chemosphere, 2018, 201: 644-654. DOI:10.1016/j.chemosphere.2018.02.144 (  0) 0) |
| [13] |
LIU S S, YING G G, LIU S, et al. Analysis of 21 progestagens in various matrices by ultra-high-performance liquid chromatography tandem mass spectrometry (UHPLC-MS/MS) with diverse sample pretreatment[J]. Analytical and Bioanalytical Chemistry, 2014, 406(28): 7299-7311. DOI:10.1007/s00216-014-8146-4 (  0) 0) |
| [14] |
PFLUG N C, HANKARD M K, BERG S M, et al. Environmental photochemistry of dienogest: Phototransformation to estrogenic products and increased environmental persistence via reversible photohydration[J]. Environmental Science Processes & Impacts, 2017, 19(11): 1414-1426. (  0) 0) |
| [15] |
PENG F Q, YING G G, YANG B, et al. Biotransformation of progesterone and norgestrel by two freshwater microalgae (Scenedesmus obliquus and Chlorella pyrenoidosa): Transformation kinetics and products identification
[J]. Chemosphere, 2014, 95: 581-588. DOI:10.1016/j.chemosphere.2013.10.013 (  0) 0) |
| [16] |
KHAN B, LEE L S, SASSMAN S A. Degradation of synthetic androgens 17α- and 17β-trenbolone and trendione in agricultural soils[J]. Environmental Science & Technology, 2008, 42(10): 3570-3574. (  0) 0) |
| [17] |
QU S, KOLODZIEJ E P, CWIERTNY D M. Phototransformation rates and mechanisms for synthetic hormone growth promoters used in animal agriculture[J]. Environmental Science & Technology, 2012, 46(24): 13202-13211. (  0) 0) |
| [18] |
KOLODZIEJ E P, QU S, FORSGREN K L, et al. Identification and environmental implications of photo-transformation products of trenbolone acetate metabolites[J]. Environmental Science & Technology, 2013, 47(10): 5031-5041. (  0) 0) |
| [19] |
WAMMER K H, ANDERSON K C, ERICKSON P R, et al. Environmental photochemistry of altrenogest: Photoisomerization to a bioactive product with increased environmental persistence via reversible photohydration[J]. Environmental Science & Technology, 2016, 50(14): 7480-7488. (  0) 0) |
| [20] |
杨明, 李艳霞, 冯成洪, 等. 类固醇激素的环境行为及其影响因素[J]. 农业环境科学学报, 2012, 31(5): 849-856. (  0) 0) |
| [21] |
杨雷, 张晋娜, 史文俊, 等. 类固醇激素在环境中的污染现状及归趋[J]. 生态毒理学报, 2019, 14(5): 1-21. (  0) 0) |
| [22] |
张晋娜. 类固醇雄激素、孕激素和糖皮质激素的环境污染特征及其生物降解转化规律[D]. 广州: 中国科学院广州地球化学研究所, 2019.
(  0) 0) |
| [23] |
ZHAO H N, TIAN Z Y, KIM K E, et al. Biotransformation of current-use progestin dienogest and drospirenone in laboratory-scale activated sludge systems forms high-yield products with altered endocrine activity[J]. Environmental Science & Technology, 2021, 55(20): 13869-13880. (  0) 0) |
| [24] |
盖新宇. 电化学辅助溴氨酸芳胺化[D]. 大连: 大连理工大学, 2015.
(  0) 0) |
| [25] |
罗渝然, 俞书勤, 张祖德, 等. 再谈什么是活化能: Arrhenius活化能的定义、解释、以及容易混淆的物理量[J]. 大学化学, 2010, 25(3): 35-42. (  0) 0) |
| [26] |
胡斯勒图, 施建成, 李明, 等. 基于卫星数据的地表下行短波辐射估算: 方法、进展及问题[J]. 中国科学:地球科学, 2020, 50(7): 887-902. (  0) 0) |
| [27] |
陈志华, 陈滨滨, 刘红波. 钢结构常用涂料太阳辐射吸收系数试验研究[J]. 建筑结构学报, 2014, 35(5): 81-87. DOI:10.14006/j.jzjgxb.2014.05.014 (  0) 0) |
| [28] |
TANG T, SHI T Y, LI D G, et al. Adsorption properties and degradation dynamics of endocrine-disrupting chemical levonorgestrel in soils[J]. Journal of Agricultural and Food Chemistry, 2012, 60(16): 3999-4004. DOI:10.1021/jf300479z (  0) 0) |
| [29] |
YANG X J, DAI X, ZHANG Y L, et al. Sorption, desorption, and transformation of synthetic progestins in soil and sediment systems[J]. Geoderma, 2020, 362(C): 114141. DOI:10.1016/j.geoderma.2019.114141 (  0) 0) |
| [30] |
WISHART D S, FEUNANG Y D, GUO A C, et al. DrugBank 5.0: A major update to the DrugBank database for 2018[J]. Nucleic Acids Research, 2018, 46(D1): D1074-D1082. DOI:10.1093/nar/gkx1037 (  0) 0) |
| [31] |
张黎, 姜力杨, 盖歆楠, 等. 风机叶片材料雷击热损伤特性及损伤机制的分子动力学研究[J]. 中国电机工程学报, 2020, 40(3): 1009-1020. DOI:10.13334/J.0258-8013.PCSEE.181425 (  0) 0) |
| [32] |
CWIERTNY D M, SNYDER S A, SCHLENK D, et al. Environmental designer drugs: When transformation may not eliminate risk[J]. Environmental Science & Technology, 2014, 48(20): 11737-11745. (  0) 0) |
| [33] |
崔子硕, 欧晓霞, 王驭晗, 等. 有机污染物光降解过程中活性中间体的研究进展[J]. 广州化工, 2019, 47(9): 23-26. DOI:10.3969/j.issn.1001-9677.2019.09.014 (  0) 0) |
| [34] |
于莉莉, 钟晔, 孙福红, 等. pH值对滇池水体溶解性有机质(DOM)光降解作用的影响[J]. 光谱学与光谱分析, 2019, 39(8): 2533-2539. (  0) 0) |
| [35] |
郭忠禹, 陈景文, 张思玉, 等. 天然水中溶解性有机质对有机微污染物光化学转化的影响[J]. 科学通报, 2020, 65(26): 2786-2803. (  0) 0) |
 2023, Vol. 44
2023, Vol. 44