据统计,全球范围内有超过50%的潜在可耕地可能是酸性的,世界上多达60%的酸性土壤在发展中国家,我国南方土地酸化也面临严峻的形势[1]。铝毒是世界范围内限制作物生产的一个重要因素,当土壤pH下降到5以下时,铝在土壤中以八面体六水Al(H2O)63+形式存在,通常称为A13+。这种形式的铝溶解到土壤溶液中后,对植物的根系造成严重胁迫[2-3]。酸铝胁迫对植物影响最快最主要的是根系,尤其是对根尖生长的抑制[4-6]。植物根尖与酸铝接触后在极短的几分钟内便可快速进入细胞质[7-9]。当细胞质内进入大量铝元素后,会抑制细胞分裂,迅速破坏根系细胞的扩张和伸长[10]。植物根系若长期暴露在酸铝胁迫下,根系的延伸会受到抑制,根尖膨胀,侧根、根毛的数量显著下降[11]。酸铝胁迫下损伤后的根系对水和矿物质等养分的吸收能力显著下降[12-13]。酸性条件下的铝离子具有较高的活性,对细胞壁、细胞膜、细胞质和细胞核的生理功能都会产生影响[14]。
华南农业大学国家大豆改良中心广东分中心前期研究发现,GsMYB7受酸铝胁迫诱导表达,在酸铝敏感大豆品种‘华春6号’中过表达,可增强植株对耐酸铝胁迫的抗性。对野生型和GsMYB7过表达株系进行酸铝处理后,RNA-Seq测序结果分析和RT-qPCR检测结果发现,有9个候选基因被GsMYB7间接或直接调控,其中,GmGST7对酸铝胁迫响应比较明显[15]。
谷胱甘肽转移酶(Glutathione S-transferase,GST)家族成员起源于一个古老的祖先基因,在漫长的进化过程中,经历了外显子改组、基因复制、选择性剪接、交换、突变和其他未知机制,导致了GST的序列多样化和功能多样性[16-18]。根据氨基酸序列的相似性和外显子的个数,GST家族在植物中主要分为4个类型:phi型、zeta型、tau型和theta型[19]。在结构上,GST含有N端和C端保守域。GST通过将谷胱甘肽偶联到疏水底物上,对内源性和外源性化合物进行解毒[20]。解毒包括3个阶段:转化、结合和分隔[21]。经典的GST有2个结合位点,位于N端的GSH结合位点(G-site)和由C端形成的亲电底物结合位点(H-site)。
GST在植物中参与除草剂解毒、激素生物合成、酪氨酸降解、过氧化物分解等过程,且环境应激反应比较敏感[22],如除草剂和低温诱导AtGSTU26表达[23],病原体感染诱导AtGSTU16表达[24]。研究发现,GST可通过调解氧化还原信号参与植物根系的发育[25-26]。
1 材料与方法 1.1 试验材料大豆Glycine max L.‘华春6号’、本氏烟草Nicotiana L.以及野生型拟南芥(Col-0) Arabidopsis thaliana L.,均由国家大豆改良中心广东分中心提供。所用菌株为大肠埃希菌Escherichia coli DH5α、根癌农杆菌Agrobacterium tumefaciens GV3101。
1.2 生物信息学分析使用NCBI大豆( https://www.ncbi.nlm.nih.gov/)和Phytozome数据库( https://phytozome- next.jgi.doe.gov/),查询基因序列、蛋白家族,使用MEGA11软件对GmGST7进行cDNA和氨基酸序列比对,完成进化树分析。
1.3 大豆试验样品处理选取饱满无病害的‘华春6号’种子,用营养土在人工气候培养间进行培育,在其幼荚期取幼荚、花、叶、茎和根样品,用锡纸包裹,迅速放置液氮中,−80 ℃保存。
挑选健康、同批收获的‘华春6号’种子,放在吸水饱满的蛭石上萌发3~4 d,至芽生长至2~3 cm时,从蛭石中取出,用清水洗净根部,固定在漂浮板上,让根部完全浸泡在pH为4.3的0.5 mmol/L简单钙离子溶液中,预培养24 h;在该培养液基础上,梯度设置AlCl3浓度为0、25、50、75 和 100 µmol/L,培养24 h。在pH为4.3的简单钙离子溶液且AlCl3浓度都为50 µmol/L的基础上,设置0、4、8、12、16、24、48、36和72 h的时间梯度。选取预处理后根部长势一致的材料进行处理;上述材料处理完后,取大豆根部样品,用锡纸包裹后迅速放入液氮中,−80 ℃保存。
使用RNA提取试剂盒(南京诺唯赞生物科技股份有限公司)分别提取各组织和处理根部RNA,统一浓度后完成反转录,将反转录后的cDNA放于−20 ℃保存,作为RT-qPCR和载体的模板。
1.4 RT-qPCR分析以各处理cDNA为模板,试剂使用SYBR荧光定量酶(苏州近岸蛋白质科技股份有限公司),仪器使用CFX96实时荧光定量PCR仪(Bio-Rad),PCR程序设置为95 ℃ 3 min;95 ℃ 10 s、58 ℃ 10 s、95 ℃ 30 s,39 个循环;95 ℃ 30 s。相关引物序列见表1,以β-actin为内参基因。目的基因的相对表达量用2−∆∆Ct法计算。
|
|
表 1 引物序列 Table 1 Primer sequence |
以‘华春6号’根部的cDNA为模板,用GmGST7的克隆引物(GmGST7-F/R)进行PCR扩增。50 µL PCR反应体系为:2×Phanta Max Buffer 25 µL、dNTP Mix 1 µL、正反向引物各2 µL、Phanta Max Super-Fidelity DNA Polymerase 1 µL、模板cDNA 2 µL、ddH2O 17 µL。PCR反应程序为95 ℃预变性3 min;95 ℃变性15 s、57 ℃退火15 s、72 ℃延伸40 s,34个循环;72 ℃保温5 min。
构建GmGST7过表达载体GmGST7-pTF101。使用Xba Ⅰ和Sac Ⅰ对pTF101进行双酶切,通过重组引物(pTF101-GmGST7-F/R)将GmGST7基因cDNA序列连入pTF101,测序无误后转化农杆菌GV3101。
构建亚细胞定位载体GmGST7-Super1300,将GmGST7基因连接Super1300亚细胞定位载体,使用Xba Ⅰ和Spe Ⅰ酶对Super1300进行双酶切,通过重组引物(Super1300-GmGST7-F/R)将GmGST7基因cDNA连到载体,测序无误后转化农杆菌GV3101。引物序列见表1。
1.6 亚细胞定位将含有质粒GmGST7-Super1300的GV3101农杆菌和Super1300空载体的GV3101农杆菌扩摇至D600 nm=0.6,离心重悬。选择生长4~5周、健壮的烟草,侵染前强白光照射2~3 h,使叶片气孔充分张开。从叶片下表皮注射菌液,注射完成后密封保湿、暗处理1 d,正常培养2 d后,使用激光共聚焦显微镜(德国徕卡,激光共聚焦TCS-SP8 SR)观察,叶绿体荧光信号激发波长640 nm,检测波长675 nm,绿色荧光蛋白GFP激发波长488 nm,检测波长510 nm。
1.7 拟南芥遗传转化在营养土中种植野生型拟南芥。第1次抽苔时剪去主苔,在侧苔快要开花时准备侵染,如第1次侵染有结荚,则去除。侵染每周1次,共侵染3次。将载体GmGST7-pTF101转化GV3101,鉴定阳性菌后扩摇至D600 nm=0.6,离心后用重悬液重悬后准备侵染。将拟南芥花浸泡1 min左右,密封保湿、暗培养1 d后,正常培养。
1.8 拟南芥酸铝处理及表型鉴定在营养土中种植侵染后收获的拟南芥种子,2片真叶完全长开后定期多次喷洒除草剂,去除假阳性苗。待植株生长健壮后选取鲜嫩的叶片,用TPS抽提液快提DNA,设计包含35S启动子区域的引物进行DNA分子水平鉴定。以此方法鉴定并加代至T3代。提取不同株系拟南芥RNA,通过荧光定量鉴定,选择表达量高的株系大量繁种。
将拟南芥种子用10%(φ)次氯酸钠溶液浸泡震荡10 min消毒,然后用无菌水清洗5遍。种植于1/2 MS培养基上,将播种后的培养基放于4 ℃冰箱春化3 d,然后转移至培养室竖直培养,待根长至1 cm左右,进行铝处理。
设置0、50、100 µmol/L AlCl3浓度梯度的1/2 MS培养基,pH调至4.3。将长势一致的拟南芥转移至该培养基上,保持根的伸长状态。竖直培养1周左右,拍照记录,测量根长,计算根相对伸长。提取RNA,对拟南芥中酸铝胁迫响应的标志基因和GmGST7同源基因At2G29420的下游基因进行荧光定量分析。酸铝标志基因为铝激活苹果酸盐转运体AtALMT(At1G08430)[27];AtMATE (At1G51340)[27]参与铝离子外排;AtALS3(At2G37330)[27]编码ABC转运蛋白,参与铝离子在体内的运转,减少铝对根的伤害;AtWAK1(At1G21250)[28]是一种细胞质相关激酶,参与细胞壁的修复。通过Phytozome搜索At2G29420基因下游基因,得到3个谷氨酰胺水解酶基因(At1G78660、At1G78670、At1G78680)和1个氨基肽酶基因(At4G33090)。引物见表2。测定植株中MDA含量、H2O2含量、POD活性(参考科铭生物试剂盒说明书)。
|
|
表 2 荧光定量引物序列 Table 2 qPCR primer sequence |
GmGST7基因在大豆第7号染色体上(基因登录号码为LOC547578),该基因周围存在基因簇。GmGST7基因含有2个外显子、1个内含子;基因组全长1 128 bp,转录本986 bp,cDNA全长678 bp,编码226个氨基酸。GmGST7编码典型的tau类GST蛋白,含有2个GST保守结构域,分别为高度保守的N端和不保守的C端,如图1所示。N端三维结构的组成是β1α1β2(α2)β3β4α3,C端是一个完全α-螺旋结构。
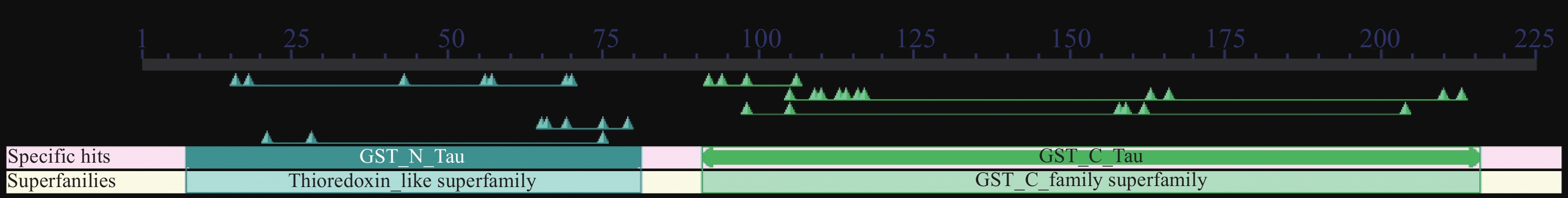
|
图 1 GmGST7蛋白结构域 Fig. 1 Protein domain of GmGST7 |
GST家族中tau类在植物物种之间的差异较为明显。选择拟南芥和大豆中同源基因进行蛋白序列比对,在NCBI中找到相似度最高的17个基因进行蛋白序列比对,N端和C端序列相似度都较高,总体序列相似度为80%~99%。在不同物种中,只有N端相对保守,C端差异较大,总体序列相似度为44%~52%,如图2A所示。在构建进化树时,大豆同源基因之间的遗传距离相对较近,和拟南芥的同源基因间的遗传距离相对较远,如图2B所示。
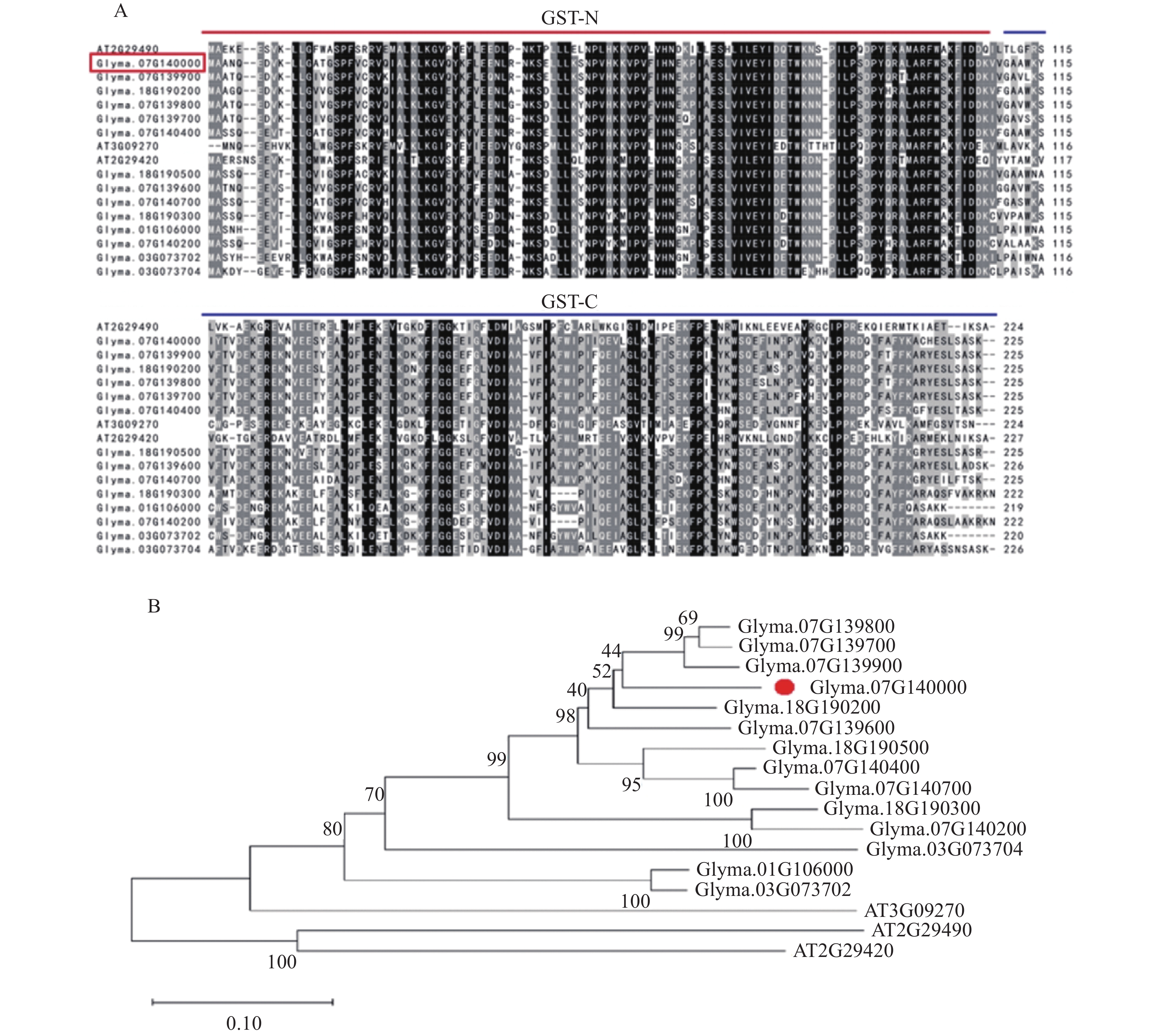
|
图 2 GmGST7蛋白序列对比(A)和进化树(B)分析 Fig. 2 Sequence comparison (A) and evolutionary tree (B) analysis of GmGST7 protein 红色横线代表GST-N,蓝色横线代表GST-C,红色点标注为目标基因GmGST7 The red horizontal line represents GST-N, the blue horizontal line represents GST-C, and the red dot is labeled as the target gene GmGST7 |
通过STRING网站对GmGST7的互作蛋白进行预测,发现有5个候选蛋白可能与GmGST7(LOC547578)互作(图3)。其中,LOC732557(GLYMA07G16850)和DHAR1(GLYMA10G43730)属于GST家族蛋白,和GmGST7属于同一个家族。GLYMA03G40050和HGS(GLYMA19G42610)属于HGS(谷胱甘肽合成酶)家族蛋白。
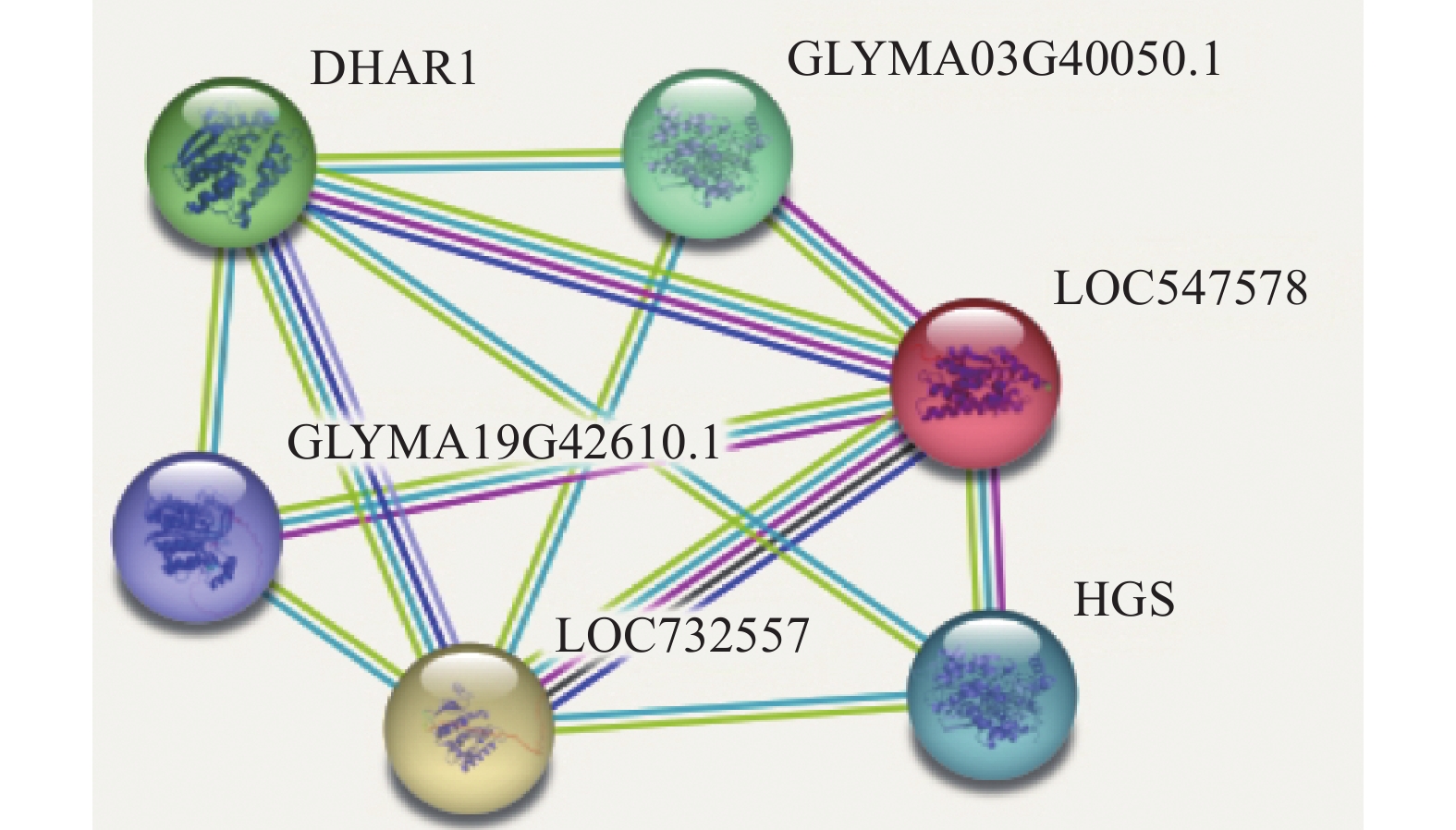
|
图 3 GmGST7互作蛋白预测 Fig. 3 Interaction protein prediction of GmGST7 |
为了检测GmGST7基因的组织表达模式,采集‘华春6号’结荚初期的根、茎、叶、花、幼荚样品,定量检测结果(图4)表明,GmGST7基因呈组成型表达模式,GmGST7基因在叶、花和幼荚中的表达量相对偏低,在根中的表达量明显高于在其他组织中的;以幼荚的表达量为对照,GmGST7基因在根中的表达量是幼荚中的171.8倍,是茎中的8.6倍。
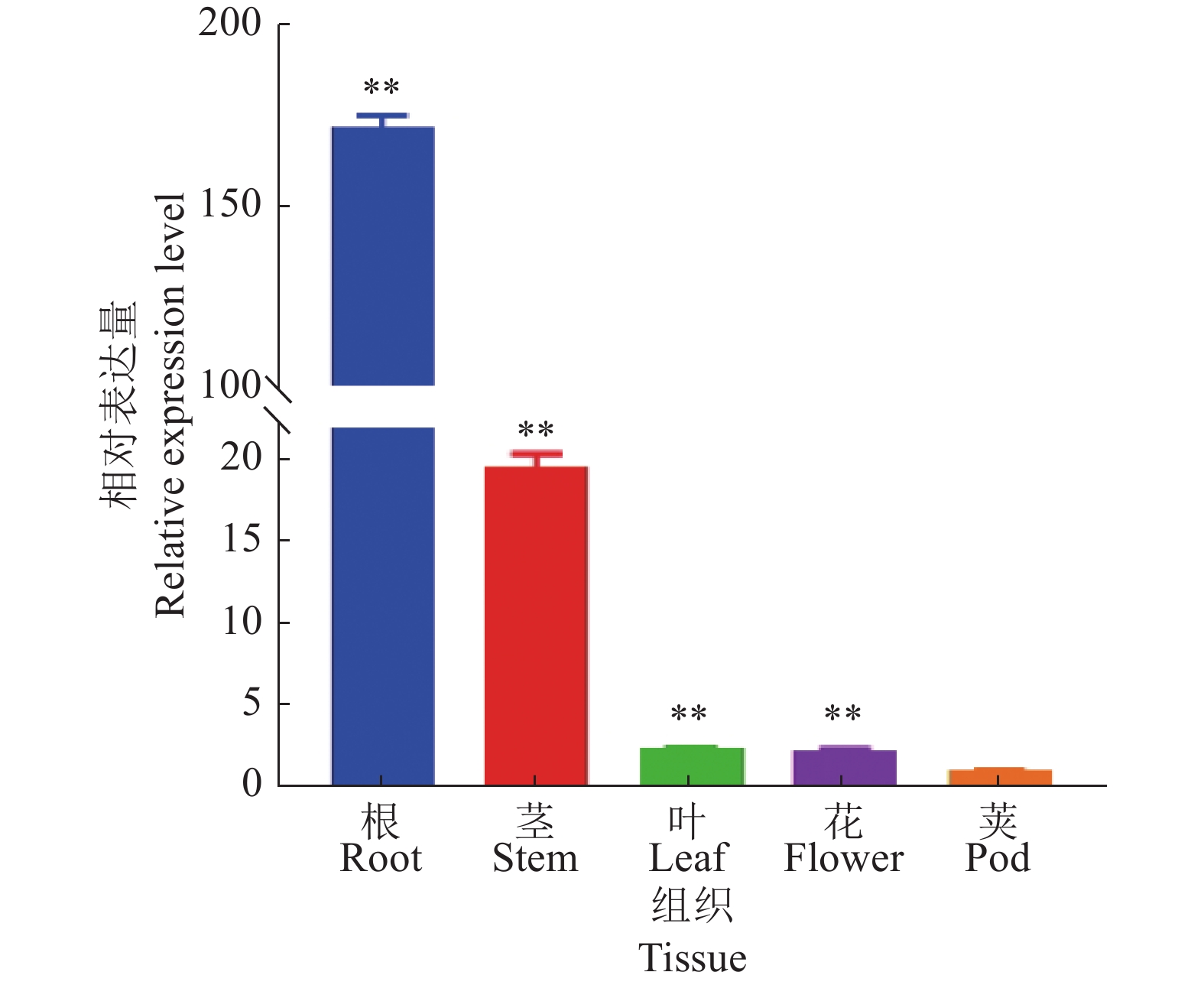
|
图 4 GmGST7基因的组织表达模式分析 Fig. 4 Analysis of tissue expression pattern of the GmGST7 gene “**”表示该组织与幼荚在P < 0.01水平差异显著(t检验) “**” indicates that the tissue differed from the young pod at P < 0.01 level (t test) |
为了进一步分析GmGST7在铝胁迫下的表达特征,对GmGST7基因进行不同浓度梯度和时间梯度的表达分析。定量结果表明,随AlCl3浓度的增加,GmGST7的相对表达量先升高后降低,在50 µmol/L AlCl3溶液中的相对表达量最高,是对照的14.5倍(图5A)。在时间梯度处理中,随着处理时间的推移,GmGST7基因表达量先升高后降低,在处理24 h时表达量最高,为对照的24.9倍(图5B)。
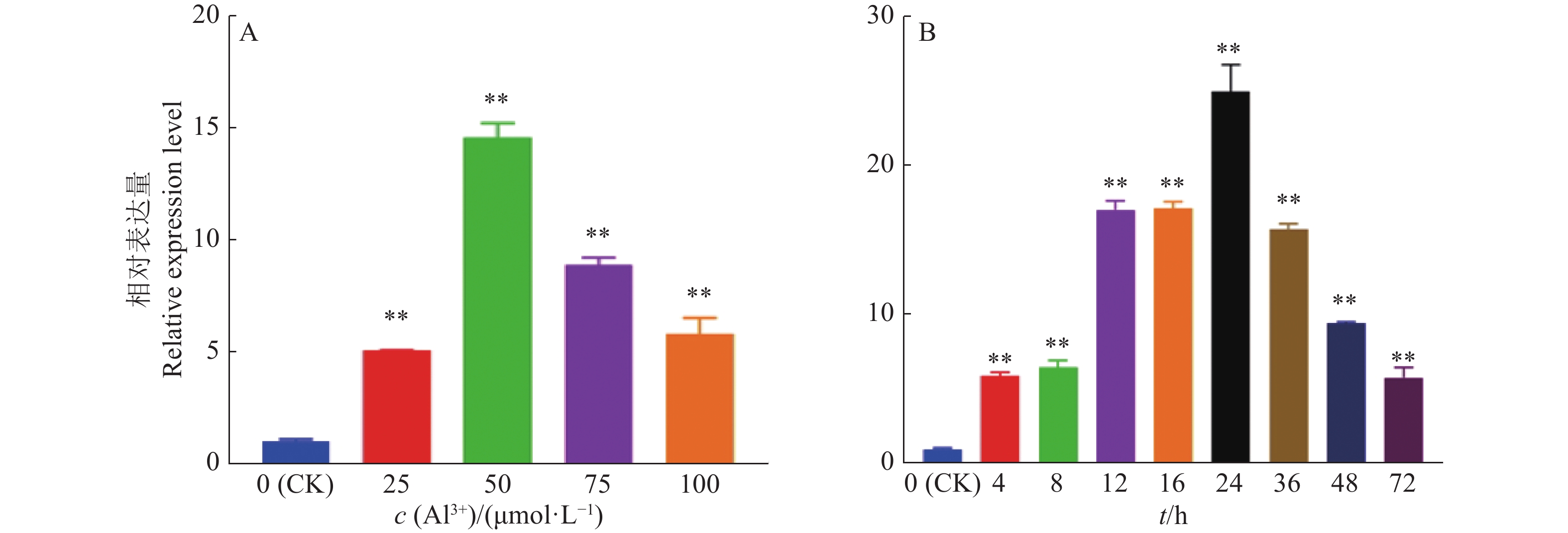
|
图 5 GmGST7基因酸铝胁迫响应 Fig. 5 Response of the GmGST7 gene to acidic aluminum stress 各图中,“**”表示处理与对照(CK)在P < 0.01水平差异显著(t检验) “**” indicates that the treatment differed from the control (CK) at P < 0.01 level in each figure (t test) |
以‘华春6号’转录组为模板,设计特异引物,PCR扩增包含GmGST7整个cDNA序列的产物。PCR后通过琼脂糖凝胶电泳,获得大小为742 bp的DNA片段(图6A),符合引物设计产物长度。将PCR产物纯化后进行测序,测序序列与NCBI数据库中目标基因的序列一致。
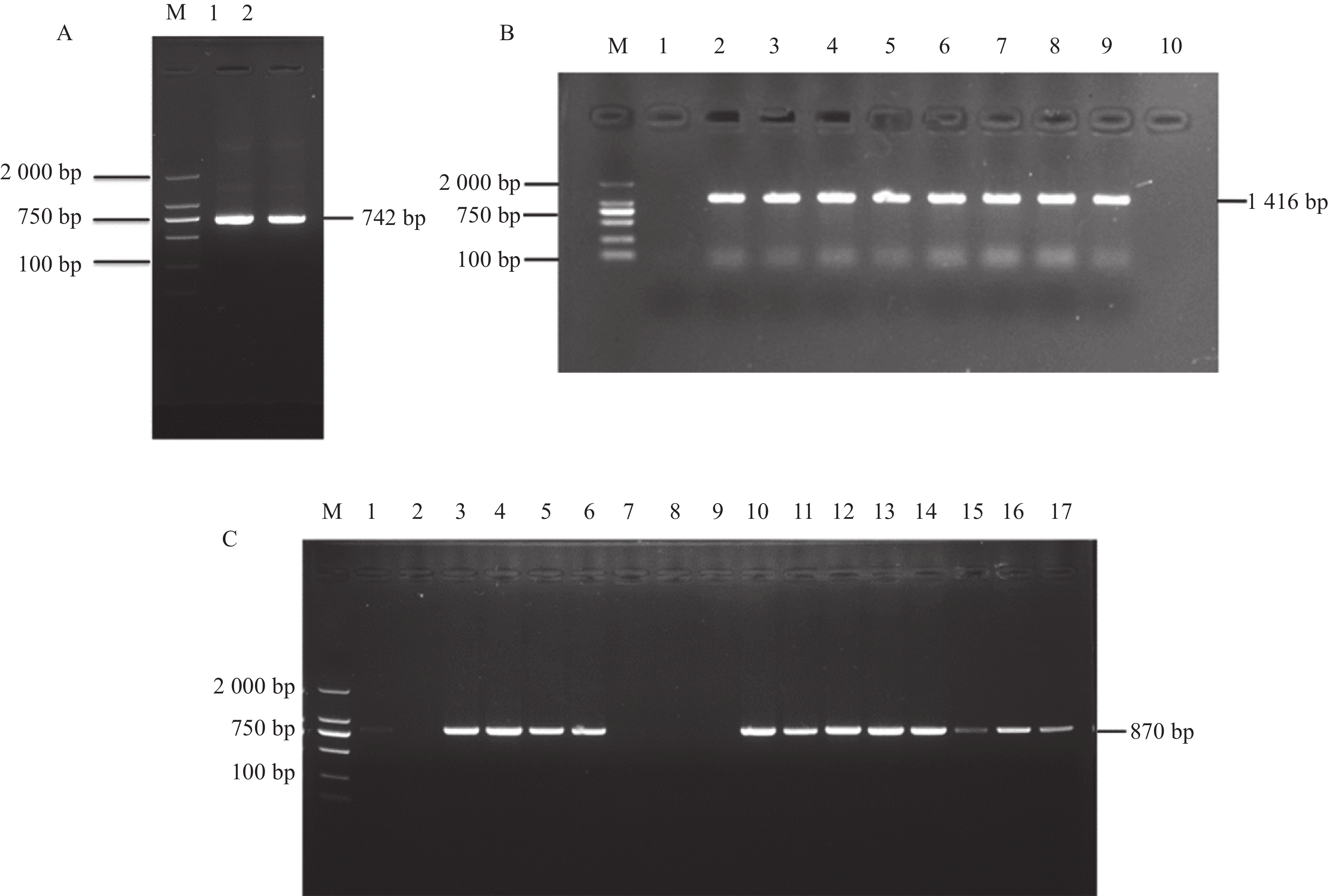
|
图 6 GmGST7基因克隆及载体构建 Fig. 6 Cloning and vector construction of the GmGST7 gene A:GmGST7基因cDNA序列克隆,根据引物位置克隆大小为742 bp;B:连亚细胞定位载体后,根据载体引物位置PCR产物大小为1 416 bp;C:连接过表达载体后,根据载体引物位置PCR产物大小为870 bp A: Cloning of GmGST7 gene cDNA sequence, according to the location of the primer, cloning size is 742 bp; B: After connecting the subcellular localization vector, according to the location of the carrier primer, the size of the PCR product is 1 416 bp; C: After connecting the overexpressed vector, according to the location of the vector primer, the size of the PCR product was 870 bp |
为验证亚细胞定位载体转化农杆菌GV3101是否成功,选取培养皿上单菌落,扩摇至浑浊后用载体上的鉴定引物进行PCR菌液鉴定,琼脂糖凝胶电泳结果(图6B)显示具有预期大小的目的条带,DNA片段大小为1 416 bp,选择阳性克隆测序,将测序序列与GmGST7基因cDNA序列进行比对,全cDNA序列都存在,且序列一致。
为验证过表达载体转化农杆菌GV3101是否成功,选取培养皿上单菌落,扩摇至浑浊后用载体上的鉴定引物进行PCR菌液鉴定,琼脂糖凝胶电泳结果(图6C)显示鉴定到预期大小的目的条带,片段大小为870 bp,表明这些菌落为阳性克隆。随后,挑选阳性克隆进行目的片段测序验证,将测序序列与GmGST7基因cDNA序列进行比对,全cDNA序列都存在,且序列一致。
2.7 GmGST7蛋白亚细胞定位利用烟草研究GmGST7蛋白的细胞定位,将GmGST7-GFP和GFP载体转化烟草,荧光检测结果(图7)表明,转化GFP载体的细胞只有细胞核和细胞膜有荧光;在转化GmGST7-GFP载体的细胞中,在细胞核和细胞质都存在荧光信号,由于细胞中央大液泡的存在,细胞质的荧光信号被挤压至细胞膜周围,且不与叶绿体信号重叠。荧光检测结果表明,GmGST7基因的蛋白定位于细胞质和细胞核,与网站( http://www.csbio.sjtu.edu.cn/bioinf/ Cell-PLoc-2/)预测的结果一致。
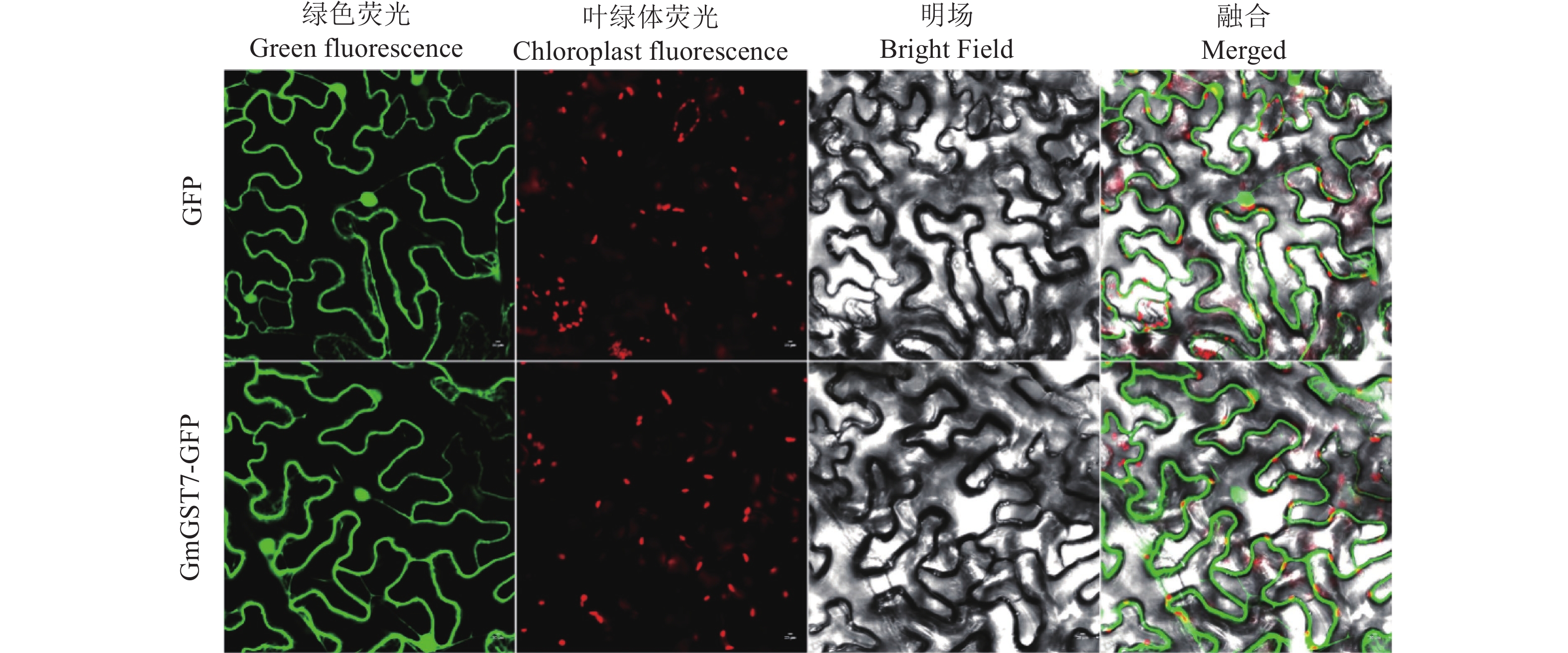
|
图 7 GmGST7蛋白亚细胞定位分析 Fig. 7 Subcellular localization analysis of GmGST7 protein |
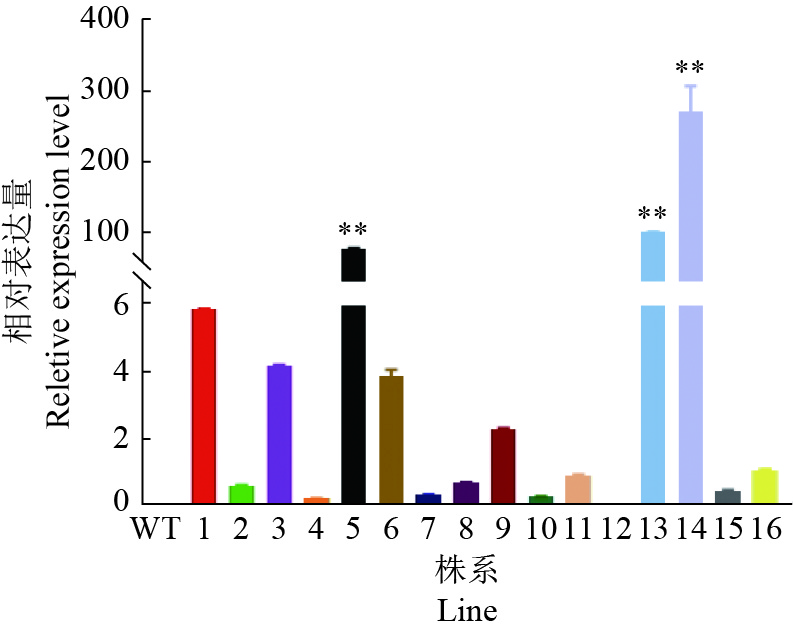
用除草剂喷施拟南芥,非转基因植株枯萎,GmGST7转基因阳性苗则正常生长(图8)。利用载体引物和GmGST7基因定量引物组成2对引物,双向鉴定,PCR产物经凝胶电泳检测后分别出现204和753 bp的目的条带(图9),通过该方法检测转基因阳性苗直至T3代。在T3代进一步通过定量PCR检测转基因阳性株系,获得表达量较高的3个株系(L5、L13、L14)(图10)。

|
图 8 GmGST7转基因拟南芥阳性苗除草剂喷洒鉴定 Fig. 8 Herbicide spraying identification of GmGST7 transgenic Arabidopsis positive seedlings 阳性苗正常生长,假阳性苗则枯萎 Positive seedlings grow normally, false positive seedlings wilt |
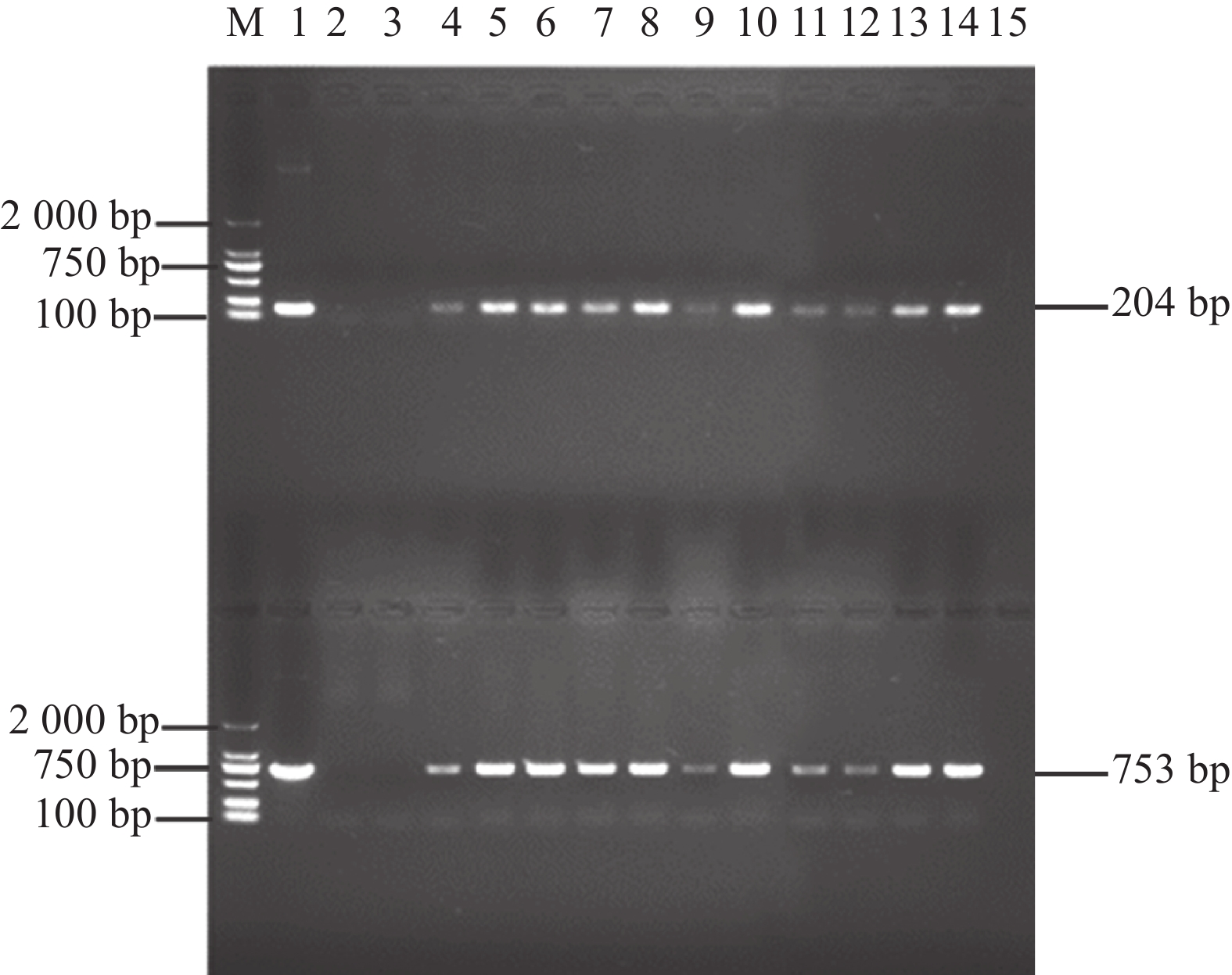
|
图 9 GmGST7转基因拟南芥阳性苗DNA鉴定 Fig. 9 DNA identification of GmGST7 transgenic Arabidopsis seedlings |
|
图 10 转基因拟南芥T3代株系中GmGST7基因表达量 Fig. 10 Expression of GmGST7 gene in T3 transgenic Arabidopsis thaliana “**”表示株系与WT在0.01水平差异显著(t检验) “**” indicates that the line differed from the WT at 0.01 level (t test) |
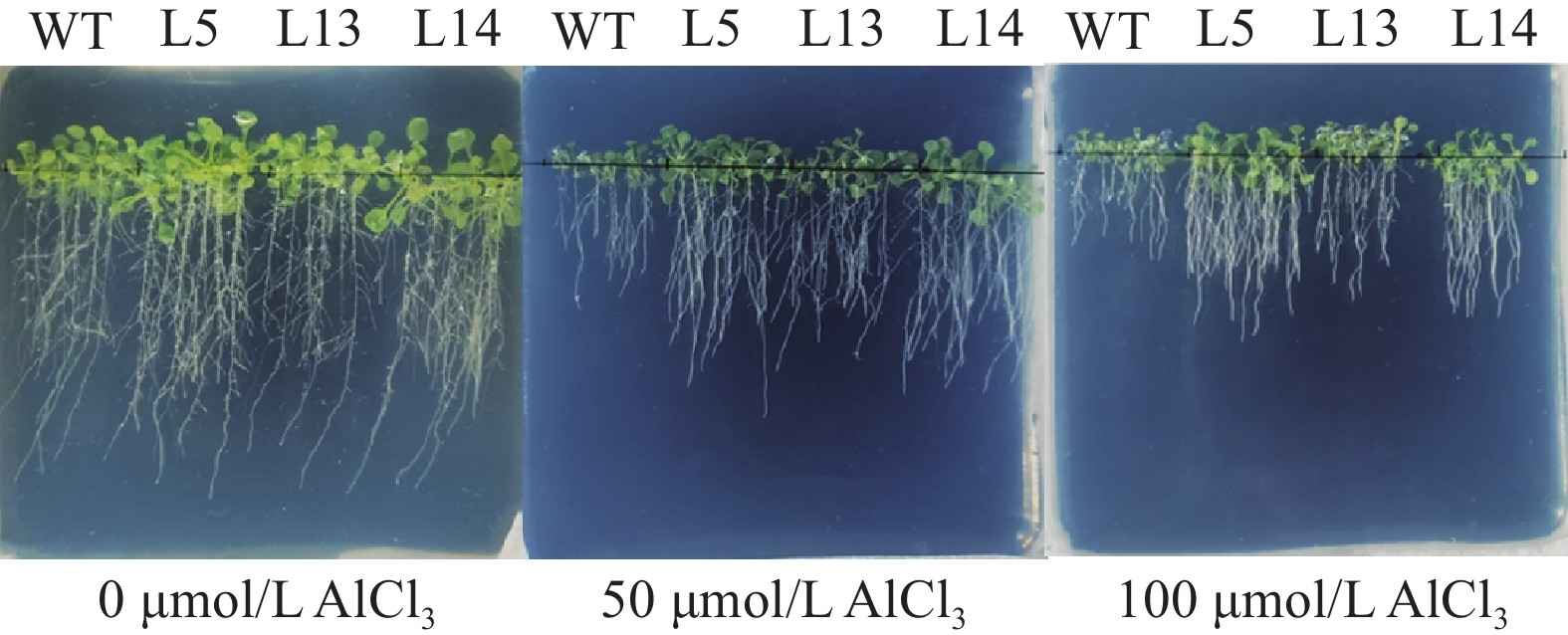
以WT为对照,选择L5、L13、L14 3个株系,设置3个AlCl3浓度梯度进行耐酸铝表型鉴定。结果(图11)表明,随着AlCl3浓度的增加,拟南芥根系伸长受到抑制,野生型受到的抑制更加明显。在50 µmol/L AlCl3浓度下,GmGST7转基因株系的相对根伸长高于60%,在100 µmol/L AlCl3浓度下,相对根伸长均高于50%,均与野生型差异极显著。
|
图 11 过表达GmGST7拟南芥耐酸铝表型 Fig. 11 Overexpressed GmGST7 Arabidopsis aluminium-resistant phenotype |
在1/2 MS培养基上,H2O2、MDA含量和POD活性在野生型和转基因拟南芥中无显著差异。在酸铝培养基上,H2O2和MDA含量在野生型和转基因拟南芥中均显著升高,其中,野生型H2O2含量增加幅度明显大于转基因株系,为对照处理的1.69倍;转基因株系L5、L13、L14 H2O2含量分别为对照处理的1.29、1.38、1.23倍。野生型MDA含量比对照处理增加了1.80倍,转基因株系比对照处理分别增加了1.30、1.23、1.21倍。在酸铝培养基上,野生型POD活性比对照处理增加了1.10倍,3个转基因株系比对照处理分别增加了1.22、1.19、1.37倍。因此,在过表达GmGST7后,转基因拟南芥体内的氧化损伤要弱于野生型,增强了对酸铝胁迫的耐受能力。
2.10 拟南芥耐酸铝分子调控分析利用酸铝胁迫响应的标志基因分析GmGST7转基因拟南芥耐酸铝的调控机制。在过表达GmGST7拟南芥中,酸铝条件下AtALMT、AtMATE、AtALS3表达量都有提高,分别为对照的1.36、1.33、1.34倍,AtWAK1表达量提高最多,是对照的2.5倍。因此,推测GmGST7可能通过清除植株内有毒物质、降低植物体内的氧化水平、促进各耐酸铝基因的表达,进而加强植株在逆境下的耐受能力。
2.11 GST下游基因的表达分析使用NCBI数据库,对GmGST7进行蛋白比对,在拟南芥中得到序列相似度最高的基因At2G29420。通过Phytozome数据库搜索At2G29420,得到该基因下游主要有2个家族,分别是谷氨酰胺水解酶(At1G78660、At1G78670、At1G78680)和氨基肽酶(At4G33090),这2个蛋白在GST催化谷胱甘肽和毒性物质结合后,参与下一步的分解工作。荧光定量分析结果表明,这4个基因受酸铝胁迫诱导上调,并受GmGST7激活表达。在酸铝胁迫下,At1G78660、At1G78670、At1G78680、At4G33090在转基因株系中的表达量为野生型的1.71、1.45、1.44、1.26倍。
3 讨论与结论GST是一个多功能的家族,是由硫氧化还原蛋白进化而来,目前已知的功能包括解毒、代谢、运输、隔离内源或者外源有毒成分等[29-30];对许多非生物胁迫产生应激反应,包括盐碱胁迫、低温高温胁迫、干旱胁迫[31-34],也对许多生物胁迫产生应激反应,如病原体攻击、重金属胁迫、过氧化物胁迫、紫外辐射等[35-38];参与催化或修饰各种酶促反应和小分子物质,包括谷胱甘肽(GSH)偶联、过氧化物酶、巯基转移酶、谷胱甘肽酰化和脱氢抗坏血酸还原酶等[39-42]。
GST tau类蛋白有2个结合域,N端序列高度保守,负责GSH的识别和结合。C端序列不保守,负责各种有毒物质或者植物体内一些信号的识别和结合[43-44];C端在同物种间高度保守,不同物种间的氨基酸序列差异明显,当面对胁迫环境时,C端会发生有利或有害突变,发生有利突变后,会增加其在基因组序列的高度重复,进而解释tau类GST在植物中的成簇出现和不同物种之间的差异[45-47]。在构建进化树时,大豆和拟南芥有许多相似的同源基因,由于C端序列差异较大,拟南芥和大豆遗传距离相隔较远,而在大豆中的同源基因遗传距离较近。
GmGST7基因翻译典型的GST家族tau类蛋白,有2个外显子分别是N端和C端。通过对GmGST7蛋白的氨基酸序列进行分析,发现N端含有Ser羟基,为GSH巯基的氢键供体,对GSH的催化激活起重要作用。C端能促进高活性硫酸阴离子的形成和稳定,为亲电底物亲核攻击提供目标,这些亲电底物是植物在逆境胁迫中产生的过氧化物、活性氧等一些有毒物质。所以GmGST7蛋白拥有GST家族tau类蛋白的典型功能,即能够促进氧化物与GSH的结合,进而降低植物的氧化水平,这与过表达拟南芥的表型一致。在50和100 µmol/L AlCl3处理下,GmGST7转基因株系比野生型的相对根伸长要高出50%。植株的氧化水平的测量结果也得出相同的结论,转基因株系的氧化水平要显著低于野生型,表现在H2O2和MDA含量增幅低于野生型,POD活性增幅低于野生型。当GmGST7基因过表达遗传转化拟南芥后,植株表现出酸铝胁迫,植株整体抗逆能力提高,相关下游基因表达量提高,氧化水平降低,进而减轻酸铝胁迫对植物生理功能的抑制。
许多研究都发现GST家族基因响应逆境胁迫,并有相关研究显示通过遗传转化的手段能提高植物对逆境的耐受能力。如通过遗传转化野生大豆中GsGST14提高栽培大豆的盐碱胁迫能力;向日葵中HaGSTU1对核盘菌的侵染响应[48];在大豆中过表达GmGST12降低雄性不育大豆小孢子中的活性氧,提高其存活率[49];玉米中ZmGST23对干旱、高温、低温盐碱胁迫的响应[50];ZmGST31在玉米中对除草剂的解毒作用[51]。
研究表明,GST家族基因在植物抵抗逆境胁迫时发挥了重要作用,大量关于GST家族基因对作物品种改良的研究都取得了成功,因此,对GmGST7的深入研究将有助于解析大豆对酸铝胁迫的响应机制,为大豆抗逆分子育种提供理论依据和基因资源。
综上所述,GmGST7基因位于大豆第7号染色体上,该基因含有2个外显子和1个内含子,2个外显子分别编码GST高度保守的N端和不保守的C端。GmGST7蛋白定位于细胞质和细胞核中;GmGST7基因受酸铝胁迫诱导表达上调且具有时空表达模式;GmGST7基因呈现组成型表达模式,在根中富集表达;GmGST7基因过表达拟南芥后,可降低酸铝胁迫后的氧化水平,酸铝胁迫响应相关基因表达增强,根伸长的抑制得到缓解,拟南芥对酸铝胁迫的耐受能力显著提高。
| [1] |
VON UEXKÜLL H R, MUTERT E. Global extent, development and economic impact of acid soils[J]. Plant and Soil, 1995, 171(1): 1-15. DOI:10.1007/BF00009558 (  0) 0) |
| [2] |
KINRAIDE T B, PARKER D R. Cation amelioration of aluminum toxicity in wheat[J]. Plant Physiology, 1987, 83(3): 546-551. DOI:10.1104/pp.83.3.546 (  0) 0) |
| [3] |
KINRAIDE T B. Assessing the rhizotoxicity of the aluminate ion, Al(OH)4−[J]. Plant Physiology, 1990, 93(4): 1620-1625. DOI:10.1104/pp.93.4.1620 (  0) 0) |
| [4] |
DELHAIZE E, RYAN P R, RANDALL P J. Aluminum tolerance in wheat (Triticum aestivum L.) II: Aluminum-stimulated excretion of malic acid from root apices)
[J]. Plant Physiology, 1993, 103(3): 695-702. DOI:10.1104/pp.103.3.695 (  0) 0) |
| [5] |
SIVAGURU M, BALUSKA F, VOLKMANN D, et al. Impacts of aluminum on the cytoskeleton of the maize root apex. short-term effects on the distal part of the transition zone[J]. Plant Physiology, 1999, 119(3): 1073-1082. DOI:10.1104/pp.119.3.1073 (  0) 0) |
| [6] |
KOLLMEIER M, FELLE H H, HORST W J. Genotypical differences in aluminum resistance of maize are expressed in the distal part of the transition zone. is reduced basipetal auxin flow involved in inhibition of root elongation by aluminum?[J]. Plant Physiology, 2000, 122(3): 945-956. DOI:10.1104/pp.122.3.945 (  0) 0) |
| [7] |
VAZQUEZ M D, POSCHENRIEDER C, et al. Change in apoplastic aluminum during the initial growth response to aluminum by roots of a tolerant maize variety[J]. Plant Physiology, 1999, 119(2): 435-444. DOI:10.1104/pp.119.2.435 (  0) 0) |
| [8] |
SILVA I R, SMYTH T J, MOXLEY D F, et al. Aluminum accumulation at nuclei of cells in the root tip. Fluorescence detection using lumogallion and confocal laser scanning microscopy[J]. Plant Physiology, 2000, 123(2): 543-552. DOI:10.1104/pp.123.2.543 (  0) 0) |
| [9] |
TAYLOR G J, MCDONALD-STEPHENS J L, HUNTER D B, et al. Direct measurement of aluminum uptake and distribution in single cells of Chara corallina[J]. Plant Physiology, 2000, 123(3): 987-996. DOI:10.1104/pp.123.3.987 (  0) 0) |
| [10] |
FRANTZIOS G, GALATIS B, APOSTOLAKOS P. Aluminium causes variable responses in actin filament cytoskeleton of the root tip cells of Triticum turgidum
[J]. Protoplasma, 2005, 225(3/4): 129-140. (  0) 0) |
| [11] |
ČIAMPOROVÁ M. Morphological and structural responses of plant roots to aluminium at organ, tissue, and cellular levels[J]. Biologia Plantarum, 2002, 45(2): 161-171. DOI:10.1023/A:1015159601881 (  0) 0) |
| [12] |
JONES D L, KOCHIAN L V. Aluminum inhibition of the inositol 1, 4, 5-trisphosphate signal transduction pathway in wheat roots: A role in aluminum toxicity?[J]. The Plant Cell, 1995: 1913-1922.
(  0) 0) |
| [13] |
BARCELÓ J, POSCHENRIEDER C. Fast root growth responses, root exudates, and internal detoxification as clues to the mechanisms of aluminium toxicity and resistance: A review[J]. Environmental and Experimental Botany, 2002, 48(1): 75-92. DOI:10.1016/S0098-8472(02)00013-8 (  0) 0) |
| [14] |
KOCHIAN L V, PIÑEROS M A, HOEKENGA O A. The physiology, genetics and molecular biology of plant aluminum resistance and toxicity[J]. Plant and Soil, 2005, 274(1/2): 175-195. DOI:10.1007/s11104-004-1158-7 (  0) 0) |
| [15] |
WANG H J. GsMYB7 encoding a R2R3-type MYB transcription factor enhances the tolerance to aluminum stress in soybean (Glycine max L.) [J]. BMC Genomics, 2022. 23(1): 529. doi: 10.1186/s12864-022-08744-w.
(  0) 0) |
| [16] |
SHEEHAN D, MEADE G, FOLEY V M, et al. Structure, function and evolution of glutathione transferases: Implications for classification of non-mammalian members of an ancient enzyme superfamily[J]. The Biochemical Journal, 2001, 360(Pt1): 1-16. (  0) 0) |
| [17] |
SAADAT M, MOHABATKAR H. Polymorphisms of glutathione S-transferases M1 and T1 do not account for inter individual differences for smoking behavior[J]. Pharmacology Biochemistry and Behavior, 2004, 77(4): 793-795. DOI:10.1016/j.pbb.2004.02.003 (  0) 0) |
| [18] |
SASAN M, BABAK S, HASSAN M. A new member of tau-class glutathione S-transferase from barley leaves
[J]. Excli Journal, 2009, 8: 190-194. (  0) 0) |
| [19] |
DROOG F, HOOYKAAS P, VAN DER ZAAL B J. 2, 4-dichlorophenoxyacetic acid and related chlorinated compounds inhibit two auxin-regulated type-III tobacco glutathione S-transferases
[J]. Plant Physiology, 1995, 107(4): 1139-1146. DOI:10.1104/pp.107.4.1139 (  0) 0) |
| [20] |
ÖZTETIK E. A tale of plant glutathione S-transferases: Since 1970
[J]. The Botanical Review, 2008, 74(3): 419-437. DOI:10.1007/s12229-008-9013-9 (  0) 0) |
| [21] |
LIGHT G G, MAHAN J R, ROXAS V P, et al. Transgenic cotton (Gossypium hirsutum L.) seedlings expressing a tobacco glutathione S-transferase fail to provide improved stress tolerance
[J]. Planta, 2005, 222(2): 346-354. DOI:10.1007/s00425-005-1531-7 (  0) 0) |
| [22] |
DIXON D P, CUMMINS I, COLE D J, et al. Glutathione-mediated detoxification systems in plants[J]. Current Opinion in Plant Biology, 1998, 1(3): 258-266. DOI:10.1016/S1369-5266(98)80114-3 (  0) 0) |
| [23] |
NUTRICATI E, MICELI A, BLANDO F, et al. Characterization of two Arabidopsis thaliana glutathione S-transferases
[J]. Plant Cell Reports, 2006, 25(9): 997-1005. DOI:10.1007/s00299-006-0146-1 (  0) 0) |
| [24] |
PANTELIDES I S, TJAMOS S E, PAPLOMATAS E J. Ethylene perception via ETR1 is required in Arabidopsis infection by Verticillium dahliae
[J]. Molecular Plant Pathology, 2010, 11(2): 191-202. DOI:10.1111/j.1364-3703.2009.00592.x (  0) 0) |
| [25] |
BELA K, HORVÁTH E, GALLÉ Á, et al. Plant glutathione peroxidases: Emerging role of the antioxidant enzymes in plant development and stress responses[J]. Journal of Plant Physiology, 2015, 176: 192-201. DOI:10.1016/j.jplph.2014.12.014 (  0) 0) |
| [26] |
BIELACH A, HRTYAN M, TOGNETTI V. Plants under stress: Involvement of auxin and cytokinin[J]. International Journal of Molecular Sciences, 2017, 18(7): 1427. DOI:10.3390/ijms18071427 (  0) 0) |
| [27] |
LIU J P, LUO X Y, SHAFF J, et al. A promoter-swap strategy between the AtALMT and AtMATE genes increased Arabidopsis aluminum resistance and improved carbon-use efficiency for aluminum resistance
[J]. The Plant Journal, 2012, 71(2): 327-337. DOI:10.1111/j.1365-313X.2012.04994.x (  0) 0) |
| [28] |
MANGEON A, PARDAL R, MENEZES-SALGUEIRO A D, et al. AtGRP3 is implicated in root size and aluminum response pathways in Arabidopsis
[J]. PLoS One, 2016, 11(3): e0150583. DOI:10.1371/journal.pone.0150583 (  0) 0) |
| [29] |
MINERVA B. Five decades with glutathione and the GSTome[J]. Journal of Biological Chemistry, 2012, 287(9): 6072-6083. DOI:10.1074/jbc.X112.342675 (  0) 0) |
| [30] |
LABROU N E, PAPAGEORGIOU A C, PAVLI O, et al. Plant GSTome: Structure and functional role in xenome network and plant stress response[J]. Current Opinion in Biotechnology, 2015, 32: 186-194. DOI:10.1016/j.copbio.2014.12.024 (  0) 0) |
| [31] |
JHA B, SHARMA A, MISHRA A. Expression of SbGSTU (tau class glutathione S-transferase) gene isolated from Salicornia brachiata in tobacco for salt tolerance
[J]. Molecular Biology Reports, 2011, 38(7): 4823-4832. DOI:10.1007/s11033-010-0625-x (  0) 0) |
| [32] |
TIWARI V, PATEL M K, CHATURVEDI A K, et al. Functional characterization of the tau class glutathione-S-transferases gene (SbGSTU) promoter of Salicornia brachiata under salinity and osmotic stress
[J]. PLoS One, 2016, 11(2): e0148494. DOI:10.1371/journal.pone.0148494 (  0) 0) |
| [33] |
XU J, ZHENG A Q, XING X J, et al. Transgenic Arabidopsis plants expressing grape glutathione S-transferase gene (VvGSTF13) show enhanced tolerance to abiotic stress
[J]. Biochemistry (Moscow), 2018, 83(6): 755-765. DOI:10.1134/S0006297918060135 (  0) 0) |
| [34] |
SRIVASTAVA D, VERMA G, CHAUHAN A S, et al. Rice (Oryza sativa L.) tau class glutathione S-transferase (OsGSTU30) overexpression in Arabidopsis thaliana modulates a regulatory network leading to heavy metal and drought stress tolerance
[J]. Metallomics, 2019, 11(2): 375-389. DOI:10.1039/C8MT00204E (  0) 0) |
| [35] |
KAMPRANIS S C, DAMIANOVA R, ATALLAH M, et al. A novel plant glutathione S-transferase/peroxidase suppresses bax lethality in yeast
[J]. Journal of Biological Chemistry, 2000, 275(38): 29207-29216. DOI:10.1074/jbc.M002359200 (  0) 0) |
| [36] |
LOYALL L, UCHIDA K, BRAUN S, et al. Glutathione and a UV light-induced glutathione S-transferase are involved in signaling to chalcone synthase in cell cultures
[J]. The Plant Cell, 2000, 12(10): 1939-1950. (  0) 0) |
| [37] |
MUELLER L A, GOODMAN C D, SILADY R A, et al. AN9, a petunia glutathione S-transferase required for anthocyanin sequestration, is a flavonoid-binding protein
[J]. Plant Physiology, 2000, 123(4): 1561-1570. DOI:10.1104/pp.123.4.1561 (  0) 0) |
| [38] |
WEISERBS K F, JACOBSON J S, BEGG M D, et al. A cross-sectional study of polycyclic aromatic hydrocarbon-DNA adducts and polymorphism of glutathione S-transferases among heavy smokers by race/ethnicity
[J]. Biomarkers, 2003, 8(2): 142-155. DOI:10.1080/1354750031000086269 (  0) 0) |
| [39] |
GARCERÁ A, BARRETO L, PIEDRAFITA L, et al. Saccharomyces cerevisiae cells have three Omega class glutathione S-transferases acting as 1-cys thiol transferases
[J]. The Biochemical Journal, 2006, 398(2): 187-196. DOI:10.1042/BJ20060034 (  0) 0) |
| [40] |
FEDERICI L, MASULLI M, GIANNI S, et al. A conserved hydrogen-bond network stabilizes the structure of Beta class glutathione S-transferases
[J]. Biochemical and Biophysical Research Communications, 2009, 382(3): 525-529. DOI:10.1016/j.bbrc.2009.03.052 (  0) 0) |
| [41] |
LALLEMENT P A, RORET T, TSAN P, et al. Insights into ascorbate regeneration in plants: Investigating the redox and structural properties of dehydroascorbate reductases from Populus trichocarpa
[J]. Biochemical Journal, 2016, 473(6): 717-731. DOI:10.1042/BJ20151147 (  0) 0) |
| [42] |
GONZALEZ D, FRAICHARD S, GRASSEIN P, et al. Characterization of a Drosophila glutathione transferase involved in isothiocyanate detoxification
[J]. Insect Biochemistry and Molecular Biology, 2018, 95: 33-43. DOI:10.1016/j.ibmb.2018.03.004 (  0) 0) |
| [43] |
TAJC S G, TOLBERT B S, BASAVAPPA R, et al. Direct determination of thiol pKa by isothermal titration microcalorimetry
[J]. Journal of the American Chemical Society, 2004, 126(34): 10508-10509. DOI:10.1021/ja047929u (  0) 0) |
| [44] |
ATKINSON H J, BABBITT P C. Glutathione transferases are structural and functional outliers in the thioredoxin fold[J]. Biochemistry, 2009, 48(46): 11108-11116. DOI:10.1021/bi901180v (  0) 0) |
| [45] |
OHNO S. Patterns in genome evolution[J]. Current Opinion in Genetics & Development, 1993, 3(6): 911-914. (  0) 0) |
| [46] |
FORCE A, LYNCH M, PICKETT F B, et al. Preservation of duplicate genes by complementary, degenerative mutations[J]. Genetics, 1999, 151(4): 1531-1545. DOI:10.1093/genetics/151.4.1531 (  0) 0) |
| [47] |
TANAKA K M, TAKAHASI K R, TAKANO-SHIMIZU T. Enhanced fixation and preservation of a newly arisen duplicate gene by masking deleterious loss-of-function mutations[J]. Genetics Research, 2009, 91(4): 267-280. DOI:10.1017/S0016672309000196 (  0) 0) |
| [48] |
马立功, 孟庆林, 张匀华, 等. 向日葵谷胱甘肽-S-转移酶基因的克隆及抗病功能研究[J]. 中国油料作物学报, 2015, 37(5): 635-643. DOI:10.7505/j.issn.1007-9084.2015.05.007 (  0) 0) |
| [49] |
韩少怀, 李佳佳, 张璟曜, 等. 大豆GmGST12基因的克隆及表达分析[J]. 大豆科学, 2015, 34(5): 782-788. DOI:10.11861/j.issn.1000-9841.2015.05.0782 (  0) 0) |
| [50] |
李永生, 方永丰, 李玥, 等. 玉米逆境响应基因ZmGST23克隆和表达分析[J]. 农业生物技术学报, 2016, 24(5): 667-677. (  0) 0) |
| [51] |
孙兰兰, 麻荣慧, 薛飞, 等. 玉米GST31基因的克隆与表达分析[J]. 作物学报, 2023, 49(10): 2717-2726. (  0) 0) |
 2023, Vol. 44
2023, Vol. 44


