生物炭是生物质在有限供氧的密闭环境中经高温热裂解产生的一类富含碳素(碳质量分数≥60%)的性质稳定、难溶以及具有一定程度高度芳香化的固体物质,主要成分是烷基和芳香结构碳。在土壤中加入生物炭,能够均衡土壤有机碳库[1]、提升肥料养分在作物中的利用率[2]以及提高作物产量[3]等。土壤微生物是土壤生态环境的重要组成部分,土壤微生物群落对土壤环境条件的变化十分敏感[4],同时,土壤微生物也是土壤养分转化和有机质分解的关键因子,常被用于评价土壤质量的生物学特性[5]。已有研究表明,生物炭可提供大量碳源以利于微生物活动并成为微生物栖息地,为微生物提供了丰富的食物来源,促进微生物繁殖,进而活化土壤肥力[6-7]。还有研究表明,生物炭能够影响微生物多样性及群落结构、改变土壤微生物利用碳源种类,张秀等[8]研究表明,施用生物炭能提高土壤中微生物群落碳源代谢活性及功能多样性。前人研究结果表明,生物炭可影响土壤细菌群落,但不同水稻品种施用生物炭对其土壤细菌群落组成及结构的影响差异性不甚明了。本研究选取广东省江门县台山镇潮土型双季稻田土壤,种植6个品种的常规优质稻水稻,在收割前进行土壤微生物取样,通过Ion S5TMXL高通量测序技术,对16S rRNA基因V3-V4进行测序和分析,比较研究不同水稻品种施用生物炭对其土壤细菌群落组成及结构的影响差异性,以期为生物炭改善不同品种稻田土壤细菌群落环境提供理论依据。
1 材料与方法 1.1 试验点与试验材料试验在广东省江门市台山市下川岛试验田进行,下川岛地处北回归线南侧,N21°39′10.49″,E112°36′46.75″,属亚热带海洋性季风气候,年平均气温23℃,年均降雨量2279.5 mm,年均日照1672.5 h,气候温和,四季如春。潮土种植6种水稻品种,分别为黄华占(Hua)、五常香稻(Wu)、象牙香占(Ya)、湘晚籼17(X)、农香32(N)、玉针香(Yu),供试生物炭是稻壳生物炭。
1.2 试验设计试验采用裂区设计。试验以生物炭处理为主区,以水稻品种为副区。其中,主区面积120 m2,副区面积20 m2,重复3次。潮土中生物炭施用量设3个处理,分别为0(对照)、3.5和 7.0 t/hm2,依次记作CK、Tr1和Tr2。在田间水稻移栽前,一次性通过人工翻耕将不同处理的生物炭施入土壤。施入前,各小区田埂均采用耐用的黑色塑料薄膜进行覆盖包裹,以防止不同处理之间发生窜肥窜水的情况,对试验地水稻按照当地常规管理制度进行日常管理。
1.3 样品采集及分析方法收割前利用取土钻采集水稻土壤0~15 cm土层土壤样品,五点土样法取样后迅速混匀,装在聚乙烯自封袋中,放入冰盒带回实验室,委托诺禾致源生物科技有限公司进行土壤DNA的提取、文库构建以及高通量测序。
1.4 基因组DNA的提取和PCR扩增及高通量测序对样本的基因组DNA进行提取,检测DNA的纯度和浓度,使用无菌水稀释样本DNA至1 ng·μL−1。以稀释后的基因组DNA为模板,选择16S rRNA基因V3-V4区引物鉴定细菌多样性。PCR产物进行电泳,检测纯化PCR产物,剪切回收目标条带。使用Ion Plus Fragment Library Kit 48 rxns建库试剂盒进行文库的构建,经Qubit定量和文库检测合格后,使用Ion S5TMXL进行上机测序。
1.5 数据分析根据Ion S5TMXL下机数据,先对Reads进行剪切、拆分,与注释数据库进行比较,去除其中的嵌合体序列得到最终的有效数据。全部Clean reads默认以97%的一致性聚类成为OTUs,选取出现频数最高的OTUs作为代表序列,与SILVA132的SSUrRNA数据库进行物种注释分析,序列进行均一化处理。使用Qiime软件(V1.9.1)计算Chao1、Shannon、Simpson和ACE指数,使用R软件(V2.15.3)绘制稀释曲线并进行Alpha多样性指数组间差异分析、Beta多样性指数组间差异分析,绘制NMDS图。数据采用SPSS(21.0)软件进行分析。
2 结果与分析 2.1 测序序列的质量控制通过对42个土壤样品细菌V3-V4区高通量测序,根据优化标准对所测序列去杂后,结果显示共获得3336672条Clean reads,平均读长大于414 bp,相似度为0.97的条件下,对土壤中细菌的覆盖率为97.9%~98.5%,由图1可知,所有样本OTU数量稀释曲线都急剧上升后趋向平坦,表示各样本高通量测序数据量渐近合理,能够较准确地反映土壤微生物的丰富度和多样性。
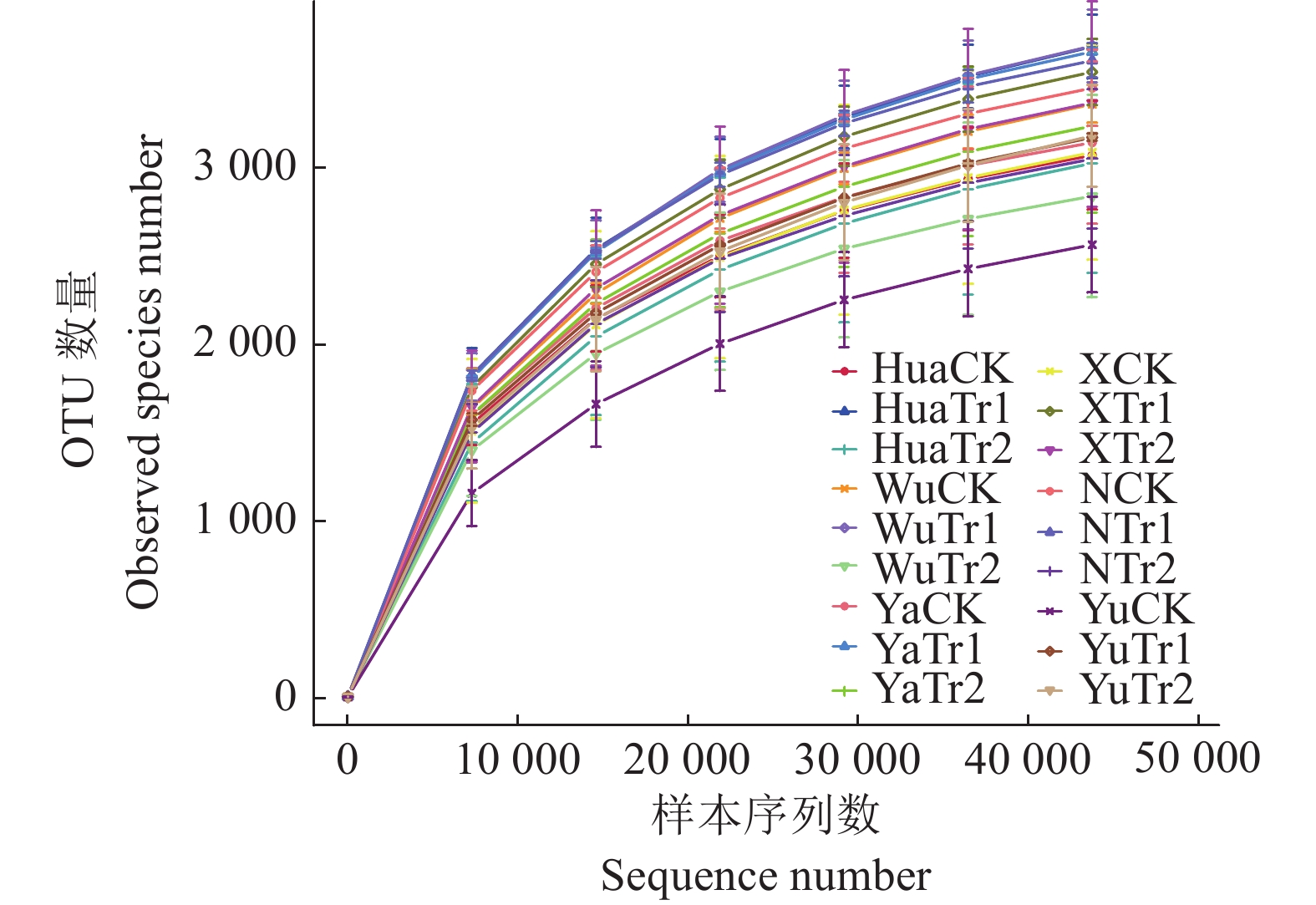
|
图 1 土壤样本稀释曲线 Fig. 1 Soil sample rarefaction curve |
选用Shannon指数、Simpson指数比较菌群中优势种种类的丰富程度,反映细菌群落多样性,选用Chao1指数和ACE指数反映细菌群落的数量丰富度。由表1可知,Shannon指数的范围是6.708~9.706,Simpson指数的范围是0.919~0.995,Chao1指数的范围是3024.949~4746.209,ACE指数的范围是3169.582~4339.961。Tr1、Tr2处理均显著提高了品种Yu的细菌群落多样性(P<0.05),但Tr1、Tr2之间差异不显著。Tr2处理显著提高水稻品种Yu的细菌群落丰富度(P<0.05)。Tr1处理显著提高了水稻品种Hua的细菌群落丰富度(P<0.05)。水稻品种Yu在CK处理时细菌群落多样性显著低于其他品种(P<0.05),但Tr2处理时水稻品种Yu的细菌群落丰富度显著高于品种Hua、Wu和N(P<0.05)。
|
|
表 1 基于OTU的土壤细菌群落多样性指数1) Table 1 Diversity index of soil bacterial community based on OTU |
本研究采用97%相似水平为标准界定OTU,对OTU代表序列进行聚类和物种注释,共检测出细菌73门、92纲、174目、298科、682属和456种,细菌群落具有较高的多样性。由图2门水平的细菌相对丰度柱状图可知,在门水平上占优势水平的为变形菌门Proteobacteria、厚壁菌门Firmicutes、拟杆菌门Bacteroidetes、硝化螺旋菌门Nitrospirae、蓝藻细菌门Cyanobacteria、酸杆菌门Acidobacteria、绿弯菌门Chloroflexi、泉古菌门Crenarchaeota、放线菌门Actinobacteria和广古菌门Euryarchaeota。细菌群落第1优势类群为变形菌门,其相对丰度为30.0%~61.1%,主要包括3个亚类:γ–变形菌(Gamma-proteobacteria)、δ–变形菌(Delta-proteobacteria)和α–变形菌(Alpha-proteobacteria),其所占的比例范围分别为9.1%~52.5%、5.7%~17.9%和2.9%~8.6%,其中,以γ–变形菌和δ–变形菌为优势菌纲。细菌群落第2大优势类群为厚壁菌门,其相对丰度为13.4%~30.6%;且绝大部分为芽孢杆菌纲Bacilli。细菌群落第3大优势类群为拟杆菌门,其相对丰度为3.3%~11.1%,其主要有拟杆菌纲Bacteroidia和懒杆菌纲Ignavibacteria。
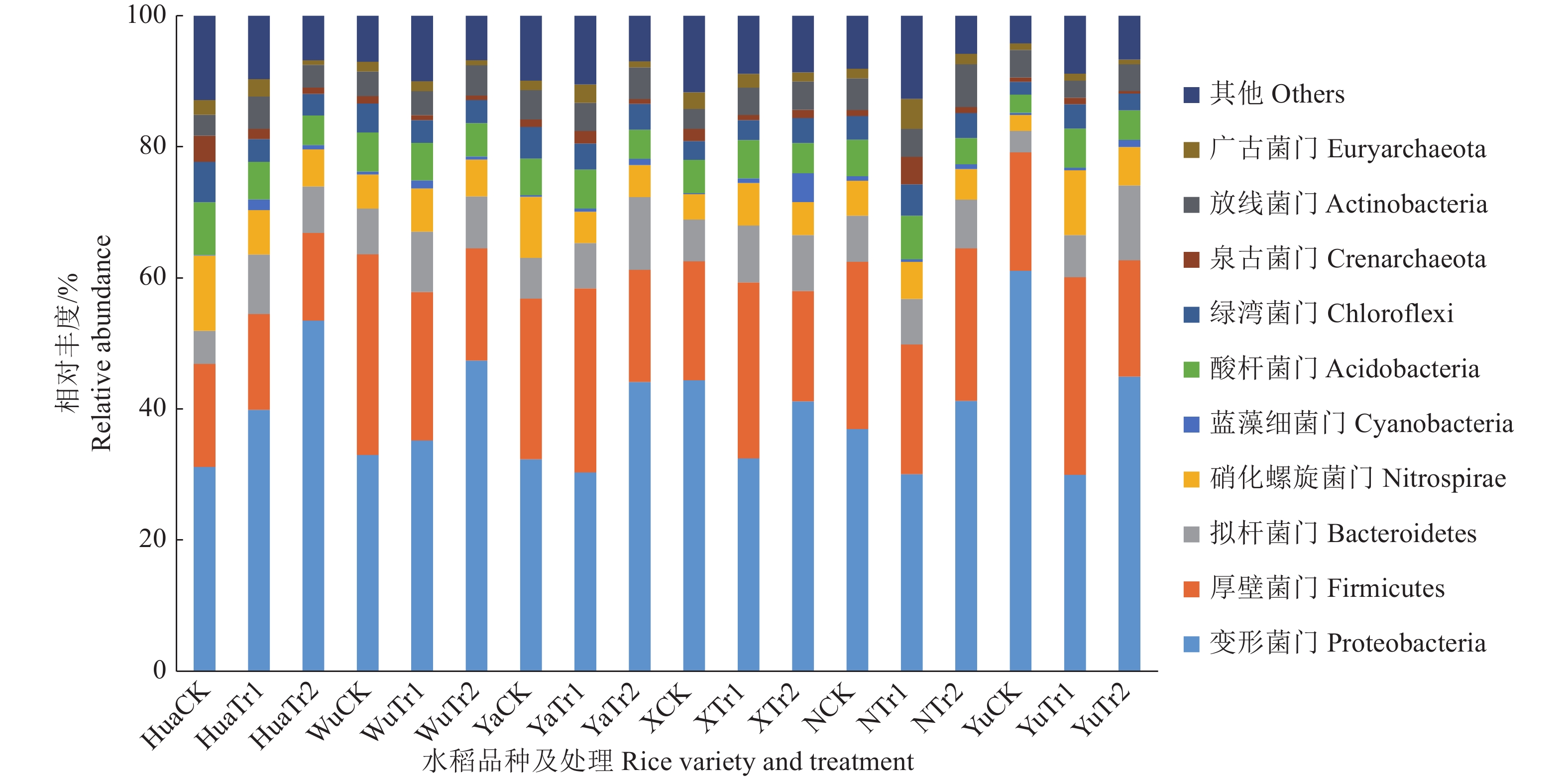
|
图 2 生物炭不同施加量处理在门水平上对土壤细菌相对丰度的影响 Fig. 2 Effects of different biochar application amounts on the relative abundance of soil bacteria at phylum level |
细菌群落组成中优势菌门类型在生物炭不同施加量处理后无较大区别,但生物炭不同施加量处理间的细菌相对丰度有所区别。各水稻品种Tr2处理相较Tr1处理均使变形菌门的相对丰度上升,其中以品种Hua变化最为明显,品种Hua的变形菌门相对丰度Tr2处理为53.5%,显著高于CK处理(相对丰度为31.2%,P<0.05)。Tr1处理降低了品种X、N、Yu的相对丰度,其中品种Yu的变形菌门相对丰度Tr1处理(30.0%)显著低于CK处理(61.1%,P<0.05)。品种Yu的拟杆菌门相对丰度随着生物炭的施加而逐渐上升,Tr2处理的相对丰度(11.4%)较CK(3.3%)明显上升(P<0.05)。品种Hua的酸杆菌门相对丰度Tr2处理(4.5%)较CK(8.0%)明显下降(P<0.05)。广古菌门的相对丰度则随着生物炭的施加,Tr1处理较CK明显上升,Tr2处理较CK明显下降(P<0.05)。厚壁菌门、硝化螺旋菌门在部分品种中同样存在相似趋势,但未表现出显著性差异。水稻土壤在CK处理的各菌门相对丰度存在品种间的显著性差异,其中,品种Yu的变形菌门相对丰度在CK处理时显著高于除品种X外的其他品种(P<0.05),以γ−变形菌相对丰度52.5%相较其他品种存在极显著差异(P<0.01);品种Hua的硝化螺旋菌门相对丰度在CK处理时显著高于除品种Ya外的其他品种(P<0.05),品种Ya的硝化螺旋菌门相对丰度在CK处理时也显著高于品种Yu(P<0.05)。不同生物炭施加量对不同菌种门的相对丰度影响不尽一致;不同品种的水稻对土壤细菌群落相对丰度存在影响。
相对丰度较高的前20属细菌中,根据各细菌类群的平均相对丰度排名,将未能在97%相似度上分类的归类为Unidentified。由图3可见,马赛菌属Massilia相对丰度为1.2%~41.4%、芽孢杆菌属Bacillus相对丰度为9.4%~24.1%,均为优势菌属,除此之外,其他各细菌类群的平均相对丰度均小于2.0%,主要有不动杆菌属Acinetobacter、寡养单胞菌属Stenotrophomonas、未鉴定的蓝细菌(Unidentified Cyanobacteria)、未鉴定的梭状芽孢杆菌(UnidentifiedClostridiales)、膨胀芽胞杆菌属Tumebacillus等。食酸菌属Acidovorax、鞘氨醇单胞菌属Sphingomonas、土地杆菌属Pedobacter等菌属的相对丰度均在Tr2处理时较CK组显著上升(P<0.05),相对丰度较小或极小的菌属易在生物炭处理后出现显著性差异。马赛菌属在水稻品种Yu的CK处理相对丰度为41.4%,极显著高于其他水稻品种(P<0.01);不动杆菌属在水稻品种Hua的Tr2处理相对丰度为14.1%,显著高于其他水稻品种及处理(P<0.05)。可见,生物炭处理引起了对应土壤细菌群落结构组成在属水平上的变化,相对丰度较低或极低的土壤细菌类群更敏感,更容易受到生物炭的影响。
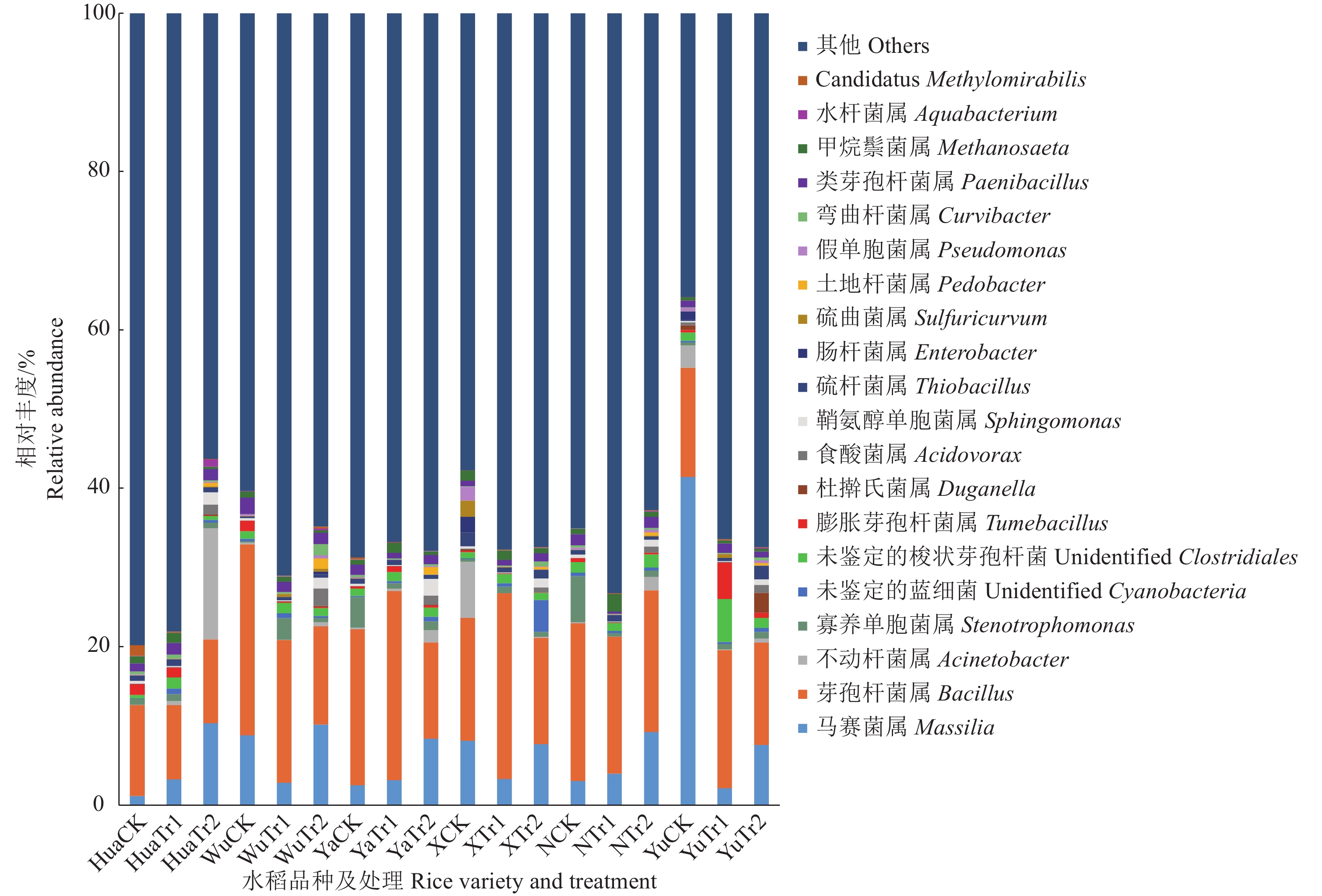
|
图 3 生物炭不同施加量处理在属水平上对土壤细菌相对丰度的影响 Fig. 3 Effect of different biochar application amounts on the relative abundance of soil bacteria at the genus level |
如图4所示,对各土壤样本序列进行非度量多维尺度(Non-metric multi-dimensional scaling, NMDS)分析,各水稻品种均显示出Tr1处理组内差异最小,CK则相对组内差异较大,Tr2处理则相对组内差异最大。尽管生物炭不同施加量处理下各样本的组内差异略大,但CK组较生物炭Tr1处理在空间位置上有明显分离,而Tr2处理的土壤样本与CK组土壤样本的空间距离较近,说明各水稻品种均表现出在Tr1处理下相较CK组土壤细菌群落组成有差别。
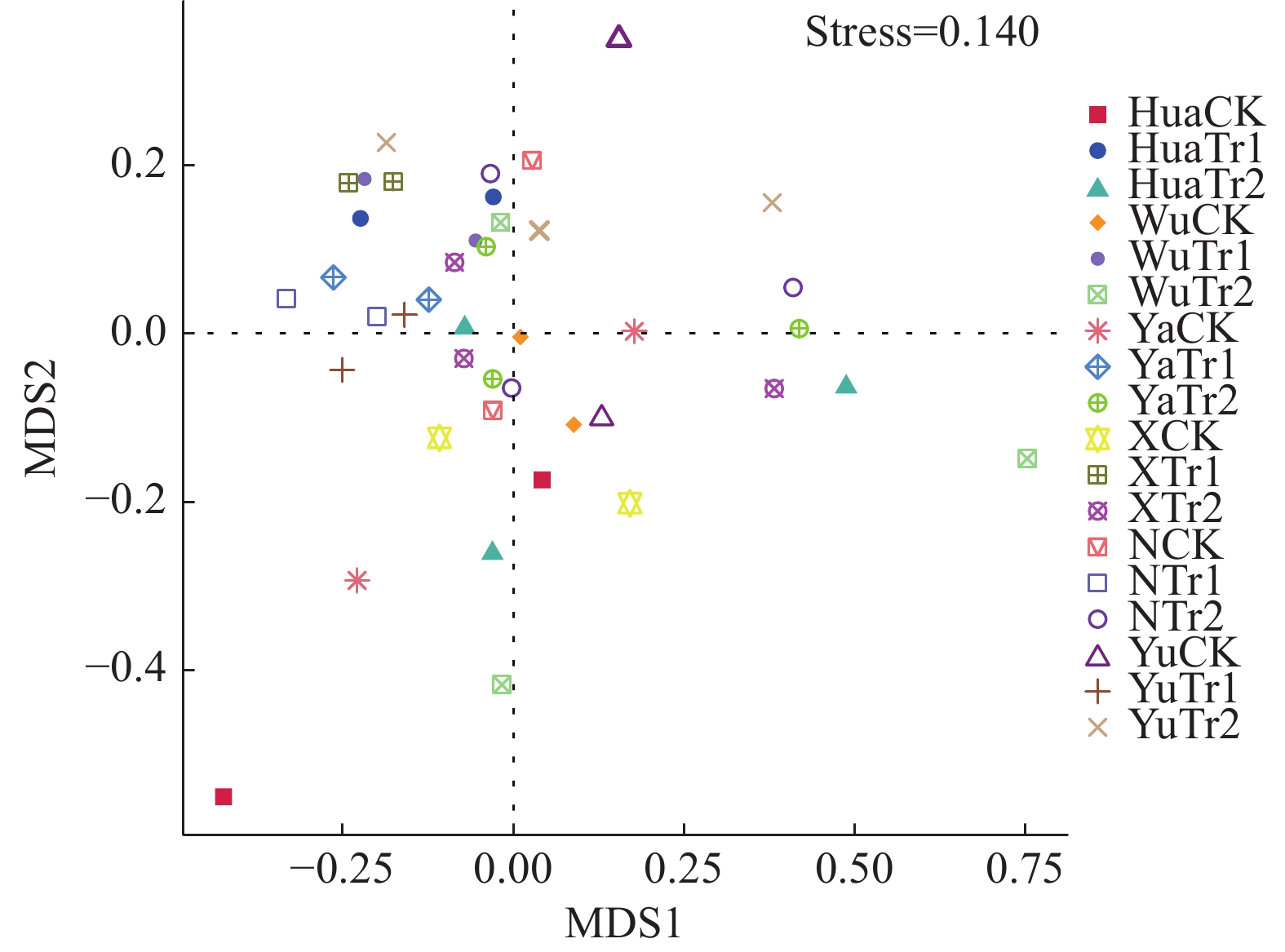
|
图 4 土壤细菌群落结构的非度量多维尺度(NMDS)分析 Fig. 4 Non-metric multi-dimensional scaling (NMDS) analysis of soil bacterial community structure |
对门水平上的物种相对丰度进行聚类分析,聚类结果(图5)显示,各处理在门水平上的细菌主要分为3个分支,主要以Tr1分类聚类在一起,CK与Tr2处理聚类在一起,说明施用生物炭Tr2处理与CK组的菌群丰度相似性较Tr1处理更高,Tr1处理对土壤细菌群落的分布存在影响。

|
图 5 门水平上的土壤细菌相对丰度聚类分析 Fig. 5 Cluster analysis of relative abundance of soil bacteria at phylum level |
研究表明,土壤微生物与其所处的环境密切相关,改变环境因素会引起微生物群落结构及其组成的变化[9];土壤细菌多样性指数大,说明供微生物生长的营养物质较丰富[10]。本研究表明,Tr1、Tr2处理均显著提高了水稻品种Yu的土壤细菌群落多样性,同时Tr2处理还显著提高了水稻品种Yu的细菌群落丰富度;生物炭Tr1处理显著提高了水稻品种Hua的细菌群落丰富度;相较于CK处理,生物炭Tr1处理对土壤群落结构也存在影响,这与Muhammad等[11]、Doan等[12]研究生物炭在适宜施加范围内能够改善微生物丰富度、群落多样性[9,13]及群落结构的结果一致。生物炭施加的促进作用主要在于生物炭为细菌生长补充了丰富的碳源,土壤中溶解性有机碳是土壤微生物群落的能量和微生物细胞组成成分的主要来源以及土壤微生物新陈代谢的主要产物,适量的外部碳源能激发细菌的生长繁育[14]。生物炭Tr1处理较CK组显著提高了水稻品种Hua的土壤细菌群落丰富度,但Tr2处理较CK无显著性差异,这一结果与Dempster等[15]、常栋等[16]研究结果相似,可能是因为微生物对有机质正当分解的碳氮质量比为25∶1,所以当生物炭施加后,需要消耗土壤中有效态氮素,但因土壤中的有效态氮素含量有限,因此当生物炭施加过量时,土壤中碳氮比增大,反而导致微生物的分解作用变慢,抑制了土壤细菌群落多样性以及物种丰富度[17]。
3.2 生物炭对土壤细菌群落组成的影响本研究中发现,不同生物炭处理并没有改变主要优势菌群门的种类,但优势类群的相对丰度存在显著差异,各处理均以变形菌门为最优势菌门,其中以γ−、δ−、α−变形菌纲为优势亚群,具有丰富的代谢多样性,Lesaulnier等[18]的研究还发现土壤中变形菌门大多为革兰阴性菌,其中许多细菌负责固氮,可增加土壤中的氮素营养,参与N、P、C等元素循环[19-20],促进植物的生长[21-22],这与周佳等[23]、毛立晖[24]研究得到的稻田土壤细菌优势菌群相似。本研究结果发现,生物炭在Tr2处理的土壤中变形菌门相对丰度明显上升,其中以水稻品种Hua的变化最为显著,表明生物炭的施加促进了土壤细菌群落的固氮功能。拟杆菌门具有降解糖类及一种分布广泛的难降解的有毒有机物多环芳烃的能力[25],试验结果表明,水稻品种Yu的拟杆菌门相对丰度随着生物炭的添加而上升,表示提升了糖类降解的能力。生物炭施加使得变形菌门及拟杆菌门相对丰度的变化结果与冯慧琳等[26]、朱孟涛等[27]在生物炭施加对土壤细菌群落的影响研究中所得结果一致。在属分类水平,隶属于变形菌门的马赛菌属以及隶属于厚壁菌门的芽孢杆菌属是优势属,优势属的相对丰度无显著性差异;但生物炭Tr2处理显著提升了食酸菌属、鞘氨醇单胞菌属、土地杆菌属等菌属的相对丰度,这些菌主要隶属于变形菌门或拟杆菌门,因此生物炭施加能够促进固氮的功能,而引发变化的主要原因可能在于生物炭的结构特性是多孔并且具有巨大比表面积,炭表面的功能基团具有专性吸附作用,能够在土壤中有效吸附包括溶解性有机碳在内的易矿化有机碳和NH4+[11],所以当生物炭被施入稻田后,稻田土壤理化性质及养分含量发生了改变,土壤中相对丰度较低的细菌菌属比优势菌属对土壤环境因子的微小变化更敏感,因此也更容易发生改变[28]。虽然马赛菌属、芽孢杆菌属等细菌的相对丰度在生物炭施加处理后也出现了波动,但因其相对丰度较高,微小的外在环境变化并未改变其在群落结构组成中的优势地位。
3.3 结论生物炭Tr1、Tr2处理显著提高了水稻品种Yu的土壤细菌群落多样性,Tr2处理显著提高了水稻品种Yu的细菌群落丰富度,生物炭Tr1处理显著提高了水稻品种Hua的细菌群落丰富度。细菌群落组成中占优势的菌门类型在生物炭不同施加量处理间无较大区别,但处理间细菌相对丰度上有所区别,某些水稻品种的生物炭Tr1或Tr2处理主要提高了变形菌门、拟杆菌门以及广古菌门的相对丰度,这些细菌在提高土壤养分方面具有一定作用。生物炭处理引起了对应土壤细菌群落结构组成在属水平上的变化,相对丰度较低或极低的土壤细菌类群更敏感,更容易受到生物炭的影响。与CK组相比,生物炭Tr1处理对土壤细菌群落组成及分布存在影响。水稻品种Hua和Yu的土壤细菌群落受生物炭施加影响变化较大。生物炭处理的差异主要体现在土壤细菌群落相对丰度上。
| [1] |
VAN ZWIETEN L, KIMBER S, MORRIS S, et al. Efects of bio-char from slow pyrolysis of papermill waste on agronomic performance and soil fertility[J]. Plant Soil, 2010, 327: 235-246. DOI:10.1007/s11104-009-0050-x (  0) 0) |
| [2] |
王丽渊, 丁松爽, 刘国顺. 生物质炭土壤改良效应研究进展[J]. 中国土壤与肥料, 2014(3): 1-6. (  0) 0) |
| [3] |
荣飞龙, 蔡正午, 覃莎莎, 等. 酸性稻田添加生物炭对水稻生长发育及产量的影响: 基于5年大田试验[J]. 生态学报, 2020, 40(13): 4413-4424. (  0) 0) |
| [4] |
KENNEDY A C, SMITH K L. Soil microbial diversity and the sustainability of agricultural soils[J]. Plant and Soil, 1995, 170(1): 75-86. DOI:10.1007/BF02183056 (  0) 0) |
| [5] |
南丽丽, 谭杰辉, 郭全恩. 黄土高原半干旱区轮作休耕模式对土壤真菌的影响[J]. 生态学报, 2020, 40(23): 8582-8592. (  0) 0) |
| [6] |
PURAKAYASTHA T J, DAS K C, GASKIN J, et al. Effect of pyrolysis temperatures on stability and priming effects of C3 and C4 biochars applied to two different soils
[J]. Soil and Tillage Research, 2016, 155(4): 107-115. (  0) 0) |
| [7] |
AMELOOT N, GRABER E R, VERHEIJEN F G A, et al. Interactions between biochar stability and soil organisms: Review and research needs[J]. European Journal of Soil Science, 2013, 64(4): 379-390. DOI:10.1111/ejss.12064 (  0) 0) |
| [8] |
张秀, 夏运生, 尚艺婕, 等. 生物质炭对镉污染土壤微生物多样性的影响[J]. 中国环境科学, 2017, 37(1): 252-262. DOI:10.3969/j.issn.1000-6923.2017.01.032 (  0) 0) |
| [9] |
SHANG J Y, ZHOU S Y, WANG Z H, et al. Effects of rainfall on the total number of bacteria and the composition of culturable bacteria in Qinhuangdao West Beach[J]. Microbiology China, 2016, 43(6): 1227-1234. (  0) 0) |
| [10] |
雷旭, 李冰, 李晓, 等. 复合垂直流人工湿地系统中不同植物根际微生物群落结构[J]. 生态学杂志, 2015, 34(5): 1373-1381. (  0) 0) |
| [11] |
MUHAMMAD N, DAI Z M, XIAO K C, et al. Changes in microbial community structure due to biochars generated from different feedstocks and their relationships with soil chemical properties[J]. Geoderma, 2014, 226/227: 270-278. DOI:10.1016/j.geoderma.2014.01.023 (  0) 0) |
| [12] |
DOAN T T, BOUVIER C, BETTAREL Y, et al. Influence of buffalo manure, compost, vermicompost and biochar amendments on bacterial and viral communities in soil and adjacent aquatic systems[J]. Applied Soil Ecology, 2014, 73: 78-86. DOI:10.1016/j.apsoil.2013.08.016 (  0) 0) |
| [13] |
STEINER C, TEIXEIRA W G, LEHMANN J, et al. Long term effects of manure, charcoal and mineral fertilization on crop production and fertility on a highly weathered central Amazonian upland soil[J]. Plant and Soil, 2007, 291: 275-290. DOI:10.1007/s11104-007-9193-9 (  0) 0) |
| [14] |
朱金山, 张慧, 马连杰, 等. 不同沼灌年限稻田土壤微生物群落分析[J]. 环境科学, 2018, 39(5): 2400-2411. (  0) 0) |
| [15] |
DEMPSTER D N, GLEESON D B, SOLAIMAN Z M, et al. Decreased soil microbial biomass and nitrogen mineralisation with Eucalyptus biochar addition to a coarse textured soil
[J]. Plant and Soil, 2012, 354: 311-324. DOI:10.1007/s11104-011-1067-5 (  0) 0) |
| [16] |
常栋, 马文辉, 张凯, 等. 生物炭基肥对植烟土壤微生物功能多样性的影响[J]. 中国烟草学报, 2018, 24(6): 58-66. (  0) 0) |
| [17] |
周凤, 耿增超, 许晨阳, 等. 生物炭用量对(土娄)土微生物量及碳源代谢活性的影响[J]. 植物营养与肥料学报, 2019, 25(8): 1277-1289. DOI:10.11674/zwyf.18276 (  0) 0) |
| [18] |
LESAULNIER C, PAPAMICHAIL D, MCCORKLE O S, et al. Elevated atmospheric CO2 affects soil microbial diversity associated with trembling aspen
[J]. Environmental Microbiology, 2008, 10(4): 926-941. DOI:10.1111/j.1462-2920.2007.01512.x (  0) 0) |
| [19] |
HOEFEL D, MONIS P T, GROOBY W L, et al. Profiling bacterial survival through a water treatment process and subsequent distribution system[J]. Journal of Applied Microbiology, 2005, 99(1): 175-186. DOI:10.1111/j.1365-2672.2005.02573.x (  0) 0) |
| [20] |
ANSOLA G, ARROYO P, SÁENZ DE MIERA L E, et al. Characterisation of the soil bacterial community structure and composition of natural and constructed wetlands[J]. Science of the Total Environment, 2014, 473/474(1): 63-71. (  0) 0) |
| [21] |
CHAUDHRY V, REHMAN A, MISHRA A, et al. Changes in bacterial community structure of agricultural land due to long-term organic and chemical amendments[J]. Microbial Ecology, 2012, 64(2): 450-460. DOI:10.1007/s00248-012-0025-y (  0) 0) |
| [22] |
宋宇, 王鹏, 韦月平. 不同稻田共作模式对土壤细菌群落结构的影响[J]. 西北农业学报, 2020, 29(2): 216-223. DOI:10.7606/j.issn.1004-1389.2020.02.007 (  0) 0) |
| [23] |
周佳, 周灵芝, 劳承英, 等. 短期不同耕作方式对水稻根际土壤细菌群落结构多样性的影响[J]. 南方农业学报, 2020, 51(10): 2401-2411. DOI:10.3969/j.issn.2095-1191.2020.10.011 (  0) 0) |
| [24] |
毛立晖. 野生稻内生细菌群落结构和多样性的研究[D]. 南昌: 南昌大学, 2018.
(  0) 0) |
| [25] |
唐涛涛. 不同类型秸秆厌氧共代谢降解污泥中多环芳烃的效能及机制研究[D]. 贵阳: 贵州大学, 2019.
(  0) 0) |
| [26] |
冯慧琳, 徐辰生, 何欢辉, 等. 生物炭对土壤酶活和细菌群落的影响及其作用机制[J]. 环境科学, 2021, 42(1): 422-432. (  0) 0) |
| [27] |
朱孟涛, 刘秀霞, 王佳盟, 等. 生物质炭对水稻土团聚体微生物多样性的影响[J]. 生态学报, 2020, 40(5): 1505-1516. (  0) 0) |
| [28] |
伏云珍, 马琨, 李倩, 等. 马铃薯| | 玉米间作对土壤细菌多样性的影响[J]. 中国生态农业学报(中英文), 2020, 28(11): 1715-1725. (  0) 0) |
 2022, Vol. 43
2022, Vol. 43


