肠道微生物与动物的健康关系密切。动物肠道内微生物的种类多、数量大。这群微生物与宿主互利共生,因其组成和分布的不同,发挥的功能也不同。肠道微生物不仅可以在机体代谢过程中提供底物、酶和能量,同时其代谢产物如脂肪酸等对机体上皮细胞生长与分化有促进作用,此外还参与合成维生素以及各种离子吸收。肠道微生物与宿主在肠道黏膜表面的交流促进了免疫系统的形成,从而构建了重要的生物及免疫屏障[1]。随着相关研究的不断发展,肠道微生物不仅在维持机体健康中发挥作用,还参与了许多疾病的进程。Qin等[2]于2012年进行了肠道微生物与Ⅱ型糖尿病的宏基因组关联分析,研究结果表明在糖尿病患者与非糖尿病患者的中国人群中,肠道微生物组成发生改变,Ⅱ型糖尿病患者产丁酸细菌种类减少。一项对人类和小鼠微生物菌群的研究表明肥胖个体具有更高的从饮食中获取能量的能力[3],其原因是肥胖与2种主要细菌分支相对丰度的差异有关,肥胖个体厚壁菌门Firmicutes的相对丰度增加,拟杆菌门Bacteroidota的丰度减少。此外,一项通过宏基因组分析比较同卵双胞胎和异卵双胞胎及其母亲的微生物群的研究,也支持了微生物多样性减少会促进热量收集的结论[4]。最近的研究同样表明,微生物基因计数低的个体有更多的全身炎症、肥胖、胰岛素抵抗和血脂异常[5]。
MicroRNAs(miRNAs) 是一类长度为18~25核苷酸的非编码小RNA分子,通过与靶基因mRNA结合,导致其翻译抑制或降解,在细胞增殖、分化以及其他生物过程中发挥关键作用[6]。其中miR-146a作为近些年来miRNAs的研究热点之一,其研究最早由Taganov等[7]报道,通过鉴定脂多糖(Lipopolysaccharide,LPS)诱导的人单核细胞系THP-1中miRNA表达谱发现,其中miR-146、miR-132和miR-155表达显著升高,且LPS介导的miR-146a表达的上调是以NF-κB依赖的方式发生的。随着miR-146a研究的深入,发现其还与癌症相关。结直肠癌(Colorectal cancer,CRC)是世界上最常见的癌症之一。2018中国癌症统计报告显示:我国结直肠癌发病率、病死率在全部恶性肿瘤中分别位居第3位、第5位[8]。研究发现miR-146a作为结肠炎症和相关肿瘤发生的主要负调控因子,调节IL-17反应,其高表达量与大概率延长结肠癌患者生存时间的表征相关,同时miR-146a缺陷的小鼠易患结肠炎相关和散发的CRC,并呈现出IL-17信号的增强[9-10]。早在1974年Reddy等[11]对无菌大鼠与普通大鼠每周注射10 mg/kg 1,2−二甲基肼,连续注射20周,发现无菌大鼠无一只患病,而常规大鼠有17%患上结直肠癌,表明肠道菌群对结直肠癌有调控作用。微生物群可以通过炎性介质(如肿瘤坏死因子、NF-κB、白细胞介素和干扰素等)、微生物代谢物(如肠道微生物源脱氧胆酸、丁酸等)以及环境因素(如饮食因素、身体不活动、环境污染物等)等影响结直肠癌的进程[12]。
那么miR-146a作为抑炎因子,是否参与宿主与微生物间的互作,进而影响肠道菌群的稳态?本文以miR-146a条件性敲除小鼠为模型,通过采用16S rRNA高通量测序技术,研究miR-146a对小鼠肠道菌群分布以及种类等方面的影响,以期为miR-146a与微生物互作的研究提供有益的数据支持。
1 研究方法 1.1 试验动物繁育miR-146a肠道特异性敲除小鼠(Conditional knockout mice,CKO鼠)由赛业(广州)生物科技有限公司制备,简单来说,应用CRISPR-Cas9技术在miR-146a基因外显子1两端插入Flox序列,经PCR可鉴定出基因组插入Flox序列的阳性鼠为对照组鼠(Flox鼠);为繁育CKO鼠,将Flox鼠与villus-Cre工具鼠进行杂交,其原理是villin-Cre基因只在肠道中表达Cre酶活性,Cre酶可将2个Flox序列中间的片段剪切,从而达到敲除的目的,具体繁育方法见下文。小鼠为普通SPF级,均购自广东省医学实验动物中心(广东佛山)。
CKO鼠的制备:首先将F0代Flox+/+纯合小鼠与villin-Cre小鼠杂交,获得F1代Flox+/−Cre+小鼠。接着把F1代Flox+/−Cre+小鼠再与F0代Flox+/+纯合小鼠杂交,获得F2代Flox+/+Cre+鼠,即CKO鼠。
试验开始前进行小鼠基因型鉴定,取同一只小鼠的少量耳朵或尾巴组织对Flox(使用Flox引物)和Cre(使用villus-Cre引物)(表1)2个基因位点的PCR产物进行琼脂糖凝胶电泳,Flox鼠的Flox PCR产物为单一206 bp条带,Cre PCR产物无明显条带;CKO鼠的Flox PCR产物为单一206 bp条带,Cre PCR产物为单一120 bp条带。将基因鉴定后的公鼠分为Flox组与CKO组各4只,单笼饲养,保证充足的饮水与饲料。
|
|
表 1 定量与测序引物序列 Table 1 Quantitation and sequencing primer sequences |
将6周龄小鼠颈椎脱臼处死,用镊子配合手术剪沿腹中线刨开腹部,分离出空肠段,再用剪刀纵切铺平,用盖玻片刮出黏膜,转移至离心管用于后续16S rRNA测序,组织部分转移至新的离心管用于后续RNA提取。
1.3 RNA 提取和qRT-PCR使用 EZB 通用型 RNA 提取试剂盒(海方生物)提取组织总 RNA,并使用分光光度计(Nanodrop 2000,ThermoFisher)测定 RNA 浓度。取 1 μg total RNA,使用 EZB 4×EZscript Reverse Transcription Mix II 逆转录试剂盒进行逆转录,mRNA 使用Oligo(dT)18引物进行逆转录,miR-146a-5p 使用特异性茎环引物(mmu-miR-146a-5p RT:GTCGTATCCAGTGCGTGTCGTGGAGTCGGCAATTGCACTGGATACGACAACCCA)逆转录。得到的cDNA 稀释 5 倍,保存在−30 ℃冰箱待用。
qRT-PCR 使用 EZB 2× Color SYBR Green qPCR Master Mix进行目的基因miR-146a-5p(使用mmu-miR-146a-5p引物)和内参基因U6(使用mmu-U6引物)(表1)表达水平检测,基因表达结果使用 2−ΔCt方法统计。
1.4 16S rRNA测序 1.4.1 基因组DNA的提取样品总基因组DNA用CTAB/SDS法提取后在10 g/L 的琼脂糖凝胶上电泳检测DNA的质量浓度和纯度,最后用无菌水将DNA质量浓度稀释至l μg/μL。
1.4.2 扩增子一代不同区域的16S rRNA/18S rRNA/ITS基因用特异性引物(16S V4、18S V4、ITS1,表1)进行扩增。参照Phusion®High-Fidelity PCR Master Mix (New England Biolabs)说明书进行PCR反应。
1.4.3 PCR产物定量和鉴定将等量的1×上样缓冲液与PCR产物混合,在20 g/L 琼脂糖凝胶上进行电泳检测并用Qiagen Gel Extraction Kit (Qiagen) 进行PCR产物纯化。
1.4.4 文库制备和测序按照TruSeq®DNA PCR-Free Sample Preparation Kit(Illumina)说明书生成测序文库,并添加索引代码。使用Qubit®2.0荧光计(Thermo Science)和安捷伦生物分析仪2100系统对文库质量进行评估。随后在Illumina NovaSeq平台上对文库进行测序,获得了250 bp的成对末端阅读序列。
1.5 数据统计分析对原始数据进行处理,得到有效数据(Clean data),基于有效数据进行OTUs(Operational taxonomic units)聚类和物种分类分析。根据OTUs聚类结果,对每个OTU的代表序列做物种注释,同时对OTUs进行丰度、Alpha和Beta多样性计算等分析。为进一步挖掘分组样本间的群落结构差异,选用t检验等统计分析方法对分组样本的物种组成和群落结构进行差异显著性检验。用Tax4Fun软件对生态样本中的微生物群落进行功能预测分析。
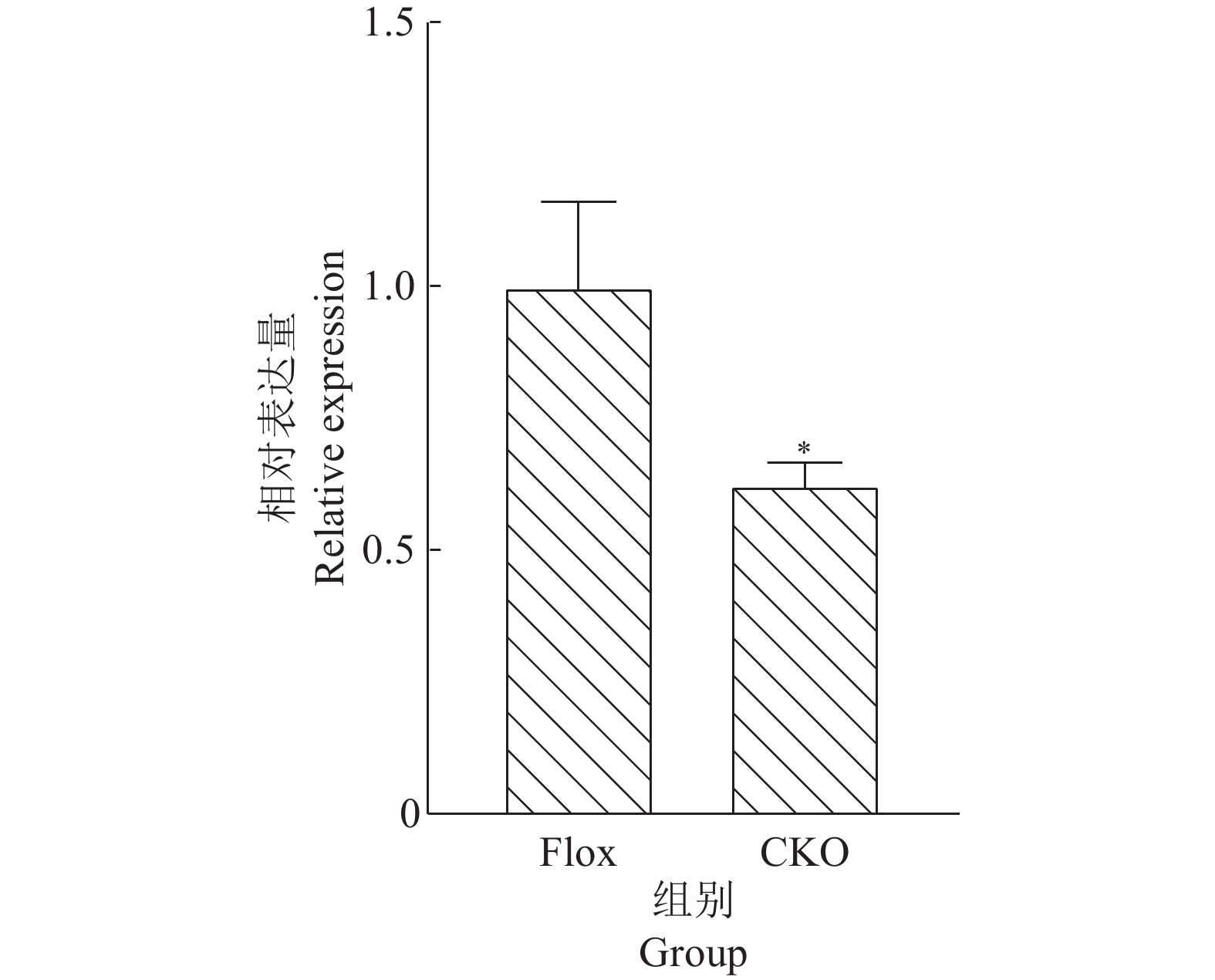
2 结果与分析 2.1 肠道miR-146a敲除小鼠的鉴定提取Flox组和CKO组小鼠空肠组织的RNA,对2组空肠组织的miR-146a-5p进行实时荧光定量PCR检测,结果表明,CKO组小鼠空肠组织的miR-146a-5p表达与Flox组相比显著降低(图1)。
|
图 1 各组小鼠空肠组织miR-146a-5p定量结果 Fig. 1 Quantitative results of miR-146a-5p in mouse jejunum tissue of each group 图中数据为平均值±标准误,“*”表示与Flox组差异显著( P <0.05,t 检验) Data in the figure are means±standard errors, “*” indicates significant difference from the Flox group ( P <0.05,t test) |
以97%的一致性将序列聚类成为OTUs,共得到1 134个OTUs,Flox组、CKO组分析共得到46个相同的OTUs,但由于CKO组间偏差较大,2组之间并不存在显著差异。根据注释到的结果,所有样本在不同等级上的种类数量依次为界(Kingdom):2;门(Phylum):37;纲(Class):80;目(Order):161;科(Family):198;属(Genus):261;种(Species):117。
2.3 小鼠空肠微生物Alpha多样性分析样本内的微生物群落的丰富度和多样性用Alpha多样性分析,分析结果如表2所示。
|
|
表 2 各组小鼠空肠微生物Alpha多样性的测定结果1) Table 2 Determination results of Alpha diversity of jejunum microbes in mice of each group |
由表2可知,各组的Good coverage指数均为0.999,说明测序数据覆盖99.9%的微生物,覆盖度较好。CKO组的Shannon 指数低于Flox组,Ace、Chao1、Observed_species指数高于Flox组,但差异均不显著(P>0.05)。
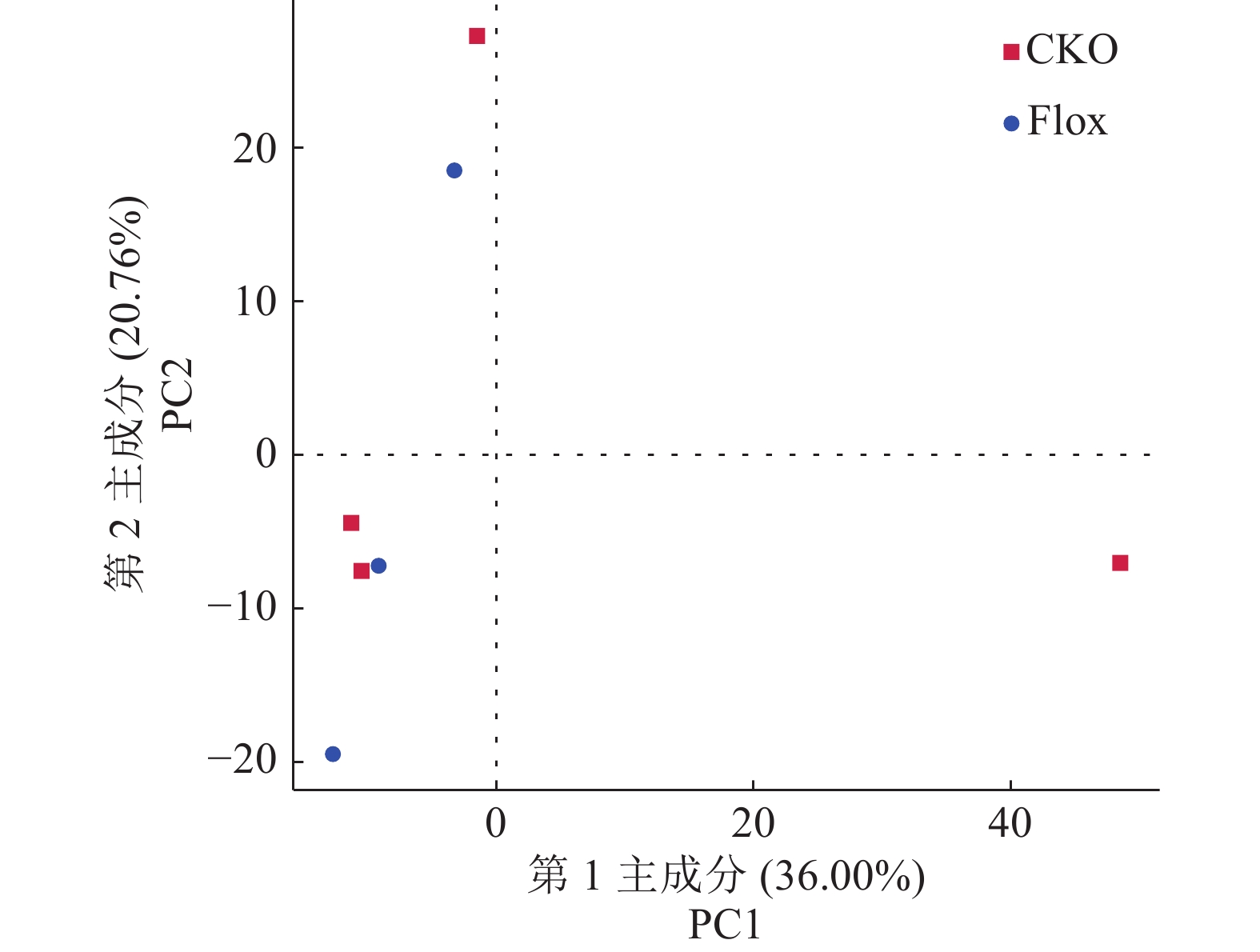
2.4 小鼠空肠微生物Beta多样性分析通过分析图2中的不同样本点的距离来判断个体或群体间的差异,样本的群落组成越相似,则它们在主成分分析(Principal component analysis,PCA)图中的距离越接近。
|
图 2 各组小鼠空肠微生物Beta多样性分析 Fig. 2 Analysis of Beta diversity of jejunum microbes in mice of each group 图中每个点代表1个样本 Each dot in the figure represents a sample |
由图2可知,PCA显示Flox组和CKO组中各样本的组内偏差较大,其微生物群落组成相似。
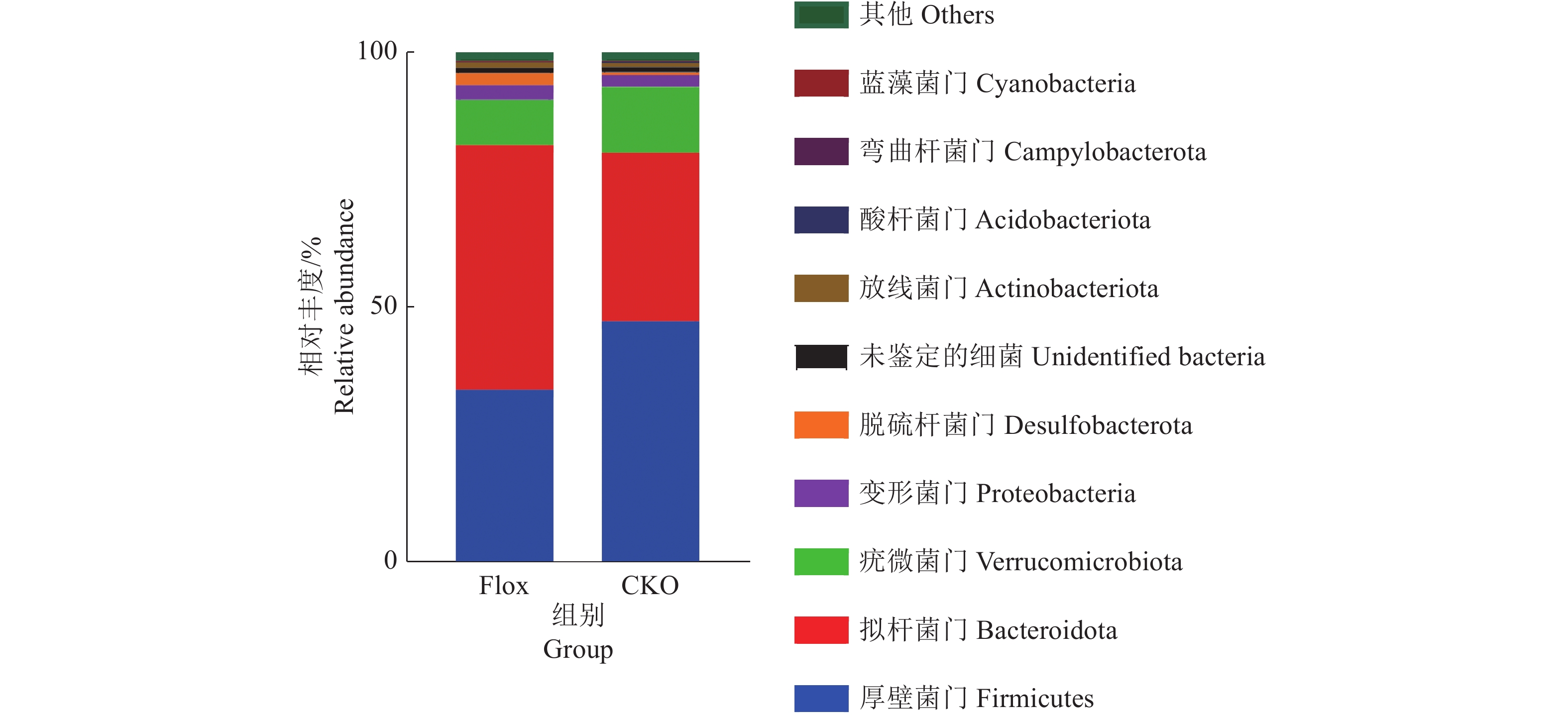
2.5 小鼠空肠微生物门水平物种分布以及有差异的物种分析各组小鼠肠道微生物在门水平上,厚壁菌门Firmicutes、拟杆菌门Bacteroidota、疣微菌门Verrucomicrobiota、变形菌门Proteobacteria、脱硫杆菌门Desulfobacterota丰度大于1%(图3)。
|
图 3 各组小鼠空肠微生物门水平组成 Fig. 3 The composition of the jejunum microbial phyla in mice of each group |
CKO组厚壁菌门、疣微菌门相对丰度与Flox组相比分别高38.24%、44.44%,而拟杆菌门相对丰度比Flox组低31.25%,但均差异不显著(P>0.05)。
从不同层级的物种丰度出发,通过常规的t检验可以得到差异物种。在纲水平上,CKO组和Flox组中梭状芽孢杆菌纲Clostridia的平均相对丰度分别为7.32%和2.23%,2组间差异不显著(P=0.067);在目水平上,毛螺菌目Lachnospirales在CKO组和Flox组中的平均相对丰度分别为1.40%和0.50%,该物种在2组间的差异显著(P=0.0135)。
2.6 Tax4Fun功能预测的KEGG通路分析各组样本Tax4Fun预测到的功能主要集中在细胞进程、环境信息处理、遗传信息处理、人类疾病、代谢、有机体系统以及其他未分类的功能,其中与膜运输、遗传信息翻译、复制和修复、碳水化合物代谢、氨基酸代谢以及核苷酸代谢方面相关的基因相对丰度较高(图4)。

|
图 4 Tax4Fun功能预测的KEGG通路分析 Fig. 4 KEGG pathway analysis through Tax4Fun function prediction |
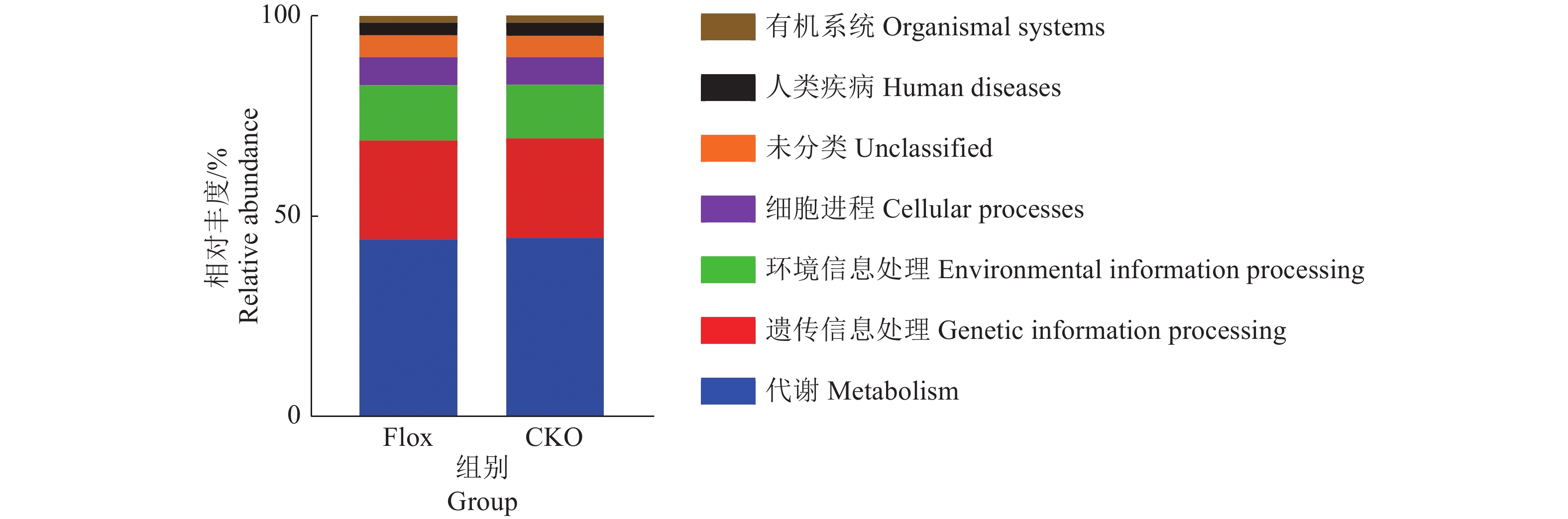
以Level 1相对丰度柱形图(图5)为例,2组间的预测功能无显著差异,主要集中在代谢、遗传信息处理与环境信息处理上。
|
图 5 KEGG通路Level 1相对丰度的分析 Fig. 5 Analysis of the relative abundance of Level 1 in the KEGG pathway |
微生物与宿主健康息息相关,例如肠道微生物多样性与长期体质量增加呈负相关,而与纤维摄入量呈正相关[13]。随着生猪养殖规模的不断扩大,封闭式猪舍越来越多,存在通风不顺畅的因素,导致封闭式猪舍内部存在大量的微生物、粉尘、内毒素等,会形成微生物气溶胶。微生物气溶胶浓度过高,就会影响生猪健康[14]。近来李喜阳等[15]通过对腹泻和健康断奶仔猪肠道微生物比较发现,在门水平上,腹泻组厚壁菌门、变形菌门、放线菌门和Myxococcota的相对丰度显著高于健康组,而拟杆菌门的相对丰度显著低于健康组;在属水平上,腹泻组中罗伊氏乳杆菌Lactobacillus reuteri、Marvinbryantia、消化球菌属Peptococcus、Subgroup_10和Bryobacter的相对丰度显著高于健康组,说明仔猪肠道菌群的结构改变可能是仔猪发生腹泻的重要原因。越来越多的研究表明,不仅肠道微生物群的组成能调控宿主的代谢活动,单个微生物的代谢产物也可以作为信号分子在宿主的代谢中发挥重要作用。微生物可以通过分泌代谢产物向宿主的上皮细胞发出信号,如食物中不能被消化吸收的多糖在微生物糖苷酶的作用下生成短链脂肪酸(如乙酸、丙酸和丁酸),其可作为胃肠道上皮细胞的直接能源,还可通过体循环来调控宿主代谢[16];丙酸盐和醋酸盐可运输到肝脏来调控糖代谢和脂代谢进而抑制糖尿病与肥胖的发生,且醋酸盐还可以通过激活白色脂肪细胞中的G蛋白偶联受体41来调节能量平衡[17];常规传统方法与分子鉴定结果表明太子参内生细菌RPB-32为芽孢杆菌Bacillus sp.。与空白对照组相比,给予内生菌代谢提取物的乙酸乙酯中剂量组、乙酸乙酯高剂量组、正丁醇低剂量组、正丁醇中剂量组及正丁醇高剂量组小鼠肠道乳酸菌数量显著增加,正丁醇中剂量组的小鼠肠道肠球菌和正丁醇高剂量组的小鼠肠道肠杆菌数量显著减少。初步判断太子参内生芽孢杆菌 RPB-32代谢物(BM)对肠道微生物组成有显著作用,并可能对机体糖脂降解、抗感染和抗炎等方面有改善作用[18];大豆异黄酮的保健功能主要归功于其肠道代谢产物 S−雌马酚。S−雌马酚是豆类食品在肠道内经特定微生物代谢后产生的一种高度稳定小分子,其与雌激素的结构和功能高度相似,能与β−雌激素 (ER-β) 受体结合,具有防治更年期综合征、心血管疾病和多种雌素依赖性癌症的功能[19]。
此外miRNA可通过特有的作用方式影响宿主肠道微生物。有研究[20]报道,生姜外泌体样纳米颗粒(Ginger exosome-like nanoparticle,GELN)优先被乳酸杆菌科以GELN脂质依赖性方式吸收,并含有靶向鼠李糖乳杆菌(Lactobacillus rhamnosus GG,LGG)中各种基因的miRNA。其中,GELN mdo-miR-7267-3p靶向LGG单加氧酶ycnE产生更多的吲哚−3−甲醛(Indole-3-carbaldehyde,I3A),GELN-RNAs或I3A是芳烃受体的配体,诱导IL-22的产生,而IL-22与屏障功能改善有关。GELN-RNA可以通过IL-22依赖性机制改善小鼠结肠炎。Guo等[21]发现,口服miRNA-10a-5p可显著防止体质量增加,并改善高脂日粮喂养小鼠的葡萄糖耐量和胰岛素敏感性,但破坏了颤螺菌属Oscillospira、瘤胃球菌属Ruminococcus和毛螺菌科Lachnospiraceae的昼夜波动。miRNA 不仅存在于细胞外囊泡中,在小鼠和人类粪便样本中含量也丰富。宿主肠道上皮细胞(Intestinal epithelial cells,IEC)和Hopx+ 细胞是粪便 miRNA 的主要来源,这些 miRNA 可以进入细菌,如具核梭杆菌Fusobacterium nucleatum和大肠埃希菌Escherichia coli,特异性调节细菌基因转录,并影响细菌生长。IEC-miRNA 缺陷 (Dicer1△IEC) 小鼠表现出肠道微生物群紊乱和结肠炎加剧,而野生型小鼠粪便 miRNA 移植可恢复缺陷小鼠粪便微生物结构并改善结肠炎。这些发现既确定了粪便 miRNA 塑造肠道微生物群的生理作用,也确定了操纵微生物组的潜在策略[22]。
miR-146a作为一个抑炎因子,在脊髓损伤大鼠中的表达低于对照组,而TLR/NF-κB信号通路相关基因和炎性细胞因子表达上调,在注射agomiR-146后,TLR/NF-κB信号通路中的炎症基因和细胞因子(IL-6和IL-8)明显下调[23]。与此类似,在急性痛风性关节炎大鼠模型中,miR-146a高表达组能显著改善关节肿胀指数、关节功能障碍指数和关节炎症指数。同时,miR-146a的高表达明显抑制滑膜组织中TLR4、MyD88、相关炎症因子和NF-κB的表达[24]。新生儿坏死性小肠结肠炎(Neonatal necrotizing enterocolitis,NEC)是新生儿重症监护病房最常见的胃肠道急症,病死率达30%。近年来,多项研究表明,早在NEC发病前数天至数周,NEC病儿已经发生肠道菌群失调且革兰阴性杆菌丰富度增多,即生态失调早于 NEC 发病[25]。以上证据说明肠道微生物菌群失调会导致肠道炎症,而miR-146a作为抑炎因子在许多炎症进程中发挥调控作用。
本研究中,肠道miR-146a特异性敲除能显著提高毛螺菌目Lachnospirales菌群的表达丰度。Zeng等[26]为了验证长期饲喂高脂料(High-fat,HF)会加速炎症过程和改变肠道菌群组成的假说,将C57BL/6小鼠分别饲喂高脂(45%能量)和低脂(Low-fat,LF,10%能量)饲料36周。研究结束时,HF组的体质量比LF组重35%,喂食 HF 饮食的小鼠血浆瘦素、IL6 和TNF-α浓度也升高,表明存在慢性炎症,提取粪便 DNA进行16S rRNA测序,发现与 LF 组相比,HF 组厚壁菌门、毛螺菌科以及毛螺菌科/链球菌科比例显著升高,而这些细菌与代谢紊乱、糖尿病和结肠癌的发展有关。在他们的另一项有关非酒精性脂肪性肝病(Non-alcoholic fatty liver disease,NAFLD)跟肥胖饮食关联的研究发现,晚期脂肪肝发展与喂养HF饮食小鼠的肝脏炎症、结肠继发性胆汁酸及其相关细菌水平升高同时发生,其中包括梭状芽孢杆菌纲和毛螺菌科的丰度增加[27]。关于早期肠道微生物与特应性皮炎(Atopic dermatitis,AD)之间的关系的研究,缺乏机制的了解和确定的结果,研究者调查了12例6月龄AD婴儿和12例健康婴儿肠道微生物区系的多样性和组成,发现AD患儿梭状芽孢杆菌的相对丰度与AD发病年龄相关,与血液中嗜酸性粒细胞百分比呈负相关[28]。也有报道证明与健康组相比,从NEC早产儿粪便样本中分离到更多的酪酸梭菌和新生儿梭状芽胞杆菌,并且这些菌具有更高的存活率与耐气性[29]。上述资料提示,miR-146a可能作用于肠道微生物,进而调节肠道的发育与功能,但其具体机制还需作进一步研究探讨。
综上所述,本研究利用miR-146a肠道特异性敲除模型,首次研究了宿主miR-146a敲除对肠道微生物的影响,结果表明miR-146a敲除可改变宿主肠道微生物的含量,即显著增加毛螺菌目Lachnospirales的平均相对丰度(P<0.05),同时梭状芽孢杆菌纲Clostridia的平均相对丰度有增加趋势(P=0.067),为进一步研究miR-146a通过影响宿主肠道微生物来调节肠道炎症进程提供了参考。
| [1] |
OLSZAK T, AN D, ZEISSIG S, et al. Microbial exposure during early life has persistent effects on natural killer T cell function[J]. Science, 2012, 336(6080): 489-493. DOI:10.1126/science.1219328 (  0) 0) |
| [2] |
QIN J, LI Y, CAI Z, et al. A metagenome-wide association study of gut microbiota in type 2 diabetes[J]. Nature, 2012, 490(7418): 55-60. DOI:10.1038/nature11450 (  0) 0) |
| [3] |
TURNBAUGH P J, LEY R E, MAHOWALD M A, et al. An obesity-associated gut microbiome with increased capacity for energy harvest[J]. Nature, 2006, 444(7122): 1027-1031. DOI:10.1038/nature05414 (  0) 0) |
| [4] |
TURNBAUGH P J, HAMADY M, YATSUNENKO T, et al. A core gut microbiome in obese and lean twins[J]. Nature, 2009, 457(7228): 480-484. DOI:10.1038/nature07540 (  0) 0) |
| [5] |
LE CHATELIER E, NIELSEN T, QIN J, et al. Richness of human gut microbiome correlates with metabolic markers[J]. Nature, 2013, 500(7464): 541-546. DOI:10.1038/nature12506 (  0) 0) |
| [6] |
BARTEL D P. MicroRNAs: Genomics, biogenesis, mechanism, and function[J]. Cell, 2004, 116(2): 281-297. DOI:10.1016/S0092-8674(04)00045-5 (  0) 0) |
| [7] |
TAGANOV K D, BOLDIN M P, CHANG K, et al. NF- κB-dependent induction of microRNA miR-146, an inhibitor targeted to signaling proteins of innate immune responses[J]. Proceedings of the National Academy of Sciences of the United States of America, 2006, 103(33): 12481-12486. DOI:10.1073/pnas.0605298103 (  0) 0) |
| [8] |
中华人民共和国国家卫生健康委员会. 中国结直肠癌诊疗规范2020版[J]. 中华消化外科杂志, 2020, 19(6): 563-588. DOI:10.3760/cma.j.cn115610-20200504-00348 (  0) 0) |
| [9] |
曾长青, 黄良祥, 郑羽, 等. miR-146a在结肠癌中的表达及意义[J]. 南方医科大学学报, 2014, 34(3): 396-400. DOI:10.3969/j.issn.1673-4254.2014.03.22 (  0) 0) |
| [10] |
GARO L P, AJAY A K, FUJIWARA M, et al. MicroRNA-146a limits tumorigenic inflammation in colorectal cancer[J]. Nature Communications, 2021, 12: 2419. DOI:10.1038/s41467-021-22641-y (  0) 0) |
| [11] |
REDDY B S, WEISBURGER J H, NARISAWA T, et al. Colon carcinogenesis in germ-free rats with 1, 2-dimethylhydrazine and N-methyl-N'-nitro-N-nitrosoguanidine[J]. Cancer Research, 1974, 34(9): 2368-2372. (  0) 0) |
| [12] |
孔垂秀. 综述微生物群与结直肠癌的关系研究[J]. 中国药物与临床, 2021, 21(23): 3839-3842. (  0) 0) |
| [13] |
MENNI C, JACKSON M A, PALLISTER T, et al. Gut microbiome diversity and high-fibre intake are related to lower long-term weight gain[J]. International Journal of Obesity, 2017, 41(7): 1099-1105. DOI:10.1038/ijo.2017.66 (  0) 0) |
| [14] |
温新水. 封闭式猪舍内微生物气溶胶对生猪的影响[J]. 畜牧兽医科技信息, 2019(12): 56. DOI:10.3969/J.ISSN.1671-6027.2019.12.040 (  0) 0) |
| [15] |
李喜阳, 王中齐, 梁璐, 等. 腹泻和健康断奶仔猪肠道微生物比较分析[J]. 黑龙江畜牧兽医, 2021(17): 83-88. DOI:10.13881/j.cnki.hljxmsy.2021.01.0035 (  0) 0) |
| [16] |
CLARKE G, STILLING R M, KENNEDY P J, et al. Minireview: Gut microbiota: The neglected endocrine organ[J]. Molecular Endocrinology, 2014, 28(8): 1221-1238. DOI:10.1210/me.2014-1108 (  0) 0) |
| [17] |
BAOTHMAN O A, ZAMZAMI M A, TAHER I, et al. The role of gut microbiota in the development of obesity and diabetes[J]. Lipids in Health and Disease, 2016, 15: 108. DOI:10.1186/s12944-016-0278-4 (  0) 0) |
| [18] |
王俊丽, 欧阳湖, 谢虹雅, 等. 太子参内生细菌RPB-32的分类鉴定及其代谢物对小鼠肠道微生物群落的影响[J]. 微生物学通报, 2021, 48(2): 502-515. DOI:10.13344/j.microbiol.china.200168 (  0) 0) |
| [19] |
李海亮, 邓颖, 王欣, 等. 肠道微生物代谢产物: S−雌马酚与人类健康关系研究进展[J]. 中国微生态学杂志, 2018, 30(3): 362-367. DOI:10.13381/j.cnki.cjm.201803027 (  0) 0) |
| [20] |
TENG Y, REN Y, SAYED M, et al. Plant-derived exosomal microRNAs shape the gut microbiota[J]. Cell Host & Microbe, 2018, 24(5): 637-652. (  0) 0) |
| [21] |
GUO Y, ZHU X, ZENG S, et al. miRNA-10a-5p alleviates insulin resistance and maintains diurnal patterns of triglycerides and gut microbiota in high-fat diet-fed mice[J]. Mediators of Inflammation, 2020, 2020: 8192187. DOI:10.1155/2020/8192187 (  0) 0) |
| [22] |
LIU S, CUNHA A P D, REZENDE R M, et al. The host shapes the gut microbiota via fecal microRNA[J]. Cell Host & Microbe, 2016, 19(1): 32-43. (  0) 0) |
| [23] |
LV Z, CAO X, GUO Y, et al. Effects of miR-146a on repair and inflammation in rats with spinal cord injury through the TLR/NF-κB signaling pathway[J]. European Review for Medical and Pharmacological Sciences, 2019, 23(11): 4558-4563. (  0) 0) |
| [24] |
CHEN X, GAO Q, ZHOU L, et al. MiR-146a alleviates inflammation of acute gouty arthritis rats through TLR4/MyD88 signal transduction pathway[J]. European Review for Medical and Pharmacological Sciences, 2019, 23(21): 9230-9237. (  0) 0) |
| [25] |
王英豪, 戴立英. 新生儿坏死性小肠结肠炎与肠道微生物群落关系的研究进展[J]. 安徽医药, 2021, 25(12): 2346-2350. DOI:10.3969/j.issn.1009-6469.2021.12.004 (  0) 0) |
| [26] |
ZENG H, ISHAQ S L, ZHAO F, et al. Colonic inflammation accompanies an increase of β-catenin signaling and Lachnospiraceae/Streptococcaceae bacteria in the hind gut of high-fat diet-fed mice
[J]. The Journal of Nutritional Biochemistry, 2016, 35: 30-36. DOI:10.1016/j.jnutbio.2016.05.015 (  0) 0) |
| [27] |
ZENG H, LARSON K J, CHENG W, et al. Advanced liver steatosis accompanies an increase in hepatic inflammation, colonic, secondary bile acids and Lactobacillaceae/Lachnospiraceae bacteria in C57BL/6 mice fed a high-fat diet[J]. The Journal of Nutritional Biochemistry, 2020, 78: 108336. DOI:10.1016/j.jnutbio.2019.108336 (  0) 0) |
| [28] |
LEE E, LEE S, KANG M, et al. Clostridia in the gut and onset of atopic dermatitis via eosinophilic inflammation[J]. Annals of Allergy, Asthma & Immunology, 2016, 117(1): 91-92. (  0) 0) |
| [29] |
SCHONHERR-HELLEC S, KLEIN G L, DELANNOY J, et al. Clostridial strain-specific characteristics associated with necrotizing enterocolitis[J]. Applied and Environmental Microbiology, 2018, 84(7): e02428-17. (  0) 0) |
 2023, Vol. 44
2023, Vol. 44


